Method Article
2단계 소화 방법을 사용한 다낭성 간 질환이 있는 마우스에서 1차 담관세포의 분리 및 배양
요약
이 프로토콜은 야생형 마우스 및 다낭성 간 질환이 있는 마우스에서 고순도 및 고생존율 1차 담관세포를 분리하기 위한 최적화된 2단계 소화 방법을 설명합니다.
초록
이 프로토콜에서는 야생형 마우스와 다낭성 간 질환(PLD)이 있는 마우스에서 고순도 및 생존율이 높은 1차 담관세포를 분리하기 위해 2단계 소화 방법을 최적화했습니다. 생쥐를 마취시킨 후, 간을 50mL의 용액 A로 하대정맥을 통해 관류한 후, 37°C에서 30mL의 용액 B를 주입하여 간 조직을 효소로 소화시켰습니다. 기계적 해리, 진탕 및 미미해부를 수행하여 부착된 실질 세포를 제거하고 온전한 담도계를 남겼습니다. 그런 다음 담도 나무를 잘게 다지고 37 ° C에서 60 분 동안 흔들면서 소화시켰다. 생성된 단일 세포 현탁액은 70μm 세포 스트레이너를 사용하여 수집되었습니다. 담관세포는 면역자기 분리를 사용하여 정제되었습니다. 세포 현탁액을 4°C에서 45분 동안 항-EpCAM 항체를 회전시켜 배양한 후, 단백질 G 비드를 첨가하고 4°C에서 45분 동안 추가로 회전시켰습니다. PBS로 3회 세척한 후, 자기 분리기를 사용하여 담관세포를 수집했습니다. 정제된 1차 담관세포를 담관세포 배양 배지에 재현탁시키고 1mg/mL I형 쥐꼬리 콜라겐으로 코팅된 세포 배양 접시에 파종했습니다. 담관세포의 순도는 담관세포 특이적 마커인 cytokeratin-19 (CK19)에 대한 면역염색으로 확인되었습니다. 이 연구는 야생형 및 PLD 마우스에서 원발성 담관세포를 분리하는 데 중점을 두었지만 이 프로토콜이 다른 질병 마우스 모델에도 적용될 수 있다고 확신합니다. 이 상세한 2단계 소화 방법은 담관병증의 체외 연구와 표적 치료법의 개발을 용이하게 합니다.
서문
담즙세포(cholangiocyte)는 간내 담도계(intrahepatic biliary tree)를 둘러싸고 있는 상피 세포로, 단층을 형성하며 간 전체 세포 집단의 약 3-5%를 차지한다1. 이 세포들은 간 내에서 상호 연결되어 복잡한 3차원 유관 네트워크를 형성합니다2. 정상적인 조건에서 담관세포는 분비, 흡수, 부상 복구, 면역 장벽 역할을 포함한 중요한 기능을 수행하여 간 생리학 및 병리학에서 중요한 역할을 합니다. 그러나 담관세포 기능 장애는 PLD, 원발성 경화성 담관염, 담관암, 담즙 유발성 간 손상 등 다양한 질병을 유발할 수 있습니다 3,4,5.
담관병증 관련 질환 중 PLD는 담관세포에서 유래하는 수많은 액체로 채워진 낭종의 형성을 특징으로 하는 유전 질환으로 두드러집니다. 이러한 낭종의 점진적인 비대는 환자의 삶의 질을 현저히 떨어뜨린다6. PLD에 대한 현재 치료법은 여전히 불충분하여 효과가 제한적이며, 종종 높은 재발률 및 합병증과 관련이 있다7. 이는 PLD 관리에서 충족되지 않은 임상적 요구를 해결하기 위해 안전하고 효과적인 치료 전략을 개발해야 할 시급한 필요성을 강조합니다.
PLD를 포함한 담관병증의 기전에 대한 연구는 적절한 세포주가 부족하여 상당한 방해를 받았습니다. 이러한 한계를 해결하기 위해 질병 마우스 모델을 사용하고 체외 실험을 위해 이러한 모델에서 원발성 담관세포를 분리하는 것은 담관병증의 기저에 있는 분자 메커니즘을 밝히고 잠재적인 치료 전략을 식별하는 데 매우 중요한 것으로 입증되었습니다.
최근 연구8에서는 Pkd1 조건부 녹아웃(KO) 마우스를 사용하여 PLD 마우스 모델을 성공적으로 구축했습니다. 간 낭종은 Pkd1 결실 후 빠르면 1개월부터 관찰되었으며 시간이 지남에 따라 점진적으로 크기가 증가했습니다. 쥐와 인간으로부터 담관세포를 분리하기 위한 프로토콜은 잘 문서화되어 있지만, 9,10, 쥐로부터 일차 담관세포를 분리하는 것은 작은 크기와 문맥 및 담도계의 복잡한 구조로 인해 특히 어려운 과제로 남아 있습니다. 기존 방법은 낮은 세포 순도, 낮은 생존력, 복잡한 절차, 높은 비용 등 상당한 한계에 직면해 있습니다 11,12.
이 원고는 2단계 분해 방법을 사용하여 마우스에서 고순도 1차 담관세포를 분리하기 위한 자세한 프로토콜을 제시합니다. 이 최적화된 접근 방식은 체외 연구를 지원하고, 담관병증의 기저에 있는 분자 메커니즘에 대한 연구를 촉진하고, 새로운 치료 전략의 개발을 촉진하는 것을 목표로 합니다.
프로토콜
모든 마우스 관리 및 실험 프로토콜은 톈진 의과대학 윤리위원회(Doc. No: TMUa-MEC 2022016)의 승인을 받았습니다.
1. 장비 및 솔루션 준비
- 수술 기구(가위, 집게, 메스 손잡이)는 세포 분리 최소 1일 전에 고압증기멸균으로 소독합니다.
- 세포 분리 최소 1일 전에 표 1 에 나열된 시약을 사용하여 담관세포 배양 배지를 준비합니다. 담관세포 배양 배지를 0.22μm 필터를 통해 여과하여 멸균합니다.
- 세포 분리 최소 1일 전에 마우스 간 관류를 위해 표 2 에 나열된 시약을 사용하여 용액 A와 용액 B를 준비합니다. 0.22μm 필터를 통해 오토클레이브 또는 필터링하여 용액 A와 용액 B를 멸균하고 부드러운 교반으로 멸균 NaOH를 사용하여 pH를 7.35로 조정합니다.
참고: 담관세포 배양 배지, 용액 A 및 용액 B는 최소 한 달 동안 4°C에서 보관할 수 있습니다. - 실험을 시작하기 전에 용액 B에 콜라겐분해효소 II 분말을 첨가하고 부드럽게 혼합하여 최종 농도 0.5mg/mL를 달성합니다. 사용하기 전에 용액 A와 용액 B를 모두 37°C 수조에서 예열하십시오.
- 실험을 시작하기 직전에 멸균 PBS로 채워진 6cm 접시를 준비하고 얼음 위에 올려 시술 중에 차갑게 유지합니다.
2. 간 조직 소화 관류
- 이소플루란 과다 흡입을 사용하여 마우스를 마취합니다. 마취된 마우스를 누운 자세로 놓고 접착 테이프로 고정하여 절차를 용이하게 합니다.
- 75% 에탄올로 복부를 살균한 후 마우스의 복강을 열고 스웨이징된 바늘을 사용하여 하대정맥 주위에 슬립매듭을 묶습니다. 20mL 주사기를 사용하여 용액 A와 함께 24G 정맥 주사 카테터를 헹굽니다.
- 정맥 내 카테터를 슬립매듭 아래의 하대정맥에 삽입하고 슬립노트를 고정한 다음 접착 테이프로 카테터를 제자리에 고정합니다.
- 20mL 주사기를 사용하여 50mL의 용액 A를 간을 하대정맥을 통해 간을 관류하고 간문맥을 절개하여 관류액을 배출합니다. 관류 속도를 10mL/분으로 유지합니다.
- 연동 펌프를 사용하여 3.5mL/분의 유속으로 콜라겐분해효소 II가 포함된 용액 B 30mL로 관류를 계속합니다.
참고: 이 단계는 간 조직의 소화를 위한 것입니다. - 성공적으로 관류된 간 조직을 제거하고 차갑고 멸균된 PBS로 채워진 6cm 접시에 넣습니다.
3. 담관세포 격리
참고: 정상 마우스의 담관세포 수는 상대적으로 적기 때문에 시술에는 2-6마리의 마우스 그룹을 사용하는 것이 좋습니다. 그러나 PLD와 같이 비정상적인 담관세포 증식이 있는 마우스 질병 모델의 경우 단일 마우스의 담관세포로 충분합니다. 달리 명시되지 않는 한, 샘플과 시약은 항상 얼음 위에 보관해야 하며 모든 절차는 생물 안전 캐비닛에서 수행해야 합니다.
- 곡선 겸자를 사용하여 간 조직을 기계적으로 해리하고 흔듭니다. 그런 다음 해부 현미경으로 현저해부를 수행하여 부착된 실질 세포를 제거하여 온전한 담도수를 남깁니다. 다음 단계로 진행하기 전에 담낭 조직을 제거합니다.
PBS로 조직을 2x 씻습니다. - 수술용 칼날을 사용하여 담도나무를 미세하게 다진 후 마우스 1개당 3mL의 소화 용액(표 3)을 37°C에서 60분 동안 흔들어(90rpm)하여 소화합니다. 30분 표시에서 피펫 팁을 사용하여 혼합물을 부드럽게 피펫으로 완전히 혼합합니다.
알림: 소화 용액은 사용하기 전에 갓 준비해야 합니다. - 70μm 세포 스트레이너를 통해 세포 현탁액을 통과시킵니다. 5mL 또는 10mL 주사기의 플런저를 사용하여 스트레이너를 통해 세포 현탁액을 부드럽게 누릅니다. PBS로 스트레이너를 세척하십시오.
- 500 x g 에서 4°C에서 5분 동안 세포 현탁액을 원심분리합니다. RPMI 배지로 세포를 3번 세척합니다.
- 500 x g 에서 4°C에서 5분 동안 다시 원심분리기를 합니다.
- 상층액을 버리고 40 U/mL DNase I을 함유한 900 μL의 RPMI 배지에 세포를 재현탁시킵니다.2 μg의 항-EpCAM 항체를 추가하고 4°C에서 45분 동안 회전기(20 rpm)에서 현탁액을 배양합니다.
- 500 x g 에서 4°C에서 5분간 원심분리기.
- 상층액을 버리고 40 U/mL DNase I. 단백질 G 비드를 1 mL의 RPMI 배지로 사전 세척하는 1 mL의 RPMI 배지에 세포를 재현탁시킵니다. 20μL의 Protein G beads를 세포 현탁액에 추가하고 4°C에서 45분 동안 회전(20rpm)으로 배양합니다.
참고: 항-EpCAM 항체는 세포 현탁액을 도입하기 전에 비드-항체 복합체를 생성하기 위해 Protein G 비드로 사전 배양할 수도 있습니다. - 자기 분리기를 사용하여 PBS로 셀을 3번 세척합니다.
- 혈구계에서 Trypan Blue 염색(0.04%, 3분)을 사용하여 세포 계수 및 세포 생존율 평가를 수행합니다.
참고: 담관세포에서 구슬을 제거할 필요가 없으며, 배양이 시작되면 자연적으로 분리되며 세포 배양을 방해하지 않습니다.
4. 담관세포 배양
참고: 담관세포 배양 전에 신선한 I형 쥐꼬리 콜라겐 코팅된 세포 배양 접시를 준비합니다. 모든 시약을 얼음으로 미리 식히십시오.
- 제조업체의 지침에 따라 멸균 ddH2O, 10x PBS, 1 N NaOH 및 유형 I 쥐꼬리 콜라겐을 혼합하여 1x PBS에서 1 mg/mL 유형 I 쥐꼬리 콜라겐의 최종 농도를 달성합니다. 세포 배양 접시에 혼합물을 고르게 코팅하고 접시를 37 ° C의 인큐베이터에 5 % CO2로 30 분 동안 넣어 콜라겐이 응고되도록합니다.
- I형 쥐꼬리 콜라겐 코팅된 세포 배양 접시를 예열된 PBS로 세척합니다.
- 예열된 담관세포 배양 배지에 담관세포를 재현탁합니다. 세포 현탁액을 1mg/mL 유형 I 쥐꼬리 콜라겐 코팅된 세포 배양 접시에 파종하고 5% CO2로 37°C에서 배양합니다. 2일마다 배지를 교체하십시오.
5. 담관세포의 패시징(Passaging) 및 동결보존(cryopreservation)
- 담관세포를 PBS로 두 번 세척한 다음 37°C에서 5-10분 동안 0.25% 트립신으로 세포를 배양합니다.
- 트립신을 중화하기 위해 동일한 부피의 담관 세포 배양 배지를 첨가한 다음 500 x g 에서 5분 동안 원심분리합니다.
- 4.1단계에 설명된 대로 유형 I 쥐꼬리 콜라겐 코팅 세포 배양 접시를 준비합니다.
- 4.2 및 4.3단계를 수행합니다.
- 동결 보존이 필요한 경우 담관세포를 저장 매체(9:1 FBS: DMSO)에 재현탁하고 -80°C 냉동고 또는 액체 질소에 보관합니다. 나중에 사용할 수 있도록 필요에 따라 세포를 해동합니다.
6. 담관세포 검증
참고: 담관세포의 순도는 담관세포 마커 CK19에 대한 염색으로 평가되었습니다.
- 담관세포를 PBS로 2회 세척한 다음 4% 파라포름알데히드로 세포를 15분 동안 고정합니다.
- 담관세포를 PBS로 세척한 다음 1% Triton X-100으로 세포를 8분 동안 투과시킵니다.
- 담관세포를 PBS로 세척한 다음 5% BSA에서 1시간 동안 세포를 차단합니다.
- 담관세포를 PBS로 세척한 다음 CK19(2% BSA로 희석 1:12)에 대한 1차 항체가 있는 세포를 4°C에서 밤새 배양합니다.
- 담관세포를 PBS로 2x 세척한 다음 실온에서 1시간 동안 당나귀 항쥐 Alexa Fluor 488 2차 항체(PBS로 희석 1:1,000)로 세포를 배양합니다.
- 담관세포를 PBS로 세척하고 4',6-디아미디노-2-페닐린돌로 15분 동안 염색한 후 현미경으로 관찰합니다.
결과
담관세포를 분리하는 데 사용되는 2단계 소화 과정에 대한 워크플로우 다이어그램은 그림 1에 나와 있습니다. 전체 절차는 ~ 5 시간이 걸립니다. 먼저, 간이 창백해지는 것으로 알 수 있듯이 혈액을 제거하기 위해 하대정맥을 통해 간에 용액 A를 관류합니다. 그런 다음 간에는 콜라겐 분해 효소 II가 함유 된 용액 B가 관류되어 조직 소화를 시작합니다. 이 초기 소화 단계는 시간에 민감하며, 조직이 눈에 띄게 부드러워지는 것이 성공적인 소화를 입증합니다. 다음으로, 구부러진 집게를 사용한 기계적 해리와 부드러운 흔들림은 간세포를 제거하는 데 도움이 됩니다. 적절한 소화는 많은 수의 간세포가 분리될 때 확인됩니다. 해부 현미경 아래에서 남아 있는 부착 실질 세포는 현미해부를 통해 조심스럽게 제거되어 온전한 담도수를 남깁니다(그림 2).
두 번째 소화 단계에서 조직은 단세포 현탁액으로 분해되며, 이 현탁액에는 여전히 일부 간세포와 섬유아세포가 포함되어 있습니다. 마지막으로, 고순도 담관세포는 면역자기 분리를 통해 이 현탁액에서 얻어집니다. 세포 생존율 평가는 혈구계에 Trypan Blue 염색을 사용하여 수행되었습니다. 그 결과 생존 가능성이 높은 담관세포를 성공적으로 분리할 수 있음을 보여주었습니다(그림 3). CK19에 대한 면역형광 염색(그림 4)을 통해 이 방법이 일관되게 고순도 마우스 담관세포를 생성한다는 것을 확인했습니다.
원발성 담관세포는 일반적으로 배양 표면에 부착되어 약 24시간 이내에 단층을 형성했으며, 특히 PLD와 같은 비정상적인 담관세포 증식을 가진 마우스 질병 모델에서 처음 세 계대 동안 빠른 증식을 보였습니다(그림 5). 그러나 후기 계대에서는 성장 속도가 감소하고 세포가 커지고 진공 형태가 발달했습니다. 담관세포에서 구슬을 제거할 필요가 없으며, 배양이 시작되면 자연적으로 분리되어 세포 배양을 방해하지 않습니다. 세포 동결 보존 및 해동은 세포 생존력에 큰 영향을 미치지 않았습니다.
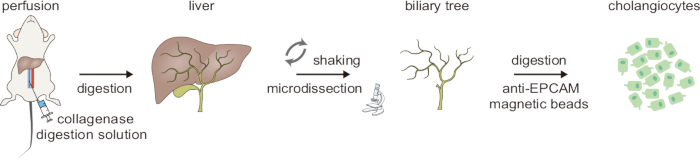
그림 1: 담관세포 분리를 위한 2단계 소화 과정의 개략도. 이 그림은 Ji et al8에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 다낭성 간 질환이 있는 마우스에서 분리한 담도나무의 대표 이미지.이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: Trypan Blue 염색을 사용한 분리된 담관세포의 세포 생존율 평가. 눈금 막대 = 50μm. 세포를 둘러싸고 배경 안에 있는 작은 검은색 입자는 단백질 G 비드입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
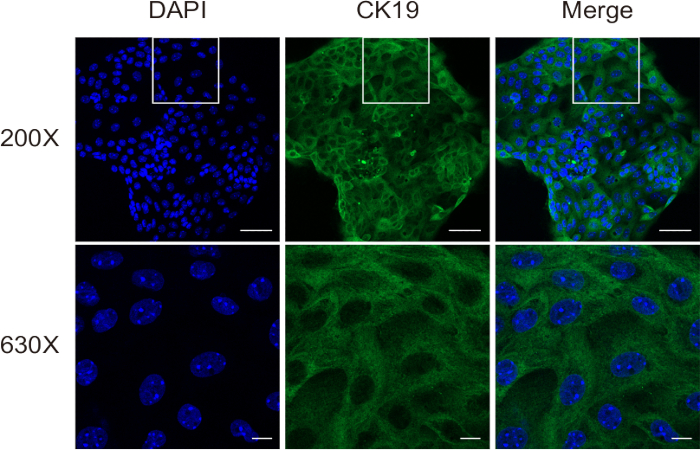
그림 4: CK19에 대한 면역형광 염색을 사용한 분리된 담관세포의 세포 순도 평가. 눈금 막대: = 50μm[위쪽] 및 10μm[아래쪽]. 이 그림은 Ji et al8에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
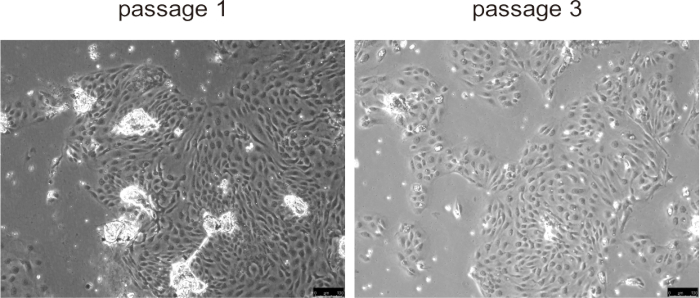
그림 5: 통로 1 및 통로 3에서 분리된 담관세포의 대표 이미지. 스케일 바 = 100μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 구성 요소 | 분량 |
| DMEM/F12 (1:1) | 415 밀리리터 |
| 소 태아 세럼(FBS) | 50 밀리리터 |
| MEM 비필수 아미노산(100x) | 5 밀리리터 |
| 인슐린-트랜스페린-셀레늄 (100x) | 5 밀리리터 |
| MEM 비타민 용액(100개) | 5 밀리리터 |
| 화학적으로 정의된 지질 농축액(100x) | 5 밀리리터 |
| 페니실린-스트렙토마이신(100x) | 5 밀리리터 |
| 겐타마이신/암포테리신 용액(500x) | 1 mL |
| 100mM Na 피루브산 | 250 마이크로L |
| 10 mg/mL 대두 트립신 억제제 | 2.5 밀리리터 |
| 200mM L-글루타민 | 5 밀리리터 |
| 덱사메타손 10mg/mL | 20 마이크로L |
| 1.7 mg/mL 3,3',5-트리요오도-L-티로닌 | 1 mL |
| 1 mg/mL 표피 성장 인자 | 12.5 μL |
| 20 mM 포스콜린 | 250 마이크로L |
| 에탄올아민 | 13 μL |
표 1: 담관세포 배양 배지의 조성.
| 구성 요소 | 분량 | |
| 솔루션 A | 염화나트륨 | 4.0908 지 |
| 케이클 | 0.1578 지 | |
| 나2HPO4 | 0.1072 지 | |
| 헤페스 | 2.9789 지 | |
| 50mM EGTA(PH = 8) | 5 밀리리터 | |
| 재질 보기 1.5 M MgCl2 | 34 μL | |
| ddH2O | 500 밀리리터 | |
| 알림: 멸균 NaOH를 사용하여 pH를 7.35로 조정합니다. | ||
| 솔루션 B | 염화나트륨 | 4.0908 지 |
| 케이클 | 0.1578 지 | |
| 나2HPO4 | 0.1072 지 | |
| 헤페스 | 2.9789 지 | |
| 2 M CaCl2 | 1.25 밀리리터 | |
| ddH2O | 500 밀리리터 | |
| 알림: 멸균 NaOH를 사용하여 pH를 7.35로 조정합니다. 콜라겐 분해 효소 II 분말을 첨가하여 최종 농도 0.5mg/mL를 달성한 후 사용해야 합니다. | ||
표 2: 용액 A와 용액 B의 구성.
| 구성 요소 | 분량 |
| 3.2 mg/mL 콜라겐분해효소 XI | 300 마이크로L |
| 10mg/mL 히알루로니다아제 | 120 μL |
| 10 U/μL DN나제 I | 12 μL |
| 페니실린-스트렙토마이신(100x) | 30 μL |
| RPMI 배지 | 2.538 밀리리터 |
표 3: 소화 용액의 조성.
토론
이 프로토콜은 2단계 소화 과정을 사용하여 마우스에서 고순도 1차 담관세포를 분리하는 상세한 방법을 제공하여 담관병증의 기저에 있는 분자 메커니즘을 연구할 수 있도록 합니다. 담관세포의 성공적인 분리를 보장하기 위해서는 몇 가지 중요한 단계가 필수적입니다.
첫 번째 중요한 단계는 용액 A와 용액 B를 사용하여 효과적인 관류 및 소화를 보장하는 것입니다. 용액 A를 사용한 성공적인 관류는 간이 창백하게 변하는 것으로 확인되었으며, 용액 B를 사용한 성공적인 소화는 간 조직이 눈에 띄게 부드러워짐에 의해 확인되었습니다. 관류에 실패하면 간 조직의 소화를 방해하고 담도계의 후속 분리를 손상시킬 수 있습니다. 소화 효율을 높이기 위해 용액 A와 용액 B의 부피를 늘리거나, 관류 유속을 줄이거나, 면봉으로 간을 부드럽게 누를 수 있습니다.
두 번째 중요한 단계는 기계적으로 해리하고 구부러진 겸자로 간 조직을 부드럽게 흔든 다음, 해부 현미경으로 미세 해부하여 부착된 실질 세포를 제거하고 온전한 담도계를 분리하는 것입니다. 이 단계는 고순도 담관세포를 얻는 데 핵심적인 역할을 했습니다. 효율성은 차가운 PBS로 흔들고 헹구는 동안 구부러진 집게로 더 큰 담관을 잡음으로써 향상될 수 있습니다. 간이 성공적으로 소화되면 많은 간세포가 분리되어 현저해부가 비교적 간단해집니다. 그러나 분해가 불완전하고 샘플이 가치가 있는 경우 현미해부 공정에 많은 노력이 필요하고 작업량이 증가하고 잠재적으로 세포 수율과 순도가 모두 감소할 수 있습니다. 따라서 간 소화를 위해 용액 B로 적절한 관류를 보장하는 것이 가장 중요했습니다.
세 번째 중요한 단계는 담도계를 두 번째로 소화하여 단세포 현탁액을 생성하는 것입니다. 소화 시간은 현미경으로 세포를 관찰하여 최적화해야 합니다: 과소화는 세포 생존력을 감소시킬 수 있으며, 과소화는 사용하지 않는 담도 조직으로 이어질 수 있습니다. 또한 모든 시약에 적절한 항생제를 포함하면 오염을 최소화하는 데 도움이 됩니다.
이 최적화된 2단계 소화 프로토콜을 사용하여 마우스에서 고순도 및 생존력이 높은 담관세포를 성공적으로 분리했습니다. 이 연구는 야생형 및 PLD 마우스 모델에서 원발성 담관세포를 분리하는 데 중점을 두었지만, 우리는 이 프로토콜이 다른 질병 마우스 모델에도 적용될 수 있다고 확신합니다. 담즙 나무를 분리하기 위한 초기 간 조직 소화 과정과 두 번째 소화 단계는 면역자기 분리의 효율성을 크게 향상시키고 더 많은 수의 생존 가능한 세포를 산출했습니다. 분리된 담관세포는 ATAC-seq, ChIP-seq, low-input ChIP-seq 및 CUT&TAG와 같이 높은 생존율이 필요한 후성유전학적 실험에 매우 적합했습니다. 또한 이러한 1차 담관세포는 3D 낭성 성장, 세포 증식, 세포사멸 및 세포주기 분석을 포함한 다양한 기능 분석을 위해 체외에서 배양할 수 있습니다.
이전에 발표된 연구8에서, 우리는 남녀 모두의 야생형 및 PLD 마우스에서 정상 및 낭포성 원발성 담관세포를 모두 분리했습니다. 수컷 및 암컷 PLD 마우스의 원발성 담관세포에 대한 다중 오믹스 프로파일링은 간 방광형성 중 담관세포에서 성별 특이적 후성유전학적 역학을 밝혔습니다. 또한, PLD 마우스 모델과 원발성 담관세포를 사용한 시험관 내 실험 모두에서 후성유전학적 변형 효소의 약리학적 억제를 통해 남성 PLD 환자를 위한 잠재적인 후성유전학적 치료 전략을 확인했습니다.
우리의 접근법은 현재 발표된 담관세포 분리 방법에 비해 몇 가지 주목할 만한 이점을 제공합니다. 관류 분해 후 간 조직을 단세포 현탁액으로 직접 소화한 다음 구배 원심분리 및 면역자기 분리를 수행하는 Kudira 등13의 방법과 비교할 때 당사의 방법은 더 간단하고 비용 효율적이며 효율적입니다. 주요 이점은 면역자기 분리 전에 담도계를 분리하여 전체 과정을 개선할 수 있다는 것입니다. 또한, 담관세포에서 비드를 제거할 필요가 없기 때문에 이 방법은 분리된 세포의 수율을 높이고 생존율을 향상시킵니다. 3D 배양을 위해 간 소화 관류에서 문맥 요로 잔류물을 해리하고 다진 다음 단일 세포 현탁액을 생성하기 전에 7일의 배양 기간을 거두는 Ueno et al.14의 방법과 비교할 때 당사의 방법은 더 시간 효율적입니다. 담도계 분리(biliary tree)를 분리한 후 면역자성 분리를 통해 세포 순도를 크게 향상시킬 수 있습니다.
그러나 이러한 장점에도 불구하고 당사의 2단계 소화 기술에는 여전히 몇 가지 한계가 있습니다. 상대적으로 노동 집약적이고, 제한된 수의 계대만 허용하며, 실질 오염을 피하기 위해 신중한 현미해부가 필요합니다.
결론적으로, 우리는 마우스에서 고순도 및 고생존율 1차 담관세포를 분리하기 위한 2단계 소화 방법을 개발하고 최적화했습니다. 이 접근법은 담관병증의 기저에 있는 분자 메커니즘을 연구하기 위한 귀중한 도구를 제공하고 잠재적인 치료 전략을 식별하기 위한 토대를 제공합니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 작업은 톈진시 교육위원회(2022ZD054 to L.Z.)의 보조금으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | PALL | 4612 | |
| 0.25% Trypsin | Gibco | 25200-056 | |
| 10 mL syringe | KONSMED | 10 mL 1.2*30TWLB | |
| 20 mL syringe | KONSMED | 20 mL 1.2*30TWLB | |
| 24 G intravenous catheter | WEGO | 24GX19 mm/Y-G | |
| 3,3',5-triiodo-L-thyronine | Sigma | T5516 | 1.7 mg/mL stock |
| 4% paraformaldehyde | Solarbio | P1110 | |
| 5 mL syringe | KONSMED | 5 mL 0.7*30TWLB | |
| 6 cm dishes | Thermo Scientific | 150462 | |
| 70 µm cell strainer | Corning | 352350 | |
| anti-CK19 antibody | DSHB | TROMA-III | |
| anti-EpCAM antibody | DSHB | G8.8 | |
| BSA | Solarbio | A8020 | |
| CaCl2 | Sangon Biotech | A501330 | 2 M stock |
| Chemically-defined lipid concentrate (100x) | Gibco | 11905-031 | |
| Collagenase II | Worthington | LS004176 | |
| Collagenase XI | Sigma | C7657 | 3.2 mg/mL stock |
| Dexamethasone | Sigma | D1756 | 10 mg/mL stock |
| Dissecting Microscope | Leica | EZ4 | |
| DMEM/F12 (1:1) | VivaCell biosciences | C3130-0500 | |
| DMSO | Sigma | D2650 | |
| DNase I | Sigma | D4513 | 10 U/μL stock |
| Donkey anti-rat Alexa Fluor 488 secondary antibody | Invitrogen | A21208 | |
| EGTA | Solarbio | E8050 | 50 mM (PH = 8) stock |
| Epidermal growth factor (1 mg/mL) | Sigma | SRP3196 | |
| Ethanolamine | Sigma | E9508 | |
| Fetal Bovine Serum | VivaCell biosciences | C04001-500 | |
| Forskolin | Sigma | F3917 | 20 mM stock |
| Gentamicin/amphotericin solution (500x) | Gibco | R01510 | |
| Hemocytometer | QIUJING | XB.K.25. | |
| HEPES | Sigma | H4034 | |
| Hyaluronidase | Sigma | H3506 | 10 mg/mL stock |
| Insulin-transferrin-selenium (100x) | Gibco | 41400045 | |
| Isoflurane | RWD | R510-22-10 | |
| KCl | Sangon Biotech | A100395 | |
| L-Glutamine (200 mM) | Sigma | G7513 | |
| Magnetic separator | Promega | Z5342 | |
| MEM non-essential amino acids (100x) | Gibco | 11140050 | |
| MEM vitamin solution (100x) | Gibco | 11120052 | |
| MgCl2 | Sangon Biotech | A100288 | 1.5 M stock |
| Na Pyruvate (100 mM) | Gibco | 11360070 | |
| Na2HPO4 | Sangon Biotech | A600487 | |
| NaCl | Sangon Biotech | A610476 | |
| NaOH | Sangon Biotech | A620617 | 1 N stock |
| PBS | VivaCell biosciences | C3580-0500 | |
| PBS | Solarbio | P1010 | |
| Penicillin-Streptomycin (100x) | Gibco | 15140-122 | |
| Peristaltic pump | BaodingRongbai | YZ1515PPS | |
| Protein G beads | Invitrogen | 10004D | |
| Rotator | Kylin-Bell | QB-528 | |
| RPMI | VivaCell biosciences | C3010-0500 | |
| Soybean trypsin inhibitor | Sigma | T6522 | 10 mg/mL stock |
| Swaged needle | Jinhuan Medical | HM601 | |
| Triton X-100 | Solarbio | T8200 | |
| Trypan blue | Sigma | T6146 | 10 mg/mL stock |
| Type I rat tail collagen | BD | 354236 |
참고문헌
- Wang, Z., et al. Human cholangiocytes form a polarized and functional bile duct on hollow fiber membranes. Front Bioeng Biotechnol. 10, 868857 (2022).
- Li, P., et al. Three-dimensional human bile duct formation from chemically induced human liver progenitor cells. Front Bioeng Biotechnol. 11, 1249769 (2023).
- Fabris, L., et al. Pathobiology of inherited biliary diseases: a roadmap to understand acquired liver diseases. Nat Rev Gastroenterol Hepatol. 16 (8), 497-511 (2019).
- Jalan-Sakrikar, N., et al. Central role for cholangiocyte pathobiology in cholestatic liver diseases. Hepatology. , (2024).
- Ilyas, S. I., Gores, G. J. Pathogenesis, diagnosis, and management of cholangiocarcinoma. Gastroenterology. 145 (6), 1215-1229 (2013).
- Perugorria, M. J., et al. Polycystic liver diseases: advanced insights into the molecular mechanisms. Nat Rev Gastroenterol Hepatol. 11 (12), 750-761 (2014).
- Masyuk, T. V., Masyuk, A. I., LaRusso, N. F. Polycystic liver disease: Advances in understanding and treatment. Annu Rev Pathol. 17, 251-269 (2022).
- Ji, R., et al. Multi-omics profiling of cholangiocytes reveals sex-specific chromatin state dynamics during hepatic cystogenesis in polycystic liver disease. J Hepatol. 78 (4), 754-769 (2023).
- Tabibian, J. H., et al. Characterization of cultured cholangiocytes isolated from livers of patients with primary sclerosing cholangitis. Lab Invest. 94 (10), 1126-1133 (2014).
- Muff, M. A., et al. Development and characterization of a cholangiocyte cell line from the PCK rat, an animal model of autosomal recessive polycystic kidney disease. Lab Invest. 86 (9), 940-950 (2006).
- Nagaya, M., Katsuta, H., Kaneto, H., Bonner-Weir, S., Weir, G. C. Adult mouse intrahepatic biliary epithelial cells induced in vitro to become insulin-producing cells. J Endocrinol. 201 (1), 37-47 (2009).
- Karjoo, S., Wells, R. G. Isolation of neonatal extrahepatic cholangiocytes. J Vis Exp. (88), e51621 (2014).
- Kudira, R., et al. Isolation and culturing primary chaolangiocytes from mouse liver. Bio Protoc. 11 (20), e4192 (2021).
- Ueno, Y., et al. Evaluation of differential gene expression by microarray analysis in small and large cholangiocytes isolated from normal mice. Liver Int. 23 (6), 449-459 (2003).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유