Method Article
عزل واستزراع الخلايا الصفراوية الأولية من الفئران المصابة بمرض الكبد المتعدد الكيسات باستخدام طريقة الهضم المكونة من خطوتين
In This Article
Summary
يصف هذا البروتوكول طريقة هضم محسنة من خطوتين لعزل الخلايا الصفراوية الأولية عالية النقاء وعالية الجدوى من الفئران والفئران البرية المصابة بمرض الكبد المتعدد الكيسات.
Abstract
في هذا البروتوكول ، قمنا بتحسين طريقة الهضم المكونة من خطوتين لعزل خلايا الأقنية الصفراوية الأولية عالية النقاء وعالية الجدوى من الفئران والفئران من النوع البري المصابة بمرض الكبد المتعدد الكيسات (PLD). بعد تخدير الفئران ، تم تخثر الكبد من خلال الوريد الأجوف السفلي مع 50 مل من المحلول أ ، متبوعا ب 30 مل من المحلول ب عند 37 درجة مئوية لهضم أنسجة الكبد إنزيميا. تم إجراء التفكك الميكانيكي والاهتزاز والتشريح المجهري لإزالة الخلايا المتني الملتصقة ، وترك شجرة صفراوية سليمة. ثم تم فرم الشجرة الصفراوية جيدا وهضمها مع الرج لمدة 60 دقيقة عند 37 درجة مئوية. تم جمع المعلق أحادي الخلية الناتج باستخدام مصفاة خلية 70 ميكرومتر. تم تنقية الخلايا الصفراوية باستخدام العزل المناعي المغناطيسي. تم تحضين تعليق الخلية بجسم مضاد مضاد ل EpCAM تحت الدوران لمدة 45 دقيقة عند 4 درجات مئوية ، متبوعا بإضافة حبات البروتين G ومزيد من الدوران لمدة 45 دقيقة أخرى عند 4 درجات مئوية. بعد ثلاث غسلات باستخدام PBS ، تم جمع الخلايا الصفراوية باستخدام فاصل مغناطيسي. تم تعليق الخلايا الصفراوية الأولية المنقاة في وسط زراعة الخلايا الصفراوية وزرعها في أطباق زراعة الخلايا المغلفة بكولاجين ذيل الفئران من النوع الأول 1 ملغم/مل. تم تأكيد نقاء الخلايا الصفراوية عن طريق التلوين المناعي للعلامة الخاصة بالخلايا الصفراوية السيتوكيراتين -19 (CK19). على الرغم من أن هذه الدراسة ركزت على عزل الخلايا الصفراوية الأولية من الفئران البرية و PLD ، إلا أننا واثقون من أنه يمكن تطبيق البروتوكول على نماذج الفئران الأخرى المرضية أيضا. تسهل طريقة الهضم المفصلة المكونة من خطوتين إجراء دراسات مختبرية لاعتلال القنوات الصفراوية وتطوير العلاجات المستهدفة.
Introduction
تشكل الخلايا الصفراوية ، وهي الخلايا الظهارية المبطنة للشجرة الصفراوية داخل الكبد ، طبقة أحادية الطبقة وتشكل ما يقرب من 3-5٪ من إجمالي خلايا الكبد1. تتصل هذه الخلايا داخل الكبد لإنشاء شبكة مجاري معقدة ثلاثية الأبعاد2. في ظل الظروف العادية ، تؤدي الخلايا الصفراوية وظائف حيوية ، بما في ذلك الإفراز والامتصاص وإصلاح الإصابات والعمل كحاجز مناعي ، وبالتالي تلعب دورا مهما في فسيولوجيا الكبد وعلم الأمراض. ومع ذلك ، يمكن أن يؤدي ضعف الخلايا الصفراوية إلى أمراض مختلفة ، بما في ذلك مرض PLD ، والتهاب الأقنية الصفراوية المصلب الأولي ، وسرطان القنوات الصفراوية ، وإصابة الكبد الصفراوية3،4،5.
من بين الأمراض المرتبطة باعتلال القنوات الصفراوية ، يبرز مرض PLD كاضطراب وراثي يتميز بتكوين العديد من الخراجات المملوءة بالسوائل التي تنشأ من خلايا القنوات الصفراوية. يؤدي التضخم التدريجي لهذه الخراجات إلى تقليل نوعية حياة المرضىبشكل كبير 6. لا تزال خيارات العلاج الحالية ل PLD غير كافية ، وتقدم فعالية محدودة بينما غالبا ما ترتبط بمعدلات تكرار عالية ومضاعفات7. هذا يسلط الضوء على الحاجة الملحة لتطوير استراتيجيات علاجية آمنة وفعالة لتلبية المتطلبات السريرية غير الملباة في إدارة PLD.
تم إعاقة البحث في آليات اعتلال القنوات الصفراوية ، بما في ذلك PLD ، بشكل كبير بسبب عدم وجود خطوط خلوية مناسبة. لمعالجة هذا القيد ، أثبت استخدام نماذج الفئران المرضية وعزل الخلايا الصفراوية الأولية عن هذه النماذج للتجارب في المختبر أنه لا يقدر بثمن للكشف عن الآليات الجزيئية الكامنة وراء اعتلال القنوات الصفراوية وتحديد الاستراتيجيات العلاجية المحتملة.
في دراستنا الأخيرة8 ، نجحنا في إنشاء نموذج فأر PLD باستخدام فئران الضربة القاضية المشروطة Pkd1 (KO). لوحظت تكيسات الكبد في وقت مبكر من شهر واحد بعد حذف Pkd1 وزاد حجمها تدريجيا بمرور الوقت. في حين أن بروتوكولات عزل الخلايا الصفراوية من الفئران والبشر موثقة جيدا9،10 ، فإن عزل الخلايا الصفراوية الأولية عن الفئران لا يزال يمثل تحديا خاصا نظرا لصغر حجمها والبنية المعقدة للوريد البابي والجهاز الصفراوي. تواجه الأساليب الحالية قيودا كبيرة ، بما في ذلك نقاء الخلايا المنخفض ، وضعف الجدوى ، والإجراءات المعقدة ، والتكاليفالمرتفعة 11،12.
تقدم هذه المخطوطة بروتوكولا مفصلا لعزل الخلايا الصفراوية الأولية عالية النقاء من الفئران باستخدام طريقة الهضم المكونة من خطوتين. يهدف هذا النهج الأمثل إلى دعم الدراسات المختبرية ، وتسهيل التحقيق في الآليات الجزيئية الكامنة وراء اعتلال الأقنية الصفراوية وتعزيز تطوير استراتيجيات علاجية جديدة.
Protocol
تمت الموافقة على جميع البروتوكولات التجريبية والعناية بالفئران من قبل اللجنة الأخلاقية لجامعة تيانجين الطبية (رقم الوثيقة: TMUa-MEC 2022016).
1. إعداد المعدات والحلول
- تعقيم الأدوات الجراحية (المقص والملقط ومقابض المشرط) عن طريق التعقيم قبل يوم واحد على الأقل من عزل الخلايا.
- قبل يوم واحد على الأقل من عزل الخلايا ، قم بإعداد وسط ثقافة الخلايا الصفراوية باستخدام الكواشف المدرجة في الجدول 1. قم بتعقيم وسط ثقافة الخلايا الصفراوية عن طريق تصفيتها من خلال مرشح 0.22 ميكرومتر.
- قبل يوم واحد على الأقل من عزل الخلايا ، قم بإعداد الحل A والمحلول B باستخدام الكواشف المدرجة في الجدول 2 لتروية كبد الفئران. قم بتعقيم المحلول A والمحلول B عن طريق التعقيم أو الترشيح من خلال مرشح 0.22 ميكرومتر وضبط درجة الحموضة إلى 7.35 باستخدام هيدروكسيد الصوديوم المعقم تحت التحريك اللطيف.
ملاحظة: يمكن تخزين وسط ثقافة الخلايا الصفراوية والمحلول A والمحلول B عند 4 درجات مئوية لمدة شهر واحد على الأقل. - قبل بدء التجربة ، أضف مسحوق الكولاجيناز II إلى المحلول B واخلطه برفق للحصول على تركيز نهائي يبلغ 0.5 مجم / مل. قم بتسخين كل من المحلول A والمحلول B في حمام مائي 37 درجة مئوية قبل الاستخدام.
- مباشرة قبل بدء التجربة ، قم بإعداد أطباق 6 سم مليئة ب PBS المعقم وضعها على الثلج لإبقائها باردة أثناء العملية.
2. نضح هضم أنسجة الكبد
- تخدير الفأر باستخدام جرعة زائدة من استنشاق الأيزوفلوران. ضع الفأر المخدر في وضع ضعيف وثبته بشريط لاصق لتسهيل الإجراء.
- افتح تجويف البطن للفأر بعد تعقيم البطن بنسبة 75٪ من الإيثانول ثم اربط عقدة حول الوريد الأجوف السفلي باستخدام إبرة متأرجحة. اشطف قسطرة وريدية 24 جم بالمحلول A باستخدام حقنة سعة 20 مل.
- أدخل القسطرة الوريدية في الوريد الأجوف السفلي أسفل العقدة المنزلقة ، وقم بتأمين العقدة المنزلقة ، وثبت القسطرة في مكانها بشريط لاصق.
- قم بتنقية الكبد ب 50 مل من المحلول A من خلال الوريد الأجوف السفلي باستخدام حقنة سعة 20 مل ، وشق الوريد البابي الكبدي لتصريف محلول التروية. حافظ على معدل التروية عند 10 مل / دقيقة.
- استمر في التروية باستخدام 30 مل من المحلول B الذي يحتوي على الكولاجيناز II بمعدل تدفق 3.5 مل / دقيقة باستخدام مضخة تمعجية.
ملاحظة: هذه الخطوة مخصصة لهضم أنسجة الكبد. - قم بإزالة أنسجة الكبد التي تم إغراقها بنجاح وضعها في طبق 6 سم مليء ب PBS المعقم البارد.
3. عزل الخلايا الصفراوية
ملاحظة: نظرا لأن عدد الخلايا الصفراوية في الفئران العادية منخفض نسبيا ، فمن المستحسن استخدام مجموعة من 2-6 فئران لهذا الإجراء. ومع ذلك ، بالنسبة لنماذج أمراض الفئران ذات التكاثر غير الطبيعي للخلايا الصفراوية ، مثل PLD ، فإن الخلايا الصفراوية من فأر واحد كافية. ما لم ينص على خلاف ذلك ، يجب دائما حفظ العينات والكواشف على الجليد ، ويجب تنفيذ جميع الإجراءات في خزانة السلامة البيولوجية.
- قم بفصل أنسجة الكبد ورجها ميكانيكيا باستخدام ملقط منحني. بعد ذلك ، قم بإجراء تشريح مجهري تحت مجهر تشريح لإزالة الخلايا المتني الملتصقة ، وترك شجرة صفراوية سليمة. قم بإزالة أنسجة المرارة قبل الانتقال إلى الخطوة التالية.
اغسل الأنسجة 2x باستخدام PBS. - قم بفرم الشجرة الصفراوية جيدا باستخدام شفرة جراحية ، وهضمها في 3 مل من محلول الهضم (الجدول 3) لكل فأر مع الرج (90 دورة في الدقيقة) عند 37 درجة مئوية لمدة 60 دقيقة. عند علامة 30 دقيقة، قم بسحب الخليط برفق باستخدام طرف ماصة لخلطه جيدا.
ملاحظة: يجب تحضير محلول الهضم طازجا قبل الاستخدام. - مرر معلق الخلية عبر مصفاة خلية 70 ميكرومتر. استخدم مكبس حقنة سعة 5 مل أو 10 مل للضغط برفق على تعليق الخلية من خلال المصفاة. اغسل المصفاة باستخدام PBS.
- جهاز الطرد المركزي لتعليق الخلية عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية. اغسل الخلايا 3 مرات باستخدام وسيط RPMI.
- جهاز الطرد المركزي مرة أخرى عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- تخلص من المادة الطافية وأعد تعليق الخلايا في 900 ميكرولتر من وسط RPMI الذي يحتوي على 40 وحدة / مل DNase I. أضف 2 ميكروغرام من الجسم المضاد المضاد ل EpCAM واحتضن التعليق على دوار (20 دورة في الدقيقة) عند 4 درجات مئوية لمدة 45 دقيقة.
- جهاز طرد مركزي عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- تخلص من المادة الطافية وأعد تعليق الخلايا في 1 مل من وسط RPMI الذي يحتوي على 40 وحدة / مل DNase I. حبات البروتين G المسبق مع 1 مل من وسط RPMI. أضف 20 ميكرولتر من حبات البروتين G إلى تعليق الخلية واحتضانها بالدوران (20 دورة في الدقيقة) عند 4 درجات مئوية لمدة 45 دقيقة أخرى.
ملاحظة: يمكن أيضا احتضان الجسم المضاد ل EpCAM مسبقا باستخدام حبيبات البروتين G لإنشاء مركب الأجسام المضادة للحبة قبل إدخال تعليق الخلية. - اغسل الخلايا 3x باستخدام PBS باستخدام فاصل مغناطيسي.
- قم بإجراء عد الخلايا وتقييم صلاحية الخلايا باستخدام تلطيخ التربان الأزرق (0.04٪ ، 3 دقائق) على مقياس كثافة الدم.
ملاحظة: ليست هناك حاجة لإزالة الخرزات من الخلايا الصفراوية ، فسوف تنفصل بشكل طبيعي بمجرد بدء الزراعة ولن تتداخل مع زراعة الخلايا.
4. ثقافة الخلايا الصفراوية
ملاحظة: قم بإعداد أطباق زراعة الخلايا الطازجة المطلية بالكولاجين من ذيل الفئران من النوع الأول قبل زراعة الخلايا الصفراوية. قم بتبريد جميع الكواشف على الجليد.
- باتباع تعليمات الشركة المصنعة ، امزج DDHالمعقم 2O و 10x PBS و 1 N NaOH وكولاجين ذيل الفئران من النوع الأول لتحقيق تركيز نهائي يبلغ 1 مجم / مل من النوع الأول من كولاجين ذيل الفئران في 1x PBS. قم بتغطية أطباق زراعة الخلايا بالتساوي بالخليط ، وضع الأطباق في حاضنة على حرارة 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2 لمدة 30 دقيقة للسماح للكولاجين بالتصلب.
- اغسل أطباق زراعة الخلايا المطلية بالكولاجين من النوع الأول باستخدام PBS الدافئ مسبقا.
- أعد تعليق الخلايا الصفراوية في وسط ثقافة الخلايا الصفراوية الدافئ مسبقا. قم بزرع معلق الخلية على أطباق زراعة الخلايا المغلفة بالكولاجين من النوع الأول من ذيل الفئران 1 مجم / مل واحتضانها عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2. استبدل الوسيط كل يومين.
5. مرور الخلايا الصفراوية وحفظها بالتبريد
- اغسل الخلايا الصفراوية مرتين باستخدام PBS ، ثم احتضن الخلايا في 0.25٪ تربسين عند 37 درجة مئوية لمدة 5-10 دقائق.
- أضف كمية متساوية من وسط ثقافة الخلايا الصفراوية لتحييد التربسين ، ثم جهاز الطرد المركزي عند 500 × جم لمدة 5 دقائق.
- قم بإعداد أطباق زراعة الخلايا المطلية بالكولاجين من النوع الأول كما هو موضح في الخطوة 4.1.
- اتبع الخطوتين 4.2 و 4.3.
- إذا كان الحفظ بالتبريد مطلوبا ، فقم بتعليق الخلايا الصفراوية في وسيط التخزين (9: 1 FBS: DMSO) وتخزينها في فريزر -80 درجة مئوية أو نيتروجين سائل. قم بإذابة الخلايا حسب الحاجة للاستخدام في المستقبل.
6. التحقق من صحة الخلايا الصفراوية
ملاحظة: تم تقييم نقاء الخلايا الصفراوية عن طريق تلطيخ علامة الخلايا الصفراوية CK19.
- اغسل الخلايا الصفراوية 2x باستخدام PBS ، ثم ثبت الخلايا في 4٪ بارافورمالدهيد لمدة 15 دقيقة.
- اغسل الخلايا الصفراوية باستخدام PBS ، ثم تخلل الخلايا بنسبة 1٪ Triton X-100 لمدة 8 دقائق.
- اغسل الخلايا الصفراوية باستخدام PBS ، ثم قم بسد الخلايا في 5٪ BSA لمدة 1 ساعة.
- اغسل الخلايا الصفراوية باستخدام PBS ، ثم احتضن الخلايا بالجسم المضاد الأساسي ضد CK19 (التخفيف 1:12 مع 2٪ BSA) طوال الليل عند 4 درجات مئوية.
- اغسل الخلايا الصفراوية 2x باستخدام PBS ، ثم احتضن الخلايا بالجسم المضاد الثانوي Alexa Fluor 488 المضاد للفئران (التخفيف 1: 1,000 مع PBS) لمدة ساعة واحدة في درجة حرارة الغرفة.
- اغسل الخلايا الصفراوية باستخدام PBS ، وصمة عار ب 4 '، 6-diamidino-2-phenylindole لمدة 15 دقيقة ، وراقبها تحت المجهر.
النتائج
يظهر مخطط سير العمل لعملية الهضم المكونة من خطوتين المستخدمة لعزل الخلايا الصفراوية في الشكل 1. يستغرق الإجراء بأكمله ~ 5 ساعات. أولا ، يتم غرق الكبد بالمحلول A من خلال الوريد الأجوف السفلي لإزالة الدم ، كما يتضح من شحوب الكبد. ثم يتم حشو الكبد بالمحلول B الذي يحتوي على الكولاجيناز II لبدء هضم الأنسجة. خطوة الهضم الأولية هذه حساسة للوقت ، ويتضح الهضم الناجح من خلال أن تصبح الأنسجة ناعمة بشكل ملحوظ. بعد ذلك ، يساعد التفكك الميكانيكي والاهتزاز اللطيف باستخدام ملقط منحني على إزالة خلايا الكبد. يتم تأكيد الهضم السليم عند انفصال عدد كبير من خلايا الكبد. تحت مجهر تشريح ، تتم إزالة الخلايا المتني الملتصقة المتبقية بعناية عن طريق التشريح المجهري ، تاركا شجرة صفراوية سليمة (الشكل 2).
في خطوة الهضم الثانية ، يتم تقسيم الأنسجة إلى معلق أحادي الخلية ، والذي لا يزال يحتوي على بعض خلايا الكبد والخلايا الليفية. أخيرا ، يتم الحصول على الخلايا الصفراوية عالية النقاء من هذا المعلق من خلال الفصل المناعي المغناطيسي. تم إجراء تقييم صلاحية الخلية باستخدام تلطيخ التربان الأزرق على مقياس كثافة الدم. أظهرت النتائج العزلة الناجحة للخلايا الصفراوية عالية الحيوية (الشكل 3). أكد تلطيخ التألق المناعي ل CK19 (الشكل 4) أن هذه الطريقة تنتج باستمرار خلايا القنوات الصفراوية عالية النقاء في الفئران.
عادة ما تلتصق الخلايا الصفراوية الأولية بسطح الثقافة وشكلت طبقة أحادية في غضون 24 ساعة تقريبا ، مما يدل على انتشار سريع خلال الممرات الثلاثة الأولى ، خاصة في نماذج أمراض الفئران مع انتشار غير طبيعي للخلايا الصفراوية ، مثل PLD (الشكل 5). ومع ذلك ، في الممرات اللاحقة ، انخفض معدل النمو ، وأصبحت الخلايا أكبر وطورت مورفولوجيا مفرغة. ليست هناك حاجة لإزالة الخرزات من الخلايا الصفراوية ، فسوف تنفصل بشكل طبيعي بمجرد بدء الزراعة ولن تتداخل مع زراعة الخلايا. لم يؤثر حفظ الخلايا بالتبريد وإذابتها بشكل كبير على بقاء الخلية.
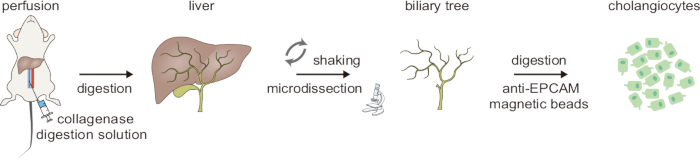
الشكل 1: نظرة عامة تخطيطية لعملية الهضم المكونة من خطوتين لعزل الخلايا الصفراوية. هذا الرقم مأخوذ من Ji et al8. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: صورة تمثيلية لشجرة القنوات الصفراوية المعزولة من فأر مصاب بمرض الكبد المتعدد الكيسات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 3: تقييم جدوى الخلية للخلايا الصفراوية المعزولة باستخدام تلطيخ التربان الأزرق. أشرطة المقياس = 50 ميكرومتر. الجسيمات السوداء الصغيرة المحيطة بالخلايا وداخل الخلفية هي حبات بروتين G. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
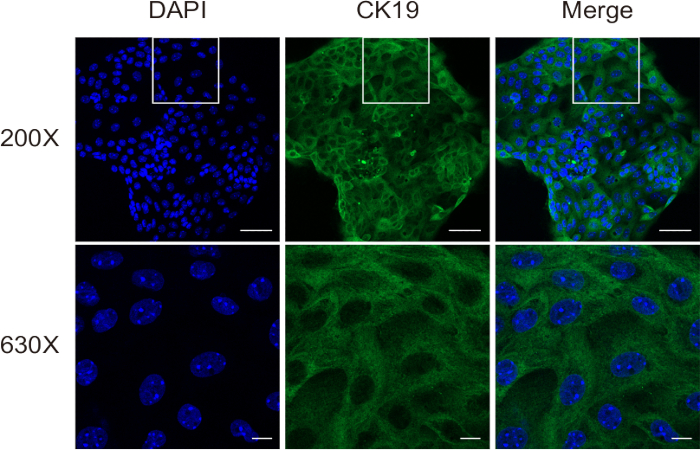
الشكل 4: تقييم نقاء الخلية للخلايا الصفراوية المعزولة باستخدام تلطيخ التألق المناعي ل CK19. قضبان المقياس: = 50 ميكرومتر [علوي] و 10 ميكرومتر [سفلي]. هذا الرقم مأخوذ من Ji et al8. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
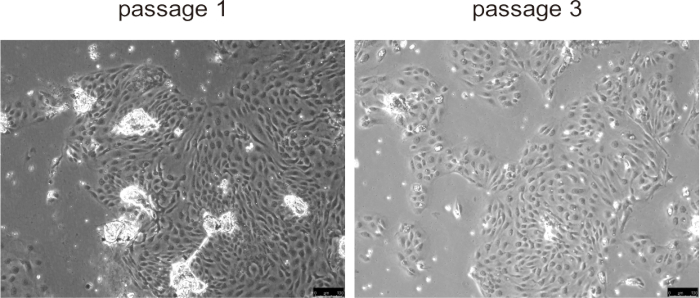
الشكل 5: صور تمثيلية للخلايا الصفراوية المعزولة في المقطع 1 والمقطع 3. أشرطة المقياس = 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مكونات | مبلغ |
| DMEM/F12 (1:1) | 415 مل |
| مصل الأبقار الجنينية (FBS) | 50 مل |
| الأحماض الأمينية غير الأساسية MEM (100x) | 5 مل |
| الأنسولين ترانسفيرين السيلينيوم (100x) | 5 مل |
| محلول فيتامين MEM (100x) | 5 مل |
| مركز الدهون المحدد كيميائيا (100x) | 5 مل |
| البنسلين الستربتومايسين (100x) | 5 مل |
| محلول الجنتاميسين/الأمفوتريسين (500x) | 1 مل |
| 100 ملي في Na بيروفات | 250 ميكرولتر |
| 10 مجم / مل مثبط التربسين فول الصويا | 2.5 مل |
| 200 ملي ل-جلوتامين | 5 مل |
| 10 ملغم/مل ديكساميثازون | 20 ميكرولتر |
| 1.7 مجم / مل 3،3 '، 5-triiodo-L-thyronine | 1 مل |
| 1 مجم / مل عامل نمو البشرة | 12.5 ميكرولتر |
| 20 ملي فورسكولين | 250 ميكرولتر |
| الإيثانولامين | 13 ميكرولتر |
الجدول 1: تكوين وسط ثقافة الخلايا الصفراوية.
| مكونات | مبلغ | |
| الحل أ | كلوريد الصوديوم | 4.0908 جرام |
| كيه سي إل | 0.1578 جرام | |
| نا2HPO4 | 0.1072 جرام | |
| هيبس | 2.9789 جرام | |
| 50 ملي ميغافور EGTA (درجة الحموضة = 8) | 5 مل | |
| 1.5 م ملجمسليد2 | 34 ميكرولتر | |
| ddH2O | 500 مل | |
| ملاحظة: اضبط الرقم الهيدروجيني على 7.35 باستخدام هيدروكسيد الصوديوم المعقم. | ||
| الحل ب | كلوريد الصوديوم | 4.0908 جرام |
| كيه سي إل | 0.1578 جرام | |
| نا2HPO4 | 0.1072 جرام | |
| هيبس | 2.9789 جرام | |
| 2 م CaCl2 | 1.25 مل | |
| ddH2O | 500 مل | |
| ملاحظة: اضبط الرقم الهيدروجيني على 7.35 باستخدام هيدروكسيد الصوديوم المعقم. يجب إضافة مسحوق الكولاجيناز II لتحقيق تركيز نهائي يبلغ 0.5 مجم / مل قبل الاستخدام. | ||
الجدول 2: تكوين الحل أ والمحلول ب.
| مكونات | مبلغ |
| 3.2 مجم / مل كولاجيناز الحادي عشر | 300 ميكرولتر |
| 10 ملغم/مل هيالورونيداز | 120 ميكرولتر |
| 10 وحدة / ميكرولتر DNase I | 12 ميكرولتر |
| البنسلين الستربتومايسين (100x) | 30 ميكرولتر |
| RPMI متوسط | 2.538 مل |
الجدول 3: تكوين محلول الهضم.
Discussion
يوفر هذا البروتوكول طريقة مفصلة لعزل الخلايا الصفراوية الأولية عالية النقاء من الفئران باستخدام عملية هضم من خطوتين ، مما يتيح دراسة الآليات الجزيئية الكامنة وراء اعتلال الأقنية الصفراوية. هناك العديد من الخطوات الحاسمة ضرورية لضمان العزلة الناجحة لخلايا القنوات الصفراوية.
تتمثل الخطوة الحاسمة الأولى في ضمان التروية والهضم الفعالين باستخدام الحل A والمحلول B. تم تأكيد التروية الناجحة مع المحلول A من خلال شحوب الكبد ، وتم تأكيد الهضم الناجح مع المحلول B من خلال أن أنسجة الكبد أصبحت ناعمة بشكل ملحوظ. الفشل في التروية من شأنه أن يعيق هضم أنسجة الكبد ويضر بالعزلة اللاحقة للشجرة الصفراوية. لتعزيز كفاءة الهضم ، يمكن للمرء زيادة أحجام الحل A والمحلول B ، أو تقليل معدل تدفق التروية ، أو الضغط برفق على الكبد باستخدام قطعة قطن.
تتضمن الخطوة الحاسمة الثانية فصل أنسجة الكبد ميكانيكيا وهزها برفق باستخدام ملقط منحني ، متبوعا بالتشريح المجهري تحت مجهر تشريح لإزالة الخلايا المتني الملتصقة وعزل شجرة صفراوية سليمة. كانت هذه الخطوة مفتاحا للحصول على خلايا القنوات الصفراوية عالية النقاء. يمكن تحسين الكفاءة عن طريق الإمساك بالقنوات الصفراوية الكبيرة بملقط منحني أثناء الاهتزاز والشطف باستخدام PBS البارد. إذا تم هضم الكبد بنجاح ، فسوف تنفصل العديد من خلايا الكبد ، مما يجعل التشريح الدقيق بسيطا نسبيا. ومع ذلك ، إذا كان الهضم غير مكتمل وكانت العينة ذات قيمة ، فستتطلب عملية التشريح المجهري جهدا مضنيا ، مما يزيد من عبء العمل ويحتمل أن يقلل من إنتاجية الخلية ونقائها. وبالتالي ، فإن ضمان التروية المناسبة مع الحل B لهضم الكبد كان أمرا بالغ الأهمية.
الخطوة الحاسمة الثالثة هي الهضم الثاني للشجرة الصفراوية لإنتاج معلق أحادي الخلية. يجب تحسين وقت الهضم من خلال مراقبة الخلايا تحت المجهر: قد يقلل فرط الهضم من قابلية الخلايا للحياة ، بينما يمكن أن يؤدي سوء الهضم إلى أنسجة صفراوية غير مستخدمة. بالإضافة إلى ذلك ، يساعد تضمين المضادات الحيوية المناسبة في جميع الكواشف على تقليل التلوث.
باستخدام بروتوكول الهضم المحسن المكون من خطوتين ، نجحنا في عزل الخلايا الصفراوية عالية النقاء والقابلة للحياة من الفئران. بينما ركزت هذه الدراسة على عزل الخلايا الصفراوية الأولية من نماذج الفئران البرية و PLD ، نحن واثقون من أنه يمكن تطبيق البروتوكول على نماذج الفئران الأخرى المرضية أيضا. أدت عملية الهضم الأولي لأنسجة الكبد لعزل الشجرة الصفراوية ، تليها خطوة هضم ثانية ، إلى تحسين كفاءة الفصل المناعي المغناطيسي بشكل كبير وأسفرت عن عدد أكبر من الخلايا القابلة للحياة. كانت الخلايا الصفراوية المعزولة مناسبة تماما للتجارب اللاجينية التي تتطلب قابلية عالية للحياة ، مثل ATAC-seq و ChIP-seq و ChIP-seq منخفضة المدخلات و CUT & TAG. بالإضافة إلى ذلك ، يمكن زراعة خلايا القنوات الصفراوية الأولية هذه في المختبر لإجراء فحوصات وظيفية مختلفة ، بما في ذلك النمو الكيسي ثلاثي الأبعاد ، وتكاثر الخلايا ، وموت الخلايا المبرمج ، وتحليل دورة الخلية.
في دراسة نشرتسابقا 8 ، قمنا بعزل كل من الخلايا الصفراوية الأولية الطبيعية والكيسية من الفئران البرية و PLD من كلا الجنسين. كشف التنميط متعدد الأومكس للخلايا الصفراوية الأولية من ذكور وإناث الفئران PLD عن ديناميكيات جينية خاصة بالجنس في الخلايا الصفراوية أثناء تكوين المثانة الكبدية. علاوة على ذلك ، حددنا استراتيجية علاجية جينية محتملة لمرضى PLD الذكور من خلال التثبيط الدوائي للإنزيمات المعدلة اللاجينية في كل من نماذج الفئران PLD والتجارب المختبرية مع الخلايا الصفراوية الأولية.
يقدم نهجنا العديد من المزايا البارزة مقارنة بطرق عزل الخلايا الصفراوية المنشورة حاليا. بالمقارنة مع طريقة Kudira et al.13 ، والتي تتضمن هضم أنسجة الكبد مباشرة إلى معلق أحادي الخلية بعد هضم التروية ، متبوعا بالطرد المركزي المتدرج والعزل المناعي المغناطيسي ، فإن طريقتنا أبسط وأكثر فعالية من حيث التكلفة وأكثر كفاءة. الميزة الرئيسية هي عزل الشجرة الصفراوية قبل العزل المناعي المغناطيسي ، مما يحسن العملية الشاملة. بالإضافة إلى ذلك ، من خلال عدم الحاجة إلى إزالة الخرز من الخلايا الصفراوية ، تحقق هذه الطريقة عائدا أعلى وقابلية محسنة للخلايا المعزولة. بالمقارنة مع طريقة Ueno et al.14 ، التي تفصل وتفرم بقايا القناة البابية من نضح هضم الكبد لثقافة ثلاثية الأبعاد ، تليها فترة ثقافة مدتها 7 أيام قبل توليد تعليق أحادي الخلية ، فإن طريقتنا أكثر كفاءة من حيث الوقت. عزل الشجرة الصفراوية ، متبوعا بالعزل المناعي المغناطيسي ، يعزز أيضا نقاء الخلية بشكل كبير.
ومع ذلك ، على الرغم من هذه المزايا ، لا تزال تقنية الهضم المكونة من خطوتين بها بعض القيود. إنه كثيف العمالة نسبيا ، ويسمح فقط بعدد محدود من الممرات ، ويتطلب تشريحا دقيقا لتجنب التلوث المتني.
في الختام ، قمنا بتطوير وتحسين طريقة هضم من خطوتين لعزل الخلايا الصفراوية الأولية عالية النقاء وعالية الصلاحية من الفئران. يوفر هذا النهج أداة قيمة لدراسة الآليات الجزيئية الكامنة وراء اعتلال القنوات الصفراوية ويوفر أساسا لتحديد الاستراتيجيات العلاجية المحتملة.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم دعم هذا العمل من خلال منح من لجنة التعليم في بلدية تيانجين (2022ZD054 إلى LZ)
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 μm filter | PALL | 4612 | |
| 0.25% Trypsin | Gibco | 25200-056 | |
| 10 mL syringe | KONSMED | 10 mL 1.2*30TWLB | |
| 20 mL syringe | KONSMED | 20 mL 1.2*30TWLB | |
| 24 G intravenous catheter | WEGO | 24GX19 mm/Y-G | |
| 3,3',5-triiodo-L-thyronine | Sigma | T5516 | 1.7 mg/mL stock |
| 4% paraformaldehyde | Solarbio | P1110 | |
| 5 mL syringe | KONSMED | 5 mL 0.7*30TWLB | |
| 6 cm dishes | Thermo Scientific | 150462 | |
| 70 µm cell strainer | Corning | 352350 | |
| anti-CK19 antibody | DSHB | TROMA-III | |
| anti-EpCAM antibody | DSHB | G8.8 | |
| BSA | Solarbio | A8020 | |
| CaCl2 | Sangon Biotech | A501330 | 2 M stock |
| Chemically-defined lipid concentrate (100x) | Gibco | 11905-031 | |
| Collagenase II | Worthington | LS004176 | |
| Collagenase XI | Sigma | C7657 | 3.2 mg/mL stock |
| Dexamethasone | Sigma | D1756 | 10 mg/mL stock |
| Dissecting Microscope | Leica | EZ4 | |
| DMEM/F12 (1:1) | VivaCell biosciences | C3130-0500 | |
| DMSO | Sigma | D2650 | |
| DNase I | Sigma | D4513 | 10 U/μL stock |
| Donkey anti-rat Alexa Fluor 488 secondary antibody | Invitrogen | A21208 | |
| EGTA | Solarbio | E8050 | 50 mM (PH = 8) stock |
| Epidermal growth factor (1 mg/mL) | Sigma | SRP3196 | |
| Ethanolamine | Sigma | E9508 | |
| Fetal Bovine Serum | VivaCell biosciences | C04001-500 | |
| Forskolin | Sigma | F3917 | 20 mM stock |
| Gentamicin/amphotericin solution (500x) | Gibco | R01510 | |
| Hemocytometer | QIUJING | XB.K.25. | |
| HEPES | Sigma | H4034 | |
| Hyaluronidase | Sigma | H3506 | 10 mg/mL stock |
| Insulin-transferrin-selenium (100x) | Gibco | 41400045 | |
| Isoflurane | RWD | R510-22-10 | |
| KCl | Sangon Biotech | A100395 | |
| L-Glutamine (200 mM) | Sigma | G7513 | |
| Magnetic separator | Promega | Z5342 | |
| MEM non-essential amino acids (100x) | Gibco | 11140050 | |
| MEM vitamin solution (100x) | Gibco | 11120052 | |
| MgCl2 | Sangon Biotech | A100288 | 1.5 M stock |
| Na Pyruvate (100 mM) | Gibco | 11360070 | |
| Na2HPO4 | Sangon Biotech | A600487 | |
| NaCl | Sangon Biotech | A610476 | |
| NaOH | Sangon Biotech | A620617 | 1 N stock |
| PBS | VivaCell biosciences | C3580-0500 | |
| PBS | Solarbio | P1010 | |
| Penicillin-Streptomycin (100x) | Gibco | 15140-122 | |
| Peristaltic pump | BaodingRongbai | YZ1515PPS | |
| Protein G beads | Invitrogen | 10004D | |
| Rotator | Kylin-Bell | QB-528 | |
| RPMI | VivaCell biosciences | C3010-0500 | |
| Soybean trypsin inhibitor | Sigma | T6522 | 10 mg/mL stock |
| Swaged needle | Jinhuan Medical | HM601 | |
| Triton X-100 | Solarbio | T8200 | |
| Trypan blue | Sigma | T6146 | 10 mg/mL stock |
| Type I rat tail collagen | BD | 354236 |
References
- Wang, Z., et al. Human cholangiocytes form a polarized and functional bile duct on hollow fiber membranes. Front Bioeng Biotechnol. 10, 868857 (2022).
- Li, P., et al. Three-dimensional human bile duct formation from chemically induced human liver progenitor cells. Front Bioeng Biotechnol. 11, 1249769 (2023).
- Fabris, L., et al. Pathobiology of inherited biliary diseases: a roadmap to understand acquired liver diseases. Nat Rev Gastroenterol Hepatol. 16 (8), 497-511 (2019).
- Jalan-Sakrikar, N., et al. Central role for cholangiocyte pathobiology in cholestatic liver diseases. Hepatology. , (2024).
- Ilyas, S. I., Gores, G. J. Pathogenesis, diagnosis, and management of cholangiocarcinoma. Gastroenterology. 145 (6), 1215-1229 (2013).
- Perugorria, M. J., et al. Polycystic liver diseases: advanced insights into the molecular mechanisms. Nat Rev Gastroenterol Hepatol. 11 (12), 750-761 (2014).
- Masyuk, T. V., Masyuk, A. I., LaRusso, N. F. Polycystic liver disease: Advances in understanding and treatment. Annu Rev Pathol. 17, 251-269 (2022).
- Ji, R., et al. Multi-omics profiling of cholangiocytes reveals sex-specific chromatin state dynamics during hepatic cystogenesis in polycystic liver disease. J Hepatol. 78 (4), 754-769 (2023).
- Tabibian, J. H., et al. Characterization of cultured cholangiocytes isolated from livers of patients with primary sclerosing cholangitis. Lab Invest. 94 (10), 1126-1133 (2014).
- Muff, M. A., et al. Development and characterization of a cholangiocyte cell line from the PCK rat, an animal model of autosomal recessive polycystic kidney disease. Lab Invest. 86 (9), 940-950 (2006).
- Nagaya, M., Katsuta, H., Kaneto, H., Bonner-Weir, S., Weir, G. C. Adult mouse intrahepatic biliary epithelial cells induced in vitro to become insulin-producing cells. J Endocrinol. 201 (1), 37-47 (2009).
- Karjoo, S., Wells, R. G. Isolation of neonatal extrahepatic cholangiocytes. J Vis Exp. (88), e51621 (2014).
- Kudira, R., et al. Isolation and culturing primary chaolangiocytes from mouse liver. Bio Protoc. 11 (20), e4192 (2021).
- Ueno, Y., et al. Evaluation of differential gene expression by microarray analysis in small and large cholangiocytes isolated from normal mice. Liver Int. 23 (6), 449-459 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved