Method Article
Измерение поглощения аналога глюкозы, 6-(N-(7-нитробенз-2-окса-1,3-диазол-4-ил)амино)-6-дезоксиглюкозы, в интактной нервной сетчатке мышей
В этой статье
Резюме
Различные типы клеток сетчатки, включая эндотелиальные клетки, нейроны и глиальные клетки, экспрессируют переносчики глюкозы (GLUT), чтобы обеспечить поглощение глюкозы клетками. Используя ex vivo нервную сетчатку мыши и флуоресцентный аналог глюкозы 6-NBDG, мы описываем относительно быстрый и недорогой метод измерения поглощения глюкозы всей сетчаткой мыши.
Аннотация
Сетчатка представляет собой высокометаболическую ткань с несколькими типами клеток, требующих глюкозы и ее производных для производства энергии в форме АТФ. Клетки сетчатки, включая эндотелиальные клетки, нейроны, фоторецепторы и глиальные клетки, экспрессируют транспортеры глюкозы (GLUTs; например, GLUT1-4), чтобы обеспечить поглощение глюкозы для производства энергии. GLUT1 является наиболее обильно экспрессируемым транспортером глюкозы в сетчатке. Этот протокол позволяет исследователям измерять поглощение глюкозы в нервной сетчатке мыши в условиях ex vivo с использованием флуоресцентного аналога глюкозы 6-(N-(7-Nitrobenz-2-oxa-1,3-diazol-4-yl)amino)-6-дезоксиглюкозы (6-NBDG). После диссекции сетчатки общий уровень 6-NBDG в сетчатке может быть легко определен с помощью измерения конечной точки флуоресценции с помощью планшетного ридера. Для консистенции мы рекомендуем нормализовать результаты до уровня общего белка. Несмотря на то, что 6-NBDG обладает высокой специфичностью для GLUT1, поглощение этого аналога обнаруживается в присутствии ингибитора GLUT1 BAY-876. Таким образом, этот анализ обеспечивает относительно быстрый и недорогой метод измерения поглощения глюкозы ex vivo в нервной сетчатке всей мыши, которая частично опосредована GLUT1.
Введение
Глюкоза является важным метаболитом для нервной сетчатки, где она используется для обеспечения высоких скоростей гликолиза и митохондриального дыхания для производства энергии в форме аденозинтрифосфата (АТФ)1. Поскольку глюкоза является предпочтительным энергетическим субстратом, многие клетки сетчатки экспрессируют транспортеры глюкозы (GLUT), чтобы облегчить поглощение глюкозы из сосудистой сети и окружающих тканей2. GLUT включают в себя семейство внутренних мембранных гликопротеинов, которые отвечают за транспорт глюкозыв клетки млекопитающих. GLUT transporter-1 (GLUT1) является основным транспортером глюкозы в сетчатке, экспрессируемым вовсех слоях сетчатки 4 и капиллярными эндотелиальными клетками, составляющими гемато-ретинальный барьер (BRB)5. Интересно, что при нейродегенеративных заболеваниях центральной нервной системы (ЦНС), включая болезнь Альцгеймера, снижение уровня белка GLUT1 и поглощения глюкозы предшествует атрофии мозга и нейрональной дисфункции у человека 6,7. В модели глазной гипертензии на крысах более низкие уровни GLUT1 также наблюдались в капиллярах8. Сниженный транспорт глюкозы во внешнюю сетчатку участвует в потере фоторецепторов у животных моделей пигментного ретинита человека, а также может играть роль в нейродегенерации сетчатки, например, при глаукоме. Таким образом, необходимо понимание транспорта глюкозы в нервной сетчатке, чтобы установить ее роль в нейродегенерации сетчатки.
В данной статье мы описываем новый, недорогой и простой биохимический метод измерения поглощения 6-NBDG в нервной сетчатке мышей ex vivo , т.е. исключая пигментный эпителий сетчатки и сосудистую оболочку. По сравнению с другими флуоресцентными аналогами, такими как 2-NBDG, 6-NBDG состоит из глюкозной части, на которой флуоресцентная нитробензодиазоаминовая группа замещает гидроксильную группу на углероде 6, предотвращая фосфорилирование гексокиназой и дальнейшееметаболическое разрушение9. Несмотря на то, что 6-NBDG обладает высокой специфичностью к GLUT1 со сродством связывания в 300 раз выше, чем у глюкозы9, мы обнаруживаем поглощение этого аналога в присутствии ингибиторов GLUT110. Таким образом, этот анализ обеспечивает относительно быстрый и недорогой метод измерения поглощения глюкозы ex vivo во всей сетчатке мыши, которая частично опосредована GLUT1.
Измерение поглощения глюкозы тканями в режиме реального времени является сложной задачей, часто требующей радиоизотопного мечения или методов визуализации с высоким разрешением. В данном случае мы используем флуоресцентный биохимический анализ для быстрого определения поглощения 6-NBDG в нескольких образцах сетчатки в условиях ex vivo . Протокол предоставляет информацию об общем поглощении глюкозы сетчаткой; он не предоставляет информации об уровнях поглощения 6-NBDG клетками сетчатки.
протокол
Все описанные здесь методы были одобрены Комитетом по уходу за животными и их использованию (IACUC) Медицинского центра Университета Вандербильта.
1. Подготовка к анализу
ПРИМЕЧАНИЕ: Подготовку следует проводить в день проведения анализа непосредственно перед проведением анализа. Это необходимо из-за чувствительности протокола ко времени.
- Общая подготовка перед экспериментом
ПРИМЕЧАНИЕ: 6-NBDG светочувствителен и должен быть защищен от света. Накройте все растворы 6-NBDG алюминиевой фольгой.- Исходный раствор 5 мМ 6-NBDG в 50% DMSO/1x PBS стабилен при -20 °C в течение 6 месяцев. Приготовьте стоковый раствор и сохраните 500 мкл аликвот для будущих анализов.
- Положите на лед коническую трубку объемом 50 мл с нейробазальной средой А (без глюкозы).
- Убедитесь, что водяная баня установлена на 37 °C.
- Пометьте 4 × 1,5 мл микроцентрифужных пробирок на сетчатку: 1) глюкозное голодание, 2) инкубация 6-NBDG, 3) ультразвуковая обработка и 4) пробирка для сбора образца для анализа Пирса (т.е. если всего у вас четыре сетчатки, вам понадобится 16 микроцентрифужных пробирок). На рисунке 1 приведена краткая информация о настройке трубки.
- Добавьте 200 мкл нейробазальной среды А из конической пробирки объемом 50 мл на льду в предварительно помеченные ультразвуковые пробирки и положите на лед для шага 2.5.4.
- Питание на считывателе пластин.
- Настройте информацию о планшете в программном обеспечении для чтения планшетов с помощью функции анализа флуоресцентной конечной точки со следующими параметрами: возбуждение 483 нм, излучение 550 нм и пороговое значение 530 нм (параметры, заранее определенные для 6-NBDG).
- Подготовка реагента перед экспериментом: 6-NBDG
- Сделайте рабочий раствор 6-NBDG в нейробазальной среде А в конечной концентрации 500 мкМ путем разведения 5 мМ запаса, полученного на шаге 1.1.1.
ПРИМЕЧАНИЕ: Не забудьте накрыть все растворы 6-NBDG алюминиевой фольгой. Приготовьте соответствующий объем рабочего раствора 6-NBDG в 500 мкМ для всего анализа (требуется 200 мкл рабочего раствора 6-NBDG на сетчатку; укажите дополнительный объем для погрешности и количество, необходимое для создания стандартных растворов, в шаге 2.4.). - Пипетку 200 мкл рабочего раствора 6-NBDG в предварительно маркированные пробирки, изготовленные на этапе 1.1.4 для стадии инкубации 6-NBDG.
- Сделайте рабочий раствор 6-NBDG в нейробазальной среде А в конечной концентрации 500 мкМ путем разведения 5 мМ запаса, полученного на шаге 1.1.1.
2. Проведение анализа поглощения 6-NBDG
ПРИМЕЧАНИЕ: Пошаговый обзор приведен на рисунке 2 .
- Диссекция ткани сетчатки
- Успокойте мышь с помощью ингаляционной анестезии изофлураном (2% изофлуран в 5% углекислом газе/95% кислорода).
ПРИМЕЧАНИЕ: Убедитесь, что мышь адекватно обезболивается, ущипнув подушечку лапы на обеих задних лапах. При правильном обезболивании не должно быть никаких дергательных движений (рефлекс отхода педалей). Если есть рефлекторное движение, вернитесь к пункту 2.1.1. - Усыпьте мышь путем вывиха шейки матки с последующим обезглавливанием, а затем быстро усыпьте глаза. Поместите энуклеированные глаза в чашку Петри, наполненную 5-10 мл ледяной нейробазальной среды А (без глюкозы) на льду.
ПРИМЕЧАНИЕ: Ниже приведены основные рекомендации по диссекции нервной сетчатки (за исключением пигментного эпителия сетчатки и сосудистой оболочки); Для получения более подробных инструкций и рекомендаций обратитесь к ранее опубликованному протоколу11 и следуйте разделу «Диссекция сетчатки мыши». - Поместите чашку Петри под диссекционный микроскоп на лед.
- Сложите безворсовую салфетку в небольшой квадрат и смочите его нейробазальным фильтром А.
- Нанесите глаз на влажную безворсовую салфетку с помощью пластиковой пипетки для переноса с обрезанным концом.
ПРИМЕЧАНИЕ: Безворсовая салфетка обеспечивает повышенное трение, предотвращая движение глаза во время вскрытия. - Возьмите иглу 26 G и проколите сторону роговицы перед лимбом.
- С помощью ножниц Vannas разрежьте вдоль лимба от точки прокола до удаления роговицы.
- После удаления роговицы захватите склеру на полпути между лимбом и диском зрительного нерва с помощью щипцов. С помощью другой пары щипцов в противоположной руке возьмитесь за линзу и быстро снимите ее одним быстрым движением.
ПРИМЕЧАНИЕ: Если хрусталик удаляется медленно, сетчатка будет оставаться прикрепленной к хрусталику и ее будет трудно препарировать. - Переложите наглазник в чашку Петри с холодным нейробазалом А на льду.
- Используя щипцы обеими руками, возьмите наглазник и осторожно держите чашку у ora serrata.
- Чтобы освободить чашечку сетчатки от склеры, зажмите склеру с помощью щипцов, стараясь не зажать ткань сетчатки.
- Осторожно проведите щипцами между склеральной тканью и тканью сетчатки по всему глазному яблоку, пока вся сетчатка не освободится от лимба.
- С помощью ножниц Ваннас сделайте небольшой разрез в склере в области лимба.
- Возьмите щипцы, чтобы захватить края разреза и отделить склеральную ткань вплоть до области головки зрительного нерва. Возьмитесь за склеру с помощью щипцов в недоминантной руке и аккуратно отведите сетчатку от склеры с помощью закрытых щипцов в доминирующей руке.
- Отрежьте ножницами корешок зрительного нерва, чтобы полностью отделить сетчатку от склеры и любого оставшегося зрительного нерва.
- Перенесите сетчатку с помощью обрезанной переносной пипетки в заранее подготовленную микроцентрифужную пробирку объемом 1,5 мл для глюкозного голодания с шага 1.1.4, которая содержит 200 мкл нейробазально-А среды (без глюкозы)-1 сетчатки на пробирку.
- Успокойте мышь с помощью ингаляционной анестезии изофлураном (2% изофлуран в 5% углекислом газе/95% кислорода).
- Этап глюкозного голодания
- Перенесите пробирки с шага 2.1.14 на водяную баню при температуре 37 °C и выдерживайте при 37 °C в течение 20 минут.
- Инкубация NBDG
- Перенесите каждую сетчатку в новую предварительно помеченную пробирку для инкубации 6-NBDG на этапе 1.1.4, которая содержит 200 μL 500 μM 6-NBDG в нейробазальной среде А на этапе 1.2.2.
ПРИМЕЧАНИЕ: Сетчатка должна быть передана с помощью переводной пипетки, которая была вырезана для увеличения наконечника и переноса сетчатки с минимальными повреждениями. Кроме того, это можно сделать с помощью пинцета, если вы уверены в своей способности перенести сетчатку без повреждений. - Переведите трубки на водяную баню при температуре 37 °C и инкубируйте при 37 °C в течение 60 минут.
- Перенесите каждую сетчатку в новую предварительно помеченную пробирку для инкубации 6-NBDG на этапе 1.1.4, которая содержит 200 μL 500 μM 6-NBDG в нейробазальной среде А на этапе 1.2.2.
- Приготовление стандартов 6-NBDG (диапазон концентраций 0 мкМ-40 мкМ)
ПРИМЕЧАНИЕ: Подготовьте стандарты в течение 60-минутного инкубационного периода 6-NBDG (шаг 2.3.2). Стандарты можно готовить при комнатной температуре. Защищайте растворы от света.- Маркируйте микроцентрифужные пробирки объемом 1,5 мл #1-8 для 8 стандартов (см. Рисунок 3).
- Для стандарта #1 (40 мкМ 6-NBDG) пипетка 32 мкл 500 мкМ 6-NBDG стокового раствора, выполненного на шаге 1.2.1.
- Добавьте 368 мкл нейробазальной среды А в микроцентрифужную пробирку и тщательно перемешайте пипетированием вверх и вниз.
- Для стандартов #2-8 последовательно разбавляйте образцы следующим образом:
- Пипетка 200 мкл нейробазальной среды А в пробирки #2-8.
- Возьмите 200 мкл из стандартной пробирки #1 и наденьте его пипеткой в пробирку #2, затем тщательно перемешайте с пипеткой, пипетируя вверх и вниз.
- Возьмите 200 μЛ из стандартной пробирки #2 и сделайте пипетку пипеткой в стандартную пробирку #3. Тщательно перемешайте с помощью пипетки, пипетируя вверх и вниз.
- Возьмите 200 мкл из стандартной пробирки #3 и направьте ее пипеткой в пробирку #4, затем тщательно перемешайте, пипетируя вверх и вниз.
- Возьмите 200 мкл из стандартной пробирки #4 и направьте ее пипеткой в пробирку #5, затем тщательно перемешайте, пипетируя вверх и вниз.
- Возьмите 200 μл из стандартной пробирки #5 и пипетируйте ее в пробирку #6, затем тщательно перемешайте, пипетируя вверх и вниз.
- Возьмите 200 μЛ из стандартной пробирки #6 и пипетируйте ее в пробирку #7, затем тщательно перемешайте, пипетируя вверх и вниз.
- В пробирку #8 не добавляйте дополнительный раствор (т.е. он должен содержать только 200 мкл нейробазальной среды А, добавленной на шаге 2.4.4.1.).
- Промывка, ультразвуковая обработка и центрифугирование для сбора образцов
- Извлеките все трубки из водяной бани при температуре 37 °C после завершения 60-минутной инкубации 6-NBDG.
- Промойте каждую сетчатку 500 мкл ледяной нейробазальной среды А как можно быстрее и тщательнее.
- Чтобы умыться, удалите раствор 6-NBDG с помощью пипетки, стараясь не касаться и не повреждать ткани сетчатки.
ПРИМЕЧАНИЕ: Существует также возможность переноса сетчатки с помощью пинцета из инкубационной пробирки 6-NBDG в свежую пробирку, содержащую 500 мкл нейробазальной среды А. Затем вам нужно будет сделать всего 3 дополнительных промывки. Сделайте это, если вас устраивает ваша способность не повредить сетчатку пинцетом. - Затем слейте раствор в соответствующий контейнер для отходов. Немедленно пипеткой внесите 500 мкл холодной нейробазальной среды в ту же пробирку взамен раствора, который был удален. Заменяйте трубки на льду между стирками.
- Чтобы умыться, удалите раствор 6-NBDG с помощью пипетки, стараясь не касаться и не повреждать ткани сетчатки.
- Повторите еще 3 раза, всего 4 стирки.
- С помощью переводной пипетки с обрезанным краем или пинцета осторожно перенесите сетчатку в ультразвуковые трубки, содержащие нейробазальную среду А на льду (см. шаг 1.1.4).
- Измельчите сетчатку на мелкие кусочки с помощью небольших ножниц для препарирования.
ПРИМЕЧАНИЕ: Обязательно мойте инструменты в этаноле между разрезаниями каждой сетчатки, чтобы не загрязнить другие образцы. - Обрабатывайте каждую сетчатку ультразвуком в течение 5-10 с с амплитудой 10 и немедленно положите ее обратно на лед.
ПРИМЕЧАНИЕ: Обязательно очистите ультразвуковой щуп между образцами 100% этанолом, а затем сверхчистым H2O. На этом этапе либо предварительно охладите центрифугу до 4 °C, либо используйте центрифугу в холодильной камере с температурой 4 °C, если таковая имеется. - Центрифуга при 4 °C в течение 15 мин при максимальной скорости 21130 x g or, если она меньше 21130 x g.
ПРИМЕЧАНИЕ: Во время 15-минутной центрифуги на шаге 2.5.7 пипетируйте 100 мкл стандартов #1-8, изготовленных на шаге 2.4, в черную 96-луночную пластину с прозрачным дном.
- Считывание образцов на планшетном считывателе
- После окончания 15-минутной работы центрифуги удалите 100 мкл надосадочной жидкости и поместите пипетку в 96-луночный планшет.
- Вставьте пластину в считыватель пластин.
ПРИМЕЧАНИЕ: Планшет должен содержать 100 мкл каждого образца и 100 мкл каждого стандарта. - В программном обеспечении для чтения планшетов выберите анализ флуоресцентной конечной точки с параметрами, выбранными на шаге 1.1.7.
- Запустите анализ и сохраните результаты.
- Пипетки с 96-луночного планшета в предварительно помеченные пробирки из 1.1.4 для анализа Пирса.
ПРИМЕЧАНИЕ: На этом этапе образцы могут быть немедленно проанализированы на белок (см. ниже) или храниться при температуре -80 °C.
- Проба Пирса для нормализации белка
ПРИМЕЧАНИЕ: Для повышения точности анализ Пирса должен проводиться в двух экземплярах (как стандартных, так и образцовых).- Используя стандарты анализа предварительно разбавленных белков по методу Пирса, пипетку по 10 мкл каждого из них в двух экземплярах в 96-луночную прозрачную донную пластину.
- Пипетку по 10 мкл каждого из образцов в двух экземплярах, начиная с шага 2.6.5, в 96-луночный планшет.
- Добавьте 150 мкл реагента Пирса во все лунки, содержащие стандарты или образцы. Накройте пластину на 96 лунок и перемешивайте в шейкере на средней скорости в течение 1 минуты.
- Инкубируйте планшет при комнатной температуре (RT) в течение 5 минут.
- Вставьте пластину в считыватель пластин. Выберите анализ конечной точки поглощения и установите длину волны на 660 нм.
- Измерьте впитываемость стандартов и образцов и сохраните результаты. Рассчитайте общее содержание белка в микрограмме в каждом образце, построив стандартную кривую.
- Расчет поглощения 6-NBDG сетчаткой.
ПРИМЕЧАНИЕ: Результаты 6-NBDG должны быть нормализованы по общему содержанию белка из-за неравномерных размеров сетчатки.- Используя значения интенсивности флуоресценции, полученные на шаге 2.6, используйте показания флуоресценции от заранее определенных стандартов для построения стандартной кривой флуоресценции 6-NBDG и количественного определения концентрации 6-NBDG (μM) в каждом образце.
- Нормализуйте результаты образца до соответствующего количества белка для определения белка [6-NBDG] μM/μг.
Результаты
На рисунке 4 представлены репрезентативные измерения флуоресценции глюкозы из сетчатки мыши WT, инкубированной с 6-NBDG в течение различных периодов времени. После 30-минутной инкубации уровни 6-NBDG составляли в среднем 336 ± 27,91 а.е., тогда как через 60 минут уровни 6-NBDG увеличивались в среднем до 616,3 ± 8,38 а.е. Дальнейшая инкубация в течение 30 мин привела к снижению уровня 6-NBDG (506,4 ± 5,3 а.е.). Через 60 мин вариабельность результатов была минимальной и, таким образом, было выбрано в качестве оптимального времени для инкубации сетчатки с 6-NBDG. Обратите внимание, что единицы измерения произвольны и что эти результаты не были нормализованы по общему белку.
На рисунке 5 показаны измерения флуоресценции глюкозы из сетчатки мыши WT, инкубированной с 6-NBDG и ингибитором GLUT1 BAY-876 (конечная концентрация 100 мкМ). Наблюдалось снижение поглощения 6-NBDG на 24%, что позволяет предположить, что существуют GLUT1-независимые механизмы поглощения 6-NBDG в сетчатке нервной системы мыши.
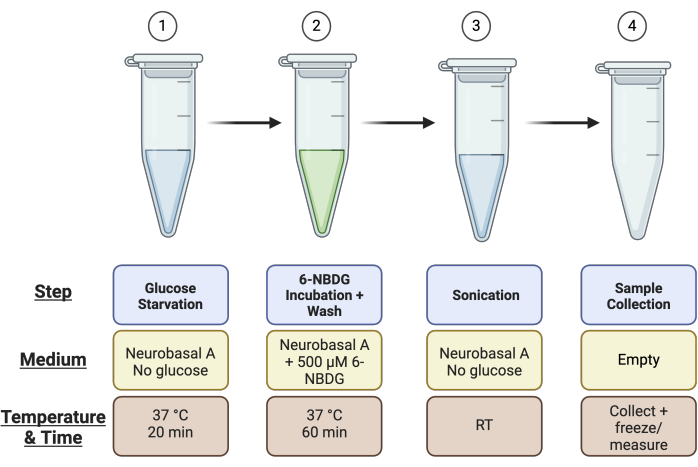
Иллюстрация 1: Схематический обзор настройки трубки для анализа. Перед проведением анализа установите 4 пробирки для каждого образца сетчатки, как описано: пробирка 1 для стадии «Глюкозное голодание», пробирка 2 для стадии «Инкубация 6-NBDG», пробирка 3 для «Ультразвуковой обработки» и пробирка 4 для «Сбора образцов». Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Схематический обзор протокола. После диссекции нервной сетчатки образцы сетчатки немедленно помещают на лед в нейробазальную среду А (без глюкозы). Затем образцы сетчатки переносят на водяную баню при температуре 37°C на 20 минут для этапа «Глюкозного голодания». Затем образцы перекладывают в пробирки для этапа «Инкубация 6-NBDG», где они остаются на водяной бане при температуре 37 °C в течение 60 минут. После инкубации образцы сетчатки промывают. Их либо перекладывают в свежие пробирки, содержащие 500 мкл ледяной нейробазальной среды А (без глюкозы), и затем промывают 3 раза, либо промывают 4 раза 500 мкл ледяной нейробазальной среды А (без глюкозы), если они остаются в той же пробирке на этапе инкубации 6-NBDG. Наконец, образцы измельчают, обрабатывают ультразвуком и центрифугируют при давлении 21130 x g , прежде чем надосадочная жидкость переносится в пробирку для сбора образцов. Затем образцы считываются на планшетном ридере с использованием функции флуоресцентного конечного анализа с возбуждением на длине волны 483 нм, излучением на длине волны 550 нм и отсечкой на длине волны 530 нм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Генерация стандартов 6-NBDG путем последовательного разбавления. Создание стандартных концентраций 6-NBDG путем последовательного разбавления стокового раствора 500 мкМ с использованием нейробазальной среды А на этапах 1-8 в пробирках с маркировкой 1-8, как показано на рисунке. Пробирка 8 содержит только нейробазальную среду А (без 6-NBDG). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Репрезентативные измерения флуоресценции глюкозы для оптимизации времени инкубации 6-NBDG. Репрезентативные показания флуоресценции после инкубации с 6-NBDG через 30 мин, 60 мин и 90 мин. Контрольный образец без 6-NBDG инкубировали в течение 90 мин (90С). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Поглощение 6-NBDG в присутствии ингибитора GLUT1 (WTi; 100 мкМ BAY-876). Результаты поглощения 6-NBDG с использованием сетчатки дикого типа (WT), инкубированной без ингибитора (WT) и в присутствии 100 мкМ BAY-876 (WTi). Результаты нормализовались по общему уровню белка, а затем по отношению к образцу WT без ингибитора. Количество животных указано в столбцах (WT = 9 сетчатка от 9 животных и WTi = 3 сетчатка от 3 животных). Статистический критерий = непараметрический критерий Манна-Уитни, p = 0,0074. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Таким образом, описанный метод позволяет исследователям фундаментальных наук измерять поглощение флуоресцентного аналога глюкозы, 6-NBDG, в мышиной нервной сетчатке ex vivo . Глюкоза является важным метаболитом для нервной сетчатки, ее поглощение поддерживает высокие показатели гликолиза и митохондриального дыхания, необходимые для производства энергии в форме аденозинтрифосфата (АТФ)1. Поскольку глюкоза является предпочтительным энергетическим субстратом, многие клетки сетчатки экспрессируют транспортеры глюкозы (GLUT), чтобы облегчить поглощение глюкозы из сосудистой сети и окружающих тканей2. Протокол позволяет исследователям быстро и недорого оценить поглощение глюкозы на мышиных моделях заболеваний сетчатки. Кроме того, метод также может быть легко переведен для использования на сетчатке крысы или других тканях, представляющих интерес.
Есть несколько важных аспектов протокола, которые обеспечат его успех. Анализ чувствителен ко времени, поэтому важно, чтобы все реагенты и пробирки были подготовлены заранее; Это гарантирует, что остальная часть анализа пройдет гладко. Важно учитывать, что после 90 минут инкубации с 6-NBDG наблюдается снижение измерения флуоресценции (рис. 4), что может указывать на ухудшение здоровья сетчатки. Таким образом, необходимо проявлять большую осторожность при соблюдении времени инкубации. Кроме того, рассечение свежей сетчатки является первым ограничивающим скорость этапом процедуры; Медленная или плохо рассеченная сетчатка может привести к ошибочным результатам, поскольку здоровье сетчатки со временем ухудшается в среде, не содержащей глюкозы. В этом протоколе изложены основные этапы диссекции нервной сетчатки мышей (за исключением пигментного эпителия сетчатки и сосудистой оболочки); Тем не менее, для исследователей, которые не имеют опыта в этой методике, можно обратиться к более глубокому ранее опубликованному протоколу11. Диссекция сетчатки является наиболее важным этапом в протоколе, мы рекомендуем исследователям тратить не более 1 минуты на каждый глаз для вскрытия. Если время вскрытия меньше, рассмотрите возможность проведения процедуры с меньшим количеством образцов, чтобы ограничить вариабельность.
Для обеспечения согласованности и ограничения вариабельности между образцами, флуоресцентные показания 6-NBDG должны быть нормализованы до общего белка сетчатки. При этом учитываются изменения размера сетчатки, которые могут возникать, например, с возрастом. Для улучшения согласованности в этом протоколе использовалась вся сетчатка без разрезов или преднамеренного повреждения. Тем не менее, с учетом диапазона обнаружения 6-NBDG, проверенного по стандартной кривой (0-40 мкМ), и с постоянными уровнями флуоресцентной ткани всей сетчатки в пределах 10-20 мкМ, возможно, что может быть использовано меньшее количество ткани сетчатки. Тем не менее, воздействие разреза сетчатки может привести к некоторому уровню несоответствия полученным результатам.
У этого протокола есть некоторые ограничения. Предположения относительно механизма, с помощью которого 6-NBDG поглощаются клетками, позволяют предположить, что поглощение 6-NBDG может происходить через GLUT1-независимые от транспортеров механизмы10. Результаты с ингибитором GLUT1 BAY-876 подтверждают эту идею; BAY-876 сократил 6-NBDG всего на 24% (Рисунок 5); однако концентрация BAY-876 не была тщательно проверена в этом протоколе. Тем не менее, описанный здесь экспериментальный план может быть использован для проведения дополнительных исследований в отношении специфичности 6-NBDG и его поглощения в сетчатке, например, для изучения потенциального поглощения 6-NBDG GLUT3 и GLUT2, которые также присутствуют в сетчатке, хотя и на гораздо более низком уровне, чем GLUT15. Еще одним важным ограничением этого анализа является то, что он количественно оценивает общее поглощение 6-NBDG сетчаткой, и, следовательно, невозможно определить специфическое для клеток поглощение 6-NBDG с помощью этого протокола.
Важно отметить, что у описанного протокола есть некоторые преимущества. Анализ не основан на объективной визуализации поглощения глюкозы в тканях, например, в тканях мозга12. Методы визуализации в реальном времени для обнаружения поглощения флуоресцентного аналога могут быть как сложными, так и дорогостоящими, этот протокол упрощает анализ поглощения для относительно высокопроизводительного анализа поглощения 6-NBDG сетчаткой. Описанный анализ может быть также распространен на другие флуоресцентные аналоги глюкозы (например, 2-NBDG)13, для которых известны параметры флуоресцентного возбуждения и излучения. В заключение следует отметить, что этот анализ обеспечивает относительно быструю, недорогую и стабильную оценку поглощения глюкозы в тканях сетчатки, что позволяет избежать использования дорогостоящих или трудоемких методов визуализации. Понимание изменений в поглощении глюкозы тканями сетчатки имеет решающее значение при заболеваниях зрительной системы, где изменения в метаболизме являются ключевым патофизиологическим событием14.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа финансировалась из неограниченных ведомственных фондов, предоставленных Лорен К. Уэрхэм.
Материалы
| Name | Company | Catalog Number | Comments |
| # 5 forceps | Katena | K5-6550 | Used for retina dissection |
| 1.5 mL microcentrifuge tubes | Thermo Fisher Scientific | 05-408-129 | |
| 26 G x 5/8" needle | sol-M | 112658 | Used to puncture cornea during dissection |
| 5 mL tubes | MTC bio | c2540 | |
| 50 mL tubes | Avantor by VWR | 89039-656 | |
| 6-NBDG | Invitrogen | N23106 | Fluorescent gucose analog |
| 96 well plates black with clear bottom | Thermo Fisher Scientific | 265301 | |
| Anesthetic Charcoal Filter Cannister | ReFresh | EZ-258 | Used in anesthesia set up |
| BAY-876 | Millipore Sigma | SML1774 | For inhibition of GLUT1. |
| Centrifuge at 4 °C | Eppendorf | EPP-5424 | |
| Compressed gas (5% carbon dioxide, 95% oxygen) | Airgas | UN3156 | Used in anesthesia set up |
| curved forceps | Roboz surgical instrument | RS-5137 | Used for retina dissection |
| DDH2O | Elga LabWater | Elga PureLab Ultra | Used after ethanol to clean sonicator in between samples |
| Dissecting microscope | Olympus | szX12 | Used for retina dissection |
| Ethanol 200 proof | Decon laboratories | 2701 | To be used to clean sonicator in between samples |
| Foam floating tube rack | Thermo Fisher Scientific | 36-099-2328 | For tubes during incubation in water bath steps |
| General scissors | Roboz surgical instrument | RS-680 | Used for retina dissection |
| Isoflurane 250 mL bottle | Piramal critical care | NDC 6679401725 | Anesthesia |
| Isoflurane equipment | Vetequip sold by VWR | 89012-492 | Used to anesthetize prior to euthanasia |
| Kim wipes | VWR | 82003-820 | |
| Microplate reader | Molecular devices | SpectraMax M2 microplate reader | Used to read sample |
| Neurobasal- A media | Gibco | 12349-015 | |
| Nose cone (low profile anesthesia mask) | Kent Scientific | SOMNO-0801 | Used to deliver ansethesia |
| Objective on dissecting microscope | Olympus | DF plapo 1x pf | Used for retina dissection |
| Petri dish | VWR | 25384-088 | Used during retina dissection |
| Pierce assay reagent | Thermo Fisher Scientific | 1861426 | |
| Pipette tips P20 | Olympus Plastics | 26-404 | |
| Pipette tips P200, P1000, P10 XL | VWR | 76322-150, 76322-154, 76322-132 | |
| Pipetteman pipettes P200, P1000, P20, P10 | VWR | F144055M, F144056M, F144058M, F144059M | |
| SoftMax Pro software on computer | Molecular devices | SoftMax Pro 7 software | Software used to read sample |
| Sonic dismembrator | Thermo Fisher Scientific | FB50110 | Sonicate sample (retina) |
| Transfer pipettes | Fisherbrand | 13-711-9AM | Used to transfer retina from one tube to another |
| Vannas spring scissors | Katena | K4-5000 | Used for retina dissection |
| Water bath set to 37 °C | N/A | N/A | Used for incubation |
Ссылки
- Casson, R. J., Chidlow, G., Crowston, J. G., Williams, P. A., Wood, J. P. M. Retinal energy metabolism in health and glaucoma. Prog Retin Eye Res. 81, 100881 (2021).
- Daniele, L. L., et al. Glucose uptake by GLUT1 in photoreceptors is essential for outer segment renewal and rod photoreceptor survival. FASEB J. 36 (8), e22428 (2022).
- Fernandes, R., Hosoya, K. -. I., Pereira, P. Reactive oxygen species downregulate glucose transport system in retinal endothelial cells. Am J Physiol Cell Physiol. 300 (4), C927-C936 (2011).
- Badr, G. A., Tang, J., Ismail-Beigi, F., Kern, T. S. Diabetes downregulates GLUT1 expression in the retina and its microvessels but not in the cerebral cortex or its microvessels. Diabetes. 49 (6), 1016-1021 (2000).
- Kumagai, A. K. Glucose transport in brain and retina: implications in the management and complications of diabetes. Diabetes Metab Res Rev. 15 (4), 261-273 (1999).
- Winkler, E. A., et al. GLUT1 reductions exacerbate Alzheimer's disease vasculo-neuronal dysfunction and degeneration. Nat Neurosci. 18 (4), 521-530 (2015).
- Mosconi, L., et al. Hypometabolism exceeds atrophy in presymptomatic early-onset familial Alzheimer's disease. J Nucl Med. 47 (11), 1778-1786 (2006).
- Moreno, M., et al. Morphological and morphometric changes in rat optic nerve microvessels in a glaucoma experimental model. Arch Soc Esp Oftalmol. 89 (12), 471-476 (2014).
- Barros, L. F., et al. Kinetic validation of 6-NBDG as a probe for the glucose transporter GLUT1 in astrocytes. J Neurochem. 109 (s1), 94-100 (2009).
- Hamilton, K. E., Bouwer, M. F., Louters, L. L., Looyenga, B. D. Cellular binding and uptake of fluorescent glucose analogs 2-NBDG and 6-NBDG occurs independent of membrane glucose transporters. Biochimie. 190, 1-11 (2021).
- Feigenspan, A., Babai, N. Z. Preparation of horizontal slices of adult mouse retina for electrophysiological studies. J Vis Exp. 119, e55173 (2017).
- Lundgaard, I., et al. Direct neuronal glucose uptake heralds activity-dependent increases in cerebral metabolism. Nat Commun. 6 (1), 6807 (2015).
- Zou, C., Wang, Y., Shen, Z. 2-NBDG as a fluorescent indicator for direct glucose uptake measurement. J Biochem Biophys Methods. 64 (3), 207-215 (2005).
- Wareham, L. K., et al. Solving neurodegeneration: common mechanisms and strategies for new treatments. Mol Neurodegener. 17 (1), 23 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены