Method Article
Medición de la absorción del análogo de glucosa, 6-(N-(7-nitrobenz-2-oxa-1,3-diazol-4-il)amino)-6-desoxiglucosa, en retina neural murina intacta
En este artículo
Resumen
Múltiples tipos de células en la retina, incluidas las células endoteliales, las neuronas y las células gliales, expresan transportadores de glucosa (GLUT) para permitir la absorción de glucosa en las células. Utilizando retina neuronal de ratón ex vivo y el análogo de glucosa fluorescente 6-NBDG, describimos un método relativamente rápido y barato para medir la absorción de glucosa en toda la retina del ratón.
Resumen
La retina es un tejido altamente metabólico con múltiples tipos de células que requieren glucosa y sus derivados para producir energía en forma de ATP. Las células de la retina, incluidas las células endoteliales, las neuronas, los fotorreceptores y las células gliales, expresan transportadores de glucosa (GLUT; por ejemplo, GLUT1-4) para permitir la absorción de glucosa para la producción de energía. GLUT1 es el transportador de glucosa más abundantemente expresado en la retina. Este protocolo permite a los investigadores medir la absorción de glucosa en la retina neural murina en condiciones ex vivo utilizando el análogo de glucosa fluorescente 6-(N-(7-Nitrobenz-2-oxa-1,3-diazol-4-il)amino)-6-Desoxiglucosa (6-NBDG). Después de la disección de la retina, los niveles totales de 6-NBDG en la retina se pueden determinar fácilmente mediante la medición del punto final de fluorescencia utilizando un lector de placas. Para mantener la consistencia, recomendamos normalizar los resultados a los niveles totales de proteína. Aunque el 6-NBDG es altamente específico para GLUT1, la absorción de este análogo se detecta en presencia del inhibidor de GLUT1 BAY-876. Como tal, este ensayo proporciona un método relativamente rápido y económico para medir la absorción de glucosa ex vivo en la retina neural completa del ratón, que está parcialmente mediada por GLUT1.
Introducción
La glucosa es un metabolito esencial para la retina neural, donde se utiliza para alimentar altas tasas de glucólisis y respiración mitocondrial para producir energía en forma de trifosfato de adenosina (ATP)1. Dado que la glucosa es el sustrato energético preferido, muchas células de la retina expresan transportadores de glucosa (GLUT) para facilitar la absorción de glucosa de la vasculatura y el tejido circundante2. Las glut comprenden una familia de glicoproteínas de membrana intrínsecas que son responsables del transporte de glucosa a las células de mamíferos3. El transportador GLUT-1 (GLUT1) es el principal transportador de glucosa en la retina, expresado a través de las capas retinianas4 y por las células endoteliales capilares que componen la barrera hematorretiniana (BRB)5. Curiosamente, en las enfermedades neurodegenerativas del sistema nervioso central (SNC), incluida la enfermedad de Alzheimer, una reducción en los niveles de proteína GLUT1 y la absorción de glucosa preceden a la atrofia cerebral y la disfunción neuronal en los seres humanos 6,7. En un modelo de hipertensión ocular en ratas, también se observaron niveles más bajos de GLUT1 en los capilares8. La reducción del transporte de glucosa a la retina externa está implicada en la pérdida de fotorreceptores en modelos animales de retinitis pigmentosa humana y también puede desempeñar un papel en la neurodegeneración de la retina, como la observada en el glaucoma. Por lo tanto, se requiere una comprensión del transporte de glucosa en la retina neural para establecer su papel en la neurodegeneración de la retina.
Aquí, describimos un método bioquímico novedoso, barato y sencillo para medir la absorción de 6-NBDG en la retina neural murina ex vivo , es decir, excluyendo el epitelio pigmentado de la retina y la coroides. En comparación con otros análogos fluorescentes como el 2-NBDG, el 6-NBDG está compuesto por una fracción de glucosa en la que un grupo nitrobenzoxidiazoamino fluorescente reemplaza al grupo hidroxilo en el carbono 6, evitando la fosforilación por hexoquinasa y una mayor degradación metabólica9. Aunque el 6-NBDG tiene una alta especificidad para GLUT1, con una afinidad de unión 300 veces mayor que la glucosa9, detectamos la captación de este análogo en presencia de inhibidores de GLUT110. Como tal, este ensayo proporciona un método relativamente rápido y económico para medir la absorción de glucosa ex vivo en toda la retina del ratón, que está parcialmente mediada por GLUT1.
La medición de la absorción de glucosa en los tejidos en tiempo real es un reto, ya que a menudo requiere el marcaje de radioisótopos o métodos de obtención de imágenes de alta resolución. Aquí, empleamos un ensayo bioquímico fluorescente para determinar rápidamente la absorción de 6-NBDG en múltiples muestras de retina en condiciones ex vivo . El protocolo proporciona información sobre la absorción total de glucosa en la retina; no proporciona información sobre los niveles específicos de captación de 6-NBDG en las células de la retina.
Protocolo
Todos los métodos descritos aquí han sido aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) del Centro Médico de la Universidad de Vanderbilt.
1. Preparación para el ensayo
NOTA: La preparación debe llevarse a cabo el día del ensayo, inmediatamente antes de realizar el ensayo. Esto es necesario debido a la naturaleza sensible al tiempo del protocolo.
- Preparación general antes del experimento
NOTA: El 6-NBDG es sensible a la luz y debe protegerse de la luz. Cubra todas las soluciones de 6-NBDG con papel de aluminio.- Una solución madre de 5 mM 6-NBDG en 50% DMSO/1x PBS es estable a -20 °C durante 6 meses. Prepare una solución madre y almacene 500 μL de alícuotas para futuros ensayos.
- Coloque un tubo cónico de 50 mL de medio Neurobasal-A (sin glucosa) sobre hielo.
- Asegúrese de que el baño de agua esté ajustado a 37 °C.
- Etiquete 4 × tubos de microcentrífuga de 1,5 ml por retina: 1) inanición de glucosa, 2) incubación de 6-NBDG, 3) sonicación y 4) tubo de recogida de muestras para el ensayo de Pierce (es decir, si tiene cuatro retinas en total, necesitará 16 tubos de microcentrífuga). Consulte la Figura 1 para obtener un resumen de la configuración del tubo.
- Añadir 200 μL de medio neurobasal A del tubo cónico de 50 mL en hielo a los tubos de sonicación premarcados y poner en hielo para el paso 2.5.4.
- Encienda el lector de placas.
- Configure la información de la placa en el software del lector de placas utilizando la función de ensayo de punto final de fluorescencia con los siguientes parámetros: excitación 483 nm, emisión 550 nm y corte 530 nm (parámetros predeterminados para 6-NBDG).
- Preparación de reactivos antes del experimento: 6-NBDG
- Hacer una solución de trabajo de 6-NBDG en medio neurobasal-A a una concentración final de 500 μM diluyendo el stock de 5 mM hecho en el paso 1.1.1.
NOTA: Recuerde cubrir todas las soluciones de 6-NBDG con papel de aluminio. Prepare un volumen adecuado de 500 μM de solución de trabajo de 6-NBDG para todo el ensayo (necesitará 200 μL de solución de trabajo de 6-NBDG por retina; incluya el volumen adicional para el error y las cantidades necesarias para crear soluciones estándar en el paso 2.4). - Pipetear 200 μL de solución de trabajo de 6-NBDG en los tubos premarcados de la etapa 1.1.4 para la etapa de incubación de 6-NBDG.
- Hacer una solución de trabajo de 6-NBDG en medio neurobasal-A a una concentración final de 500 μM diluyendo el stock de 5 mM hecho en el paso 1.1.1.
2. Ejecución del ensayo de absorción de 6-NBDG
NOTA: Consulte la Figura 2 para obtener una descripción general paso a paso.
- Disección de tejido retiniano
- Sedar al ratón con anestesia inhalada con isoflurano (2% de isoflurano en 5% de dióxido de carbono/95% de oxígeno).
NOTA: Confirme que el ratón está adecuadamente anestesiado pellizcando la almohadilla de ambos pies traseros. Si se anestesia adecuadamente, no debe haber movimientos bruscos (reflejo de retirada del pedal). Si hay un movimiento reflejo, regrese al paso 2.1.1. - Eutanasia al ratón mediante dislocación cervical seguida de decapitación y luego enuclear rápidamente los ojos. Coloque los ojos enucleados en una placa de Petri llena de 5-10 mL de medio neurobasal-A helado (sin glucosa) en hielo.
NOTA: A continuación se presentan las pautas básicas para la disección neural de la retina (excluyendo el epitelio pigmentario de la retina y la coroides); Para obtener instrucciones y orientación más detalladas, consulte un protocolo11 publicado anteriormente y siga la sección "Disección de retina en ratones". - Coloque la placa de Petri bajo un microscopio de disección en hielo.
- Dobla una toallita sin pelusa en un cuadrado pequeño y humedécelo con el medio Neurobasal A.
- Transfiera un ojo a la toallita húmeda y sin pelusa con una pipeta de transferencia de plástico con el extremo recortado.
NOTA: La toallita sin pelusa proporciona una mayor fricción para evitar que el ojo se mueva durante la disección. - Tome una aguja de 26 G y perfore el lado de la córnea anterior al limbo.
- Use las tijeras Vannas para cortar a lo largo del limbo desde el punto de punción para extraer la córnea.
- Una vez que se haya extirpado la córnea, agarre la esclerótica a medio camino entre el limbo y la cabeza del nervio óptico con un par de pinzas. Con otro par de pinzas en la mano opuesta, agarre la lente y retírela rápidamente con un movimiento rápido.
NOTA: Si el cristalino se retira lentamente, la retina permanecerá adherida al cristalino y será difícil de diseccionar. - Transfiera la copa del ojo a una placa de Petri con Neurobasal A frío en hielo.
- Usando pinzas en ambas manos, tome la copa del ojo y sostenga con cuidado la copa en la ora serrata.
- Para liberar la copa de la retina de la esclerótica, sujete la esclerótica con pinzas, teniendo cuidado de no sujetar el tejido de la retina.
- Deslice las pinzas con cuidado entre el tejido escleral y el tejido de la retina alrededor de todo el globo hasta que toda la retina se libere del limbo.
- Con las tijeras Vannas, haga una pequeña incisión en la esclerótica en el limbo.
- Tome pinzas para agarrar los bordes de la incisión y despegue el tejido escleral hasta la región de la cabeza del nervio óptico. Agarre la esclerótica con pinzas en la mano no dominante y guíe suavemente la retina lejos de la esclerótica con pinzas cerradas en la mano dominante.
- Cortar la cabeza del nervio óptico con unas tijeras para separar la retina completamente de la esclerótica y de cualquier nervio óptico que quede.
- Transfiera la retina con una pipeta de transferencia recortada al tubo de microcentrífuga de 1,5 ml preparado previamente para la inanición de glucosa del paso 1.1.4, que contiene 200 μl de retina neurobasal-A media (sin glucosa)-1 por tubo.
- Sedar al ratón con anestesia inhalada con isoflurano (2% de isoflurano en 5% de dióxido de carbono/95% de oxígeno).
- Paso de inanición de glucosa
- Transfiera los tubos del paso 2.1.14 a un baño de agua a 37 °C e incube a 37 °C durante 20 minutos.
- Incubación de NBDG
- Transfiera cada retina a un nuevo tubo premarcado para la incubación de 6-NBDG del paso 1.1.4, que contiene 200 μL de 500 μM de 6-NBDG en medio neurobasal-A del paso 1.2.2.
NOTA: La retina debe transferirse utilizando una pipeta de transferencia que se haya cortado para agrandar la punta y transferir la retina con un daño mínimo. Además, esto se puede hacer con pinzas si se confía en la capacidad de transferir la retina sin dañarla. - Transfiera los tubos al baño de agua a 37 °C e incube a 37 °C durante 60 min.
- Transfiera cada retina a un nuevo tubo premarcado para la incubación de 6-NBDG del paso 1.1.4, que contiene 200 μL de 500 μM de 6-NBDG en medio neurobasal-A del paso 1.2.2.
- Preparación de patrones 6-NBDG (rango de concentración 0 μM-40 μM)
NOTA: Prepare los patrones durante el período de incubación de 6-NBDG de 60 min (paso 2.3.2.). Los patrones se pueden preparar a temperatura ambiente. Proteja las soluciones de la luz.- Etiquete los tubos de microcentrífuga de 1.5 mL #1-8 para los 8 estándares (consulte la Figura 3).
- Para el estándar #1 (40 μM 6-NBDG), pipetee 32 μL de 500 μM de solución madre de 6-NBDG fabricada en el paso 1.2.1.
- Añada 368 μl de medio neurobasal-A en el tubo de microcentrífuga y mezcle bien pipeteando hacia arriba y hacia abajo.
- Para los estándares # 2-8, diluya las muestras en serie de la siguiente manera:
- Pipetear 200 μL de medio neurobasal-A en los tubos #2-8.
- Tome 200 μL del tubo estándar #1 y pipetee en el tubo #2, luego mezcle bien con la pipeta pipeteando hacia arriba y hacia abajo.
- Tome 200 μL del tubo estándar #2 y pipetee en el tubo estándar #3. Mezcle bien con la pipeta pipeteando hacia arriba y hacia abajo.
- Tome 200 μL del tubo estándar # 3 y pipetee en el tubo # 4, luego mezcle bien pipeteándolo hacia arriba y hacia abajo.
- Tome 200 μL del tubo estándar # 4 y pipetee en el tubo # 5, luego mezcle bien pipeteándolo hacia arriba y hacia abajo.
- Tome 200 μL del tubo estándar # 5 y pipetee en el tubo # 6, luego mézclelo bien pipeteándolo hacia arriba y hacia abajo.
- Tome 200 μL del tubo estándar # 6 y pipetee en el tubo # 7, luego mézclelo bien pipeteándolo hacia arriba y hacia abajo.
- No agregue solución adicional al tubo # 8 (es decir, debe contener solo 200 μL de medio neurobasal-A agregado en el paso 2.4.4.1.).
- Lavado, sonicación y centrifugación para la recogida de muestras
- Retire todos los tubos del baño de agua a 37 °C una vez que se haya completado la incubación de 60 minutos con 6-NBDG.
- Lave cada retina con 500 μL de medio neurobasal-A helado lo más rápido y cuidadosamente posible.
- Para lavar, retire la solución de 6-NBDG con una pipeta, asegurándose de no tocar ni alterar el tejido de la retina.
NOTA: También existe la opción de transferir la retina con pinzas del tubo de incubación 6-NBDG a un tubo nuevo que tenga 500 uL de medio neurobasal-A. Luego, solo tienes que hacer 3 lavados adicionales. Haga esto si se siente cómodo con su capacidad de no dañar la retina con pinzas. - Luego, deseche la solución en un recipiente de desechos apropiado. Pipetear inmediatamente 500 μL de medio neurobasal-A frío en el mismo tubo para reemplazar la solución que se extrajo. Reemplace los tubos con hielo entre lavados.
- Para lavar, retire la solución de 6-NBDG con una pipeta, asegurándose de no tocar ni alterar el tejido de la retina.
- Repita 3 veces más para un total de 4 lavados.
- Con una pipeta de transferencia con el borde recortado o pinzas, transfiera cuidadosamente la retina a los tubos de sonicación que contienen medio neurobasal A en hielo (ver paso 1.1.4).
- Corta la retina en pedazos pequeños con unas tijeras de disección pequeñas.
NOTA: Asegúrese de lavar las herramientas en etanol entre el corte de cada retina para no contaminar otras muestras. - Sonicar cada retina durante 5-10 s en una amplitud de 10 e inmediatamente volver a colocarla en hielo.
NOTA: Asegúrese de limpiar la sonda de sonicación entre muestras con etanol al 100% seguido de H2O ultrapuro. En este punto, preenfríe la centrífuga a 4 °C o utilice la centrífuga en una cámara frigorífica a 4 °C, si está disponible. - Centrifugar a 4 °C durante 15 min a una velocidad máxima de 21130 x g or si es inferior a 21130 x g.
NOTA: Durante la centrífuga de 15 minutos en el paso 2.5.7, pipetee 100 μL de patrones #1-8 hechos en el paso 2.4 en una placa de 96 pocillos de fondo transparente y negro.
- Lectura de muestras en un lector de placas
- Una vez finalizada la centrífuga de 15 minutos, extraiga 100 μL de sobrenadante y pipetee en la placa de 96 pocillos.
- Inserte la placa en el lector de placas.
NOTA: La placa debe tener 100 μL de cada muestra y 100 μL de cada patrón. - En el software del lector de placas, seleccione el ensayo de punto final de fluorescencia con los parámetros seleccionados en el paso 1.1.7.
- Ejecute el ensayo y guarde los resultados.
- Pipetee muestras de la placa de 96 pocillos en los tubos premarcados de 1.1.4 para el ensayo Pierce.
NOTA: En este punto, las muestras pueden analizarse inmediatamente para detectar proteínas (véase más abajo) o almacenarse a -80 °C.
- Ensayo de Pierce para la normalización de proteínas
NOTA: El ensayo Pierce debe ejecutarse por duplicado (tanto estándares como muestras) para aumentar la precisión.- Utilizando los estándares de ensayo de proteínas prediluidas del ensayo Pierce, pipetee 10 μl de cada uno por duplicado en una placa inferior transparente de 96 pocillos.
- Pipetear 10 μL de cada una de las muestras por duplicado del paso 2.6.5 en la placa de 96 pocillos.
- Añada 150 μL de reactivo Pierce a todos los pocillos que contengan patrones o muestras. Cubra el plato de 96 pocillos y mezcle en un agitador de platos a velocidad media durante 1 min.
- Incubar la placa a temperatura ambiente (RT) durante 5 min.
- Inserte la placa en el lector de placas. Seleccione el ensayo de punto final de absorbancia y ajuste la longitud de onda a 660 nm.
- Mida la absorbancia de los patrones y las muestras y guarde los resultados. Calcule el total de microgramos de proteína en cada muestra trazando una curva estándar.
- Cálculo de la captación retinal de 6-NBDG.
NOTA: Los resultados de 6-NBDG deben normalizarse al contenido total de proteínas debido a los tamaños desiguales de la retina.- Utilizando los valores de intensidad de fluorescencia obtenidos en el paso 2.6, utilice las lecturas de fluorescencia de patrones predeterminados para trazar una curva estándar de fluorescencia de 6-NBDG y cuantificar la concentración de 6-NBDG (μM) en cada muestra.
- Normalice los resultados de la muestra a las cantidades de proteína correspondientes para determinar [6-NBDG] μM/μg de proteína.
Resultados
La Figura 4 muestra mediciones representativas de fluorescencia de glucosa de retina de ratón WT incubada con 6-NBDG durante diferentes períodos de tiempo. Después de 30 min de incubación, los niveles de 6-NBDG fueron un promedio de 336 ± 27.91 UA, mientras que después de 60 min, los niveles de 6-NBDG aumentaron a un promedio de 616.3 ± 8.38 UA. Una incubación adicional de 30 min condujo a un nivel reducido de 6-NBDG (506,4 ± 5,3 UA). A los 60 min, la variabilidad en los resultados fue mínima, por lo que se eligió como el momento óptimo para la incubación de la retina con 6-NBDG. Tenga en cuenta que las unidades son arbitrarias y que estos resultados no se normalizaron a la proteína total.
La Figura 5 muestra las mediciones de fluorescencia de glucosa de la retina de ratón WT incubada con 6-NBDG y el inhibidor de GLUT1 BAY-876 (concentración final de 100 μM). Se observó una disminución del 24% en la captación de 6-NBDG, lo que sugiere que existen mecanismos independientes de GLUT1 para la absorción de 6-NBDG en la retina neural de ratón.
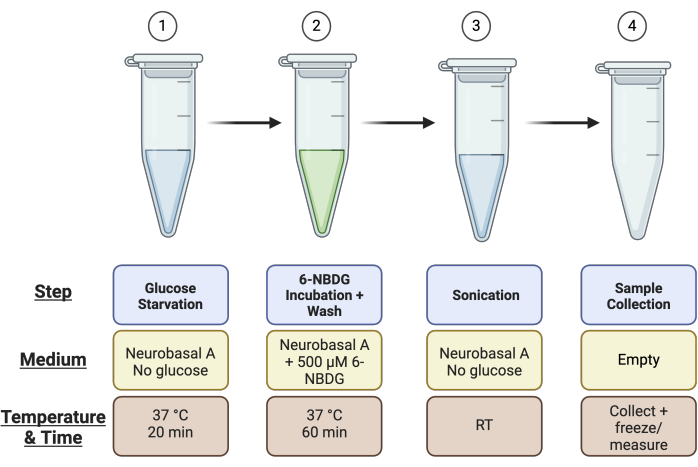
Figura 1: Resumen esquemático de la configuración del tubo para el ensayo. Antes de realizar el ensayo, configure 4 tubos por muestra de retina como se describe: Tubo 1 para el paso de "Falta de glucosa", Tubo 2 para el paso de "Incubación de 6-NBDG", Tubo 3 para la "Sonicación" y Tubo 4 para la "Recolección de muestras". Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Resumen esquemático del protocolo. Después de la disección neural de la retina, las muestras de retina se colocan inmediatamente en hielo en el medio Neurobasal A (sin glucosa). A continuación, las muestras de retina se transfieren a un baño de agua a 37 °C durante 20 minutos para la etapa de "Falta de glucosa". A continuación, las muestras se transfieren a los tubos para la etapa de "incubación 6-NBDG", donde permanecen en el baño de agua a 37 °C durante 60 min. Después de la incubación, se lavan las muestras de retina. Se transfieren a tubos nuevos que contienen 500 uL de medio Neurobasal A helado (sin glucosa) y luego se lavan 3 veces o se lavan 4 veces con 500 uL de medio Neurobasal A helado (sin glucosa) si permanecen en el mismo tubo que la etapa de incubación 6-NBDG. Finalmente, las muestras se cortan, se sonican y se centrifugan a 21130 x g antes de que los sobrenadantes se transfieran a un tubo de "recolección de muestras". A continuación, las muestras se leen en un lector de placas utilizando la función de ensayo de punto final de fluorescencia con excitación a 483 nm, emisión a 550 nm y corte a 530 nm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Generación de patrones de 6-NBDG por dilución en serie. Cree concentraciones estándar de 6-NBDG diluyendo la solución madre de 500 μM en serie utilizando el medio Neurobasal A a través de los pasos 1-8 en tubos etiquetados 1-8 como se indica. El tubo 8 contiene solo medio Neurobasal A (sin 6-NBDG). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Mediciones representativas de fluorescencia de glucosa para la optimización del tiempo de incubación de 6-NBDG. Lectura representativa de fluorescencia después de la incubación con 6-NBDG a los 30 min, 60 min y 90 min. Se incubó una muestra de control sin 6-NBDG durante 90 min (90C). Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Absorción de 6-NBDG en presencia de inhibidor de GLUT1 (WTi; 100 μM BAY-876). Resultados de absorción de 6-NBDG utilizando retina de tipo salvaje (WT) incubada sin inhibidor (WT) y en presencia de 100 μM de BAY-876 (WTi). Los resultados se normalizaron a los niveles de proteína total y luego con respecto a la muestra de WT sin inhibidor. Número de animales expresado en barras (WT = 9 retina de 9 animales y WTi = 3 retina de 3 animales). Prueba estadística = prueba no paramétrica de Mann Whitney, p = 0,0074. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En resumen, el método descrito permite a los investigadores de ciencias básicas medir la absorción del análogo fluorescente de la glucosa, 6-NBDG, en la retina neural murina ex vivo . La glucosa es un metabolito esencial para la retina neural, su absorción apoya las altas tasas de glucólisis y respiración mitocondrial necesarias para producir energía en forma de trifosfato de adenosina (ATP)1. Dado que la glucosa es el sustrato energético preferido, muchas células de la retina expresan transportadores de glucosa (GLUT) para facilitar la absorción de glucosa de la vasculatura y el tejido circundante2. El protocolo permite a los investigadores evaluar de forma rápida y económica la absorción de glucosa en modelos de ratón de enfermedad de la retina. Además, el método también podría traducirse fácilmente para su uso en retina de rata u otros tejidos de interés.
Hay algunos aspectos importantes del protocolo que garantizarán su éxito. El ensayo es sensible al tiempo, por lo que es importante que todos los reactivos y tubos se preparen antes del experimento; Esto garantiza que el resto del ensayo se desarrolle sin problemas. Es importante considerar que después de 90 min de incubación con 6-NBDG, hay una disminución en la medición de fluorescencia (Figura 4), lo que podría indicar un deterioro en la salud de la retina. Como tal, se debe tener mucho cuidado para cumplir con los tiempos de incubación. Además, la disección de la retina fresca es el primer paso limitante del procedimiento; Una retina lenta o mal diseccionada puede conducir a resultados erróneos, ya que la salud de la retina empeora en un medio libre de glucosa con el tiempo. Este protocolo describe los pasos básicos para la disección neural de la retina murina (excluyendo el epitelio pigmentario de la retina y la coroides); Sin embargo, para los investigadores que no tienen experiencia en esta técnica, se puede hacer referencia a un protocolo más profundo publicado previamente11. La disección de la retina es el paso más crucial en el protocolo, recomendamos que los investigadores no dediquen más de 1 minuto por ojo a la disección. Si los tiempos de disección son más lentos, considere realizar el procedimiento con menos muestras para limitar la variabilidad.
Para mantener la consistencia y limitar la variabilidad entre las muestras, las lecturas fluorescentes de 6-NBDG deben normalizarse a la proteína total de la retina. Esto tiene en cuenta las variaciones en el tamaño de la retina, que pueden ocurrir con la edad, por ejemplo. Para mejorar la consistencia en este protocolo, se utilizó toda la retina sin cortes ni daños deliberados. Sin embargo, con el rango de detección de 6-NBDG probado para la curva estándar (0-40 μM), y con niveles de fluorescencia de retina completa que descansan constantemente entre 10-20 μM, es posible que se utilicen cantidades más pequeñas de tejido retiniano. Sin embargo, el impacto del corte de la retina puede introducir cierto nivel de inconsistencia con los resultados obtenidos.
Este protocolo tiene algunas limitaciones. La especulación sobre el mecanismo por el cual las células absorben la 6-NBDG sugiere que la absorción de la 6-NBDG puede ocurrir a través de mecanismos independientes del transportador GLUT110. Los resultados con el inhibidor de GLUT1 BAY-876 respaldan esta noción; BAY-876 redujo el 6-NBDG solo en un 24% (Figura 5); sin embargo, la concentración de BAY-876 no se probó exhaustivamente en este protocolo. Sin embargo, el diseño experimental descrito aquí se puede utilizar para llevar a cabo investigaciones adicionales sobre la especificidad y la absorción de 6-NBDG en la retina, por ejemplo, para explorar la posible absorción de 6-NBDG por GLUT3 y GLUT2, que también están presentes en la retina, aunque a un nivel mucho más bajo que GLUT15. Otra limitación importante de este ensayo es que cuantifica la absorción total de 6-NBDG en la retina y, por lo tanto, no es posible determinar la absorción de 6-NBDG específica de la célula utilizando este protocolo.
Es importante destacar que el protocolo descrito tiene algunas ventajas. El ensayo no se basa en imágenes objetivas de la absorción de glucosa en los tejidos, como la que se lleva a cabo en el tejido cerebral12, por ejemplo. Los métodos de adquisición de imágenes en tiempo real para detectar la absorción de analógicos fluorescentes pueden ser desafiantes y costosos, este protocolo simplifica el análisis de la absorción para un análisis de rendimiento relativamente alto de la absorción de 6-NBDG en la retina. El ensayo descrito también podría extenderse a otros análogos de glucosa fluorescente (p. ej., 2-NBDG)13, para los que se conocen los parámetros de excitación y emisión fluorescentes. En conclusión, este ensayo proporciona una medida relativamente rápida, económica y consistente de la absorción de glucosa en el tejido de la retina que evita el uso de métodos de imagen costosos o que requieren mucho tiempo. Comprender los cambios en la absorción de glucosa en el tejido de la retina es fundamental en las enfermedades del sistema visual, donde los cambios en el metabolismo son un evento fisiopatológico clave14.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por fondos departamentales sin restricciones otorgados a Lauren K. Wareham.
Materiales
| Name | Company | Catalog Number | Comments |
| # 5 forceps | Katena | K5-6550 | Used for retina dissection |
| 1.5 mL microcentrifuge tubes | Thermo Fisher Scientific | 05-408-129 | |
| 26 G x 5/8" needle | sol-M | 112658 | Used to puncture cornea during dissection |
| 5 mL tubes | MTC bio | c2540 | |
| 50 mL tubes | Avantor by VWR | 89039-656 | |
| 6-NBDG | Invitrogen | N23106 | Fluorescent gucose analog |
| 96 well plates black with clear bottom | Thermo Fisher Scientific | 265301 | |
| Anesthetic Charcoal Filter Cannister | ReFresh | EZ-258 | Used in anesthesia set up |
| BAY-876 | Millipore Sigma | SML1774 | For inhibition of GLUT1. |
| Centrifuge at 4 °C | Eppendorf | EPP-5424 | |
| Compressed gas (5% carbon dioxide, 95% oxygen) | Airgas | UN3156 | Used in anesthesia set up |
| curved forceps | Roboz surgical instrument | RS-5137 | Used for retina dissection |
| DDH2O | Elga LabWater | Elga PureLab Ultra | Used after ethanol to clean sonicator in between samples |
| Dissecting microscope | Olympus | szX12 | Used for retina dissection |
| Ethanol 200 proof | Decon laboratories | 2701 | To be used to clean sonicator in between samples |
| Foam floating tube rack | Thermo Fisher Scientific | 36-099-2328 | For tubes during incubation in water bath steps |
| General scissors | Roboz surgical instrument | RS-680 | Used for retina dissection |
| Isoflurane 250 mL bottle | Piramal critical care | NDC 6679401725 | Anesthesia |
| Isoflurane equipment | Vetequip sold by VWR | 89012-492 | Used to anesthetize prior to euthanasia |
| Kim wipes | VWR | 82003-820 | |
| Microplate reader | Molecular devices | SpectraMax M2 microplate reader | Used to read sample |
| Neurobasal- A media | Gibco | 12349-015 | |
| Nose cone (low profile anesthesia mask) | Kent Scientific | SOMNO-0801 | Used to deliver ansethesia |
| Objective on dissecting microscope | Olympus | DF plapo 1x pf | Used for retina dissection |
| Petri dish | VWR | 25384-088 | Used during retina dissection |
| Pierce assay reagent | Thermo Fisher Scientific | 1861426 | |
| Pipette tips P20 | Olympus Plastics | 26-404 | |
| Pipette tips P200, P1000, P10 XL | VWR | 76322-150, 76322-154, 76322-132 | |
| Pipetteman pipettes P200, P1000, P20, P10 | VWR | F144055M, F144056M, F144058M, F144059M | |
| SoftMax Pro software on computer | Molecular devices | SoftMax Pro 7 software | Software used to read sample |
| Sonic dismembrator | Thermo Fisher Scientific | FB50110 | Sonicate sample (retina) |
| Transfer pipettes | Fisherbrand | 13-711-9AM | Used to transfer retina from one tube to another |
| Vannas spring scissors | Katena | K4-5000 | Used for retina dissection |
| Water bath set to 37 °C | N/A | N/A | Used for incubation |
Referencias
- Casson, R. J., Chidlow, G., Crowston, J. G., Williams, P. A., Wood, J. P. M. Retinal energy metabolism in health and glaucoma. Prog Retin Eye Res. 81, 100881 (2021).
- Daniele, L. L., et al. Glucose uptake by GLUT1 in photoreceptors is essential for outer segment renewal and rod photoreceptor survival. FASEB J. 36 (8), e22428 (2022).
- Fernandes, R., Hosoya, K. -. I., Pereira, P. Reactive oxygen species downregulate glucose transport system in retinal endothelial cells. Am J Physiol Cell Physiol. 300 (4), C927-C936 (2011).
- Badr, G. A., Tang, J., Ismail-Beigi, F., Kern, T. S. Diabetes downregulates GLUT1 expression in the retina and its microvessels but not in the cerebral cortex or its microvessels. Diabetes. 49 (6), 1016-1021 (2000).
- Kumagai, A. K. Glucose transport in brain and retina: implications in the management and complications of diabetes. Diabetes Metab Res Rev. 15 (4), 261-273 (1999).
- Winkler, E. A., et al. GLUT1 reductions exacerbate Alzheimer's disease vasculo-neuronal dysfunction and degeneration. Nat Neurosci. 18 (4), 521-530 (2015).
- Mosconi, L., et al. Hypometabolism exceeds atrophy in presymptomatic early-onset familial Alzheimer's disease. J Nucl Med. 47 (11), 1778-1786 (2006).
- Moreno, M., et al. Morphological and morphometric changes in rat optic nerve microvessels in a glaucoma experimental model. Arch Soc Esp Oftalmol. 89 (12), 471-476 (2014).
- Barros, L. F., et al. Kinetic validation of 6-NBDG as a probe for the glucose transporter GLUT1 in astrocytes. J Neurochem. 109 (s1), 94-100 (2009).
- Hamilton, K. E., Bouwer, M. F., Louters, L. L., Looyenga, B. D. Cellular binding and uptake of fluorescent glucose analogs 2-NBDG and 6-NBDG occurs independent of membrane glucose transporters. Biochimie. 190, 1-11 (2021).
- Feigenspan, A., Babai, N. Z. Preparation of horizontal slices of adult mouse retina for electrophysiological studies. J Vis Exp. 119, e55173 (2017).
- Lundgaard, I., et al. Direct neuronal glucose uptake heralds activity-dependent increases in cerebral metabolism. Nat Commun. 6 (1), 6807 (2015).
- Zou, C., Wang, Y., Shen, Z. 2-NBDG as a fluorescent indicator for direct glucose uptake measurement. J Biochem Biophys Methods. 64 (3), 207-215 (2005).
- Wareham, L. K., et al. Solving neurodegeneration: common mechanisms and strategies for new treatments. Mol Neurodegener. 17 (1), 23 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados