Method Article
Mesure de l’absorption de l’analogue du glucose, le 6-(N-(7-nitrobenz-2-oxa-1,3-diazol-4-yl)amino)-6-désoxyglucose, dans la rétine neurale murine intacte
Dans cet article
Résumé
Plusieurs types de cellules de la rétine, y compris les cellules endothéliales, les neurones et les cellules gliales, expriment des transporteurs de glucose (GLUT) pour permettre l’absorption du glucose dans les cellules. En utilisant la rétine neurale de souris ex vivo et l’analogue fluorescent du glucose 6-NBDG, nous décrivons une méthode relativement rapide et peu coûteuse pour mesurer l’absorption de glucose dans l’ensemble de la rétine de la souris.
Résumé
La rétine est un tissu hautement métabolique avec plusieurs types de cellules nécessitant du glucose et de ses dérivés pour produire de l’énergie sous forme d’ATP. Les cellules rétiniennes, y compris les cellules endothéliales, les neurones, les photorécepteurs et les cellules gliales, expriment des transporteurs de glucose (GLUT, par exemple, GLUT1-4) pour permettre l’absorption du glucose pour la production d’énergie. GLUT1 est le transporteur de glucose le plus abondamment exprimé dans la rétine. Ce protocole permet aux chercheurs de mesurer l’absorption du glucose dans la rétine neurale murine dans des conditions ex vivo à l’aide de l’analogue fluorescent du glucose 6-(N-(7-Nitrobenz-2-oxa-1,3-diazol-4-yl)amino)-6-Deoxyglucose (6-NBDG). Après le curage ganglionnaire rétinien, les taux totaux de 6-NBDG rétiniens peuvent être facilement déterminés par mesure du point final de fluorescence à l’aide d’un lecteur de plaques. Pour plus de cohérence, nous recommandons de normaliser les résultats aux niveaux totaux de protéines. Bien que le 6-NBDG soit très spécifique de GLUT1, l’absorption de cet analogue est détectée en présence de l’inhibiteur de GLUT1, BAY-876. En tant que tel, ce test fournit une méthode relativement rapide et peu coûteuse pour mesurer l’absorption du glucose ex vivo dans la rétine neurale de souris entière, qui est partiellement médiée par GLUT1.
Introduction
Le glucose est un métabolite essentiel pour la rétine neurale, où il est utilisé pour alimenter des taux élevés de glycolyse et de respiration mitochondriale pour produire de l’énergie sous forme d’adénosine triphosphate (ATP)1. Le glucose étant le substrat énergétique privilégié, de nombreuses cellules rétiniennes expriment des transporteurs de glucose (GLUT) pour faciliter l’absorption du glucose par le système vasculaire et les tissus environnants2. Les GLUT comprennent une famille de glycoprotéines membranaires intrinsèques qui sont responsables du transport du glucose dans les cellules de mammifères3. Le transporteur GLUT-1 (GLUT1) est le principal transporteur de glucose dans la rétine, exprimé dans les couches rétiniennes4 et par les cellules endothéliales capillaires qui composent la barrière hémato-rétinienne (BRB)5. Il est intéressant de noter que dans les maladies neurodégénératives du système nerveux central (SNC), y compris la maladie d’Alzheimer, une réduction des niveaux de protéine GLUT1 et de l’absorption de glucose précède l’atrophie cérébrale et le dysfonctionnement neuronal chez l’homme 6,7. Dans un modèle d’hypertension oculaire chez le rat, des niveaux plus faibles de GLUT1 ont également été observés dans les capillaires8. La réduction du transport du glucose dans la rétine externe est impliquée dans la perte de photorécepteurs dans les modèles animaux de rétinite pigmentaire humaine et peut également jouer un rôle dans la neurodégénérescence rétinienne, comme celle observée dans le glaucome. Par conséquent, une compréhension du transport du glucose dans la rétine neurale est nécessaire pour établir son rôle dans la neurodégénérescence rétinienne.
Ici, nous décrivons une méthode biochimique nouvelle, peu coûteuse et simple pour mesurer l’absorption de 6-NBDG dans la rétine neurale murine ex vivo , c’est-à-dire à l’exclusion de l’épithélium pigmenté rétinien et de la choroïde. Comparé à d’autres analogues fluorescents tels que le 2-NBDG, le 6-NBDG est composé d’un groupement glucose sur lequel un groupe nitrobenzoxydiazoamino fluorescent remplace le groupe hydroxyle au carbone 6, empêchant la phosphorylation par l’hexokinase et la dégradation métabolique9. Bien que le 6-NBDG ait une spécificité élevée pour GLUT1, avec une affinité de liaison 300 fois supérieure à celle du glucose9, nous détectons l’absorption de cet analogue en présence d’inhibiteurs de GLUT110. En tant que tel, ce test fournit une méthode relativement rapide et peu coûteuse pour mesurer l’absorption de glucose ex vivo dans l’ensemble de la rétine de la souris, qui est partiellement médiée par GLUT1.
La mesure de l’absorption du glucose dans les tissus en temps réel est difficile, nécessitant souvent un marquage radio-isotopique ou des méthodes d’imagerie à haute résolution. Ici, nous utilisons un test biochimique fluorescent pour déterminer rapidement l’absorption du 6-NBDG dans plusieurs échantillons rétiniens dans des conditions ex vivo . Le protocole fournit des informations sur l’absorption totale de glucose rétinien ; il ne fournit pas d’information sur les niveaux spécifiques des cellules rétiniennes de l’absorption du 6-NBDG.
Protocole
Toutes les méthodes décrites ici ont été approuvées par le Comité institutionnel de soin et d’utilisation des animaux (IACUC) du Centre médical de l’Université Vanderbilt.
1. Préparation du test
REMARQUE : La préparation doit être effectuée le jour de l’essai, immédiatement avant l’exécution de l’essai. Cela est nécessaire en raison de la nature sensible au temps du protocole.
- Préparation générale en amont de l’expérience
REMARQUE : Le 6-NBDG est sensible à la lumière et doit être protégé de la lumière. Recouvrez toutes les solutions 6-NBDG de papier d’aluminium.- Une solution mère de 5 mM de 6-NBDG dans 50 % de DMSO/1x PBS est stable à -20 °C pendant 6 mois. Préparez une solution mère et conservez 500 μL d’aliquotes pour les tests futurs.
- Placez un tube conique de 50 mL de milieu Neurobasal-A (sans glucose) sur de la glace.
- Assurez-vous que le bain-marie est réglé à 37 °C.
- Étiquetez 4 × des tubes de microcentrifugation de 1,5 mL par rétine : 1) privation de glucose, 2) incubation de 6-NBDG, 3) sonication et 4) tube de prélèvement d’échantillon pour le test Pierce (c.-à-d. si vous avez quatre rétines au total, vous aurez besoin de 16 tubes de microcentrifugation). Voir la figure 1 pour un résumé de la configuration du tube.
- Ajouter 200 μL de milieu neurobasal A du tube conique de 50 mL sur de la glace aux tubes de sonication pré-étiquetés et laisser reposer sur de la glace pour l’étape 2.5.4.
- Mettez le lecteur de plaques sous tension.
- Configurez les informations sur les plaques dans le logiciel de lecture de plaques à l’aide de la fonction de test de point final de fluorescence avec les paramètres suivants : excitation 483 nm, émission 550 nm et coupure 530 nm (paramètres prédéterminés pour le 6-NBDG).
- Préparation du réactif avant l’expérience : 6-NBDG
- Produire une solution de travail de 6-NBDG dans un milieu neurobasal-A à une concentration finale de 500 μM en diluant la substance de 5 mM obtenue à l’étape 1.1.1.
REMARQUE : N’oubliez pas de couvrir toutes les solutions 6-NBDG avec du papier d’aluminium. Prévoir un volume approprié de solution de travail de 6-NBDG de 500 μM pour l’ensemble du test (besoin de 200 μL de solution de travail de 6-NBDG par rétine ; inclure le volume supplémentaire pour l’erreur et les quantités nécessaires à la création de solutions standard à l’étape 2.4.). - Pipeter 200 μL de solution de travail 6-NBDG dans les tubes pré-étiquetés fabriqués à l’étape 1.1.4 pour l’étape d’incubation 6-NBDG.
- Produire une solution de travail de 6-NBDG dans un milieu neurobasal-A à une concentration finale de 500 μM en diluant la substance de 5 mM obtenue à l’étape 1.1.1.
2. Exécution du test d’absorption du 6-NBDG
REMARQUE : reportez-vous à la Figure 2 pour une vue d’ensemble étape par étape.
- Dissection tissulaire rétinienne
- Endormir la souris à l’aide d’un anesthésique à l’isoflurane inhalé (2 % d’isoflurane dans 5 % de dioxyde de carbone et 95 % d’oxygène).
REMARQUE : Vérifiez que la souris est correctement anesthésiée en pinçant le coussinet du pied sur les deux pattes arrière. S’il est correctement anesthésié, il ne devrait pas y avoir de mouvement saccadé (réflexe de retrait de la pédale). S’il y a un mouvement réflexe, revenez à l’étape 2.1.1. - Euthanasier la souris par luxation cervicale suivie d’une décapitation, puis énucléer rapidement les yeux. Placez les yeux énucléés dans une boîte de Pétri remplie de 5 à 10 ml de milieu neurobasal-A glacé (sans glucose) sur de la glace.
REMARQUE : Vous trouverez ci-dessous des directives de base pour la dissection neurale de la rétine (à l’exclusion de l’épithélium pigmentaire rétinien et de la choroïde) ; Pour des instructions et des conseils plus approfondis, reportez-vous à un protocole11 publié précédemment et suivez la section « Dissection rétinienne de souris ». - Placez la boîte de Pétri sous un microscope de dissection sur de la glace.
- Pliez une lingette non pelucheuse en un petit carré et humidifiez-la avec un média Neurobasal A.
- Transférez un œil sur la lingette humide et non pelucheuse à l’aide d’une pipette de transfert en plastique avec l’extrémité coupée.
REMARQUE : La lingette non pelucheuse offre une friction accrue pour empêcher l’œil de bouger pendant la dissection. - Prenez une aiguille de 26 G et percez le côté de la cornée en avant du limbe.
- Utilisez des ciseaux Vannas pour couper le long du limbe à partir du point de ponction afin d’enlever la cornée.
- Une fois la cornée retirée, saisissez la sclérotique à mi-chemin entre le limbe et la tête du nerf optique avec une paire de pinces. À l’aide d’une autre paire de pinces dans la main opposée, saisissez la lentille et retirez-la rapidement d’un seul mouvement rapide.
REMARQUE : Si le cristallin est retiré lentement, la rétine restera attachée au cristallin et deviendra difficile à disséquer. - Transférez l’œilleton dans une boîte de Pétri avec du neurobasal A froid sur de la glace.
- À l’aide d’une pince à deux mains, prenez l’œilleton et tenez soigneusement la tasse au niveau de l’ora serrata.
- Pour libérer la cupule rétinienne de la sclère, clampez la sclérotique à l’aide d’une pince en prenant soin de ne pas clamper le tissu rétinien.
- Faites glisser la pince avec précaution entre le tissu scléral et le tissu rétinien sur l’ensemble du globe jusqu’à ce que toute la rétine soit libérée du limbe.
- À l’aide de ciseaux Vannas, faites une petite incision dans la sclérotique au niveau du limbe.
- Prenez une pince pour saisir les bords de l’incision et décollez le tissu scléral jusqu’à la région de la tête du nerf optique. Saisissez la sclérotique à l’aide d’une pince dans la main non dominante et guidez doucement la rétine loin de la sclère à l’aide d’une pince fermée dans la main dominante.
- Coupez la tête du nerf optique avec des ciseaux pour détacher complètement la rétine de la sclérotique et de tout nerf optique restant.
- Transférez la rétine à l’aide d’une pipette de transfert taillée dans le tube de microcentrifugation de 1,5 mL préparé à l’avance pour la privation de glucose à l’étape 1.1.4, qui contient 200 μL de rétine neurobasale-A (sans glucose)-1 par tube.
- Endormir la souris à l’aide d’un anesthésique à l’isoflurane inhalé (2 % d’isoflurane dans 5 % de dioxyde de carbone et 95 % d’oxygène).
- Étape de privation de glucose
- Transvasez les tubes de l’étape 2.1.14 dans un bain-marie à 37 °C et incubez à 37 °C pendant 20 min.
- Incubation NBDG
- Transférez chaque rétine dans un nouveau tube prémarqué pour l’incubation du 6-NBDG à partir de l’étape 1.1.4, qui contient 200 μL de 500 μM de 6-NBDG dans le milieu neurobasal-A de l’étape 1.2.2.
REMARQUE : La rétine doit être transférée à l’aide d’une pipette de transfert qui a été coupée pour agrandir l’extrémité afin de transférer la rétine avec un minimum de dommages. De plus, cela peut être fait avec une pince à épiler si l’on est sûr de sa capacité à transférer la rétine sans dommage. - Transvaser les tubes à 37 °C et incuber à 37 °C pendant 60 min.
- Transférez chaque rétine dans un nouveau tube prémarqué pour l’incubation du 6-NBDG à partir de l’étape 1.1.4, qui contient 200 μL de 500 μM de 6-NBDG dans le milieu neurobasal-A de l’étape 1.2.2.
- Préparation d’étalons de 6-NBDG (plage de concentration 0 μM-40 μM)
REMARQUE : Préparez les étalons pendant la période d’incubation de 60 minutes au 6-NBDG (étape 2.3.2.). Les étalons peuvent être préparés à température ambiante. Protégez les solutions de la lumière.- Étiquetez les tubes de microcentrifugation de 1,5 mL #1-8 pour les 8 étalons (voir la figure 3).
- Pour l’étalon #1 (40 μM 6-NBDG), pipette 32 μL de 500 μM de solution mère 6-NBDG effectuée à l’étape 1.2.1.
- Ajoutez 368 μL de milieu neurobasal-A dans le tube de microcentrifugation et mélangez soigneusement en pipetant de haut en bas.
- Pour les normes #2-8, diluer en série les échantillons comme suit :
- Pipeter 200 μL de milieu neurobasal-A dans les tubes #2-8.
- Prenez 200 μL du tube standard #1 et pipetez-le dans le tube #2, puis mélangez soigneusement avec la pipette en pipetant de haut en bas.
- Prélever 200 μL du tube standard #2 et pipeter dans le tube standard #3. Mélangez soigneusement avec la pipette en pipetant de haut en bas.
- Prenez 200 μL du tube standard #3 et pipetez-le dans le tube #4, puis mélangez soigneusement en le pipetant de haut en bas.
- Prenez 200 μL du tube standard #4 et pipetez-le dans le tube #5, puis mélangez soigneusement en le pipetant de haut en bas.
- Prenez 200 μL du tube standard #5 et pipetez-le dans le tube #6, puis mélangez-le soigneusement en le pipetant de haut en bas.
- Prenez 200 μL du tube standard #6 et pipetez-le dans le tube #7, puis mélangez-le soigneusement en le pipetant de haut en bas.
- N’ajoutez pas de solution supplémentaire au tube #8 (c’est-à-dire qu’il ne doit contenir que 200 μL de milieu neurobasal-A ajouté à l’étape 2.4.4.1.).
- Lavage, sonication et centrifugation pour la collecte d’échantillons
- Retirer tous les tubes du bain-marie à 37 °C une fois l’incubation de 60 minutes au 6-NBDG terminée.
- Lavez chaque rétine avec 500 μL de milieu neurobasal-A glacé aussi rapidement et soigneusement que possible.
- Pour le lavage, prélever la solution de 6-NBDG à l’aide d’une pipette, en veillant à ne pas toucher ou déranger le tissu rétinien.
REMARQUE : Il est également possible de transférer la rétine à l’aide d’une pince à épiler du tube d’incubation 6-NBDG à un tube frais contenant 500 μL de média neurobasal-A. Ensuite, vous n’avez plus qu’à faire 3 lavages supplémentaires. Faites-le si vous êtes à l’aise avec votre capacité à ne pas endommager la rétine avec une pince à épiler. - Ensuite, jetez la solution dans une poubelle appropriée. Pipeter immédiatement 500 μL de milieu neurobasal-A froid dans le même tube pour remplacer la solution qui a été retirée. Replacez les tubes sur de la glace entre les lavages.
- Pour le lavage, prélever la solution de 6-NBDG à l’aide d’une pipette, en veillant à ne pas toucher ou déranger le tissu rétinien.
- Répétez l’opération 3 fois de plus pour un total de 4 lavages.
- À l’aide d’une pipette de transfert à bord taillé ou d’une pince à épiler, transférez soigneusement la rétine dans les tubes de sonication contenant du milieu neurobasal A sur de la glace (voir étape 1.1.4).
- Coupez la rétine en petits morceaux à l’aide de petits ciseaux de dissection.
REMARQUE : Assurez-vous de laver les outils à l’éthanol entre chaque rétine afin de ne pas contaminer d’autres échantillons. - Sonicez chaque rétine pendant 5 à 10 secondes sur une amplitude de 10 et remettez-la immédiatement sur de la glace.
REMARQUE : Assurez-vous de nettoyer la sonication entre les échantillons avec de l’éthanol à 100 % suivi de H2O ultra-pur. À ce stade, pré-refroidissez la centrifugeuse à 4 °C ou utilisez-la dans une chambre froide à 4 °C si disponible. - Centrifugeuse à 4 °C pendant 15 min à 21130 x g ouvitesse maximale si inférieure à 21130 x g.
REMARQUE : Au cours de la centrifugeuse de 15 minutes à l’étape 2.5.7, pipeter 100 μL des étalons #1 à 8 effectués à l’étape 2.4 dans une plaque noire à fond transparent à 96 puits.
- Lecture d’échantillons sur un lecteur de plaques
- Une fois la centrifugeuse de 15 minutes terminée, prélever 100 μL de surnageant et pipeter dans la plaque à 96 puits.
- Insérez la plaque dans le lecteur de plaques.
REMARQUE : La plaque doit contenir 100 μL de chaque échantillon et 100 μL de chaque étalon. - Dans le logiciel du lecteur de plaques, sélectionnez le test de fluorescence avec les paramètres sélectionnés à l’étape 1.1.7.
- Exécutez le test et enregistrez les résultats.
- Pipetez les échantillons de la plaque de 96 puits dans les tubes pré-étiquetés de la version 1.1.4 pour le test Pierce.
REMARQUE : À ce stade, les échantillons peuvent être immédiatement analysés pour les protéines (voir ci-dessous) ou stockés à -80 °C.
- Dosage par perçage pour la normalisation des protéines
REMARQUE : Le test Pierce doit être effectué en double (à la fois sur les étalons et les échantillons) pour une précision accrue.- À l’aide des étalons de dosage des protéines pré-diluées du test Pierce, pipeter 10 μL de chaque en double dans une plaque inférieure transparente à 96 puits.
- Pipeter 10 μL de chacun des échantillons en double de l’étape 2.6.5 dans la plaque à 96 puits.
- Ajouter 150 μL de réactif Pierce dans tous les puits contenant des étalons ou des échantillons. Couvrir la plaque à 96 puits et mélanger sur un agitateur à vitesse moyenne pendant 1 min.
- Incuber la plaque à température ambiante (RT) pendant 5 min.
- Insérez la plaque dans le lecteur de plaques. Sélectionnez le test du point final d’absorbance et réglez la longueur d’onde sur 660 nm.
- Mesurez l’absorbance des étalons et des échantillons et enregistrez les résultats. Calculez le microgramme total de protéines dans chaque échantillon en traçant une courbe standard.
- Calcul de l’absorption rétinienne de 6-NBDG.
REMARQUE : Les résultats du 6-NBDG doivent être normalisés en fonction de la teneur totale en protéines en raison de la taille inégale de la rétine.- À l’aide des valeurs d’intensité de fluorescence obtenues à l’étape 2.6, utilisez les lectures de fluorescence des étalons prédéterminés pour tracer une courbe d’étalon de fluorescence 6-NBDG et quantifier la concentration de 6-NBDG (μM) dans chaque échantillon.
- Normaliser les résultats de l’échantillon en fonction des quantités de protéines correspondantes pour déterminer la protéine [6-NBDG] μM/μg.
Résultats
La figure 4 montre des mesures représentatives de la fluorescence du glucose à partir de la rétine de souris WT incubées avec du 6-NBDG pendant différentes périodes de temps. Après 30 minutes d’incubation, les concentrations de 6-NBDG étaient en moyenne de 336 ± 27,91 UA, tandis qu’après 60 min, les concentrations de 6-NBDG ont augmenté à une moyenne de 616,3 ± 8,38 UA. Une autre incubation de 30 minutes a permis d’obtenir une réduction de la concentration de 6-NBDG (506,4 ± 5,3 UA). À 60 min, la variabilité des résultats était minimale et a donc été choisie comme moment optimal pour l’incubation de la rétine avec le 6-NBDG. Notez que les unités sont arbitraires et que ces résultats n’ont pas été normalisés en protéines totales.
La figure 5 montre les mesures de fluorescence du glucose à partir de la rétine de souris WT incubée avec le 6-NBDG et l’inhibiteur de GLUT1 BAY-876 (concentration finale de 100 μM). Une diminution de 24 % de l’absorption du 6-NBDG a été observée, ce qui suggère qu’il existe des mécanismes indépendants de GLUT1 de l’absorption du 6-NBDG dans la rétine neurale de la souris.
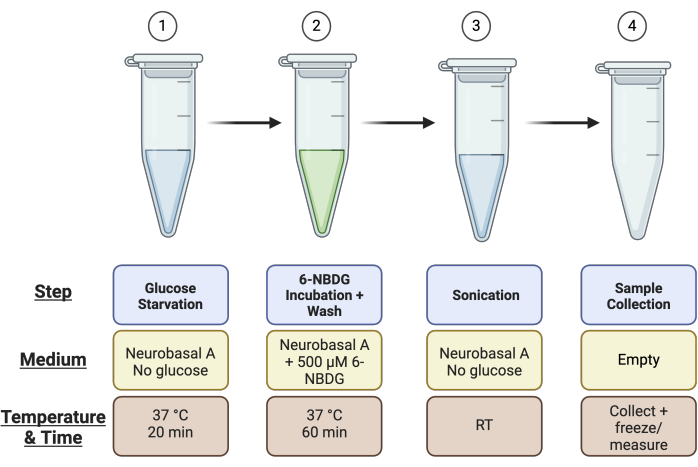
Figure 1 : Vue d’ensemble schématique de la configuration du tube pour le test. Avant d’effectuer le test, installez 4 tubes par échantillon rétinien comme décrit : le tube 1 pour l’étape « Manque de glucose », le tube 2 pour l’étape « Incubation 6-NBDG », le tube 3 pour la « Sonication » et le tube 4 pour le « Prélèvement d’échantillons ». Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Vue d’ensemble schématique du protocole. Après le curage neural de la rétine, les échantillons rétiniens sont immédiatement placés sur de la glace dans le milieu neurobasal A (sans glucose). Les échantillons rétiniens sont ensuite transférés dans un bain-marie à 37°C pendant 20 min pour l’étape « Glucose Starvation ». Les échantillons sont ensuite transférés dans les tubes pour l’étape d’incubation 6-NBDG, où ils restent dans le bain-marie à 37 °C pendant 60 min. Après l’incubation, les échantillons rétiniens sont lavés. Ils sont soit transférés dans des tubes frais contenant 500 μL de milieu neurobasal A glacé (sans glucose), puis lavés 3 fois, soit lavés 4 fois avec 500 μL de milieu neurobasal A glacé (sans glucose) s’ils restent dans le même tube que l’étape d’incubation 6-NBDG. Enfin, les échantillons sont hachés, soniqués et centrifugés à 21130 x g avant que les surnageants ne soient transférés dans un tube de « collecte d’échantillons ». Les échantillons sont ensuite lus sur un lecteur de plaques à l’aide de la fonction de test de fluorescence avec excitation à 483 nm, émission à 550 nm et coupure à 530 nm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Génération d’étalons de 6-NBDG par dilution en série. Créer des concentrations étalons de 6-NBDG en diluant la solution mère de 500 μM en série à l’aide d’un milieu neurobasal A en suivant les étapes 1 à 8 dans des tubes étiquetés 1 à 8 comme indiqué. Le tube 8 ne contient que du milieu neurobasal A (pas de 6-NBDG). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Mesures représentatives de la fluorescence du glucose pour l’optimisation du temps d’incubation du 6-NBDG. Lecture représentative de la fluorescence après incubation avec le 6-NBDG à 30 min, 60 min et 90 min. Un échantillon témoin sans 6-NBDG a été incubé pendant 90 min (90C). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Absorption de 6-NBDG en présence d’un inhibiteur de GLUT1 (WTi ; 100 μM BAY-876). Résultats de l’absorption du 6-NBDG à l’aide de rétine de type sauvage (WT) incubée sans inhibiteur (WT) et en présence de 100 μM BAY-876 (WTi). Les résultats ont été normalisés en fonction des teneurs en protéines totales, puis par rapport à l’échantillon WT sans inhibiteur. Nombre d’animaux indiqué en barres (WT = 9 rétines de 9 animaux et WTi = 3 rétines de 3 animaux). Test statistique = test non paramétrique de Mann Whitney, p = 0,0074. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
En résumé, la méthode décrite permet aux chercheurs en sciences fondamentales de mesurer l’absorption de l’analogue fluorescent du glucose, le 6-NBDG, in vivo de la rétine neurale murine. Le glucose est un métabolite essentiel pour la rétine neurale, son absorption soutient les taux élevés de glycolyse et de respiration mitochondriale nécessaires pour produire de l’énergie sous forme d’adénosine triphosphate (ATP)1. Le glucose étant le substrat énergétique privilégié, de nombreuses cellules rétiniennes expriment des transporteurs de glucose (GLUT) pour faciliter l’absorption du glucose par le système vasculaire et les tissus environnants2. Le protocole permet aux chercheurs d’évaluer rapidement et à moindre coût l’absorption du glucose dans des modèles murins de maladie rétinienne. De plus, la méthode pourrait également être facilement traduite pour une utilisation dans la rétine du rat ou d’autres tissus d’intérêt.
Il y a quelques aspects importants du protocole qui assureront son succès. Le test est sensible au temps, il est donc important que tous les réactifs et tubes soient préparés avant l’expérience ; Cela garantit que le reste du test se déroule sans problème. Il est important de considérer qu’après 90 minutes d’incubation avec le 6-NBDG, il y a une diminution de la mesure de fluorescence (figure 4), ce qui pourrait indiquer une baisse de la santé rétinienne. En tant que tel, il faut faire très attention à respecter les temps d’incubation. De plus, la dissection de la rétine fraîche est la première étape limitant la fréquence de la procédure ; Une rétine lente ou mal disséquée peut conduire à des résultats erronés car la santé de la rétine décline dans un milieu sans glucose au fil du temps. Ce protocole décrit les étapes de base de la dissection neurale rétinienne murine (à l’exclusion de l’épithélium pigmentaire rétinien et de la choroïde) ; Cependant, pour les chercheurs qui n’ont pas d’expérience dans cette technique, un protocole plus approfondi déjà publié peut être référé11. Le curage ganglionnaire rétinien est l’étape la plus cruciale du protocole, nous recommandons aux chercheurs de ne pas passer plus de 1 minute par œil pour la dissection. Si les temps de dissection sont plus lents, envisagez d’effectuer la procédure avec moins d’échantillons pour limiter la variabilité.
Par souci d’uniformité et afin de limiter la variabilité entre les échantillons, les lectures fluorescentes de 6-NBDG doivent être normalisées en fonction de la protéine rétinienne totale. Cela prend en compte les variations de la taille de la rétine, qui peuvent survenir avec l’âge, par exemple. Pour améliorer la cohérence de ce protocole, l’ensemble de la rétine sans coupures ni dommages délibérés a été utilisé. Cependant, avec la plage de détection du 6-NBDG testée pour la courbe standard (0-40 μM), et avec des niveaux de fluorescence rétinienne entière se situant constamment entre 10-20 μM, il est possible que de plus petites quantités de tissu rétinien puissent être utilisées. Cependant, l’impact de l’incision de la rétine peut introduire un certain niveau d’incohérence avec les résultats obtenus.
Ce protocole présente certaines limites. Les spéculations concernant le mécanisme par lequel le 6-NBDG est absorbé par les cellules suggèrent que l’absorption du 6-NBDG peut se produire par des mécanismes indépendants du transporteur GLUT110. Les résultats obtenus avec l’inhibiteur de GLUT1 BAY-876 soutiennent cette notion ; Le BAY-876 a réduit le 6-NBDG de seulement 24 % (figure 5) ; cependant, la concentration de BAY-876 n’a pas été testée de manière approfondie dans le cadre de ce protocole. Cependant, la conception expérimentale décrite ici peut être utilisée pour mener des recherches supplémentaires concernant la spécificité et l’absorption du 6-NBDG dans la rétine, par exemple, pour explorer l’absorption potentielle du 6-NBDG par GLUT3 et GLUT2, qui sont également présents dans la rétine, bien qu’à un niveau beaucoup plus bas que GLUT15. Une autre limitation importante de ce test est qu’il quantifie l’absorption totale de 6-NBDG rétinienne, et il n’est donc pas possible de déterminer l’absorption de 6-NBDG spécifique à la cellule à l’aide de ce protocole.
Il est important de noter que le protocole décrit présente certains avantages. Le test ne repose pas sur une imagerie objective de l’absorption du glucose dans les tissus, comme celle réalisée dans le tissu cérébral12, par exemple. Les méthodes d’imagerie en temps réel pour détecter l’absorption analogique fluorescente peuvent être à la fois difficiles et coûteuses, ce protocole simplifie l’analyse de l’absorption pour une analyse à débit relativement élevé de l’absorption rétinienne de 6-NBDG. Le dosage décrit pourrait également être étendu à d’autres analogues du glucose fluorescents (p. ex., le 2-NBDG)13, pour lesquels les paramètres d’excitation et d’émission fluorescents sont connus. En conclusion, ce test fournit une mesure relativement rapide, peu coûteuse et cohérente de l’absorption du glucose dans le tissu rétinien, ce qui évite l’utilisation de méthodes d’imagerie coûteuses ou chronophages. Il est essentiel de comprendre les changements dans l’absorption du glucose dans le tissu rétinien dans les maladies du système visuel où les changements dans le métabolisme sont un événement physiopathologique clé14.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été financé par des fonds ministériels non affectés accordés à Lauren K. Wareham.
matériels
| Name | Company | Catalog Number | Comments |
| # 5 forceps | Katena | K5-6550 | Used for retina dissection |
| 1.5 mL microcentrifuge tubes | Thermo Fisher Scientific | 05-408-129 | |
| 26 G x 5/8" needle | sol-M | 112658 | Used to puncture cornea during dissection |
| 5 mL tubes | MTC bio | c2540 | |
| 50 mL tubes | Avantor by VWR | 89039-656 | |
| 6-NBDG | Invitrogen | N23106 | Fluorescent gucose analog |
| 96 well plates black with clear bottom | Thermo Fisher Scientific | 265301 | |
| Anesthetic Charcoal Filter Cannister | ReFresh | EZ-258 | Used in anesthesia set up |
| BAY-876 | Millipore Sigma | SML1774 | For inhibition of GLUT1. |
| Centrifuge at 4 °C | Eppendorf | EPP-5424 | |
| Compressed gas (5% carbon dioxide, 95% oxygen) | Airgas | UN3156 | Used in anesthesia set up |
| curved forceps | Roboz surgical instrument | RS-5137 | Used for retina dissection |
| DDH2O | Elga LabWater | Elga PureLab Ultra | Used after ethanol to clean sonicator in between samples |
| Dissecting microscope | Olympus | szX12 | Used for retina dissection |
| Ethanol 200 proof | Decon laboratories | 2701 | To be used to clean sonicator in between samples |
| Foam floating tube rack | Thermo Fisher Scientific | 36-099-2328 | For tubes during incubation in water bath steps |
| General scissors | Roboz surgical instrument | RS-680 | Used for retina dissection |
| Isoflurane 250 mL bottle | Piramal critical care | NDC 6679401725 | Anesthesia |
| Isoflurane equipment | Vetequip sold by VWR | 89012-492 | Used to anesthetize prior to euthanasia |
| Kim wipes | VWR | 82003-820 | |
| Microplate reader | Molecular devices | SpectraMax M2 microplate reader | Used to read sample |
| Neurobasal- A media | Gibco | 12349-015 | |
| Nose cone (low profile anesthesia mask) | Kent Scientific | SOMNO-0801 | Used to deliver ansethesia |
| Objective on dissecting microscope | Olympus | DF plapo 1x pf | Used for retina dissection |
| Petri dish | VWR | 25384-088 | Used during retina dissection |
| Pierce assay reagent | Thermo Fisher Scientific | 1861426 | |
| Pipette tips P20 | Olympus Plastics | 26-404 | |
| Pipette tips P200, P1000, P10 XL | VWR | 76322-150, 76322-154, 76322-132 | |
| Pipetteman pipettes P200, P1000, P20, P10 | VWR | F144055M, F144056M, F144058M, F144059M | |
| SoftMax Pro software on computer | Molecular devices | SoftMax Pro 7 software | Software used to read sample |
| Sonic dismembrator | Thermo Fisher Scientific | FB50110 | Sonicate sample (retina) |
| Transfer pipettes | Fisherbrand | 13-711-9AM | Used to transfer retina from one tube to another |
| Vannas spring scissors | Katena | K4-5000 | Used for retina dissection |
| Water bath set to 37 °C | N/A | N/A | Used for incubation |
Références
- Casson, R. J., Chidlow, G., Crowston, J. G., Williams, P. A., Wood, J. P. M. Retinal energy metabolism in health and glaucoma. Prog Retin Eye Res. 81, 100881 (2021).
- Daniele, L. L., et al. Glucose uptake by GLUT1 in photoreceptors is essential for outer segment renewal and rod photoreceptor survival. FASEB J. 36 (8), e22428 (2022).
- Fernandes, R., Hosoya, K. -. I., Pereira, P. Reactive oxygen species downregulate glucose transport system in retinal endothelial cells. Am J Physiol Cell Physiol. 300 (4), C927-C936 (2011).
- Badr, G. A., Tang, J., Ismail-Beigi, F., Kern, T. S. Diabetes downregulates GLUT1 expression in the retina and its microvessels but not in the cerebral cortex or its microvessels. Diabetes. 49 (6), 1016-1021 (2000).
- Kumagai, A. K. Glucose transport in brain and retina: implications in the management and complications of diabetes. Diabetes Metab Res Rev. 15 (4), 261-273 (1999).
- Winkler, E. A., et al. GLUT1 reductions exacerbate Alzheimer's disease vasculo-neuronal dysfunction and degeneration. Nat Neurosci. 18 (4), 521-530 (2015).
- Mosconi, L., et al. Hypometabolism exceeds atrophy in presymptomatic early-onset familial Alzheimer's disease. J Nucl Med. 47 (11), 1778-1786 (2006).
- Moreno, M., et al. Morphological and morphometric changes in rat optic nerve microvessels in a glaucoma experimental model. Arch Soc Esp Oftalmol. 89 (12), 471-476 (2014).
- Barros, L. F., et al. Kinetic validation of 6-NBDG as a probe for the glucose transporter GLUT1 in astrocytes. J Neurochem. 109 (s1), 94-100 (2009).
- Hamilton, K. E., Bouwer, M. F., Louters, L. L., Looyenga, B. D. Cellular binding and uptake of fluorescent glucose analogs 2-NBDG and 6-NBDG occurs independent of membrane glucose transporters. Biochimie. 190, 1-11 (2021).
- Feigenspan, A., Babai, N. Z. Preparation of horizontal slices of adult mouse retina for electrophysiological studies. J Vis Exp. 119, e55173 (2017).
- Lundgaard, I., et al. Direct neuronal glucose uptake heralds activity-dependent increases in cerebral metabolism. Nat Commun. 6 (1), 6807 (2015).
- Zou, C., Wang, Y., Shen, Z. 2-NBDG as a fluorescent indicator for direct glucose uptake measurement. J Biochem Biophys Methods. 64 (3), 207-215 (2005).
- Wareham, L. K., et al. Solving neurodegeneration: common mechanisms and strategies for new treatments. Mol Neurodegener. 17 (1), 23 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon