Method Article
测量完整小鼠神经视网膜中葡萄糖类似物 6-(N-(7-硝基苯并-2-氧杂-1,3-二唑-4-基)氨基)-6-脱氧葡萄糖的摄取
摘要
视网膜中的多种细胞类型,包括内皮细胞、神经元和神经胶质细胞,表达葡萄糖转运蛋白 (GLUT) 以使葡萄糖能够被细胞摄取。使用 离体 小鼠神经视网膜和荧光葡萄糖类似物 6-NBDG,我们描述了一种相对快速且廉价的方法来测量整个小鼠视网膜中的葡萄糖摄取。
摘要
视网膜是一种高度代谢的组织,具有多种细胞类型,需要葡萄糖及其衍生物以 ATP 的形式产生能量。视网膜细胞,包括内皮细胞、神经元、光感受器和神经胶质细胞,表达葡萄糖转运蛋白 (GLUT;例如 GLUT1-4),使葡萄糖的摄取能够产生能量。GLUT1 是视网膜中表达最丰富的葡萄糖转运蛋白。该协议使研究人员能够使用荧光葡萄糖类似物 6-(N-(7-硝基苯并-2-氧杂-1,3-二唑-4-基)氨基)-6-脱氧葡萄糖 (6-NBDG) 在离体条件下测量神经小鼠视网膜中葡萄糖的摄取。视网膜解剖后,通过使用读板器进行荧光终点测量,可以很容易地确定总视网膜 6-NBDG 水平。为了保持一致性,我们建议将结果标准化为总蛋白水平。尽管 6-NBDG 对 GLUT1 具有高度特异性,但在 GLUT1 抑制剂 BAY-876 存在下可检测到这种类似物的摄取。因此,该测定提供了一种相对快速且廉价的方法来测量整个小鼠神经视网膜离体葡萄糖摄取,这部分由 GLUT1 介导。
引言
葡萄糖是神经视网膜的重要代谢物,用于促进高速率的糖酵解和线粒体呼吸,以三磷酸腺苷 (ATP) 的形式产生能量1。由于葡萄糖是首选的能量底物,因此许多视网膜细胞表达葡萄糖转运蛋白 (GLUT) 以促进葡萄糖从脉管系统和周围组织吸收2。GLUT 包括一个内在膜糖蛋白家族,负责将葡萄糖转运到哺乳动物细胞中 3。GLUT 转运蛋白-1 (GLUT1) 是视网膜中的主要葡萄糖转运蛋白,在整个视网膜层4 和构成血液视网膜屏障 (BRB) 的毛细血管内皮细胞中表达5。有趣的是,在包括阿尔茨海默病在内的中枢神经系统 (CNS) 神经退行性疾病中,GLUT1 蛋白水平和葡萄糖摄取的降低先于人类的脑萎缩和神经元功能障碍 6,7。在高眼压大鼠模型中,在毛细血管中也观察到较低水平的 GLUT18。在人类视网膜色素变性动物模型中,葡萄糖向视网膜外层的转运减少与光感受器丢失有关,也可能在视网膜神经变性中发挥作用,例如在青光眼中观察到的。因此,需要了解神经视网膜中的葡萄糖转运才能确定其在视网膜神经变性中的作用。
在这里,我们描述了一种新颖、廉价且直接的生化方法,用于测量 离体 小鼠神经视网膜中 6-NBDG 的摄取,即排除视网膜色素上皮和脉络膜。与 2-NBDG 等其他荧光类似物相比,6-NBDG 由一个葡萄糖部分组成,其上有一个荧光硝基苯氧基重氮氨基取代碳 6 处的羟基,从而防止己糖激酶磷酸化和进一步的代谢分解9。尽管 6-NBDG 对 GLUT1 具有高度特异性,结合亲和力比葡萄糖高300 倍 9,但我们在 GLUT1 抑制剂存在下检测该类似物的摄取10。因此,该测定提供了一种相对快速且廉价的方法来测量整个小鼠视网膜 离体 葡萄糖摄取,这部分是由 GLUT1 介导的。
实时测量组织中的葡萄糖摄取具有挑战性,通常需要放射性同位素标记或高分辨率成像方法。在这里,我们采用荧光生化测定法在 离体 条件下快速测定多个视网膜样品中的 6-NBDG 摄取。该方案提供有关视网膜总葡萄糖摄取的信息;它不提供有关视网膜细胞特异性 6-NBDG 摄取水平的信息。
研究方案
此处描述的所有方法均已获得范德堡大学医学中心机构动物护理和使用委员会 (IACUC) 的批准。
1. 化验准备
注意:准备工作应在检测当天进行,然后再进行检测。由于协议的时间敏感性,这是必要的。
- 实验前的一般准备
注意:6-NBDG 对光敏感,应避光保存。用铝箔覆盖所有 6-NBDG 溶液。- 5 mM 6-NBDG 在 50% DMSO/1x PBS 中的储备溶液在 -20 °C 下可稳定保存 6 个月。制备储备溶液并储存 500 μL 等分试样以备将来测定。
- 将 50 mL Neurobasal-A 培养基(不含葡萄糖)锥形管置于冰上。
- 确保水浴设置为 37 °C。
- 为每个视网膜标记 4 × 1.5 mL 微量离心管:1) 葡萄糖饥饿,2) 6-NBDG 孵育,3) 超声处理,以及 4) 用于 Pierce 测定的样品收集管(即,如果您总共有 4 个视网膜,则需要 16 个微量离心管)。有关管设置的摘要,请参见 图 1 。
- 将 200 μL Neurobasal A 培养基从 50 mL 冰上锥形管中加入到预先标记的超声处理管中,并置于冰上进行步骤 2.5.4。
- 打开读板器的电源。
- 使用荧光终点测定功能在读板器软件中设置板信息,参数如下:激发 483 nm、发射 550 nm 和截止 530 nm(为 6-NBDG 预先确定的参数)。
- 实验前的试剂制备:6-NBDG
- 通过稀释步骤 1.1.1 中制备的 5 mM 原液,在 neurobasal-A 培养基中制备终浓度为 500 μM 的 6-NBDG 工作溶液。
注意:请记住用铝箔覆盖所有 6-NBDG 溶液。为整个测定制备适当体积的 500 μM 6-NBDG 工作溶液(每个视网膜需要 200 μL 工作 6-NBDG 溶液;包括额外的错误体积和步骤 2.4 中创建标准溶液所需的量)。 - 将 200 μL 6-NBDG 工作溶液移液到步骤 1.1.4 中为 6-NBDG 孵育步骤制作的预标记管中。
- 通过稀释步骤 1.1.1 中制备的 5 mM 原液,在 neurobasal-A 培养基中制备终浓度为 500 μM 的 6-NBDG 工作溶液。
2. 运行 6-NBDG 摄取测定
注意:有关分步概述,请参见图 2 。
- 视网膜组织清扫术
- 使用吸入异氟醚麻醉剂(2% 异氟醚在 5% 二氧化碳/95% 氧气中)镇静小鼠。
注意: 通过捏住双后脚的脚垫,确认鼠标已充分麻醉。如果麻醉得当,不应有抽搐动作(踏板撤退反射)。如果有反射动作,请返回步骤 2.1.1。 - 通过颈椎脱位对小鼠实施安乐死,然后斩首,然后迅速摘除眼睛。将去核的眼睛放入装有 5-10 mL 冰冷的 neurobasal-A 培养基(不含葡萄糖)的培养皿中。
注意:以下是神经视网膜清扫的基本指南(不包括视网膜色素上皮和脉络膜);有关更深入的说明和指导,请参阅以前发布的方案11 并遵循“小鼠视网膜解剖”部分。 - 将培养皿置于冰上的解剖显微镜下。
- 将无绒湿巾折叠成一个小方块,然后用 Neurobasal A 介质润湿。
- 使用塑料移液管将眼睛转移到潮湿的无绒湿巾上,并修剪掉末端。
注意:无绒湿巾增加了摩擦力,以防止眼睛在解剖过程中移动。 - 取一根 26 G 针,刺穿角膜缘前方的角膜一侧。
- 使用 Vannas 剪刀从穿刺点沿角膜缘切割以去除角膜。
- 切除角膜后,用一对镊子抓住角膜缘和视神经头之间的巩膜。使用另一只手的另一对镊子,抓住晶状体并以一个快速的动作快速将其取出。
注意:如果晶状体缓慢移除,视网膜将保持附着在晶状体上,变得难以解剖。 - 将眼罩转移到装有冰冷 Neurobasal A 的培养皿中。
- 用双手用镊子拿起眼罩,小心地将杯子放在 ora serrata 上。
- 要从巩膜中释放视网膜杯,请使用镊子夹住巩膜,注意不要夹住视网膜组织。
- 小心地将镊子滑入巩膜组织和视网膜组织之间,绕着整个眼球,直到整个视网膜从角膜缘中释放出来。
- 使用 Vannas 剪刀,在角膜缘的巩膜上做一个小切口。
- 用镊子抓住切口的边缘,将巩膜组织剥离到视神经头区域。用非惯用手的镊子抓住巩膜,然后用惯用手的闭合镊子轻轻地将视网膜从巩膜上引开。
- 用剪刀剪断视神经头,将视网膜与巩膜和任何残留的视神经完全分离。
- 使用修剪过的移液管将视网膜转移到预先准备好的 1.5 mL 微量离心管中,用于步骤 1.1.4 中的葡萄糖饥饿,该离心管每管含有 200 μL 神经基础 A 培养基(不含葡萄糖)-1 视网膜。
- 使用吸入异氟醚麻醉剂(2% 异氟醚在 5% 二氧化碳/95% 氧气中)镇静小鼠。
- 葡萄糖饥饿步骤
- 将步骤2.1.14中的试管转移到37°C水浴中,并在37°C下孵育20分钟。
- NBDG 孵化
- 从步骤 1.1.4 将每个视网膜转移到新的预标记管中进行 6-NBDG 孵育,该管在步骤 1.2.2 中的 neurobasal-A 培养基中含有 200 μL 500 μM 6-NBDG。
注意:应使用已切割以扩大尖端的移液管转移视网膜,以便以最小的损伤转移视网膜。此外,如果对自己在不损伤视网膜的情况下转移视网膜的能力有信心,可以用镊子来完成。 - 将试管转移至37°C水浴中,并在37°C下孵育60分钟。
- 从步骤 1.1.4 将每个视网膜转移到新的预标记管中进行 6-NBDG 孵育,该管在步骤 1.2.2 中的 neurobasal-A 培养基中含有 200 μL 500 μM 6-NBDG。
- 6-NBDG 标准品的制备(浓度范围 0 μM-40 μM)
注意:在 60 分钟 6-NBDG 孵育期间准备标准品(步骤 2.3.2.)。标准品可在室温下制备。保护溶液避光。- 为 8 个标准品标记 1.5 mL 微量离心管 #1-8(参见 图 3)。
- 对于标准 #1 (40 μM 6-NBDG),移液 32 μL 在步骤 1.2.1 中制备的 500 μM 6-NBDG 储备液。
- 将 368 μL Neurobasal-A 培养基加入微量离心管中,并通过上下吹打充分混合。
- 对于标准品 #2-8,按如下方式连续稀释样品:
- 将 200 μL neurobasal-A 培养基移液到试管 #2-8 中。
- 从标准管 #1 中取出 200 μL,移液到管 #2 中,然后通过上下移液与移液器充分混合。
- 从标准管 #2 中取出 200 μL,移液管进入标准管 #3。通过上下移液,用移液器充分混合。
- 从标准管 #3 中取出 200 μL,移液至管 #4 中,然后上下移液充分混匀。
- 从标准管 #4 中取出 200 μL,移液到管 #5 中,然后上下移液充分混合。
- 从标准管 #5 中取出 200 μL,移液到管 #6 中,然后上下移液充分混合。
- 从标准管 #6 中取出 200 μL,移液到管 #7 中,然后上下移液充分混合。
- 不向试管 #8 中添加额外的溶液(即,它应仅包含步骤 2.4.4.1 中添加的 200 μL neurobasal-A 培养基)。
- 用于样品采集的清洗、超声处理和离心
- 60 分钟 6-NBDG 孵育完成后,从 37 °C 水浴中取出所有试管。
- 尽可能快速、小心地用 500 μL 冰冷的 neurobasal-A 培养基清洗每个视网膜。
- 洗涤时,用移液管去除 6-NBDG 溶液,确保不要接触或干扰视网膜组织。
注意:还可以选择用镊子将视网膜从 6-NBDG 孵育管转移到含有 500 μL 神经基底 A 培养基的新鲜管中。然后,您只需再进行 3 次洗涤。如果您对自己不用镊子损坏视网膜的能力感到满意,请这样做。 - 然后,将溶液丢弃在适当的废物容器中。立即将 500 μL 冷 neurobasal-A 培养基移液到同一管中,以替换去除的溶液。在两次洗涤之间更换冰上的试管。
- 洗涤时,用移液管去除 6-NBDG 溶液,确保不要接触或干扰视网膜组织。
- 再重复 3 次,总共洗涤 4 次。
- 使用带有修剪边缘或镊子的移液管,小心地将视网膜转移到含有冰上 neurobasal A 培养基的超声管中(参见步骤 1.1.4)。
- 用小解剖剪刀将视网膜切成小块。
注意:确保在切碎每个视网膜之间用乙醇清洗工具,以免交叉污染其他样品。 - 以 10 的振幅对每个视网膜进行 5-10 秒的超声处理,然后立即将其放回冰上。
注:确保先用 100% 乙醇清洁样品之间的超声处理探针,然后用超纯 H2O 清洁。此时,将离心机预冷至 4 °C,或在 4 °C 步入式冷藏室(如果有)中使用离心机。 - 如果小于 21130 x g,则以 21130 x g 或最大速度在 4 °C 下离心 15 分钟。
注意:在步骤 2.5.7 的 15 分钟离心过程中,将步骤 2.4 中制备的 100 μL 标准品 #1-8 移液到黑色、透明底部 96 孔板中。
- 在酶标仪上读取样品
- 离心机 15 分钟结束后,取出 100 μL 上清液,移液到 96 孔板中。
- 将板插入读板器。
注:板中每个样品应有 100 μL 和 100 μL 每个标准品。 - 在读板软件中,使用步骤 1.1.7 中选择的参数选择荧光终点测定。
- 运行检测并保存结果。
- 将样品从 96 孔板移液到 1.1.4 的预标记管中,用于 Pierce 测定。
注:此时,可以立即对样品进行蛋白质检测(见下文)或储存在 -80 °C 下。
- 用于蛋白质归一化的 Pierce 测定
注:Pierce 分析应一式两份(标准品和样品)运行,以提高准确性。- 使用 Pierce 检测预稀释的蛋白质检测标准品,将每种标准品 10 μL 一式两份移液到 96 孔透明底板中。
- 将步骤 2.6.5 中每个样品的 10 μL 一式两份移液到 96 孔板中。
- 向所有含有标准品或样品的孔中加入 150 μL Pierce 试剂。盖上 96 孔板,在板振荡器上以中速混合 1 分钟。
- 在室温 (RT) 下孵育板 5 分钟。
- 将板插入读板器。选择吸光度终点测定并将波长设置为 660 nm。
- 测量标准品和样品的吸光度并保存结果。通过绘制标准曲线计算每个样品中的总微克蛋白。
- 计算视网膜 6-NBDG 摄取。
注意:由于视网膜的大小不均匀,需要将 6-NBDG 结果标准化为总蛋白质含量。- 使用在步骤 2.6 中获得的荧光强度值,使用预定标准品的荧光读数绘制 6-NBDG 荧光标准品曲线并定量每个样品中的 6-NBDG 浓度 (μM)。
- 将样品结果标准化为相应的蛋白质量,以确定 [6-NBDG] μM/μg 蛋白质。
结果
图 4 显示了与 6-NBDG 孵育不同时间的 WT 小鼠视网膜的代表性葡萄糖荧光测量值。孵育 30 分钟后,6-NBDG 水平平均为 336 ± 27.91 AU,而 60 分钟后,6-NBDG 水平增加到平均 616.3 ± 8.38 AU。进一步孵育 30 分钟导致 6-NBDG 水平降低 (506.4 ± 5.3 AU)。在 60 分钟时,结果的可变性最小,因此被选为视网膜与 6-NBDG 孵育的最佳时间。请注意,单位是任意的,并且这些结果未归一化为总蛋白质。
图 5 显示了与 6-NBDG 和 GLUT1 抑制剂 BAY-876(终浓度 100 μM)一起孵育的 WT 小鼠视网膜的葡萄糖荧光测量值。观察到 6-NBDG 摄取减少 24%,表明神经小鼠视网膜中存在 6-NBDG 摄取的 GLUT1 非依赖性机制。
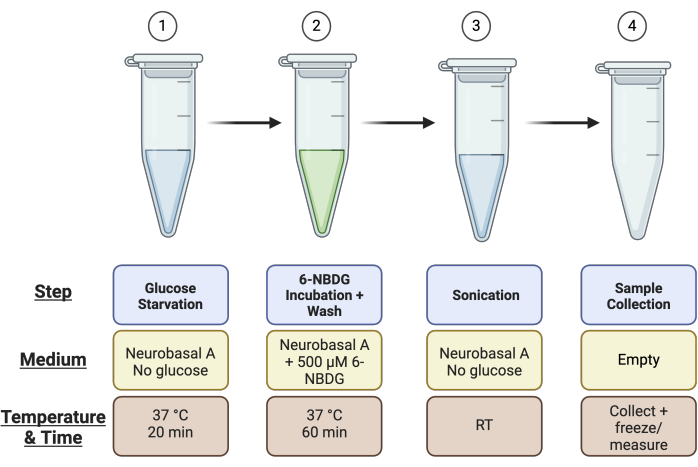
图 1:用于分析的试管设置示意图概述。 在运行检测之前,如图所示为每个视网膜样品设置 4 个试管:试管 1 用于“葡萄糖饥饿”步骤,试管 2 用于“6-NBDG 孵育”步骤,试管 3 用于“超声处理”,试管 4 用于“样品收集”。 请单击此处查看此图的较大版本。

图 2:协议的示意图概述。 神经视网膜解剖后,立即将视网膜样品置于 Neurobasal A 培养基(不含葡萄糖)中的冰上。然后将视黄醇样品转移到 37°C 水浴中 20 分钟,以进行“葡萄糖饥饿”步骤。然后将样品转移到试管中进行“6-NBDG 孵育”步骤,在 37 °C 水浴中保持 60 分钟。孵育后,洗涤视黄醛样品。如果与 6-NBDG 孵育步骤保持在同一试管中,则将它们转移到含有 500 μL 冰冷的 Neurobasal A 培养基(不含葡萄糖)的新鲜试管中,然后洗涤 3 次,或者用 500 μLof 冰冷的 Neurobasal A 培养基(不含葡萄糖)洗涤 4 次。最后,将样品切碎、超声处理并以 21130 x g 离心,然后将上清液转移至“样品采集”管中。然后使用荧光终点测定功能在读板器上读取样品,激发波长为 483 nm,发射波长为 550 nm,截止波长为 530 nm。 请单击此处查看此图的较大版本。

图 3:通过连续稀释生成 6-NBDG 标准品。 通过步骤 1-8 在标有 1-8 的试管中连续稀释 500 μM 储备溶液,制备标准浓度的 6-NBDG,如图所示。试管 8 仅包含 Neurobasal A 培养基(无 6-NBDG)。 请单击此处查看此图的较大版本。

图 4:用于 6-NBDG 孵育时间优化的代表性葡萄糖荧光测量值。 与 6-NBDG 孵育后 30 分钟、60 分钟和 90 分钟的代表性荧光读数。将不含 6-NBDG 的对照样品孵育 90 分钟 (90C)。 请单击此处查看此图的较大版本。

图 5:在 GLUT1 抑制剂 (WTi;100 μM BAY-876) 存在下 6-NBDG 的摄取。 使用野生型 (WT) 视网膜在无抑制剂 (WT) 的情况下在 100 μM BAY-876 (WTi) 存在下孵育的 6-NBDG 摄取结果。结果归一化为总蛋白水平,然后相对于无抑制剂的 WT 样品。动物编号以条形表示(WT = 9 只动物的 9 个视网膜和 WTi = 3 只动物的 3 个视网膜)。统计检验 = Mann Whitney 非参数检验,p = 0.0074。 请单击此处查看此图的较大版本。
讨论
总之,所描述的方法使基础科学研究人员能够测量 离体 小鼠神经视网膜中荧光葡萄糖类似物 6-NBDG 的摄取。葡萄糖是神经视网膜的重要代谢物,它的摄取支持以三磷酸腺苷 (ATP) 的形式产生能量所需的高糖酵解和线粒体呼吸速率1。由于葡萄糖是首选的能量底物,因此许多视网膜细胞表达葡萄糖转运蛋白 (GLUT) 以促进葡萄糖从脉管系统和周围组织吸收2。该方案使研究人员能够快速且廉价地评估视网膜疾病小鼠模型中的葡萄糖摄取。此外,该方法也可以很容易地转化为大鼠视网膜或其他感兴趣的组织。
该协议有几个重要方面将确保其成功。该检测对时间敏感,因此在实验前准备好所有试剂和试管非常重要;这确保了检测的其余部分顺利进行。重要的是要考虑到,与 6-NBDG 孵育 90 分钟后,荧光测量值降低(图 4),这可能表明视网膜健康状况下降。因此,需要非常小心地遵守孵化时间。此外,解剖新鲜视网膜是该程序的第一个限速步骤;视网膜解剖缓慢或解剖不良会导致错误的结果,因为视网膜的健康状况会随着时间的推移而在无葡萄糖培养基中下降。该方案概述了小鼠神经视网膜解剖的基本步骤(不包括视网膜色素上皮和脉络膜);但是,对于对这项技术没有经验的研究人员,可以参考更深入的先前发布的协议11。视网膜解剖是方案中最关键的步骤,我们建议研究人员每只眼睛的解剖时间不超过 1 分钟。如果解剖时间较慢,请考虑使用较少的样本进行该过程,以限制变异性。
为了保持一致性并限制样品之间的差异,应将荧光 6-NBDG 读数标准化为总视网膜蛋白。这考虑了视网膜大小的变化,例如,这可能随着年龄的增长而发生。为了提高该协议的一致性,使用了没有割伤或故意损伤的整个视网膜。然而,由于针对标准曲线 (0-40 μM) 测试的 6-NBDG 检测范围,并且整个视网膜荧光水平始终保持在 10-20 μM 之间,因此可以使用少量的视网膜组织。然而,切割视网膜的影响可能会与获得的结果产生一定程度的不一致。
此协议有一些限制。关于 6-NBDG 被细胞摄取的机制的推测表明,6-NBDG 的摄取可以通过 GLUT1 转运蛋白非依赖性机制发生10。GLUT1 抑制剂 BAY-876 的结果支持这一观点;BAY-876 仅将 6-NBDG 降低了 24%(图 5);然而,在该方案中未对 BAY-876 的浓度进行彻底测试。然而,此处概述的实验设计可用于进行有关 6-NBDG 特异性和视网膜摄取的额外研究,例如,探索 GLUT3 和 GLUT2 对 6-NBDG 的潜在摄取,它们也存在于视网膜中,尽管水平远低于 GLUT15。 该测定法的另一个重要局限性是它量化了视网膜 6-NBDG 总摄取,因此,无法使用该方案确定细胞特异性 6-NBDG 摄取。
重要的是,所描述的协议有一些优点。该测定不依赖于组织中葡萄糖摄取的客观成像,例如在脑组织中进行的12。检测荧光类似物摄取的实时成像方法可能既具有挑战性又昂贵,该协议简化了视网膜 6-NBDG 摄取的相对高通量分析的摄取分析。所描述的测定也可以扩展到其他荧光葡萄糖类似物(例如,2-NBDG)13,这些类似物的荧光激发和发射参数是已知的。总之,该测定提供了一种相对快速、廉价且一致的视网膜组织中葡萄糖摄取的测量方法,避免了使用昂贵或耗时的成像方法。了解视网膜组织中葡萄糖摄取的变化对于视觉系统疾病至关重要,其中新陈代谢的变化是一个关键的病理生理事件14。
披露声明
作者没有什么可披露的。
致谢
这项工作由授予 Lauren K. Wareham 的不受限制的部门资金资助。
材料
| Name | Company | Catalog Number | Comments |
| # 5 forceps | Katena | K5-6550 | Used for retina dissection |
| 1.5 mL microcentrifuge tubes | Thermo Fisher Scientific | 05-408-129 | |
| 26 G x 5/8" needle | sol-M | 112658 | Used to puncture cornea during dissection |
| 5 mL tubes | MTC bio | c2540 | |
| 50 mL tubes | Avantor by VWR | 89039-656 | |
| 6-NBDG | Invitrogen | N23106 | Fluorescent gucose analog |
| 96 well plates black with clear bottom | Thermo Fisher Scientific | 265301 | |
| Anesthetic Charcoal Filter Cannister | ReFresh | EZ-258 | Used in anesthesia set up |
| BAY-876 | Millipore Sigma | SML1774 | For inhibition of GLUT1. |
| Centrifuge at 4 °C | Eppendorf | EPP-5424 | |
| Compressed gas (5% carbon dioxide, 95% oxygen) | Airgas | UN3156 | Used in anesthesia set up |
| curved forceps | Roboz surgical instrument | RS-5137 | Used for retina dissection |
| DDH2O | Elga LabWater | Elga PureLab Ultra | Used after ethanol to clean sonicator in between samples |
| Dissecting microscope | Olympus | szX12 | Used for retina dissection |
| Ethanol 200 proof | Decon laboratories | 2701 | To be used to clean sonicator in between samples |
| Foam floating tube rack | Thermo Fisher Scientific | 36-099-2328 | For tubes during incubation in water bath steps |
| General scissors | Roboz surgical instrument | RS-680 | Used for retina dissection |
| Isoflurane 250 mL bottle | Piramal critical care | NDC 6679401725 | Anesthesia |
| Isoflurane equipment | Vetequip sold by VWR | 89012-492 | Used to anesthetize prior to euthanasia |
| Kim wipes | VWR | 82003-820 | |
| Microplate reader | Molecular devices | SpectraMax M2 microplate reader | Used to read sample |
| Neurobasal- A media | Gibco | 12349-015 | |
| Nose cone (low profile anesthesia mask) | Kent Scientific | SOMNO-0801 | Used to deliver ansethesia |
| Objective on dissecting microscope | Olympus | DF plapo 1x pf | Used for retina dissection |
| Petri dish | VWR | 25384-088 | Used during retina dissection |
| Pierce assay reagent | Thermo Fisher Scientific | 1861426 | |
| Pipette tips P20 | Olympus Plastics | 26-404 | |
| Pipette tips P200, P1000, P10 XL | VWR | 76322-150, 76322-154, 76322-132 | |
| Pipetteman pipettes P200, P1000, P20, P10 | VWR | F144055M, F144056M, F144058M, F144059M | |
| SoftMax Pro software on computer | Molecular devices | SoftMax Pro 7 software | Software used to read sample |
| Sonic dismembrator | Thermo Fisher Scientific | FB50110 | Sonicate sample (retina) |
| Transfer pipettes | Fisherbrand | 13-711-9AM | Used to transfer retina from one tube to another |
| Vannas spring scissors | Katena | K4-5000 | Used for retina dissection |
| Water bath set to 37 °C | N/A | N/A | Used for incubation |
参考文献
- Casson, R. J., Chidlow, G., Crowston, J. G., Williams, P. A., Wood, J. P. M. Retinal energy metabolism in health and glaucoma. Prog Retin Eye Res. 81, 100881 (2021).
- Daniele, L. L., et al. Glucose uptake by GLUT1 in photoreceptors is essential for outer segment renewal and rod photoreceptor survival. FASEB J. 36 (8), e22428 (2022).
- Fernandes, R., Hosoya, K. -. I., Pereira, P. Reactive oxygen species downregulate glucose transport system in retinal endothelial cells. Am J Physiol Cell Physiol. 300 (4), C927-C936 (2011).
- Badr, G. A., Tang, J., Ismail-Beigi, F., Kern, T. S. Diabetes downregulates GLUT1 expression in the retina and its microvessels but not in the cerebral cortex or its microvessels. Diabetes. 49 (6), 1016-1021 (2000).
- Kumagai, A. K. Glucose transport in brain and retina: implications in the management and complications of diabetes. Diabetes Metab Res Rev. 15 (4), 261-273 (1999).
- Winkler, E. A., et al. GLUT1 reductions exacerbate Alzheimer's disease vasculo-neuronal dysfunction and degeneration. Nat Neurosci. 18 (4), 521-530 (2015).
- Mosconi, L., et al. Hypometabolism exceeds atrophy in presymptomatic early-onset familial Alzheimer's disease. J Nucl Med. 47 (11), 1778-1786 (2006).
- Moreno, M., et al. Morphological and morphometric changes in rat optic nerve microvessels in a glaucoma experimental model. Arch Soc Esp Oftalmol. 89 (12), 471-476 (2014).
- Barros, L. F., et al. Kinetic validation of 6-NBDG as a probe for the glucose transporter GLUT1 in astrocytes. J Neurochem. 109 (s1), 94-100 (2009).
- Hamilton, K. E., Bouwer, M. F., Louters, L. L., Looyenga, B. D. Cellular binding and uptake of fluorescent glucose analogs 2-NBDG and 6-NBDG occurs independent of membrane glucose transporters. Biochimie. 190, 1-11 (2021).
- Feigenspan, A., Babai, N. Z. Preparation of horizontal slices of adult mouse retina for electrophysiological studies. J Vis Exp. 119, e55173 (2017).
- Lundgaard, I., et al. Direct neuronal glucose uptake heralds activity-dependent increases in cerebral metabolism. Nat Commun. 6 (1), 6807 (2015).
- Zou, C., Wang, Y., Shen, Z. 2-NBDG as a fluorescent indicator for direct glucose uptake measurement. J Biochem Biophys Methods. 64 (3), 207-215 (2005).
- Wareham, L. K., et al. Solving neurodegeneration: common mechanisms and strategies for new treatments. Mol Neurodegener. 17 (1), 23 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。