Method Article
Messung der Aufnahme des Glukoseanalogons 6-(n-(7-nitrobenz-2-oxa-1,3-diazol-4-yl)amino)-6-desoxyglucose in intakter neuraler Netzhaut der Maus
In diesem Artikel
Zusammenfassung
Mehrere Zelltypen in der Netzhaut, darunter Endothelzellen, Neuronen und Gliazellen, exprimieren Glukosetransporter (GLUTs), um die Glukoseaufnahme in die Zellen zu ermöglichen. Unter Verwendung von ex vivo neuraler Netzhaut der Maus und dem fluoreszierenden Glukoseanalogon 6-NBDG beschreiben wir eine relativ schnelle und kostengünstige Methode zur Messung der Glukoseaufnahme in der gesamten Mausnetzhaut.
Zusammenfassung
Die Netzhaut ist ein hochgradig metabolisches Gewebe mit mehreren Zelltypen, das Glukose und ihre Derivate benötigt, um Energie in Form von ATP zu produzieren. Netzhautzellen, einschließlich Endothelzellen, Neuronen, Photorezeptoren und Gliazellen, exprimieren Glukosetransporter (GLUTs; z. B. GLUT1-4), um die Aufnahme von Glukose für die Energieproduktion zu ermöglichen. GLUT1 ist der am häufigsten exprimierte Glukosetransporter in der Netzhaut. Dieses Protokoll ermöglicht es den Forschern, die Aufnahme von Glukose in der neuralen Netzhaut von Mäusen unter ex vivo-Bedingungen mit dem fluoreszierenden Glukoseanalogon 6-(N-(7-Nitrobenz-2-oxa-1,3-diazol-4-yl)amino)-6-Desoxyglucose (6-NBDG) zu messen. Nach der Netzhautdissektion können die gesamtretinalen 6-NBDG-Spiegel einfach über eine Fluoreszenzendpunktmessung mit einem Plattenleser bestimmt werden. Aus Gründen der Konsistenz empfehlen wir, die Ergebnisse auf den Gesamtproteingehalt zu normalisieren. Obwohl 6-NBDG hochspezifisch für GLUT1 ist, wird die Aufnahme dieses Analogons in Gegenwart des GLUT1-Inhibitors BAY-876 nachgewiesen. Damit bietet dieser Assay eine relativ schnelle und kostengünstige Methode zur Messung der Glukoseaufnahme ex vivo in der gesamten neuralen Netzhaut der Maus, die teilweise durch GLUT1 vermittelt wird.
Einleitung
Glukose ist ein essentieller Metabolit für die neuronale Netzhaut, wo sie verwendet wird, um hohe Glykolyseraten und mitochondriale Atmung zu fördern, um Energie in Form von Adenosintriphosphat (ATP) zu erzeugen1. Da Glukose das bevorzugte Energiesubstrat ist, exprimieren viele Netzhautzellen Glukosetransporter (GLUTs), um die Aufnahme von Glukose aus dem Gefäßsystem und dem umgebenden Gewebe zu erleichtern2. GLUTs umfassen eine Familie von intrinsischen Membranglykoproteinen, die für den Glukosetransport in Säugetierzellen verantwortlich sind3. Der GLUT-Transporter-1 (GLUT1) ist der primäre Glukosetransporter in der Netzhaut, der in den Netzhautschichtenexprimiert wird 4 und von den Kapillarendothelzellen, die die Blut-Netzhaut-Schranke (BRB) bilden5. Interessanterweise geht bei neurodegenerativen Erkrankungen des Zentralnervensystems (ZNS), einschließlich der Alzheimer-Krankheit, eine Verringerung des GLUT1-Proteinspiegels und der Glukoseaufnahme der Hirnatrophie und der neuronalen Dysfunktion beim Menschen voraus 6,7. In einem Rattenmodell für okuläre Hypertonie wurden auch in den Kapillaren niedrigere GLUT1-Spiegel beobachtet8. Ein verminderter Transport von Glukose in die äußere Netzhaut ist mit dem Verlust von Photorezeptoren in Tiermodellen der menschlichen Retinitis pigmentosa verbunden und kann auch eine Rolle bei der retinalen Neurodegeneration spielen, wie sie beim Glaukom beobachtet wurde. Daher ist ein Verständnis des Glukosetransports in der neuronalen Netzhaut erforderlich, um seine Rolle bei der retinalen Neurodegeneration zu belegen.
Hier beschreiben wir eine neuartige, kostengünstige und unkomplizierte biochemische Methode zur Messung der 6-NBDG-Aufnahme in ex vivo muriner neuraler Netzhaut, d.h. unter Ausschluss von retinalem pigmentiertem Epithel und Aderhaut. Im Vergleich zu anderen fluoreszierenden Analoga wie 2-NBDG besteht 6-NBDG aus einer Glukoseeinheit, auf der eine fluoreszierende Nitrobenzoxydiazoaminogruppe die Hydroxylgruppe an Kohlenstoff 6 ersetzt, wodurch die Phosphorylierung durch Hexokinase und ein weiterer metabolischer Abbau verhindertwerden 9. Obwohl 6-NBDG eine hohe Spezifität für GLUT1 aufweist, mit einer 300-mal höheren Bindungsaffinität als Glucose9, weisen wir die Aufnahme dieses Analogons in Gegenwart von GLUT1-Inhibitoren10 nach. Damit bietet dieser Assay eine relativ schnelle und kostengünstige Methode zur Messung der Glukoseaufnahme ex vivo in der gesamten Mausnetzhaut, die teilweise GLUT1-vermittelt ist.
Die Messung der Glukoseaufnahme im Gewebe in Echtzeit ist eine Herausforderung und erfordert oft eine Radioisotopenmarkierung oder hochauflösende bildgebende Verfahren. Hier verwenden wir einen fluoreszierenden biochemischen Assay, um die 6-NBDG-Aufnahme über mehrere Netzhautproben unter ex vivo-Bedingungen schnell zu bestimmen. Das Protokoll liefert Informationen über die Gesamtglukoseaufnahme der Netzhaut; sie liefert keine Informationen über die netzhautzellspezifischen Niveaus der 6-NBDG-Aufnahme.
Protokoll
Alle hier beschriebenen Methoden wurden vom Institutional Animal Care and Use Committee (IACUC) des Vanderbilt University Medical Center zugelassen.
1. Vorbereitung für den Assay
HINWEIS: Die Vorbereitung sollte am Tag des Assays unmittelbar vor der Durchführung des Assays durchgeführt werden. Dies ist aufgrund der zeitkritischen Natur des Protokolls notwendig.
- Allgemeine Vorbereitung vor dem Experiment
HINWEIS: 6-NBDG ist lichtempfindlich und sollte vor Licht geschützt werden. Decken Sie alle 6-NBDG-Lösungen mit Aluminiumfolie ab.- Eine Stammlösung von 5 mM 6-NBDG in 50 % DMSO/1x PBS ist bei -20 °C für 6 Monate stabil. Stellen Sie eine Stammlösung her und lagern Sie 500 μl Aliquote für zukünftige Assays.
- Legen Sie ein konisches 50-ml-Röhrchen mit Neurobasal-A-Medien (ohne Glukose) auf Eis.
- Stellen Sie sicher, dass das Wasserbad auf 37 °C eingestellt ist.
- Etikettieren Sie 4 × 1,5-ml-Mikrozentrifugenröhrchen pro Netzhaut: 1) Glukosemangel, 2) 6-NBDG-Inkubation, 3) Ultraschall und 4) Entnahmeröhrchen für die Probe für den Pierce-Assay (d. h. wenn Sie insgesamt vier Netzhaut haben, benötigen Sie 16 Mikrozentrifugenröhrchen). In Abbildung 1 finden Sie eine Zusammenfassung des Röhrenaufbaus.
- Geben Sie 200 μl neurobasales A-Medium aus dem konischen 50-ml-Röhrchen auf Eis in die vormarkierten Beschallungsröhrchen und legen Sie es für Schritt 2.5.4 auf Eis.
- Schalten Sie das Plattenlesegerät ein.
- Richten Sie die Platteninformationen in der Plattenlesesoftware mit der Fluoreszenz-Endpunkt-Assay-Funktion mit den folgenden Parametern ein: Anregung 483 nm, Emission 550 nm und Cut-off 530 nm (Parameter für 6-NBDG vorgegeben).
- Reagenzienvorbereitung vor dem Experiment: 6-NBDG
- Eine Arbeitslösung von 6-NBDG wird in neurobasalen A-Medien mit einer Endkonzentration von 500 μM hergestellt, indem der in Schritt 1.1.1 hergestellte 5 mM-Stamm verdünnt wird.
HINWEIS: Denken Sie daran, alle 6-NBDG-Lösungen mit Aluminiumfolie abzudecken. Stellen Sie ein geeignetes Volumen von 500 μM 6-NBDG-Arbeitslösung für den gesamten Assay her (benötigen Sie 200 μl 6-NBDG-Arbeitslösung pro Netzhaut; fügen Sie zusätzliches Volumen für Fehler und Mengen hinzu, die für die Herstellung von Standardlösungen in Schritt 2.4 benötigt werden). - Pipettieren Sie 200 μl 6-NBDG-Arbeitslösung in die vormarkierten Röhrchen, die in Schritt 1.1.4 für den 6-NBDG-Inkubationsschritt hergestellt wurden.
- Eine Arbeitslösung von 6-NBDG wird in neurobasalen A-Medien mit einer Endkonzentration von 500 μM hergestellt, indem der in Schritt 1.1.1 hergestellte 5 mM-Stamm verdünnt wird.
2. Durchführung des 6-NBDG-Aufnahmeassays
HINWEIS: In Abbildung 2 finden Sie eine Schritt-für-Schritt-Übersicht.
- Dissektion von Netzhautgewebe
- Sedieren Sie die Maus mit inhalativer Isofluran-Anästhesie (2 % Isofluran in 5 % Kohlendioxid/95 % Sauerstoff).
HINWEIS: Vergewissern Sie sich, dass die Maus ausreichend betäubt ist, indem Sie das Fußpolster an beiden Hinterfüßen einklemmen. Bei richtiger Betäubung sollte es keine ruckartige Bewegung geben (Pedalentzugsreflex). Wenn es eine Reflexbewegung gibt, kehren Sie zu Schritt 2.1.1 zurück. - Euthanasieren Sie die Maus durch Gebärmutterhalsluxation, gefolgt von einer Enthauptung, und enukleieren Sie dann schnell die Augen. Legen Sie die enukleierten Augen in eine Petrischale, die mit 5-10 ml eiskaltem neurobasalem A-Medium (ohne Glukose) auf Eis gefüllt ist.
HINWEIS: Im Folgenden finden Sie grundlegende Richtlinien für die neuronale Netzhautdissektion (ausgenommen retinales Pigmentepithel und Aderhaut); Ausführlichere Anweisungen und Anleitungen finden Sie in einem zuvor veröffentlichten Protokoll11 und im Abschnitt "Netzhautdissektion der Maus". - Stellen Sie die Petrischale unter ein Seziermikroskop auf Eis.
- Falten Sie ein fusselfreies Tuch zu einem kleinen Quadrat und befeuchten Sie es mit Neurobasal A media.
- Übertragen Sie mit einer Kunststoff-Transferpipette ein Auge auf das feuchte, fusselfreie Tuch, wobei das Ende abgeschnitten ist.
HINWEIS: Das fusselfreie Tuch sorgt für eine erhöhte Reibung, um zu verhindern, dass sich das Auge während des Präparierens bewegt. - Nehmen Sie eine 26 G Nadel und stechen Sie die Seite der Hornhaut vor dem Limbus ein.
- Verwenden Sie eine Vannas-Schere, um den Limbus von der Einstichstelle aus zu durchtrennen und die Hornhaut zu entfernen.
- Sobald die Hornhaut entfernt ist, fassen Sie die Sklera auf halbem Weg zwischen dem Limbus und dem Sehnervenkopf mit einer Pinzette. Fassen Sie mit einer weiteren Pinzette in der gegenüberliegenden Hand die Linse und entfernen Sie sie schnell mit einer schnellen Bewegung.
HINWEIS: Wenn die Linse langsam entfernt wird, bleibt die Netzhaut an der Linse haften und lässt sich nur noch schwer sezieren. - Übertragen Sie die Augenmuschel in eine Petrischale mit kaltem Neurobasal A auf Eis.
- Nehmen Sie mit einer Pinzette in beiden Händen die Augenmuschel und halten Sie die Tasse vorsichtig an die Ora Serrata.
- Um die Netzhautschale von der Sklera zu lösen, drücken Sie die Sklera mit einer Pinzette fest und achten Sie darauf, das Netzhautgewebe nicht einzuklemmen.
- Schieben Sie die Pinzette vorsichtig zwischen dem Skleragewebe und dem Netzhautgewebe um den gesamten Globus, bis die gesamte Netzhaut aus dem Limbus gelöst ist.
- Machen Sie mit einer Vannas-Schere einen kleinen Schnitt in der Sklera am Limbus.
- Nehmen Sie eine Pinzette, um die Ränder des Schnitts zu greifen und das Skleralgewebe bis in die Kopfregion des Sehnervs zu schälen. Fassen Sie die Sklera mit einer Pinzette in der nicht-dominanten Hand und führen Sie die Netzhaut mit einer geschlossenen Pinzette in der dominanten Hand sanft von der Sklera weg.
- Schneiden Sie den Sehnervenkopf mit einer Schere ab, um die Netzhaut vollständig von der Sklera und dem verbleibenden Sehnerv zu lösen.
- Die Netzhaut wird mit einer getrimmten Transferpipette in das vorbereitete 1,5-ml-Mikrozentrifugenröhrchen für Glukosemangel aus Schritt 1.1.4 übertragen, das 200 μl neurobasales A-Medium (ohne Glukose)-1 Netzhaut pro Röhrchen enthält.
- Sedieren Sie die Maus mit inhalativer Isofluran-Anästhesie (2 % Isofluran in 5 % Kohlendioxid/95 % Sauerstoff).
- Schritt zum Glukosemangel
- Die Röhrchen aus Schritt 2.1.14 in ein 37 °C warmes Wasserbad überführen und bei 37 °C für 20 min inkubieren.
- NBDG-Inkubation
- Übertragen Sie jede Netzhaut in ein neues, vormarkiertes Röhrchen für die 6-NBDG-Inkubation aus Schritt 1.1.4, das 200 μl 500 μM 6-NBDG in neurobasalem A-Medium aus Schritt 1.2.2 enthält.
HINWEIS: Die Netzhaut sollte mit einer Transferpipette übertragen werden, die geschnitten wurde, um die Spitze zu vergrößern, um die Netzhaut mit minimaler Beschädigung zu übertragen. Darüber hinaus kann dies mit einer Pinzette erfolgen, wenn man sich sicher ist, dass man die Netzhaut ohne Beschädigung übertragen kann. - Röhrchen in 37 °C Wasserbad überführen und bei 37 °C 60 min inkubieren.
- Übertragen Sie jede Netzhaut in ein neues, vormarkiertes Röhrchen für die 6-NBDG-Inkubation aus Schritt 1.1.4, das 200 μl 500 μM 6-NBDG in neurobasalem A-Medium aus Schritt 1.2.2 enthält.
- Erstellung von 6-NBDG-Standards (Konzentrationsbereich 0 μM-40 μM)
HINWEIS: Bereiten Sie die Standards während der 60-minütigen 6-NBDG-Inkubationszeit vor (Schritt 2.3.2.). Standards können bei Raumtemperatur zubereitet werden. Schützen Sie Lösungen vor Licht.- Beschriften Sie 1,5 mL Mikrozentrifugenröhrchen #1-8 für die 8 Standards (siehe Abbildung 3).
- Für Standard #1 (40 μM 6-NBDG) pipettieren Sie 32 μl 500 μM 6-NBDG-Stammlösung, die in Schritt 1.2.1 hergestellt wurde.
- Geben Sie 368 μl neurobasal-A-Medium in das Mikrozentrifugenröhrchen und mischen Sie es gründlich, indem Sie auf und ab pipettieren.
- Für die Standards #2-8 verdünnen Sie die Proben wie folgt:
- Pipettieren Sie 200 μl neurobasal-A-Medium in die Röhrchen #2-8.
- Nehmen Sie 200 μl aus dem Standardröhrchen #1 und pipettieren Sie es in das Röhrchen #2, mischen Sie es dann gründlich mit der Pipette, indem Sie auf und ab pipettieren.
- Nehmen Sie 200 μl aus dem Standardröhrchen #2 und pipettieren Sie es in das Standardröhrchen #3. Mischen Sie gründlich mit der Pipette, indem Sie auf und ab pipettieren.
- Nehmen Sie 200 μl aus dem Standardröhrchen #3 und pipettieren Sie es in das Röhrchen #4, dann mischen Sie es gründlich, indem Sie es auf und ab pipettieren.
- Nehmen Sie 200 μl aus dem Standardröhrchen #4 und pipettieren Sie es in das Röhrchen #5, dann mischen Sie es gründlich, indem Sie es auf und ab pipettieren.
- Nehmen Sie 200 μl aus dem Standardröhrchen #5 und pipettieren Sie es in das Röhrchen #6, dann mischen Sie es gründlich, indem Sie es auf und ab pipettieren.
- Nehmen Sie 200 μl aus dem Standardröhrchen #6 und pipettieren Sie es in das Röhrchen #7, mischen Sie es dann gründlich, indem Sie es auf und ab pipettieren.
- Geben Sie keine zusätzliche Lösung in das Röhrchen #8 (d.h. es sollte nur 200 μl neurobasales A-Medium enthalten, das in Schritt 2.4.4.1 hinzugefügt wurde).
- Waschen, Beschallung und Zentrifugation zur Probenentnahme
- Entfernen Sie alle Röhrchen aus dem 37 °C warmen Wasserbad, sobald die 60-minütige 6-NBDG-Inkubation abgeschlossen ist.
- Waschen Sie jede Netzhaut so schnell und vorsichtig wie möglich mit 500 μl eiskaltem Neurobasal-A-Medium.
- Entfernen Sie zum Waschen die 6-NBDG-Lösung mit einer Pipette und achten Sie darauf, das Netzhautgewebe nicht zu berühren oder zu stören.
HINWEIS: Es besteht auch die Möglichkeit, die Netzhaut mit einer Pinzette aus dem 6-NBDG-Inkubationsröhrchen auf ein frisches Röhrchen mit 500 μl neurobasalem A-Medium zu übertragen. Dann müssen Sie nur noch 3 zusätzliche Wäschen machen. Tun Sie dies, wenn Sie mit Ihrer Fähigkeit, die Netzhaut nicht mit einer Pinzette zu beschädigen, zufrieden sind. - Entsorgen Sie dann die Lösung in einem geeigneten Abfallbehälter. Pipettieren Sie sofort 500 μl kaltes neurobasales Medium in dasselbe Röhrchen, um die entfernte Lösung zu ersetzen. Ersetzen Sie die Schläuche zwischen den Wäschen auf Eis.
- Entfernen Sie zum Waschen die 6-NBDG-Lösung mit einer Pipette und achten Sie darauf, das Netzhautgewebe nicht zu berühren oder zu stören.
- Wiederholen Sie dies noch 3 Mal für insgesamt 4 Wäschen.
- Mit einer Transferpipette mit abgeschnittenem Rand oder einer Pinzette die Netzhaut vorsichtig in die Beschallungsröhrchen mit neurobasalem A-Medium auf Eis übertragen (siehe Schritt 1.1.4).
- Schneide die Netzhaut mit einer kleinen Sezierschere in kleine Stücke.
HINWEIS: Achten Sie darauf, die Werkzeuge zwischen dem Zerkleinern jeder Netzhaut mit Ethanol zu waschen, um andere Proben nicht zu kontaminieren. - Beschallen Sie jede Netzhaut 5-10 s lang mit einer Amplitude von 10 und legen Sie sie sofort wieder auf Eis.
HINWEIS: Stellen Sie sicher, dass die Ultraschallsonde zwischen den Proben mit 100 % Ethanol gefolgt von ultrareinem H2O gereinigt wird. Kühlen Sie die Zentrifuge zu diesem Zeitpunkt entweder auf 4 °C vor oder verwenden Sie die Zentrifuge in einem begehbaren Kühlraum mit 4 °C, falls verfügbar. - Zentrifugieren Sie bei 4 °C für 15 min bei 21130 x g or Höchstdrehzahl, wenn weniger als 21130 x g.
HINWEIS: Pipettieren Sie während der 15-minütigen Zentrifuge in Schritt 2.5.7 100 μl der Standards #1-8, die in Schritt 2.4 hergestellt wurden, in eine schwarze, durchsichtige untere 96-Well-Platte.
- Lesen von Proben auf einem Plattenlesegerät
- Nach Beendigung der 15-minütigen Zentrifuge 100 μl Überstand entfernen und in die 96-Well-Platte pipettieren.
- Platte in den Tellerleser einlegen.
HINWEIS: Die Platte sollte 100 μl jeder Probe und 100 μl jedes Standards enthalten. - Wählen Sie in der Plattenlesesoftware den Fluoreszenz-Endpunkt-Assay mit den in Schritt 1.1.7 ausgewählten Parametern aus.
- Führen Sie den Assay aus und speichern Sie die Ergebnisse.
- Pipettieren Sie Proben aus der 96-Well-Platte in die vormarkierten Röhrchen aus Nummer 1.1.4 für den Pierce-Assay.
HINWEIS: Zu diesem Zeitpunkt können die Proben sofort auf Protein untersucht (siehe unten) oder bei -80 °C gelagert werden.
- Pierce-Assay zur Proteinnormalisierung
HINWEIS: Der Pierce-Assay sollte in doppelter Ausführung (sowohl Standards als auch Proben) durchgeführt werden, um die Genauigkeit zu erhöhen.- Pipettieren Sie unter Verwendung der vorverdünnten Protein-Assay-Standards des Pierce-Assays jeweils 10 μl in doppelter Ausführung in eine durchsichtige 96-Well-Bodenplatte.
- Pipettieren Sie 10 μl jeder Probe in doppelter Ausführung aus Schritt 2.6.5 in die 96-Well-Platte.
- Geben Sie 150 μl Pierce-Reagenz in alle Vertiefungen, die Standards oder Proben enthalten. Decken Sie die 96-Well-Platte ab und mixen Sie sie auf einem Plattenschüttler bei mittlerer Geschwindigkeit 1 Minute lang.
- Inkubieren Sie die Platte 5 Minuten lang bei Raumtemperatur (RT).
- Platte in den Tellerleser einlegen. Wählen Sie den Absorptionsendpunkt-Assay aus und stellen Sie die Wellenlänge auf 660 nm ein.
- Messen Sie die Absorption von Standards und Proben und speichern Sie die Ergebnisse. Berechnen Sie die Gesamtmenge an Mikrogramm Protein in jeder Probe, indem Sie eine Standardkurve zeichnen.
- Berechnung der retinalen 6-NBDG-Aufnahme.
HINWEIS: Die 6-NBDG-Ergebnisse müssen aufgrund der ungleichmäßigen Größe der Netzhaut auf den Gesamtproteingehalt normalisiert werden.- Unter Verwendung der in Schritt 2.6 ermittelten Fluoreszenzintensitätswerte werden die Fluoreszenzmesswerte aus vorgegebenen Standards verwendet, um eine 6-NBDG-Fluoreszenzstandardkurve zu erstellen und die 6-NBDG-Konzentration (μM) in jeder Probe zu quantifizieren.
- Normalisieren Sie die Probenergebnisse auf die entsprechenden Proteinmengen, um das Protein [6-NBDG] μM/μg zu bestimmen.
Ergebnisse
Abbildung 4 zeigt repräsentative Glukosefluoreszenzmessungen aus der Netzhaut von WT-Mäusen, die über verschiedene Zeiträume mit 6-NBDG inkubiert wurden. Nach 30 Minuten Inkubation betrugen die 6-NBDG-Spiegel durchschnittlich 336 ± 27,91 AE, während nach 60 Minuten die 6-NBDG-Spiegel auf durchschnittlich 616,3 ± 8,38 AE anstiegen. Eine weitere Inkubation von 30 Minuten führte zu einem reduzierten Gehalt an 6-NBDG (506,4 ± 5,3 AE). Bei 60 min war die Variabilität der Ergebnisse minimal und wurde daher als optimaler Zeitpunkt für die Inkubation der Netzhaut mit 6-NBDG gewählt. Beachten Sie, dass die Einheiten willkürlich sind und dass diese Ergebnisse nicht auf das Gesamtprotein normalisiert wurden.
Abbildung 5 zeigt Glukosefluoreszenzmessungen aus der Netzhaut von WT-Mäusen, die mit 6-NBDG und dem GLUT1-Inhibitor BAY-876 inkubiert wurden (100 μM Endkonzentration). Es wurde eine Abnahme der 6-NBDG-Aufnahme um 24% beobachtet, was darauf hindeutet, dass es GLUT1-unabhängige Mechanismen der 6-NBDG-Aufnahme in der neuronalen Mausnetzhaut gibt.
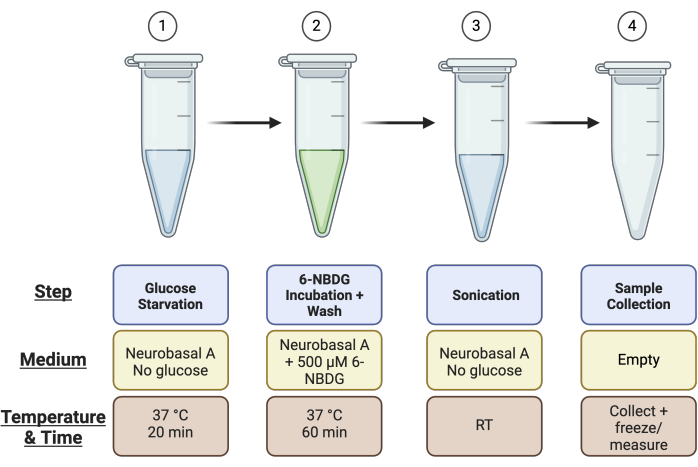
Abbildung 1: Schematische Übersicht über den Aufbau des Röhrchens für den Assay. Richten Sie vor der Durchführung des Assays 4 Röhrchen pro Netzhautprobe wie beschrieben ein: Röhrchen 1 für den Schritt "Glukosemangel", Röhrchen 2 für den Schritt "6-NBDG-Inkubation", Röhrchen 3 für die "Beschallung" und Röhrchen 4 für die "Probenentnahme". Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Schematische Übersicht des Protokolls. Nach der Sektion der neuronalen Netzhaut werden die Netzhautproben sofort auf Eis im Neurobasal-A-Medium (ohne Glukose) gelegt. Die Netzhautproben werden dann für 20 Minuten in ein 37 °C warmes Wasserbad für den Schritt "Glukosemangel" überführt. Die Proben werden dann in die Röhrchen für den Schritt "6-NBDG-Inkubation" überführt, wo sie 60 Minuten lang im 37 °C warmen Wasserbad verbleiben. Nach der Inkubation werden die Netzhautproben gewaschen. Sie werden entweder in frische Röhrchen mit 500 μl eiskaltem Neurobasal-A-Medium (ohne Glukose) überführt und dann 3-mal gewaschen, oder sie werden 4-mal mit 500 μl eiskaltem Neurobasal-A-Medium (ohne Glukose) gewaschen, wenn sie im selben Röhrchen wie der 6-NBDG-Inkubationsschritt verbleiben. Schließlich werden die Proben zerkleinert, beschallt und bei 21130 x g zentrifugiert, bevor die Überstände in ein "Probenentnahme"-Röhrchen überführt werden. Die Proben werden dann auf einem Platten-Reader unter Verwendung der Fluoreszenz-Endpunkt-Assay-Funktion mit Anregung bei 483 nm, Emission bei 550 nm und Cut-off bei 530 nm abgelesen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Erzeugung von 6-NBDG-Standards durch serielle Verdünnung. Erstellen Sie Standardkonzentrationen von 6-NBDG, indem Sie die 500 μM-Stammlösung seriell mit Neurobasal-A-Medium durch die Schritte 1-8 in Röhrchen verdünnen, die mit 1-8 wie skizziert gekennzeichnet sind. Sonde 8 enthält nur Neurobasal-A-Medium (kein 6-NBDG). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Repräsentative Glukosefluoreszenzmessungen zur Optimierung der 6-NBDG-Inkubationszeit. Repräsentative Fluoreszenzmessung nach Inkubation mit 6-NBDG bei 30 min, 60 min und 90 min. Eine Kontrollprobe ohne 6-NBDG wurde 90 min lang (90C) inkubiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Aufnahme von 6-NBDG in Gegenwart von GLUT1-Inhibitor (WTi; 100 μM BAY-876). 6-NBDG-Aufnahmeergebnisse mit Wildtyp-Netzhaut (WT), inkubiert ohne Inhibitor (WT) und in Gegenwart von 100 μM BAY-876 (WTi). Die Ergebnisse normalisierten sich auf die Gesamtproteinspiegel und dann in Bezug auf die WT-Probe ohne Inhibitor. Die Tierzahlen werden in Balken angegeben (WT = 9 Netzhaut von 9 Tieren und WTi = 3 Netzhaut von 3 Tieren). Statistischer Test = nichtparametrischer Mann-Whitney-Test, p = 0,0074. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Zusammenfassend lässt sich sagen, dass die beschriebene Methode es Grundlagenforschern ermöglicht, die Aufnahme des fluoreszierenden Glukoseanalogons 6-NBDG in ex vivo neuralen Netzhäuten von Mäusen zu messen. Glukose ist ein essentieller Metabolit für die neuronale Netzhaut, seine Aufnahme unterstützt die hohen Raten der Glykolyse und der mitochondrialen Atmung, die zur Energieerzeugung in Form von Adenosintriphosphat (ATP)1 erforderlich sind. Da Glukose das bevorzugte Energiesubstrat ist, exprimieren viele Netzhautzellen Glukosetransporter (GLUTs), um die Aufnahme von Glukose aus dem Gefäßsystem und dem umgebenden Gewebe zu erleichtern2. Das Protokoll ermöglicht es Forschern, die Glukoseaufnahme in Mausmodellen für Netzhauterkrankungen schnell und kostengünstig zu bewerten. Darüber hinaus könnte die Methode auch leicht auf den Einsatz in der Netzhaut von Ratten oder anderen interessanten Geweben übertragen werden.
Es gibt einige wichtige Aspekte des Protokolls, die seinen Erfolg sicherstellen werden. Der Assay ist zeitkritisch, daher ist es wichtig, dass alle Reagenzien und Röhrchen vor dem Experiment vorbereitet werden. Dadurch wird sichergestellt, dass der Rest des Assays reibungslos abläuft. Es ist wichtig zu berücksichtigen, dass nach 90 Minuten Inkubation mit 6-NBDG die Fluoreszenzmessung abnimmt (Abbildung 4), was auf eine Verschlechterung der Netzhautgesundheit hinweisen könnte. Daher muss sehr darauf geachtet werden, dass die Inkubationszeiten eingehalten werden. Darüber hinaus ist die Dissektion der frischen Netzhaut der erste geschwindigkeitsbegrenzende Schritt des Eingriffs; Eine langsame oder schlecht präparierte Netzhaut kann zu fehlerhaften Ergebnissen führen, da die Gesundheit der Netzhaut in glukosefreiem Medium mit der Zeit abnimmt. Dieses Protokoll beschreibt die grundlegenden Schritte für die neuronale Netzhautdissektion an Mäusen (ohne retinales Pigmentepithel und Aderhaut); Für Forscher, die in dieser Technik unerfahren sind, kann jedoch auf ein ausführlicheres, zuvor veröffentlichtes Protokoll verwiesen werden11. Die Netzhautdissektion ist der wichtigste Schritt im Protokoll, wir empfehlen, dass Forscher nicht mehr als 1 Minute pro Auge für die Dissektion aufwenden. Wenn die Präparierzeiten langsamer sind, sollten Sie in Betracht ziehen, das Verfahren mit weniger Proben durchzuführen, um die Variabilität zu begrenzen.
Aus Gründen der Konsistenz und um die Variabilität zwischen den Proben zu begrenzen, sollten die fluoreszierenden 6-NBDG-Messwerte auf das gesamte retinale Protein normalisiert werden. Dabei werden Schwankungen in der Netzhautgröße berücksichtigt, die zum Beispiel mit zunehmendem Alter auftreten können. Um die Konsistenz in diesem Protokoll zu verbessern, wurde die gesamte Netzhaut ohne Schnitte oder absichtliche Beschädigung verwendet. Mit dem Nachweisbereich von 6-NBDG, der für die Standardkurve (0-40 μM) getestet wurde, und mit Fluoreszenzwerten der gesamten Netzhaut, die konstant zwischen 10 und 20 μM liegen, ist es jedoch möglich, dass kleinere Mengen an Netzhautgewebe verwendet werden können. Die Auswirkungen des Schneidens der Netzhaut können jedoch zu einem gewissen Maß an Inkonsistenz mit den erzielten Ergebnissen führen.
Es gibt einige Einschränkungen für dieses Protokoll. Spekulationen über den Mechanismus, durch den 6-NBDG von Zellen aufgenommen wird, deuten darauf hin, dass die Aufnahme von 6-NBDG durch GLUT1-Transporter-unabhängige Mechanismen erfolgen kann10. Die Ergebnisse mit dem GLUT1-Inhibitor BAY-876 unterstützen diese Annahme; BAY-876 reduzierte 6-NBDG um nur 24 % (Abbildung 5); Die Konzentration von BAY-876 wurde in diesem Protokoll jedoch nicht gründlich getestet. Das hier skizzierte Versuchsdesign kann jedoch genutzt werden, um zusätzliche Untersuchungen zur 6-NBDG-Spezifität und -Aufnahme in der Netzhaut durchzuführen, z. B. zur Untersuchung einer möglichen 6-NBDG-Aufnahme durch GLUT3 und GLUT2, die ebenfalls in der Netzhaut vorhanden sind, wenn auch auf einem viel niedrigeren Niveau als GLUT15. Eine weitere wichtige Einschränkung dieses Assays besteht darin, dass er die gesamte retinale 6-NBDG-Aufnahme quantifiziert und es daher nicht möglich ist, die zellspezifische 6-NBDG-Aufnahme mit diesem Protokoll zu bestimmen.
Wichtig ist, dass das beschriebene Protokoll einige Vorteile bietet. Der Assay stützt sich nicht auf eine objektive Bildgebung der Glukoseaufnahme im Gewebe, wie sie beispielsweise im Hirngewebe12 durchgeführt wird. Echtzeit-Bildgebungsverfahren zum Nachweis der Aufnahme von Fluoreszenzanaloga können sowohl schwierig als auch teuer sein, dieses Protokoll vereinfacht die Analyse der Aufnahme für eine relativ hohe Durchsatzanalyse der retinalen 6-NBDG-Aufnahme. Der beschriebene Assay könnte auch auf andere fluoreszierende Glukoseanaloga (z. B. 2-NBDG)13 erweitert werden, für die fluoreszierende Anregungs- und Emissionsparameter bekannt sind. Zusammenfassend lässt sich sagen, dass dieser Assay eine relativ schnelle, kostengünstige und konsistente Messung der Glukoseaufnahme im Netzhautgewebe bietet, die den Einsatz teurer oder zeitaufwändiger Bildgebungsverfahren vermeidet. Das Verständnis von Veränderungen der Glukoseaufnahme im Netzhautgewebe ist entscheidend für Erkrankungen des visuellen Systems, bei denen Veränderungen im Stoffwechsel ein wichtiges pathophysiologisches Ereignis darstellen14.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde durch uneingeschränkte Abteilungsmittel finanziert, die Lauren K. Wareham zur Verfügung gestellt wurden.
Materialien
| Name | Company | Catalog Number | Comments |
| # 5 forceps | Katena | K5-6550 | Used for retina dissection |
| 1.5 mL microcentrifuge tubes | Thermo Fisher Scientific | 05-408-129 | |
| 26 G x 5/8" needle | sol-M | 112658 | Used to puncture cornea during dissection |
| 5 mL tubes | MTC bio | c2540 | |
| 50 mL tubes | Avantor by VWR | 89039-656 | |
| 6-NBDG | Invitrogen | N23106 | Fluorescent gucose analog |
| 96 well plates black with clear bottom | Thermo Fisher Scientific | 265301 | |
| Anesthetic Charcoal Filter Cannister | ReFresh | EZ-258 | Used in anesthesia set up |
| BAY-876 | Millipore Sigma | SML1774 | For inhibition of GLUT1. |
| Centrifuge at 4 °C | Eppendorf | EPP-5424 | |
| Compressed gas (5% carbon dioxide, 95% oxygen) | Airgas | UN3156 | Used in anesthesia set up |
| curved forceps | Roboz surgical instrument | RS-5137 | Used for retina dissection |
| DDH2O | Elga LabWater | Elga PureLab Ultra | Used after ethanol to clean sonicator in between samples |
| Dissecting microscope | Olympus | szX12 | Used for retina dissection |
| Ethanol 200 proof | Decon laboratories | 2701 | To be used to clean sonicator in between samples |
| Foam floating tube rack | Thermo Fisher Scientific | 36-099-2328 | For tubes during incubation in water bath steps |
| General scissors | Roboz surgical instrument | RS-680 | Used for retina dissection |
| Isoflurane 250 mL bottle | Piramal critical care | NDC 6679401725 | Anesthesia |
| Isoflurane equipment | Vetequip sold by VWR | 89012-492 | Used to anesthetize prior to euthanasia |
| Kim wipes | VWR | 82003-820 | |
| Microplate reader | Molecular devices | SpectraMax M2 microplate reader | Used to read sample |
| Neurobasal- A media | Gibco | 12349-015 | |
| Nose cone (low profile anesthesia mask) | Kent Scientific | SOMNO-0801 | Used to deliver ansethesia |
| Objective on dissecting microscope | Olympus | DF plapo 1x pf | Used for retina dissection |
| Petri dish | VWR | 25384-088 | Used during retina dissection |
| Pierce assay reagent | Thermo Fisher Scientific | 1861426 | |
| Pipette tips P20 | Olympus Plastics | 26-404 | |
| Pipette tips P200, P1000, P10 XL | VWR | 76322-150, 76322-154, 76322-132 | |
| Pipetteman pipettes P200, P1000, P20, P10 | VWR | F144055M, F144056M, F144058M, F144059M | |
| SoftMax Pro software on computer | Molecular devices | SoftMax Pro 7 software | Software used to read sample |
| Sonic dismembrator | Thermo Fisher Scientific | FB50110 | Sonicate sample (retina) |
| Transfer pipettes | Fisherbrand | 13-711-9AM | Used to transfer retina from one tube to another |
| Vannas spring scissors | Katena | K4-5000 | Used for retina dissection |
| Water bath set to 37 °C | N/A | N/A | Used for incubation |
Referenzen
- Casson, R. J., Chidlow, G., Crowston, J. G., Williams, P. A., Wood, J. P. M. Retinal energy metabolism in health and glaucoma. Prog Retin Eye Res. 81, 100881 (2021).
- Daniele, L. L., et al. Glucose uptake by GLUT1 in photoreceptors is essential for outer segment renewal and rod photoreceptor survival. FASEB J. 36 (8), e22428 (2022).
- Fernandes, R., Hosoya, K. -. I., Pereira, P. Reactive oxygen species downregulate glucose transport system in retinal endothelial cells. Am J Physiol Cell Physiol. 300 (4), C927-C936 (2011).
- Badr, G. A., Tang, J., Ismail-Beigi, F., Kern, T. S. Diabetes downregulates GLUT1 expression in the retina and its microvessels but not in the cerebral cortex or its microvessels. Diabetes. 49 (6), 1016-1021 (2000).
- Kumagai, A. K. Glucose transport in brain and retina: implications in the management and complications of diabetes. Diabetes Metab Res Rev. 15 (4), 261-273 (1999).
- Winkler, E. A., et al. GLUT1 reductions exacerbate Alzheimer's disease vasculo-neuronal dysfunction and degeneration. Nat Neurosci. 18 (4), 521-530 (2015).
- Mosconi, L., et al. Hypometabolism exceeds atrophy in presymptomatic early-onset familial Alzheimer's disease. J Nucl Med. 47 (11), 1778-1786 (2006).
- Moreno, M., et al. Morphological and morphometric changes in rat optic nerve microvessels in a glaucoma experimental model. Arch Soc Esp Oftalmol. 89 (12), 471-476 (2014).
- Barros, L. F., et al. Kinetic validation of 6-NBDG as a probe for the glucose transporter GLUT1 in astrocytes. J Neurochem. 109 (s1), 94-100 (2009).
- Hamilton, K. E., Bouwer, M. F., Louters, L. L., Looyenga, B. D. Cellular binding and uptake of fluorescent glucose analogs 2-NBDG and 6-NBDG occurs independent of membrane glucose transporters. Biochimie. 190, 1-11 (2021).
- Feigenspan, A., Babai, N. Z. Preparation of horizontal slices of adult mouse retina for electrophysiological studies. J Vis Exp. 119, e55173 (2017).
- Lundgaard, I., et al. Direct neuronal glucose uptake heralds activity-dependent increases in cerebral metabolism. Nat Commun. 6 (1), 6807 (2015).
- Zou, C., Wang, Y., Shen, Z. 2-NBDG as a fluorescent indicator for direct glucose uptake measurement. J Biochem Biophys Methods. 64 (3), 207-215 (2005).
- Wareham, L. K., et al. Solving neurodegeneration: common mechanisms and strategies for new treatments. Mol Neurodegener. 17 (1), 23 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten