Method Article
포도당 유사체, 6-(N-(7-니트로벤츠-2-옥사-1,3-디아졸-4-일)아미노)-6-데옥시글루코스의 흡수 측정, 온전한 쥐 신경 망막에서
요약
내피 세포(endothelial cell), 뉴런(neuron), 신경교세포(glial cell)를 포함한 망막의 여러 세포 유형은 포도당 수송체(glucose transporter, GLUT)를 발현하여 포도당이 세포로 흡수될 수 있도록 합니다. 생체 외 마우스 신경 망막과 형광 포도당 아날로그 6-NBDG를 사용하여 전체 마우스 망막의 포도당 흡수를 측정하는 비교적 빠르고 저렴한 방법을 설명합니다.
초록
망막은 ATP 형태의 에너지를 생산하기 위해 포도당과 그 유도체를 필요로 하는 여러 세포 유형을 가진 고도의 대사 조직입니다. 내피 세포, 뉴런, 광수용체 및 신경교세포를 포함한 망막 세포는 포도당 수송체(GLUTs, 예: GLUT1-4)를 발현하여 에너지 생산을 위한 포도당 흡수를 가능하게 합니다. GLUT1은 망막에서 가장 풍부하게 발현되는 포도당 수송체입니다. 이 프로토콜을 통해 연구원들은 형광 포도당 유사체 6-(N-(7-Nitrobenz-2-oxa-1,3-diazol-4-yl)amino)-6-Deoxyglucose(6-NBDG)를 사용하여 생체 외 조건에서 신경 쥐 망막의 포도당 흡수를 측정할 수 있습니다. 망막 박리 후 총 망막 6-NBDG 수치는 플레이트 리더를 사용한 형광 종말점 측정을 통해 쉽게 측정할 수 있습니다. 일관성을 위해 결과를 총 단백질 수준으로 정규화하는 것이 좋습니다. 6-NBDG는 GLUT1에 대해 매우 특이적이지만, 이 유사체의 흡수는 GLUT1 억제제 BAY-876의 존재 하에서 감지됩니다. 따라서 이 분석법은 GLUT1에 의해 부분적으로 매개되는 전체 마우스 신경 망막에서 생체 외 포도당 흡수를 측정하는 비교적 빠르고 저렴한 방법을 제공합니다.
서문
포도당은 신경 망막에 필수적인 대사 산물로, 높은 해당과정과 미토콘드리아 호흡을 촉진하여 아데노신 삼인산(ATP) 형태의 에너지를 생산하는 데 사용됩니다1. 포도당이 선호되는 에너지 기질이기 때문에 많은 망막 세포는 혈관 구조와 주변 조직에서 포도당의 흡수를 촉진하기 위해 포도당 수송체(glucose transporter, GLUTs)를 발현합니다2. GLUT는 포유류 세포로의 포도당 수송을 담당하는 내인성 막 당단백질(intrinsic membrane glycoprotein)의 계열로 구성됩니다3. GLUT transporter-1 (GLUT1)은 망막의 주요 포도당 수송체로, 망막층4 전체와 혈액-망막 장벽(BRB)5을 구성하는 모세혈관 내피 세포에 의해 발현됩니다. 흥미롭게도, 알츠하이머 병을 포함한 중추 신경계 (CNS)의 신경 퇴행성 질환에서 GLUT1 단백질 수치와 포도당 흡수의 감소는 인간의 뇌 위축 및 신경 기능 장애보다 선행합니다6 , 7. 안구 고혈압에 대한 쥐 모델에서, 모세혈관에서 낮은 수준의 GLUT1이 관찰되었다8. 망막 외부로의 포도당 수송 감소는 인간 색소성 망막염의 동물 모델에서 광수용체 손실과 관련이 있으며 녹내장에서 관찰되는 것과 같은 망막 신경 퇴행에도 역할을 할 수 있습니다. 따라서 망막 신경퇴행에서 포도당의 역할을 규명하기 위해서는 신경 망막의 포도당 수송에 대한 이해가 필요합니다.
여기에서는 생체 외 쥐 신경 망막에서 6-NBDG 흡수를 측정하기 위한 새롭고 저렴하며 간단한 생화학적 방법, 즉 망막 색소 상피 및 맥락막을 제외하는 방법을 설명합니다. 2-NBDG와 같은 다른 형광 유사체와 비교하여, 6-NBDG는 형광 니트로벤즈옥시디아조아미노기가 탄소 6에서 수산기를 대체하는 포도당 부분으로 구성되어 헥소키나제에 의한 인산화와 추가 대사 분해를 방지합니다9. 6-NBDG는 글루코스9보다 결합 친화도가 300배 높은 GLUT1에 대한 특이성이 높지만, GLUT1 억제제10의 존재 하에서 이 유사체의 흡수를 검출합니다. 따라서 이 분석법은 부분적으로 GLUT1 매개 쥐 망막에서 생체 외 포도당 흡수를 측정하는 비교적 빠르고 저렴한 방법을 제공합니다.
조직 내 포도당 흡수량을 실시간으로 측정하는 것은 까다로우며, 종종 방사성 동위원소 라벨링 또는 고해상도 이미징 방법이 필요합니다. 여기에서는 형광 생화학 분석을 사용하여 생체 외 조건에서 여러 망막 샘플에서 6-NBDG 흡수를 신속하게 측정합니다. 프로토콜은 총 망막 포도당 흡수에 대한 정보를 제공합니다. 6-NBDG 흡수의 망막 세포 특이적 수준에 대한 정보는 제공하지 않습니다.
프로토콜
여기에 설명된 모든 방법은 밴더빌트 대학 의료 센터의 기관 동물 관리 및 사용 위원회(IACUC)의 승인을 받았습니다.
1. 분석 준비
참고: 준비는 분석을 실행하기 직전에 분석 당일에 수행해야 합니다. 이는 프로토콜의 시간에 민감한 특성으로 인해 필요합니다.
- 실험에 앞서 일반적인 준비 사항
참고: 6-NBDG는 빛에 민감하므로 빛으로부터 보호해야 합니다. 모든 6-NBDG 솔루션을 알루미늄 호일로 덮습니다.- 50% DMSO/1x PBS의 5mM 6-NBDG 원액은 -20°C에서 6개월 동안 안정적입니다. 원액을 만들고 향후 분석을 위해 500μL 분취량을 저장합니다.
- Neurobasal-A 배지(포도당 제외)가 담긴 50mL 원뿔형 튜브를 얼음 위에 놓습니다.
- 수조가 37°C로 설정되어 있는지 확인하십시오.
- 망막당 라벨 4 × 1.5mL 마이크로 원심분리기 튜브: 1) 포도당 결핍, 2) 6-NBDG 배양, 3) 초음파 처리, 4) Pierce 분석을 위한 시료 채취 튜브(즉, 총 4개의 망막이 있는 경우 16개의 마이크로 원심분리 튜브가 필요함). 튜브 설정에 대한 요약은 그림 1 을 참조하십시오.
- 얼음 위의 50mL 원뿔형 튜브에서 200μL의 neurobasal A 배지를 사전 라벨링된 초음파 처리 튜브에 추가하고 2.5.4단계를 위해 얼음 위에 놓습니다.
- 플레이트 리더의 전원을 켭니다.
- excitation 483 nm, emission 550 nm 및 cut-off 530 nm(6-NBDG에 대해 미리 결정된 매개변수)와 함께 형광 종말점 분석 기능을 사용하여 플레이트 리더 소프트웨어에서 플레이트 정보를 설정합니다.
- 실험 전 시약 준비: 6-NBDG
- 1.1.1단계에서 만든 5mM 스톡을 희석하여 500μM의 최종 농도에서 neurobasal-A 배지에서 6-NBDG의 작업 용액을 만듭니다.
알림: 모든 6-NBDG 솔루션을 알루미늄 호일로 덮는 것을 잊지 마십시오. 전체 분석에 대해 적절한 부피의 500μM 6-NBDG 작업 용액을 만듭니다(망막당 200μL의 작업 6-NBDG 용액 필요, 오류에 대한 추가 부피 및 2.4단계에서 표준 용액을 만드는 데 필요한 양 포함). - 6-NBDG 인큐베이션 단계를 위해 1.1.4단계에서 만든 사전 라벨링된 튜브에 200μL의 6-NBDG 작업 용액을 피펫팅합니다.
- 1.1.1단계에서 만든 5mM 스톡을 희석하여 500μM의 최종 농도에서 neurobasal-A 배지에서 6-NBDG의 작업 용액을 만듭니다.
2. 6-NBDG 흡수 분석 실행
참고: 단계별 개요는 그림 2 를 참조하십시오.
- 망막 조직 절제
- 흡입 이소플루란 마취(5% 이산화탄소/95% 산소에 2% 이소플루란)를 사용하여 마우스를 진정시킵니다.
알림: 양쪽 뒷발의 발 패드를 꼬집어 마우스가 적절하게 마취되었는지 확인합니다. 적절하게 마취되면 경련 동작(페달 철수 반사)이 없어야 합니다. 반사 움직임이 있는 경우 2.1.1단계로 돌아갑니다. - 경추 탈구로 생쥐를 안락사시킨 다음 참수한 다음 눈을 빠르게 적출합니다. 적출된 눈을 얼음 위에 얼음처럼 차가운 neurobasal-A 배지(포도당 제외) 5-10mL를 채운 페트리 접시에 넣습니다.
참고: 다음은 신경 망막 박리(망막 색소, 상피 및 맥락막 제외)에 대한 기본 지침입니다. 보다 심층적인 지침 및 지침은 이전에 발표된 프로토콜11 을 참조하고 "마우스 망막 박리" 섹션을 따르십시오. - 페트리 접시를 얼음 위의 해부 현미경 아래에 놓습니다.
- 보풀이 없는 물티슈를 작은 사각형에 접고 Neurobasal A 배지로 적십니다.
- 끝부분을 잘라낸 플라스틱 전사 피펫을 사용하여 보풀이 없는 젖은 물티슈로 눈을 옮깁니다.
알림: 보푸라기가 없는 물티슈는 해부 중에 눈이 움직이지 않도록 마찰을 증가시킵니다. - 26g의 바늘을 가지고 가장자리 앞쪽의 각막 측면에 구멍을 뚫습니다.
- Vannas 가위를 사용하여 천자 지점부터 가장자리를 따라 잘라 각막을 제거합니다.
- 각막이 제거되면 한 쌍의 집게로 윤막과 시신경두 사이의 중간에 있는 공막을 잡습니다. 반대쪽 손에 있는 다른 집게를 사용하여 렌즈를 잡고 한 번의 빠른 동작으로 빠르게 제거합니다.
참고: 렌즈를 천천히 제거하면 망막이 렌즈에 부착된 상태로 유지되어 절개가 어려워집니다. - 얼음에 차가운 Neurobasal A를 넣은 페트리 접시에 아이컵을 옮깁니다.
- 양손에 집게를 사용하여 아이컵을 잡고 컵을 오라 세라타에 조심스럽게 잡습니다.
- 공막에서 망막 컵을 분리하려면 망막 조직을 조이지 않도록 주의하면서 집게를 사용하여 공막을 조입니다.
- 망막 전체가 변연에서 분리될 때까지 공막 조직과 망막 조직 사이에 집게를 조심스럽게 밀어 넣습니다.
- Vannas 가위를 사용하여 가장자리의 공막을 작게 절개합니다.
- 집게를 잡고 절개 부위의 가장자리를 잡고 공막 조직을 시신경 머리 부위까지 벗겨냅니다. 주로 사용하지 않는 손의 집게를 사용하여 공막을 잡고 주로 사용하는 손의 닫힌 집게를 사용하여 망막을 공막에서 부드럽게 안내합니다.
- 시신경두를 가위로 잘라 공막과 남아 있는 시신경에서 망막을 완전히 분리합니다.
- 포도당 결핍을 위해 1.1.4단계에서 포도당 결핍을 위해 미리 준비된 1.5mL 마이크로 원심분리 튜브로 트리밍된 전사 피펫을 사용하여 망막을 이식하며, 여기에는 튜브당 200μL의 neurobasal-A 배지(포도당 없음)-1개의 망막이 포함되어 있습니다.
- 흡입 이소플루란 마취(5% 이산화탄소/95% 산소에 2% 이소플루란)를 사용하여 마우스를 진정시킵니다.
- 포도당 결핍 단계
- 2.1.14 단계의 튜브를 37 ° C 수조로 옮기고 37 ° C에서 20 분 동안 배양합니다.
- NBDG 배양
- 1.2.2단계의 neurobasal-A 배지에 200μL의 500μM 6-NBDG가 포함된 1.1.4단계의 6-NBDG 배양을 위해 각 망막을 사전 라벨링된 새 튜브로 이식합니다.
참고: 망막은 손상을 최소화하면서 망막을 전달할 수 있도록 팁을 확대하기 위해 절단된 전사 피펫을 사용하여 이식해야 합니다. 또한, 손상 없이 망막을 전달할 수 있는 능력에 확신이 있는 경우 핀셋으로 이를 수행할 수 있습니다. - 튜브를 37°C 수조로 옮기고 37°C에서 60분 동안 배양합니다.
- 1.2.2단계의 neurobasal-A 배지에 200μL의 500μM 6-NBDG가 포함된 1.1.4단계의 6-NBDG 배양을 위해 각 망막을 사전 라벨링된 새 튜브로 이식합니다.
- 6-NBDG 표준물질 준비(농도 범위 0 μM-40 μM)
참고: 60분 6-NBDG 배양 기간(2.3.2단계) 동안 표준물질을 준비합니다. 표준은 실온에서 준비할 수 있습니다. 빛으로부터 솔루션을 보호하십시오.- 8가지 표준물질에 대해 1.5mL 마이크로 원심분리기 튜브 #1-8을 표시합니다( 그림 3 참조).
- 표준 #1(40μM 6-NBDG)의 경우 1.2.1단계에서 만든 500μM 6-NBDG 원액 32μL를 피펫으로 만듭니다.
- 368 μL의 neurobasal-A 배지를 마이크로 원심분리 튜브에 추가하고 위아래로 피펫팅하여 철저히 혼합합니다.
- 표준 #2-8의 경우 다음과 같이 샘플을 연속으로 희석합니다.
- 200μL의 neurobasal-A 배지를 튜브 #2-8에 피펫팅합니다.
- 표준 튜브 #1에서 200 μL를 취하여 튜브 #2에 피펫팅한 다음 위아래로 피펫팅하여 피펫과 완전히 혼합합니다.
- 표준 튜브 #2에서 200 μL를 취하고 표준 튜브 #3에 피펫을 넣습니다. 위아래로 피펫팅하여 피펫과 완전히 혼합합니다.
- 표준 튜브 #3에서 200 μL를 취하여 튜브 #4에 피펫팅한 다음 위아래로 피펫팅하여 철저히 혼합합니다.
- 표준 튜브 #4에서 200 μL를 취하여 튜브 #5에 피펫으로 주입한 다음 위아래로 피펫팅하여 완전히 혼합합니다.
- 표준 튜브 #5에서 200 μL를 취하여 튜브 #6에 피펫팅한 다음 위아래로 피펫팅하여 철저히 혼합합니다.
- 표준 튜브 #6에서 200 μL를 취하여 튜브 #7에 피펫팅한 다음 위아래로 피펫팅하여 철저히 혼합합니다.
- 튜브 #8에 추가 용액을 추가하지 마십시오(즉, 2.4.4.1단계에서 추가된 200μL의 neurobasal-A 배지만 포함해야 함).
- 시료 채취를 위한 세척, 초음파 처리 및 원심분리
- 37분 60-NBDG 배양이 완료되면 6°C 수조에서 모든 튜브를 제거합니다.
- 각 망막을 500μL의 얼음처럼 차가운 neurobasal-A 배지로 가능한 한 빠르고 조심스럽게 세척합니다.
- 세척하려면 피펫으로 6-NBDG 용액을 제거하고 망막 조직을 만지거나 방해하지 않도록 하십시오.
참고: 핀셋으로 망막을 6-NBDG 배양 튜브에서 500uL의 neurobasal-A 배지가 있는 새 튜브로 옮기는 옵션도 있습니다. 그런 다음 3번만 추가로 세탁하면 됩니다. 핀셋으로 망막을 손상시키지 않는 능력에 익숙하다면 이 작업을 수행하십시오. - 그런 다음 용액을 적절한 폐기물 용기에 버리십시오. 즉시 500μL의 차가운 neurobasal- 배지를 동일한 튜브에 피펫팅하여 제거된 용액을 교체합니다. 세탁 사이에 얼음에 튜브를 교체하십시오.
- 세척하려면 피펫으로 6-NBDG 용액을 제거하고 망막 조직을 만지거나 방해하지 않도록 하십시오.
- 3회 더 반복하여 총 4회 세탁합니다.
- 가장자리가 잘린 전사 피펫 또는 핀셋을 사용하여 얼음 위의 neurobasal A 매체가 들어있는 초음파 처리 튜브로 망막을 조심스럽게 옮깁니다 (1.1.4 단계 참조).
- 작은 해부 가위를 사용하여 망막을 작은 조각으로 자릅니다.
알림: 다른 샘플이 교차 오염되지 않도록 각 망막을 자르는 사이에 도구를 에탄올로 세척하십시오. - 각 망막을 진폭 10으로 5-10초 동안 초음파 처리한 후 즉시 얼음 위에 다시 놓습니다.
참고 : 100 % 에탄올로 샘플 사이의 초음파 처리 프로브를 청소하고 초순수 H2O를 청소하십시오. 이 시점에서 원심분리기를 4°C로 예냉각하거나 가능한 경우 4°C의 대형 냉장실에서 원심분리기를 사용하십시오. - 4°C에서 15분 동안 21130 x g or 최대 속도(21130 x g 미만인 경우)를 원심분리기합니다.
참고: 2.5.7단계에서 15분 동안 원심분리하는 동안 2.4단계에서 만든 표준물질 #1-8의 100μL를 검은색의 투명한 바닥 96웰 플레이트에 피펫팅합니다.
- 플레이트 리더에서 샘플 읽기
- 15분 원심분리기가 끝난 후 100μL의 상층액과 피펫을 96웰 플레이트에 넣습니다.
- 플레이트 리더에 플레이트를 삽입합니다.
참고: 플레이트에는 각 샘플이 100μL이고 각 표준물질이 100μL여야 합니다. - 플레이트 리더 소프트웨어에서 1.1.7단계에서 선택한 파라미터로 형광 종말점 분석을 선택합니다.
- 분석을 실행하고 결과를 저장합니다.
- Pierce 분석을 위해 96웰 플레이트의 피펫 샘플을 1.1.4의 사전 라벨링된 튜브로 이동합니다.
주: 이 시점에서, 표본은 단백질을 위해 즉각 분석될지도 모릅니다 (아래에 보십시오) 또는 -80 °C에 저장될지도 모릅니다.
- 단백질 정규화를 위한 Pierce 분석
참고: Pierce 분석은 정확성 향상을 위해 중복(표준물질 및 샘플 모두)으로 실행해야 합니다.- Pierce assay pre-diluted protein assay 표준물질을 사용하여 각각 10μL씩 96웰 투명 바닥 플레이트에 중복하여 피펫팅합니다.
- 단계 2.6.5에서 복제된 각 샘플의 10μL를 96웰 플레이트에 피펫팅합니다.
- 150μL의 Pierce 시약을 표준물질 또는 샘플이 포함된 모든 웰에 추가합니다. 96웰 플레이트를 덮고 플레이트 셰이커에 중간 속도로 1분 동안 섞습니다.
- 플레이트를 실온(RT)에서 5분 동안 배양합니다.
- 플레이트 리더에 플레이트를 삽입합니다. 흡광도 종말점 분석을 선택하고 파장을 660nm로 설정합니다.
- 표준물질 및 샘플의 흡광도를 측정하고 결과를 저장합니다. 표준 곡선을 플로팅하여 각 샘플의 총 마이크로그램 단백질을 계산합니다.
- 망막 6-NBDG 흡수 계산.
참고: 6-NBDG 결과는 망막의 크기가 고르지 않기 때문에 총 단백질 함량으로 정규화되어야 합니다.- 2.6단계에서 얻은 형광 강도 값을 사용하여 사전 결정된 표준물질의 형광 판독값을 사용하여 6-NBDG 형광 표준 곡선을 플롯하고 각 샘플에서 6-NBDG 농도(μM)를 정량화합니다.
- 샘플 결과를 해당 단백질 양으로 정규화하여 [6-NBDG] μM/μg 단백질을 측정합니다.
결과
그림 4는 서로 다른 기간 동안 6-NBDG로 배양된 WT 마우스 망막의 대표적인 포도당 형광 측정을 보여줍니다. 30분 배양 후 6-NBDG 수준은 평균 336 ± 27.91 AU인 반면, 60분 후 6-NBDG 수준은 평균 616.3 ± 8.38 AU로 증가했습니다. 30분의 추가 배양으로 6-NBDG(506.4 ± 5.3 AU) 수준이 감소했습니다. 60분에서 결과의 변동성은 최소였으므로 6-NBDG로 망막을 배양하기 위한 최적의 시간으로 선택되었습니다. 단위는 임의적이며 이러한 결과는 총 단백질로 정규화되지 않았습니다.
그림 5는 6-NBDG 및 GLUT1 억제제 BAY-876(100μM 최종 농도)과 함께 배양된 WT 마우스 망막의 포도당 형광 측정을 보여줍니다. 6-NBDG 흡수가 24% 감소하는 것이 관찰되었는데, 이는 신경쥐 망막에서 6-NBDG 흡수의 GLUT1-독립적 메커니즘이 있음을 시사합니다.
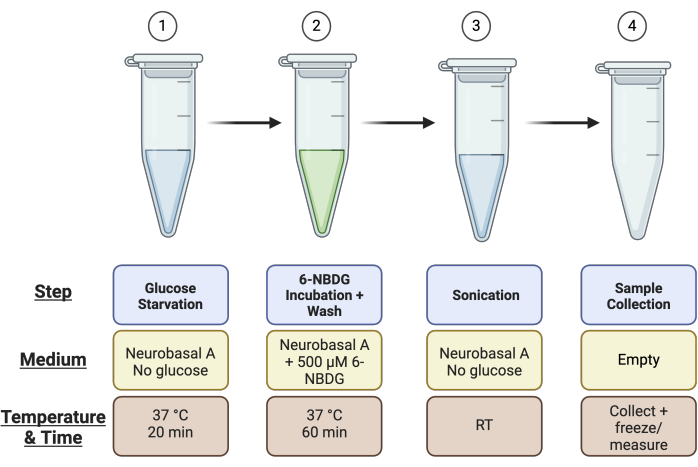
그림 1: 분석을 위한 튜브 설정의 개략도. 분석을 실행하기 전에 설명된 대로 망막 샘플당 4개의 튜브를 설정합니다: "포도당 결핍" 단계를 위한 튜브 1, "6-NBDG 배양" 단계를 위한 튜브 2, "초음파 처리"를 위한 튜브 3, "샘플 수집"을 위한 튜브 4. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 프로토콜의 개략적 개요. 신경 망막 박리 후 망막 샘플을 즉시 Neurobasal A 배지(포도당 없음)의 얼음 위에 놓습니다. 그런 다음 망막 샘플을 37°C 수조로 20분 동안 옮겨 "포도당 결핍" 단계를 수행합니다. 그런 다음 샘플은 "6-NBDG 배양" 단계를 위해 튜브로 옮겨져 37°C 수조에서 60분 동안 유지됩니다. 배양 후 망막 샘플을 세척합니다. 500 uL의 얼음처럼 차가운 Neurobasal A 배지(포도당 없음)를 함유한 신선한 튜브로 옮긴 다음 3회 세척하거나 6-NBDG 배양 단계와 동일한 튜브에 남아 있는 경우 500uLof 얼음처럼 차가운 Neurobasal A 배지(포도당 없음)로 4회 세척합니다. 마지막으로, 상층액을 "Sample Collection" 튜브로 옮기기 전에 21130 x g 에서 샘플을 절단, 초음파 처리 및 원심분리합니다. 그런 다음 483nm에서 여기, 550nm에서 방출, 530nm에서 차단된 형광 종말점 분석 기능을 사용하여 플레이트 리더에서 샘플을 판독합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 직렬 희석에 의한 6-NBDG 표준물질 생성. 설명된 대로 1-8로 표시된 튜브에서 1-8단계를 통해 Neurobasal A 배지를 사용하여 500μM 원액을 직렬로 희석하여 6-NBDG의 표준 농도를 생성합니다. 튜브 8에는 Neurobasal A 배지만 포함되어 있습니다(6-NBDG 없음). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 6-NBDG 배양 시간 최적화를 위한 대표적인 포도당 형광 측정. 30분, 60분, 90분에 6-NBDG로 배양 후 대표적인 형광 판독. 6-NBDG가 없는 대조군 샘플을 90분(90C) 동안 배양했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: GLUT1 억제제(WTi, 100μM BAY-876)가 있는 상태에서 6-NBDG 흡수. 억제제(WT) 없이 100μM BAY-876(WTi)이 있는 상태에서 배양한 야생형(WT) 망막을 사용한 6-NBDG 흡수 결과. 결과는 총 단백질 수준으로 정규화 된 다음 억제제가없는 WT 샘플에 대해 정규화되었습니다. 막대에 표시된 동물 번호(WT = 9마리의 망막, WTi = 3마리의 망막). 통계 검정 = Mann Whitney 비모수 검정, p = 0.0074. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
요약하면, 설명된 방법을 통해 기초 과학 연구자들은 생체 외 쥐 신경 망막에서 형광 포도당 유사체인 6-NBDG의 흡수를 측정할 수 있습니다. 포도당은 신경 망막의 필수 대사 산물이며, 포도당의 흡수는 아데노신 삼인산(ATP) 형태의 에너지를 생산하는 데 필요한 높은 해당과정 및 미토콘드리아 호흡 속도를 지원합니다1. 포도당이 선호되는 에너지 기질이기 때문에 많은 망막 세포는 혈관 구조와 주변 조직에서 포도당의 흡수를 촉진하기 위해 포도당 수송체(glucose transporter, GLUTs)를 발현합니다2. 이 프로토콜을 통해 연구원들은 망막 질환의 마우스 모델에서 포도당 흡수를 빠르고 저렴하게 평가할 수 있습니다. 또한, 이 방법은 쥐의 망막 또는 기타 관심 조직에 사용하기 위해 쉽게 번역될 수도 있습니다.
프로토콜의 성공을 보장하는 몇 가지 중요한 측면이 있습니다. 분석은 시간에 민감하므로 모든 시약과 튜브를 실험 전에 준비하는 것이 중요합니다. 이렇게 하면 나머지 분석이 원활하게 실행됩니다. 6-NBDG로 90분 동안 배양한 후 형광 측정이 감소하며(그림 4), 이는 망막 건강의 저하를 나타낼 수 있다는 점을 고려하는 것이 중요합니다. 따라서 잠복기를 준수하기 위해 세심한 주의를 기울여야 합니다. 또한, 신선한 망막의 절제는 절차의 첫 번째 속도 제한 단계입니다. 망막이 느리거나 제대로 절개되지 않으면 시간이 지남에 따라 포도당이 없는 매체에서 망막의 건강이 악화되어 잘못된 결과를 초래할 수 있습니다. 이 프로토콜은 쥐 신경 망막 박리(망막 색소, 상피 및 맥락막 제외)에 대한 기본 단계를 설명합니다. 그러나, 이 기술에 대한 경험이 없는 연구자의 경우, 이전에 발표된 보다 심층적인 프로토콜을 참조할 수 있습니다11. 망막 박리는 프로토콜에서 가장 중요한 단계이며, 연구자들은 해부를 위해 눈당 1분 이상을 소비하지 않는 것이 좋습니다. 해부 시간이 더 느리면 변동성을 제한하기 위해 더 적은 수의 샘플로 절차를 수행하는 것이 좋습니다.
일관성을 위해 그리고 샘플 간의 변동성을 제한하기 위해 형광 6-NBDG 판독값은 총 망막 단백질로 정규화되어야 합니다. 이는 예를 들어 나이가 들면서 발생할 수 있는 망막 크기의 변화를 고려합니다. 이 프로토콜의 일관성을 개선하기 위해 절개나 고의적인 손상이 없는 망막 전체를 사용했습니다. 그러나 표준 곡선(0-40μM)에 대해 테스트된 6-NBDG의 검출 범위와 전체 망막 형광 수치가 10-20μM 사이에서 일관되게 유지됨에 따라 더 적은 양의 망막 조직을 사용할 수 있습니다. 그러나 망막 절단의 영향으로 인해 얻은 결과와 어느 정도의 불일치가 발생할 수 있습니다.
이 프로토콜에는 몇 가지 제한 사항이 있습니다. 6-NBDG가 세포에 의해 흡수되는 메커니즘에 관한 추측은 6-NBDG의 흡수가 GLUT1 수송체 독립적 메커니즘10을 통해 발생할 수 있음을 시사합니다. GLUT1 억제제 BAY-876의 결과는 이러한 개념을 뒷받침합니다. BAY-876은 6-NBDG를 24% 감소시키는 데 그쳤습니다(그림 5). 그러나 BAY-876의 농도는 이 프로토콜에서 철저히 테스트되지 않았습니다. 그러나, 여기에 요약된 실험 설계는 예를 들어 GLUT1보다 훨씬 낮은 수준이지만 망막에 존재하는 GLUT3 및 GLUT2에 의한 잠재적인 6-NBDG 흡수를 탐색하기 위해 망막에서의 6-NBDG 특이성 및 흡수에 관한 추가 연구를 수행하는 데 활용될 수 있습니다5. 이 분석법의 또 다른 중요한 한계는 총 망막 6-NBDG 흡수를 정량화한다는 것이므로 이 프로토콜을 사용하여 세포 특이적 6-NBDG 흡수를 결정할 수 없다는 것입니다.
중요한 것은 설명된 프로토콜에 몇 가지 이점이 있다는 것입니다. 이 분석은 예를 들어 뇌 조직12에서 수행되는 것과 같은 조직 내 포도당 흡수의 객관적인 이미징에 의존하지 않습니다. 형광 아날로그 흡수를 감지하기 위한 실시간 이미징 방법은 까다롭고 비용이 많이 들 수 있으며, 이 프로토콜은 망막 6-NBDG 흡수에 대한 상대적으로 높은 처리량 분석을 위해 흡수 분석을 단순화합니다. 설명된 분석은 또한 형광 여기 및 방출 매개변수가 알려진 다른 형광 포도당 유사체(예: 2-NBDG)13로 확장될 수 있습니다. 결론적으로, 이 분석은 비용이 많이 들거나 시간이 많이 소요되는 이미징 방법의 사용을 피하는 망막 조직의 포도당 흡수에 대한 비교적 빠르고 저렴하며 일관된 측정을 제공합니다. 망막 조직의 포도당 흡수 변화를 이해하는 것은 신진대사의 변화가 주요 병태생리학적 사건인 시각 계통 질환에서 매우 중요하다14.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이 작업은 Lauren K. Wareham에게 수여된 무제한 부서 기금으로 자금을 지원받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| # 5 forceps | Katena | K5-6550 | Used for retina dissection |
| 1.5 mL microcentrifuge tubes | Thermo Fisher Scientific | 05-408-129 | |
| 26 G x 5/8" needle | sol-M | 112658 | Used to puncture cornea during dissection |
| 5 mL tubes | MTC bio | c2540 | |
| 50 mL tubes | Avantor by VWR | 89039-656 | |
| 6-NBDG | Invitrogen | N23106 | Fluorescent gucose analog |
| 96 well plates black with clear bottom | Thermo Fisher Scientific | 265301 | |
| Anesthetic Charcoal Filter Cannister | ReFresh | EZ-258 | Used in anesthesia set up |
| BAY-876 | Millipore Sigma | SML1774 | For inhibition of GLUT1. |
| Centrifuge at 4 °C | Eppendorf | EPP-5424 | |
| Compressed gas (5% carbon dioxide, 95% oxygen) | Airgas | UN3156 | Used in anesthesia set up |
| curved forceps | Roboz surgical instrument | RS-5137 | Used for retina dissection |
| DDH2O | Elga LabWater | Elga PureLab Ultra | Used after ethanol to clean sonicator in between samples |
| Dissecting microscope | Olympus | szX12 | Used for retina dissection |
| Ethanol 200 proof | Decon laboratories | 2701 | To be used to clean sonicator in between samples |
| Foam floating tube rack | Thermo Fisher Scientific | 36-099-2328 | For tubes during incubation in water bath steps |
| General scissors | Roboz surgical instrument | RS-680 | Used for retina dissection |
| Isoflurane 250 mL bottle | Piramal critical care | NDC 6679401725 | Anesthesia |
| Isoflurane equipment | Vetequip sold by VWR | 89012-492 | Used to anesthetize prior to euthanasia |
| Kim wipes | VWR | 82003-820 | |
| Microplate reader | Molecular devices | SpectraMax M2 microplate reader | Used to read sample |
| Neurobasal- A media | Gibco | 12349-015 | |
| Nose cone (low profile anesthesia mask) | Kent Scientific | SOMNO-0801 | Used to deliver ansethesia |
| Objective on dissecting microscope | Olympus | DF plapo 1x pf | Used for retina dissection |
| Petri dish | VWR | 25384-088 | Used during retina dissection |
| Pierce assay reagent | Thermo Fisher Scientific | 1861426 | |
| Pipette tips P20 | Olympus Plastics | 26-404 | |
| Pipette tips P200, P1000, P10 XL | VWR | 76322-150, 76322-154, 76322-132 | |
| Pipetteman pipettes P200, P1000, P20, P10 | VWR | F144055M, F144056M, F144058M, F144059M | |
| SoftMax Pro software on computer | Molecular devices | SoftMax Pro 7 software | Software used to read sample |
| Sonic dismembrator | Thermo Fisher Scientific | FB50110 | Sonicate sample (retina) |
| Transfer pipettes | Fisherbrand | 13-711-9AM | Used to transfer retina from one tube to another |
| Vannas spring scissors | Katena | K4-5000 | Used for retina dissection |
| Water bath set to 37 °C | N/A | N/A | Used for incubation |
참고문헌
- Casson, R. J., Chidlow, G., Crowston, J. G., Williams, P. A., Wood, J. P. M. Retinal energy metabolism in health and glaucoma. Prog Retin Eye Res. 81, 100881 (2021).
- Daniele, L. L., et al. Glucose uptake by GLUT1 in photoreceptors is essential for outer segment renewal and rod photoreceptor survival. FASEB J. 36 (8), e22428 (2022).
- Fernandes, R., Hosoya, K. -. I., Pereira, P. Reactive oxygen species downregulate glucose transport system in retinal endothelial cells. Am J Physiol Cell Physiol. 300 (4), C927-C936 (2011).
- Badr, G. A., Tang, J., Ismail-Beigi, F., Kern, T. S. Diabetes downregulates GLUT1 expression in the retina and its microvessels but not in the cerebral cortex or its microvessels. Diabetes. 49 (6), 1016-1021 (2000).
- Kumagai, A. K. Glucose transport in brain and retina: implications in the management and complications of diabetes. Diabetes Metab Res Rev. 15 (4), 261-273 (1999).
- Winkler, E. A., et al. GLUT1 reductions exacerbate Alzheimer's disease vasculo-neuronal dysfunction and degeneration. Nat Neurosci. 18 (4), 521-530 (2015).
- Mosconi, L., et al. Hypometabolism exceeds atrophy in presymptomatic early-onset familial Alzheimer's disease. J Nucl Med. 47 (11), 1778-1786 (2006).
- Moreno, M., et al. Morphological and morphometric changes in rat optic nerve microvessels in a glaucoma experimental model. Arch Soc Esp Oftalmol. 89 (12), 471-476 (2014).
- Barros, L. F., et al. Kinetic validation of 6-NBDG as a probe for the glucose transporter GLUT1 in astrocytes. J Neurochem. 109 (s1), 94-100 (2009).
- Hamilton, K. E., Bouwer, M. F., Louters, L. L., Looyenga, B. D. Cellular binding and uptake of fluorescent glucose analogs 2-NBDG and 6-NBDG occurs independent of membrane glucose transporters. Biochimie. 190, 1-11 (2021).
- Feigenspan, A., Babai, N. Z. Preparation of horizontal slices of adult mouse retina for electrophysiological studies. J Vis Exp. 119, e55173 (2017).
- Lundgaard, I., et al. Direct neuronal glucose uptake heralds activity-dependent increases in cerebral metabolism. Nat Commun. 6 (1), 6807 (2015).
- Zou, C., Wang, Y., Shen, Z. 2-NBDG as a fluorescent indicator for direct glucose uptake measurement. J Biochem Biophys Methods. 64 (3), 207-215 (2005).
- Wareham, L. K., et al. Solving neurodegeneration: common mechanisms and strategies for new treatments. Mol Neurodegener. 17 (1), 23 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유