Case Report
Лапароскопическая гепатэктомия S7 с положительным флуоресцентным окрашиванием
В этой статье
Резюме
Протокол демонстрирует, что под лапароскопическим ультразвуковым контролем сегмент печени S7 может быть успешно окрашен путем прокола висцеральной и диафрагмальной ветвей опухоли, что способствует анатомической гепатэктомии сегмента S7.
Аннотация
Лапароскопическая резекция печени при опухолях, расположенных в сегменте печени S7, обычно использует традиционный хирургический подход. Основной целью данной процедуры является точное рассечение ножки печени сегмента S7. Рассечение печеночной ножки сегмента S7 вдоль ворот печени требует относительно длинного пути внутри печени, что увеличивает риск потери ориентации и потенциального повреждения прилегающей печеночной ножки сегментов S5 и S6, тем самым нарушая плоскость резекции печени. Метод положительного окрашивания использовали для прямой пункции соответствующей воротной вены под ультразвуковым контролем (обычно для сегментов S7 и S8) для специфического окрашивания целевого сегмента печени, тем самым избегая обширной резекции паренхимы печени и уменьшая повреждение окружающей здоровой ткани печени. Тем не менее, метод положительного окрашивания требует определенной основы в интраоперационных процедурах, что может быть сложным для хирургов и требует определенной кривой обучения. В настоящее время такие технологии, как трехмерный анализ территории реконструкции, интраоперационное ультразвуковое исследование и индоцианиновая зеленая флуоресцентная визуализация, популярны и широко используются при лапароскопической резекции печени. В этом протоколе под лапароскопическим ультразвуковым контролем опухолевый бассейн прокалывался через висцеральную и диафрагмальную поверхности печени для окрашивания сегмента S7. Успешно выполнена лапароскопическая резекция сегмента S7 в пределах анатомической области портальной печени, что еще раз подтверждает целесообразность и преимущества положительного флуоресцентного окрашивания при лапароскопической резекции печени на данном этапе.
Введение
Первичный рак печени в настоящее время является четвертой по распространенности злокачественной опухолью и второй по значимости причиной смертности, связанной с раком, в Китае, представляя серьезную угрозу для жизни и здоровья людей во всеммире1. При гепатоцеллюлярной карциноме (ГЦК) хирургическая резекция долгое время была основным вариантом лечения. С развитием минимально инвазивных технологий растет число сообщений о лапароскопической анатомической резекции печени для лечения ГЦК. Для лапароскопической гепатэктомии, локализуемой в различных сегментах печени, в том числе в специализированных сегментах (I, IVb, VII и VIII), соответствующие исследования показали, что этот метод безопасен и эффективен2.
Концепция анатомической резекции печени была впервые предложена Makuuchi et al. в 1985 году 3,4. Правильной процедурой является сегментация в соответствии с окрашиванием территории воротной вены и выполнение полной резекции окрашивания территории воротной вены, к которой относится опухоль5. Поскольку ГЦК в основном распространяется по воротной вене, теоретически такой подход может обеспечить лучшую онкологическую эффективность и достичь истинной анатомической резекции печени при опухолях различной локализации6. Однако в прошлом, из-за ограничений в технологиях и оборудовании, такое лечение было редким. В большинстве центров выполняли анатомическую резекцию печени на основе метода сегментации печени по Куино. Когда опухоль охватывает несколько сегментов печени, выполнение анатомической резекции печени может привести к чрезмерному удалению здоровой ткани печени, тем самым увеличивая риск хирургического вмешательства и послеоперационные осложнения. Кроме того, потенциальные микрометастатические поражения могут сохраняться из-за неполной резекции области воротной вены опухоли 7,8.
Благодаря достижениям в области технологий и оборудования, мы можем определить территорию опухолевой воротной вены на основе предоперационной трехмерной реконструкции. Это помогает клиницистам определить диапазон резекции, выполнить пункцию под ультразвуковым контролем и окрашивание области воротной вены, к которой относится опухоль, во время операции, а также определить плоскость участка печени с помощью индоцианиновой зеленой флуоресцентной визуализации для достижения более точной анатомической резекции печени9. Однако при лапароскопической анатомической резекции печени сегмента печени S7 операция является более сложной, поскольку ножка печени глубоко скрыта в паренхиме печени и локализована проксимально к дорсальной и головной сторонам, что приводит к увеличению времени операции и большей травматизации. Метод положительного окрашивания включает прямую пункцию соответствующей воротной вены под ультразвуковым контролем (обычно используется в сегментах печени S7 и S8) таким образом, чтобы целевой сегмент печени был непосредственно окрашен. Это помогает хирургу избежать разрезания чрезмерного количества паренхимы печени, тем самым максимизируя защиту функционального объема печени11. Тем не менее, метод положительного окрашивания требует специфической интраоперационной ультразвуковой основы, правильной идентификации внутрипеченочных протоков и соответствующего использования методов интраоперационной пункции воротной вены. Это также предъявляет высокие требования к хирургу и связано с необходимой кривой обучения.
У описанного здесь пациента опухоль располагалась в сегменте S7 печени. В ходе предоперационной трехмерной реконструкции были выявлены две ветви воротной вены. Поскольку ствол S7 короткий и расположен близко к корню сегмента S6 воротной вены, он был проколот вдоль диафрагмальной и висцеральной поверхностей печени. Для окрашивания целевого сегмента печени вводили индоцианин зеленый, а резецировали печень в соответствии с флуоресцентным сигналом, который направлял процедуру и обеспечивал бесперебойную работу.
Целью продемонстрированного здесь метода резекции сегмента печени S7 является дальнейшее продвижение концепции анатомической резекции печени под контролем окрашивания портальной территории и освещение преимуществ резекции с положительным окрашиванием сегмента S7. Эта процедура сводит к минимуму объем здоровой ткани печени, удаляемой во время резекции опухоли, при этом максимизируя эффективность удаления опухоли.
ПРЕЗЕНТАЦИЯ КЛИНИЧЕСКОГО СЛУЧАЯ:
30-летний мужчина был госпитализирован в больницу Фошань Фосун Чанчэн 2023-02-02. За 1 месяц до этого в другой больнице у пациента было обнаружено занимающее пространство поражение печени без дискомфорта. В остальном у него было хорошее здоровье.
Диагностика, оценка и планирование:
Диагноз: Гепатоцеллюлярная карцинома.
Оценка: АЛТ (аланинаминотрансфераза): 123 ЕД/л, АСТ (аспартатаминотрансфераза): 34 ЕД/л, гемоглобин: 141 г/л, количество тромбоцитов: 125 x 109 клеток/л, альбумин: 40,5 г/л, общий билирубин: 10,1 мкмоль/л, креатинин: 67 мкмоль/л, протромбиновое время (ПВ): 14,1 с, поверхностный антиген гепатита В, ДНК ВГВ (ДНК вируса гепатита В): 3,51 x 106 МЕ/л, аномальный протромбин (ПИВКА-II): 21 мЕД/мл, АФП (альфа-фетопротеин): 56,29 мкг/л, CA199 (углеводный антиген199): <0,8 ЕД/мл, РЭА (раково-эмбриональный антиген): 4,65 ЕД/мл, холинэстераза: 7128 ЕД/л, класс А по классификации Чайлд-Пью. Усиленная КТ (компьютерная томография) и усиленная (гадоксетат динатрия) МРТ (магнитно-резонансная томография) верхней части брюшной полости: 1 см масса в сегменте печени S7, трехмерная реконструкция анализа территории (см. рис. 1). Оставшийся объем печени составил 78,8%.

Рисунок 1: Трехмерный анализ реконструкции. Расположение опухоли, трехмерная реконструкция связанных с опухолью ворот и печеночных вен, а также важных кровеносных сосудов рядом с опухолью. Сокращения: v7 = сегменты из 7 ветвей печеночной вены; PPC = задняя воротная вена C; PPD = задняя воротная вена D; IHV = межтерритория печеночная вена; RHV = правая печеночная вена. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
План: планировалась лапароскопическая гепатэктомия S7 с флуоресцентно-положительным окрашиванием. Шаг 1: Для анализа территории были использованы компьютерная томография и трехмерная реконструкция. Опухоль располагалась на территории задней воротной вены C (PPc) и задней воротной вены D (PPd) сегмента S7 печени (в соответствии с классификацией правой задней воротной вены японских ученых4; см. рис. 2). Шаг 2: Интраоперационное УЗИ показало, что воротная вена, к которой принадлежала опухоль, имела две сосудистые ветви. Шаг 3: Целевые ножки печени PPc и PPd были разорваны, а вены между областями печени S6 и S7 и правой печеночной веной были полностью обнажены под контролем флуоресценции. Шаг 4: Резекция опухоли под контролем флуоресцентного окрашивания.

Рисунок 2. Предоперационная компьютерная томография. (А) КТ-сечение опухолевой воротной вены PPd (красная стрелка). (B) КТ-секция опухолево-ассоциированной воротной вены PPc. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
Этот протокол соответствовал рекомендациям Комитета по этике исследований человека больницы Фошань Фосун Чанчэн. Для участия в данном исследовании от пациента было получено письменное информированное согласие.
1. Предоперационная подготовка
- Подготовка пациента: Пациента уложили в положение лежа на спине, голову приподняли, а ноги опустили и наклонили влево примерно на 30°. Была проведена общая анестезия, включая интубацию трахеи. Проводилась дезинфекция брюшной полости и драпировка операционной области.
- Схема троакара: Троакар (смотровое отверстие) вставлялся после разрезания кожи горизонтально на 1 см справа от пупка хирургическим ножом. Затем троакар длиной 1,0 см вводили на пересечении среднеключичной линии, на 5 см ниже правого реберного края, троакар длиной 0,5 см — ниже правого реберного края и подмышечной впадины, троакар длиной 1,2 см — ниже мечевидного отростка, а троакар длиной 0,5 см — на 3 см левее середины линии, соединяющей пупок и мечевидный отросток. Хирург стоит справа, а ассистент слева от пациента. Камера была помещена в смотровое отверстие.
- Исследование брюшной полости: Интраоперационные ультразвуковые исследования были проведены вдоль воротных и печеночных вен для определения взаимосвязи между опухолью и протоком, подтвержденной трехмерной реконструкцией. Лапароскопическое исследование печени и брюшной полости не выявило других поражений и метастазов. Ультразвуковая локализация переднего портала (АД) и ПП показала, что ПП относится к типу В.
ПРИМЕЧАНИЕ: Интраоперационное ультразвуковое исследование оценивает размер, расположение, внутрипеченочные метастазы и их взаимосвязь с окружающими кровеносными сосудами.
2. Хирургическое вмешательство
- Разделение околопеченочной связки: с помощью ультразвукового ножа были отрезаны круглые и серповидные связки печени. Второй печеночный портал был рассечен, обнажив корень правой печеночной вены. Была разрезана правая коронарная связка и правая треугольная связка. Шов был использован для перевязки трех коротких печеночных вен дорсально с правой стороны нижней полой вены, чтобы полностью освободить правую печень.
- Окклюзионная лента: Ультразвуковой нож был использован для удаления спаек вокруг желчного пузыря, чтобы обнажить отверстие Вентури. Желудочные щипцы для желудка были использованы вдоль отверстия Вентури, а окклюзионный бандаж был помещен в первый печеночный портал.
- Пункция и резекция
- PPc был виден через правый основной рабочий порт на диафрагмальной поверхности, а PPd был виден на висцеральной поверхности. PPc и PPd пункционировали под интраоперационным ультразвуковым контролем с зондом и пункционным отверстием.
- Пункция поверхности диафрагмы (Рисунок 3 и Рисунок 4): Датчик был введен в основное операционное отверстие под правым реберным краем. PPC был виден на поверхности диафрагмы, и был открыт длинный диаметр PPC. Была выбрана точка прокола от корня ППК. Чрескожная чреспеченочная холангиальная игла (PTC) 21G использовалась для укола желчного протока. Использовался метод «одно лицо, три точки и четыре горизонтальных пальца».
- С одной стороны, средняя точка левого и правого корректирующих стержней использовалась для интраоперационного ультразвука в качестве точки прицеливания, а стержень зонда использовался в качестве вертикальной плоскости для внутриплоскостной пункции. Были выбраны три точки: точка прокола кожи, отверстие для прокола интраоперационного зонда и точка прокола на ножке печени. Длина четырех горизонтальных пальцев использовалась для измерения точки прокола кожи примерно на пересечении вертикальной плоскости стержня зонда и кожи перед троакаром.
- Игла PTC держалась так, чтобы скос был обращен к вентральной дистальной стороне. Сердцевину иглы удаляли, и медленно вводили 3 мл 0,025 мг/мл индоцианина зеленого. Поверхность диафрагмы визуализировалась с помощью флуоресцентной визуализации.
- Прокол висцеральной поверхности (Рисунок 5 и Рисунок 6): Место прокола было выбрано в соответствии с мечевидным отростком для введения зонда. PPd выбирали в качестве точки прокола, и медленно вводили 3 мл 0,025 мг/мл зеленого разведения индоцианина.
- В это время висцеральная поверхность сегмента печени S7 была флуоресцентно визуализирована и использована для определения края резекции. Эластичный тракционный канат был использован для вытягивания сегмента печени S7 от нижнего края сегмента печени S6 к левой нижней части живота.
- Ткань печени разрезали от каудальной до головной стороны и вдоль границы между флуоресцентным и нефлуоресцентным сегментами, вдоль межтерритории печеночной вены (ВЖК) между сегментами печени S6 и S7 и правой печеночной вены (рис. 7).
- По правому краю правой печеночной вены рефлюксная вена печени S7 была перевязана с помощью лигирующих зажимов и отсоединена от двух ножек печени отдела печени S7. Ультразвуковой скальпель и биполярная электрокоагуляция были использованы для разрезания ткани печени с использованием границ флуоресцентной визуализации в условиях низкого центрального венозного давления под действием анестезии.
- Гемостаз остаточной печени: остаточная печень была тщательно проверена, и точки кровотечения были закрыты одна за другой с помощью биполярной электрокоагуляции. Для наложения швов на разрез был использован антибактериальный шов с покрытием Vicryl.
- При послеоперационных болях, вводили внутривенные анальгетики. Во время послеоперационного наблюдения измеряли изменения функции печени и уровня билирубина.

Рисунок 3: Прокол поверхности диафрагмы. (A) Интраоперационный ультразвук вводится вдоль основного операционного отверстия. (B) Лапароскопическая игла для пункции PTC используется для пункции вдоль интраоперационного отверстия для ультразвуковой фиксации. (C) Пункционная игла PTC (белая стрелка) пункция изображения воротной вены PPc под ультразвуковым контролем. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Иллюстрация 4: Положительное окрашивание при проколе диафрагмы. PPc портальную вену положительно окрашиваем картинкой и отмечаем окрашенные края ультразвуковым ножом. Зеленой областью обозначена территория портала, к которой принадлежит PPc. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
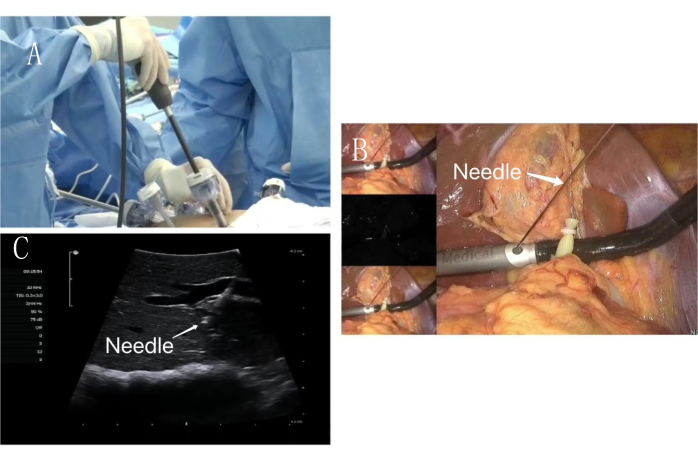
Рисунок 5: Прокол висцеральной поверхности. (A) Интраоперационный ультразвук вводится вдоль отверстия ассистента операции. (B) Лапароскопическая игла для пункции PTC используется для пункции вдоль интраоперационного отверстия для ультразвуковой фиксации. (C) Пункционная игла PTC (белая стрелка) прокол изображения воротной вены PPd под ультразвуковым контролем. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
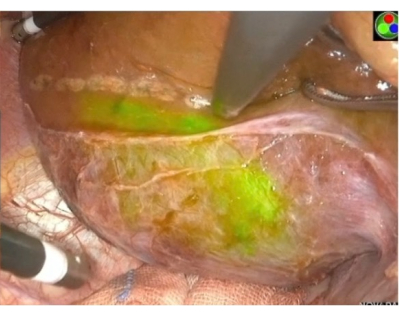
Рисунок 6: Положительное окрашивание от прокола висцеральной поверхности. PPd портальную вену положительно окрашиваем картину и отмечаем окрашенные края ультразвуковым ножом. Зеленой областью обозначена территория портала, к которой принадлежит PPd. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 7: IHV и правая печеночная вена. На фиолетовой области видна правая печеночная вена; на зеленой области показаны сегменты 7 ветвей печеночной вены; желтая область – это поперечное сечение PPC и PPD; Красная область — это правая задняя печеночная ножка. Сокращения: v7-1= Первая из ветвей сегмента S7 печеночной вены; v7-2= Вторая из ветвей сегмента S7 печеночной вены; RHV = правая печеночная вена; PPc: С ветвь воротной вены в правой задней доле печени; PPd: D ветвь воротной вены в правой задней доле печени. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Результаты
В данном случае была успешно выполнена лапароскопическая анатомическая резекция печени сегмента S7 под контролем окрашивания портальной территории с положительным окрашиванием вдоль диафрагмальной и висцеральной поверхностей (рис. 6 и рис. 7). Выполнена резекция одной опухоли размером 1 см. Время операции составило 210 мин, а интраоперационная кровопотеря – 100 мл. Продолжительность послеоперационной госпитализации составила 7 дней, пациентка все еще находится под непрерывным наблюдением. Последующее наблюдение проводится каждые 2 месяца в течение 2 лет, включая функциональные пробы печени, исследование на онкомаркеры и исследования на основе визуализации (УЗИ, КТ или МРТ). Послеоперационная МРТ показана на рисунке 8.
Исследование образца: По результатам послеоперационного патологоанатомического обследования выявлена ГЦК III степени (умеренно слабодифференцированная) с отрицательным хирургическим краем. Иммуногистохимия: АФП (+), CK19 (+), глипикан-3 (+), гепатоцит (+), CD10 (-), CD34 (+, капиллярная трансформация), CK7 (-) и Ki-67 (+, примерно 30% в области горячей точки).

Рисунок 8: Послеоперационная МРТ. МРТ пациента после операции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
В настоящее время хирургия печени вступает в эру малоинвазивной хирургии. Были сообщения об анатомической резекции различных сегментов печени у пациентов с ГЦК, и безопасность этой операции была проверена2. Его эффективность в онкологии привлекает все большее внимание, и подход к анатомической гепатэктомии, предложенный Shindoh et al., предполагает полную резекцию на основеокрашивания территории, связанной с опухолью. Ограниченная предыдущими методами и оборудованием, только сегментация печени по Куино может быть использована для достижения концепции, аналогичной анатомической резекции.
Хорошо известно, что ГЦК в первую очередь метастазирует вдоль воротной вены, при этом у большинства пациентов развиваются тромбы опухоли воротной вены. 32-е ежегодное собрание Японского общества гепатобилиарной хирургии и хирургии поджелудочной железы и Экспертное консенсусное совещание по точной анатомии для минимально инвазивной гепатобилиарной хирургии и хирургии поджелудочной железы уточнили и унфицировали определение анатомической гепатэктомии, то есть полного удаления паренхимы печени PT8. Анатомическая сегментэктомия печени четко определяется как полное удаление окрашивающей территории сегментов печени, в которой доминирует ножка печени третьего уровня. С помощью трехмерного анализа реконструктивного окрашивания территории и индоцианиновой зеленой флуоресцентной визуализации была достигнута анатомическая гепатэктомия на основе окрашивания территории воротной вены, несущей опухоль9. Люди начали обнаруживать, что объем резекции анатомической резекции печени в бассейне воротной вены значительно отличается от объема классической анатомической резекции печени. Это отклонение может привести к остаточным микрометастазам в бассейне воротной вены и местному рецидиву. Когда опухоль охватывает несколько сегментов печени, объем резекции классической анатомической гепатэктомии значительно больше, чем при анатомической гепатэктомии в бассейне воротной вены, что затрудняет достижение точной и минимально инвазивной резекции для удовлетворения клинических потребностей.
Лапароскопическая анатомическая резекция печени под контролем окрашивания портальной территории использует предоперационную трехмерную реконструкцию для определения персонализированного бассейна воротной вены, несущей опухоль. Метод сочетался с индоцианиновой зеленой флуоресцентной системой визуализации во время операции для обеспечения точной резекции.
Ранее, для классической анатомической гепатэктомии, Ferrero et al. препарировали небольшое количество ткани печени с дорсальной стороны для точного контроля ножки печени сегмента S7, искали основной ствол правой печеночной вены с помощью доступа к головной печеночной вене и следили за основным стволом для разрезания печени и завершения анатомической резекции печени S72. Morise et al. выполнили лапароскопическую анатомическую резекцию печени S7 с использованием торакального доступа9, в то время как GoroHonda et al. резецировали сегмент печени S7 с использованием дорсального каудального доступа12. Chen et al. выступали за лапароскопическую ортотопическую гепатэктомию с использованием S713; однако для лапароскопической окрашивания портальной территории анатомической резекции сегмента печени S7 под контролем лапароскопии, если ножка-мишень печени получена с помощью классического хирургического подхода, необходимо расщепить большое количество паренхимы печени. Если окрашивание проводится на этой основе, то некоторые сегменты печени, которые относятся к водоразделу опухоли, могут не быть окрашены из-за уже разрезанной ткани печени. Это повлияет на эффективность окрашивания и удаления опухоли.
Ключевым этапом лапароскопической окрашивания портальной территории анатомической резекции S7-сегмента печени под контролем является точная пункция целевой ножки печени под интраоперационным ультразвуковым контролем. Только обезопасив территорию, связанную с опухолью, и окрашивая ветви, можно провести флуоресцентное окрашивание для проведения операции. Лапароскопический метод пункции воротной вены имеет крутую кривую обучения, требующую не только знания анатомии печени, но и прочной основы для интерпретации результатов ультразвукового исследования во время лапароскопии. Таким образом, этот метод представляет собой международно признанную техническую проблему.
Хотя новички могут быстро освоить эту технологию с помощью отверстий для пункции на некоторых ультразвуковых аппаратах, поскольку угол между туннелем для прокола и зондом зафиксирован на уровне 60°, это требует точного выбора точки прокола через брюшную стенку; В противном случае может произойти неудача прокола14. Чтобы решить эту проблему, мы предлагаем односторонний, трехточечный и четырехгоризонтальный метод пальцев: с одной стороны, средняя точка левого и правого регулировочных стержней использовалась в качестве точки прицеливания, а стержень зонда использовался в качестве вертикальной плоскости для плоского прокола. На трех точках — точка прокола кожи, отверстие для прокола интраоперационного зонда и точка прокола на ножке печени, а на четырех горизонтальных пальцах — кожа. Точка прокола располагалась примерно на пересечении четырех горизонтальных пальцев, от вертикальной плоскости стержня зонда и обшивки перед троакаром. Пункция воротной вены с диафрагмальной и висцеральной поверхностей печени проводилась с целью лапароскопической окрашивания портальной территории анатомического сегмента печени S7 и проверки целесообразности и безопасности операции.
На протяжении всей процедуры пункции мы выделяли несколько важных деталей, требующих внимания, в том числе тип иглы для пункции, положение хирурга, угол и направление кончика иглы, а также скорость, с которой ассистент вводит лекарство. Размер пункционной иглы в идеале должен находиться в диапазоне от 18G до 21G (0,8-1,2 мм), а скорость потока инъекции должна тщательно контролироваться. Позиция хирурга в целом следует контралатеральному принципу опухоли: если опухоль находится на правой стороне печени, хирург стоит на левой стороне, и наоборот. Кончик иглы вводили в печень под углом вверх и направляли к дистальному концу целевой ножки печени для предотвращения рефлюкса препарата и загрязнения других ветвей во время инъекции. Направление кончика иглы было следующим: одна точка, три точки и четыре горизонтальных пальца, при этом игла входила в печень вверх. После того, как кончик иглы попадал в печень, корректировки сводились к минимуму, чтобы избежать повреждения печени, и направление кончика иглы могло быть потеряно из-за смещения зонда во время процедуры. Затем зонд следует осторожно поворачивать, чтобы найти кончик иглы, а не регулировать направление иглы для выравнивания по плоскости ультразвука. Если направление кончика иглы не совпадает с направлением целевой ножки печени, кончик может быть извлечен и объединен с ультразвуковым исследованием, а игла может быть введена снова. Что касается скорости введения лекарства, крайне важно сохранять контроль над скоростью инъекции под прямой ультразвуковой визуализацией, чтобы гарантировать, что лекарство следует направлению кровотока в воротной вене.
Неудача лапароскопического пункционного окрашивания воротной вены в основном делится на два аспекта: слишком большое количество ветвей опухоли, которые не могут быть полностью окрашены, и неудачное окрашивание, вызванное лекарственным рефлюксом. Что касается этих двух ограничений, если обнаружено, что несколько ветвей воротной вены снабжают кровью опухоль во время операции, но предоперационная 3D-реконструкция не отражает этого, частичное окрашивание водосбором и флуоресцентные границы могут быть использованы для расщепления паренхимы печени, локализации и блокировки печеночной ножки, а затем отделения оставшейся паренхимы печени в соответствии с ишемической линией или обратным окрашиванием. Если вышеперечисленные детали не учтены и возникает лекарственный рефлюкс, флуоресцентный прибор можно настроить на черно-белый режим для улучшения контрастности.
Однако, по сравнению с существующими лапароскопическими анатомическими сегментами печени S7 и S815, метод аспирации воротной вены с положительным окрашиванием имеет следующие преимущества. Теоретически положительно окрашенный сегмент печени водораздела воротной вены является наиболее близким проявлением к реальному анатомическому водоразделу, что позволяет эффективно избежать остаточного нефункционального объема печени и снизить риск микрометастазирования опухоли и рецидива16. Точное позиционирование целевой ножки печени без рассечения печеночного портала и повреждения паренхимы печени может эффективно избежать послеоперационных осложнений, таких как утечка желчи. При условии успешного окрашивания полное разделение паренхимы печени по флуоресцентной границе эффективно предотвращает повреждение печеночной вены и снижает риск кровотечения.
Необходимо провести дальнейшие исследования рандомизированных контролируемых исследований лапароскопической анатомической резекции печени на портальной территории для лечения ГЦК, чтобы изучить превосходство этого подхода в онкологии. Кроме того, важность ультразвука в гепатобилиарной хирургии становится все более очевидной.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторам нечего раскрывать.
Материалы
| Name | Company | Catalog Number | Comments |
| Coated Vicryl Plus Antibacterial Suture | Ethicon, Inc. | 3650118 | The product is suitable for the placement and/or ligation of soft tissues |
| Color Doppler ultrasound diagnostic scanner | BK Medical | 20153251933 | intraoperative ultrasound |
| Disposable laparoscopic puncture device and puncture sheath | Jiangsu Fenghe Medical Equipment Co., Ltd | 20182021588 | Used for laparoscopic examination and surgical procedures, to puncture the abdominal wall tissue of the human body and establish a working channel for abdominal surgery |
| Four way curved electron convex array laparoscopic intraoperative probe | BK Medical | 20153251933 | Used for intraoperative examination and interventional treatment in various laparoscopic surgeries |
| HAKKO SONOGUIDE PTC NEEDLE | Baguang Trading (Shanghai) Co., Ltd | 20172146872 | Percutaneous liver bile duct puncture needle |
| Indocyanine Green for Injection | DANDONG YICHUANG PHARMACEUTICAL | ICP-09018669-1 | Assessment of liver reserve function and liver imaging |
| WECK Hem-o-lok | Teleflex Medical | 20143466018 | Ligation of blood vessels or tissues |
Ссылки
- Han, B. F., et al. Cancer incidence and mortality in China, 2022. J Natl Cancer Cent. 4 (1), 47-53 (2024).
- Ishizawa, T., et al. Laparoscopic segmentectomy of the liver: from segment I to VIII. Ann Surg. 256 (6), 959-964 (2012).
- Makuuchi, M., et al. Ultrasonically guided subsegmentectomy. Surg Gynecol Obstet. 161 (4), 346-350 (1985).
- Takamoto, T., Makuuchi, M. Precision surgery for primary liver cancer. Cancer Biol Med. 16 (3), 475-485 (2019).
- Cho, A., et al. Relation between hepatic and portal veins in the right paramedian sector: proposal for anatomical reclassification of the liver. World J Surg. 28, 8-12 (2004).
- Shindoh, J., et al. Complete removal of the tumor-bearing portal territory decreases local tumor recurrence and improves disease-specific survival of patients with hepatocellular carcinoma. J Hepatol. 64 (3), 594-600 (2016).
- Shindoh, J., et al. The intersegmental plane of the liver is not always flat - tricks for anatomical liver resection. Ann Surg. 251 (5), 917-922 (2010).
- Ciria, R., et al. A snapshot of the 2020 conception of anatomic liver resections and their applicability on minimally invasive liver surgery. A preparatory survey for the expert consensus meeting on precision anatomy for minimally invasive HBP surgery. J Hepatobiliary Pancreat Sci. 29 (1), 41-50 (2022).
- Zheng, J., et al. Laparoscopic anatomical portal territory hepatectomy with cirrhosis by takasaki's approach and indocyanine green fluorescence navigation (with Video). Ann Surg Oncol. 27 (13), 5179-5180 (2020).
- Kawaguchi, Y., et al. Difficulty of laparoscopic liver resection: proposal for a new classification. Ann Surg. 267 (1), 13-17 (2018).
- Liang, X., et al. Laparoscopic anatomical portal territory hepatectomy using Glissonean pedicle approach (Takasaki approach) with indocyanine green fluorescence negative staining: how I do it. HPB. 23 (9), 1392-1399 (2021).
- Ferrero, A., et al. Laparoscopic right posterior anatomic liver resections with Glissonean pedicle -first and venous craniocaudal approach. Surg Endosc. 35 (1), 449-455 (2021).
- Morise, Z. Laparoscopic liver resection for posterosuperior tumors using caudal approach and postural changes: a new technical approach. World J Gastroenterol. 2016 (47), 10267-10274 (2016).
- Okuda, Y., et al. Intrahepatic Glissonean pedicle approach to segment 7 from the dorsal side during laparoscopic anatomic hepatectomy of the cranial part of the right liver. J Am Coll Surg. 226 (2), e1-e6 (2018).
- Cao, J., et al. Totally laparoscopic anatomic S7 segmentectomy using in situ split along the right intersectoral and intersegmental planes. Surg Endosc. 35 (1), 174-181 (2021).
- Wang, X., Tong, H., Li, J., Wang, H. I. Indocyanine green fluorescence-guided laparoscopic anatomical segmentectomy of liver segment 6: Surgical strategy and technical details. Ann Surg Oncol. 31 (10), 6546-6550 (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены