Case Report
荧光染色阳性的腹腔镜 S7 肝切除术
摘要
该方案表明,在腹腔镜超声引导下,可以通过穿刺肿瘤的内脏和膈支成功对肝脏的 S7 段进行染色,从而促进 S7 段的解剖肝切除术。
摘要
位于肝脏 S7 段的肿瘤的腹腔镜肝脏切除术通常采用传统的手术方法。该程序的主要目标是准确解剖 S7 段的肝蒂。沿肝门解剖 S7 段的肝蒂需要在肝脏内有相对较长的路径,这会增加失去方向的风险,并可能损伤 S5 和 S6 段的相邻肝蒂,从而损害肝脏切除平面。采用阳性染色法,在超声引导下直接穿刺相应的门静脉(常用于 S7 和 S8 段),对目标肝段进行特异性着色,从而避免肝实质的广泛切除,减少对周围健康肝组织的损伤。然而,阳性染色方法需要在术中手术中具有特定的基础,这对外科医生来说可能具有挑战性,并且具有一定的学习曲线。目前,三维重建区域分析、术中超声、吲哚菁绿荧光成像等技术在腹腔镜肝切除术中较为普及和普遍使用。在该方案中,在腹腔镜超声引导下,通过肝脏的内脏和膈肌表面穿刺肿瘤盆,对 S7 段进行染色。腹腔镜切除了门静脉区域解剖肝脏内的 S7 段,进一步证实了现阶段腹腔镜肝脏切除术中荧光染色阳性的可行性和优势。
引言
原发性肝癌目前是中国第四大常见恶性肿瘤,也是癌症相关死亡的第二大原因,对全球人民的生命健康构成严重威胁1。对于肝细胞癌 (HCC),手术切除长期以来一直是主要的治疗选择。随着微创技术的进步,腹腔镜解剖肝切除术治疗 HCC 的报道越来越多。对于位于各个肝脏节段的腹腔镜肝切除术,包括特殊节段(I、IVb、VII 和 VIII),相关研究表明该方法安全有效2。
解剖性肝切除术的概念最早由 Makuuchi 等人于 1985 年提出 3,4。正确的程序是根据门静脉区域染色进行分割,并对肿瘤所属的门静脉区域染色进行完全切除5。由于 HCC 主要沿门静脉扩散,理论上,这种方法可以提供更好的肿瘤疗效,并实现对不同部位肿瘤的真正解剖肝切除6。然而,在过去,由于技术和设备的限制,这种处理并不常见。大多数中心根据 Couinaud 肝脏分割法进行解剖肝切除术。当肿瘤跨越多个肝段时,进行解剖性肝切除术会导致健康肝组织过度切除,从而增加手术风险和术后并发症。此外,由于肿瘤门静脉区域未完全切除,潜在的微转移病灶可能会持续存在 7,8。
随着技术和设备的进步,我们可以在术前三维重建的基础上定义肿瘤门静脉区域。这有助于临床医生确定切除范围,在手术过程中对肿瘤所属的门静脉区域进行超声穿刺和染色,并使用吲哚菁绿荧光成像确定肝脏切片平面,以实现更准确的解剖肝脏切除9。然而,对于腹腔镜解剖肝脏 S7 段的肝脏切除术,手术更具挑战性,因为肝蒂深藏在肝实质中,并位于背侧和头侧的近端,从而导致手术时间更长,创伤更大10。阳性染色法包括在超声引导下直接穿刺相应的门静脉(通常用于肝段 S7 和 S8),以便直接对目标肝段进行染色。这有助于外科医生避免切开过多的肝实质,从而最大限度地保护功能性肝脏体积11。然而,阳性染色方法需要特定的术中超声基础,正确识别肝内导管,并适当使用术中门静脉穿刺技术。它还对外科医生提出了很高的要求,并且与先决条件的学习曲线有关。
在此处描述的患者中,肿瘤位于肝脏的 S7 段。术前 3D 重建显示 2 个门静脉分支。由于 S7 躯干较短且靠近 S6 段门静脉的根部,因此它沿肝脏的膈肌和内脏表面被穿刺。注射吲哚菁绿对目标肝段进行染色,并在指导手术并确保手术顺利的荧光信号下切除肝脏。
这里展示的肝脏 S7 段切除术的目的是进一步推广门静脉区染色引导解剖肝切除术的概念,并突出 S7 段阳性染色切除术的优势。该程序最大限度地减少了肿瘤切除过程中切除的健康肝组织的体积,同时最大限度地提高了肿瘤切除效率。
案例介绍:
一名 30 岁男性于 2023 年 2 月 2 日入住佛山市复星禅城医院。1 个月前在另一家医院发现患者的肝脏有占位性病变,无不适。除此之外,他有良好的健康史。
诊断、评估和计划:
诊断:肝细胞癌。
评估:ALT(丙氨酸转氨酶):123 U/L,AST(天冬氨酸转氨酶):34 U/L,血红蛋白:141 g/L,血小板计数:125 x 109 个细胞/L,白蛋白:40.5 g/L,总胆红素:10.1 μmol/L,肌酐:67 μmol/L,凝血酶原时间(PT):14.1 s,乙型肝炎表面抗原阳性,HBV DNA(乙型肝炎病毒DNA):3.51 x 106 IU/L,异常凝血酶原 (PIVKA-II):21 mAU/mL,AFP(甲胎蛋白):56.29 μg/L,CA199(碳水化合物抗原 199):<0.8 U/mL,CEA(癌胚抗原):4.65 U/mL,胆碱酯酶:7128 U/L,Child-Pugh A 级。上腹部增强 CT(计算机断层扫描)和增强(钆塞酸盐二钠)MRI(磁共振成像):肝脏 S7 段 1 cm 肿块, 三维重建区域分析(见 图 1)。剩余肝脏体积为 78.8%。

图 1:三维重建分析。 肿瘤的位置、肿瘤相关门静脉和肝静脉的三维重建,以及肿瘤附近的重要血管。缩写: v7 = 肝静脉 7 个分支的节段;PPC = 后门静脉 C;PPD = 后门静脉 D;IHV = 区域间肝静脉;RHV = 右肝静脉。 请单击此处查看此图的较大版本。
计划: 计划进行荧光阳性染色的腹腔镜 S7 肝切除术。第 1 步:使用 CT 和三维重建进行区域分析。肿瘤位于肝脏 S7 段的后门静脉 C (PPc) 和后门静脉 D (PPd) 区域(参考日本学者的右后门静脉分类4;参见 图 2)。第 2 步:术中超声显示肿瘤所属的门静脉有两个血管分支。第 3 步:切断目标肝蒂 PPc 和 PPd,在荧光引导下,肝脏区域 S6 和 S7 与右肝静脉之间的静脉充分曝光。第 4 步:荧光染色引导的肿瘤切除。

图 2.术前 CT 扫描。 (A) PPd 肿瘤相关门静脉的 CT 切片(红色箭头)。 (B) PPc 肿瘤相关门静脉的 CT 切片。请点击此处查看此图的较大版本。
研究方案
该协议遵循佛山市复星禅城医院人类研究伦理委员会的指导方针。获得患者参与本研究的书面知情同意书。
1. 术前准备
- 患者准备:将患者置于仰卧位,头部抬高,双脚降低,向左倾斜约 30°。进行全身麻醉,包括气管插管。对手术区域进行腹部消毒和悬垂。
- 套管针布局:用手术刀将皮肤水平切开肚脐右侧 1 cm 后,插入 1.2 cm 套管针(观察孔)。然后,在锁骨中线交点处,右肋缘下方 5 cm 处插入 1.0 cm 套管针,在右肋缘和腋窝下方插入 0.5 cm 套管针,在剑突下方插入 1.2 cm 套管针,在连接脐部和剑突的线中点左侧 3 cm 处插入 0.5 cm 套管针。外科医生站在病人的右侧,助手站在病人的左侧。相机被放置在观察孔中。
- 腹部探查:术中沿门静脉和肝静脉进行超声扫描,以确定肿瘤与导管之间的关系,通过三维重建证实。腹腔镜下肝脏和腹腔探查未发现其他病变或转移。前门 (AP) 和 PP 的超声定位显示 PP 为 B 型。
注意:术中超声评估肿瘤大小、位置、肝内转移及其与周围血管的关系。
2. 外科手术
- 肝周韧带的分离:用超声刀切断肝脏的圆韧带和镰状韧带。解剖第二肝门,露出右肝静脉的根部。右冠状韧带和右三角韧带被切断。使用缝线将下腔静脉背侧的三条短肝静脉结扎,以完全释放右肝。
- 闭塞带:使用超声刀释放胆囊周围的粘连,露出文丘里孔。沿文丘里孔使用胃胃钳,并在第一肝门放置闭塞带。
- 穿刺和切除术
- 通过膈肌表面的右侧主作端口可以看到 PPc,而 PPd 在内脏表面可见。使用术中超声引导下用探头和穿刺孔穿刺 PPc 和 PPd 穿刺。
- 膈肌表面穿刺(图 3 和 图 4):将探头插入右肋缘下方的主手术孔中。PPC 在膈肌表面可见,并且 PPC 的长直径暴露在外。选择了从 PPC 根部开始的穿刺点。使用 21G 经皮经肝胆管 (PTC) 针刺破胆管。使用了 1 个面、3 个点和 4 个水平手指的方法。
- 一侧以左右调节杆中点为术中超声瞄准点,以探杆为平面内穿刺。选取的 3 个穴位分别为皮肤穿刺点、术中探针穿刺孔和目标肝蒂穿刺点。四个水平手指的长度用于测量探针杆垂直平面与套管针前皮肤交点处的皮肤穿刺点。
- 握住 PTC 针,使斜面面向腹侧远端。取出针芯,缓慢注入 0.025 mg/mL 吲哚菁绿 3 mL。使用荧光成像观察膈肌表面。
- 内脏表面穿刺(图 5 和 图 6):在剑突工艺下选择穿刺孔位置进行探针插入。选择 PPd 作为穿刺点,缓慢注射 3 mL 0.025 mg/mL 吲哚菁绿稀释液。
- 此时,对肝脏 S7 段的内脏表面进行荧光成像,用于确定切缘。使用弹性牵引绳将肝脏 S7 段从肝脏 S6 段的下缘拉到左下腹部。
- 从尾侧到头侧,沿着荧光和非荧光段之间的边界,沿着肝段 S6 和 S7 之间的区域间肝静脉 (IVH) 和右肝静脉切开肝组织(图 7)。
- 沿右肝静脉右缘,使用结扎夹结扎肝脏 S7 反流静脉,并与肝段 S7 的两个分支肝蒂断开。在麻醉辅助的低中心静脉压下,使用超声手术刀和双极电凝术使用荧光成像边界切割肝组织。
- 残肝止血:仔细检查残肝,采用双极电凝法逐一闭合出血点。涂层 Vicryl 抗菌缝合线用于缝合切口。
- 对于术后疼痛,静脉注射镇痛药。术后观察时,测量肝功能和胆红素水平的变化。

图 3:膈肌表面穿刺。 (A) 术中超声沿主手术孔进入。(B) 腹腔镜 PTC 穿刺针沿术中超声固定孔穿刺。(C) 超声引导下 PTC 穿刺针(白色箭头)穿刺 PPc 门静脉图像。 请单击此处查看此图的较大版本。

图 4:膈肌表面穿刺阳性染色。 PPc 门静脉阳性染色图片,并用超声刀标记染色边缘。绿色区域显示 PPc 所属的门户区域。 请单击此处查看此图的较大版本。
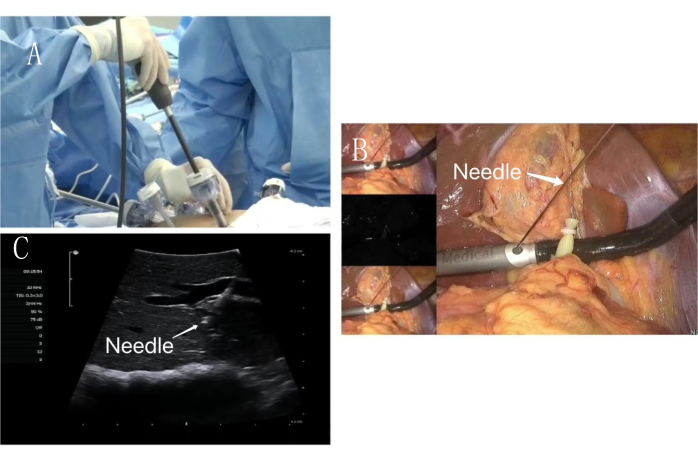
图 5:内脏表面穿刺。 (A) 术中超声沿辅助手术孔进入。(B) 腹腔镜 PTC 穿刺针沿术中超声固定孔穿刺。(C) 超声引导下 PTC 穿刺针(白色箭头)穿刺 PPd 门静脉图像。 请单击此处查看此图的较大版本。
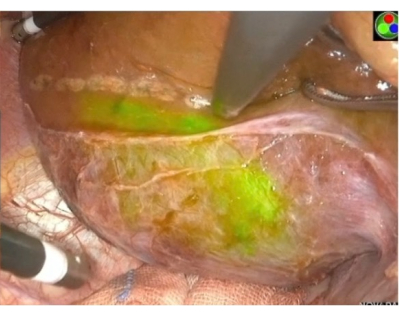
图 6:内脏表面穿刺阳性染色。 PPd 门静脉阳性染色图片,并用超声刀标记染色边缘。绿色区域显示 PPd 所属的门户区域。 请单击此处查看此图的较大版本。

图 7:IHV 和右肝静脉。 紫色区域显示右侧肝静脉;绿色区域显示肝静脉 7 个分支的节段;黄色区域是 PPC 和 PPD 的横截面;红色区域是右肝后蒂。缩写: v7-1= 肝静脉 S7 段分支的第一个;v7-2= 肝静脉 S7 段分支的第二个;RHV = 右肝静脉;PPc: 肝脏右后叶门静脉的 C 支;PPd:肝脏右后叶门静脉的 D 分支。 请单击此处查看此图的较大版本。
结果
在本病例报告中,成功进行了腹腔镜门静脉区域染色引导的 S7 段解剖肝切除术,沿膈肌和内脏表面染色阳性(图 6 和 图7)。切除单个 1 cm 肿瘤。手术时间为 210 min,术中出血量为 100 mL。术后住院时间为 7 d,患者仍在持续随访中。每 2 个月进行一次随访,持续 2 年,包括肝功能检查、肿瘤标志物检测和影像学检查(超声、CT 或 MRI)。术后 MRI 如图 8 所示。
标本检查: 术后病理检查结果显示 HCC III 级 (中度低分化),手术切缘阴性。免疫组化:AFP (+)、CK19 (+)、磷脂酰聚糖-3 (+)、肝细胞 (+)、CD10 (-)、CD34(+,毛细血管转化)、CK7 (-) 和 Ki-67 (+,热点区域约 30%)。

图 8:术后 MRI 扫描。 患者术后的 MRI 扫描。 请单击此处查看此图的较大版本。
讨论
目前,肝脏手术正在进入微创手术时代。已有报道称 HCC 患者解剖切除了各种肝脏节段,该手术的安全性已得到验证2。它在肿瘤学中的疗效越来越受到关注,Shindoh 等人提出的解剖肝切除术方法涉及基于肿瘤相关区域染色的完全切除6。受先前技术和设备的限制,只能使用 Couinaud 肝脏分割来实现类似于解剖切除术的概念。
众所周知,HCC 主要沿门静脉转移,大多数患者发展为门静脉癌栓。日本肝胆胰外科学会第 32 届年会和微创肝胆胰外科精确解剖专家共识会议明确并统一了解剖肝切除术的定义,即完全切除 PT 肝实质8。解剖肝段切除术被明确定义为完全去除以第三级肝蒂为主的肝段染色区域。随着三维重建区域染色分析和吲哚菁绿荧光成像的发展,基于荷瘤门静脉区域染色的解剖肝切除术已实现9。人们开始发现,门静脉盆地解剖肝切除术的切除范围与传统解剖肝切除术明显不同。这种偏差可能导致门静脉盆中残留的微转移和局部复发。当肿瘤跨越多个肝段时,经典解剖肝切除术的切除范围明显大于门静脉盆地解剖肝切除术,难以实现精准、微创切除,满足临床需求。
腹腔镜门静脉区域染色引导解剖肝切除术利用术前三维重建来描绘个性化的、荷瘤的门静脉盆。该方法在手术过程中与吲哚菁绿荧光成像系统相结合,以确保精确切除。
此前,对于经典的解剖肝切除术,Ferrero 等人从背侧解剖少量肝组织,以准确控制 S7 段的肝蒂,利用头肝静脉入路寻找右肝静脉主干,并跟随主干切断肝脏,完成解剖肝脏 S7 切除2。Morise 等人使用胸椎入路进行腹腔镜解剖 S7 肝脏切除术9,而 GoroHonda 等人使用背尾入路切除肝脏的 S7 段12。Chen 等人提倡使用 S7 进行腹腔镜原位肝切除术13;然而,对于腹腔镜门静脉区域染色引导的解剖型 S7 段肝切除术,如果通过经典手术途径获得目标肝蒂,则需要劈开大量肝实质。如果在此基础上进行染色,由于肝组织已经被切开,一些属于肿瘤分水岭的肝段可能无法染色。这会影响染色和肿瘤切除效果。
腹腔镜门静脉区域染色引导解剖 S7 段肝切除术的关键步骤是在术中超声引导下对目标肝蒂进行精确穿刺。只有固定肿瘤相关区域和染色分支,才能进行荧光染色以指导手术。腹腔镜门静脉穿刺染色法的学习曲线陡峭,不仅需要熟练理解肝脏解剖结构,还需要为解释腹腔镜检查中的超声结果奠定坚实的基础。因此,这种方法提出了国际公认的技术挑战。
虽然初学者可以通过一些超声设备上的穿刺引导孔快速学习这项技术,因为穿刺隧道与探头之间的角度固定在 60°,但它需要通过腹壁精确选择穿刺点;否则,可能会发生穿刺失败14.为了解决这个问题,我们提出了一种单侧、三点、四横指的方法:一侧以左右调节杆的中点作为瞄准点,以探杆作为面内穿刺的垂直平面。在三个点上,皮肤穿刺点、术中探针穿刺孔和目标肝蒂穿刺点,在四个水平指上,皮肤。穿刺点大约位于四个水平手指的交点处,从探针杆的垂直平面和套管针前面的皮肤开始。从肝脏的膈肌和内脏表面穿刺门静脉,实现腹腔镜门静脉区域染色引导下肝脏解剖 S7 段的切除,验证手术的可行性和安全性。
在整个穿刺过程中,我们强调了几个需要注意的关键细节,包括穿刺针的类型、外科医生的姿势、针尖的角度和方向以及助手给药的速度。穿刺针的尺寸理想情况下应在 18G 至 21G (0.8 mm-1.2 mm) 之间,并且应仔细控制注射流速。外科医生的姿势通常遵循肿瘤的对侧原则:如果肿瘤在肝脏的右侧,外科医生就站在左侧,反之亦然。针尖以向上的角度插入肝脏,并指向目标肝蒂的远端,以防止注射过程中药物反流和其他分支的污染。针尖的方向如下:1 个点、3 个点和 4 个水平手指,针头朝上进入肝脏。一旦针尖进入肝脏,就尽量减少调整以避免肝脏损伤,并且由于手术过程中探针的移位,针尖的方向可能会丢失。然后应轻轻旋转探头以定位针尖,而不是调整针的方向以与超声平面对齐。如果针尖的方向与目标肝蒂的方向不一致,可以撤回针尖并与超声结合,然后再次插入针头。关于药物给药速度,在直接超声可视化下保持对注射速度的控制至关重要,以确保药物遵循门静脉血流的方向。
腹腔镜门静脉穿刺染色失败主要分为两个方面:不能完全染色的肿瘤分支过多和药物反流引起的染色失败。关于这两个限制,如果在手术中发现多个门静脉分支向肿瘤供血,但术前 3D 重建没有反映这一点,可以采用部分分水岭染色和荧光边界来劈开肝实质,定位并阻断肝蒂,然后根据缺血线或反向染色分离剩余的肝实质。如果未考虑上述细节并且发生药物回流,则可以将荧光设备调整为黑白模式以提高对比度。
然而,与目前的腹腔镜解剖肝段 S7 和 S815 相比,门静脉穿刺阳性染色方法具有以下优点。理论上,门静脉分水岭阳性染色的肝脏段最接近真实的解剖分水岭,可以有效避免残留的非功能性肝脏体积,降低肿瘤微转移和复发的风险16。准确定位目标肝蒂,不解剖肝门,不损伤任何肝实质,可有效避免胆漏等术后并发症。在染色成功的前提下,肝脏实质沿荧光界面完全分离,有效防止肝静脉损伤,降低出血风险。
应进一步研究腹腔镜门静脉区域解剖肝切除术治疗 HCC 的随机对照试验,以探讨该方法在肿瘤学中的优越性。此外,超声在肝胆手术中的重要性越来越不言而喻。
披露声明
作者没有什么可披露的。
致谢
作者没有什么可披露的。
材料
| Name | Company | Catalog Number | Comments |
| Coated Vicryl Plus Antibacterial Suture | Ethicon, Inc. | 3650118 | The product is suitable for the placement and/or ligation of soft tissues |
| Color Doppler ultrasound diagnostic scanner | BK Medical | 20153251933 | intraoperative ultrasound |
| Disposable laparoscopic puncture device and puncture sheath | Jiangsu Fenghe Medical Equipment Co., Ltd | 20182021588 | Used for laparoscopic examination and surgical procedures, to puncture the abdominal wall tissue of the human body and establish a working channel for abdominal surgery |
| Four way curved electron convex array laparoscopic intraoperative probe | BK Medical | 20153251933 | Used for intraoperative examination and interventional treatment in various laparoscopic surgeries |
| HAKKO SONOGUIDE PTC NEEDLE | Baguang Trading (Shanghai) Co., Ltd | 20172146872 | Percutaneous liver bile duct puncture needle |
| Indocyanine Green for Injection | DANDONG YICHUANG PHARMACEUTICAL | ICP-09018669-1 | Assessment of liver reserve function and liver imaging |
| WECK Hem-o-lok | Teleflex Medical | 20143466018 | Ligation of blood vessels or tissues |
参考文献
- Han, B. F., et al. Cancer incidence and mortality in China, 2022. J Natl Cancer Cent. 4 (1), 47-53 (2024).
- Ishizawa, T., et al. Laparoscopic segmentectomy of the liver: from segment I to VIII. Ann Surg. 256 (6), 959-964 (2012).
- Makuuchi, M., et al. Ultrasonically guided subsegmentectomy. Surg Gynecol Obstet. 161 (4), 346-350 (1985).
- Takamoto, T., Makuuchi, M. Precision surgery for primary liver cancer. Cancer Biol Med. 16 (3), 475-485 (2019).
- Cho, A., et al. Relation between hepatic and portal veins in the right paramedian sector: proposal for anatomical reclassification of the liver. World J Surg. 28, 8-12 (2004).
- Shindoh, J., et al. Complete removal of the tumor-bearing portal territory decreases local tumor recurrence and improves disease-specific survival of patients with hepatocellular carcinoma. J Hepatol. 64 (3), 594-600 (2016).
- Shindoh, J., et al. The intersegmental plane of the liver is not always flat - tricks for anatomical liver resection. Ann Surg. 251 (5), 917-922 (2010).
- Ciria, R., et al. A snapshot of the 2020 conception of anatomic liver resections and their applicability on minimally invasive liver surgery. A preparatory survey for the expert consensus meeting on precision anatomy for minimally invasive HBP surgery. J Hepatobiliary Pancreat Sci. 29 (1), 41-50 (2022).
- Zheng, J., et al. Laparoscopic anatomical portal territory hepatectomy with cirrhosis by takasaki's approach and indocyanine green fluorescence navigation (with Video). Ann Surg Oncol. 27 (13), 5179-5180 (2020).
- Kawaguchi, Y., et al. Difficulty of laparoscopic liver resection: proposal for a new classification. Ann Surg. 267 (1), 13-17 (2018).
- Liang, X., et al. Laparoscopic anatomical portal territory hepatectomy using Glissonean pedicle approach (Takasaki approach) with indocyanine green fluorescence negative staining: how I do it. HPB. 23 (9), 1392-1399 (2021).
- Ferrero, A., et al. Laparoscopic right posterior anatomic liver resections with Glissonean pedicle -first and venous craniocaudal approach. Surg Endosc. 35 (1), 449-455 (2021).
- Morise, Z. Laparoscopic liver resection for posterosuperior tumors using caudal approach and postural changes: a new technical approach. World J Gastroenterol. 2016 (47), 10267-10274 (2016).
- Okuda, Y., et al. Intrahepatic Glissonean pedicle approach to segment 7 from the dorsal side during laparoscopic anatomic hepatectomy of the cranial part of the right liver. J Am Coll Surg. 226 (2), e1-e6 (2018).
- Cao, J., et al. Totally laparoscopic anatomic S7 segmentectomy using in situ split along the right intersectoral and intersegmental planes. Surg Endosc. 35 (1), 174-181 (2021).
- Wang, X., Tong, H., Li, J., Wang, H. I. Indocyanine green fluorescence-guided laparoscopic anatomical segmentectomy of liver segment 6: Surgical strategy and technical details. Ann Surg Oncol. 31 (10), 6546-6550 (2024).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。