Case Report
腹腔鏡下 S7 肝切除術と陽性蛍光染色
要約
このプロトコルは、腹腔鏡下超音波ガイド下で、腫瘍の内臓および横隔膜の枝を穿刺することにより、肝臓のS7セグメントを成功裏に染色できることを示しています。これにより、S7セグメントの解剖学的肝切除術が容易になります。
要約
肝臓のS7セグメントに位置する腫瘍に対する腹腔鏡下肝切除術は、通常、従来の外科的アプローチを採用しています。この手順の主な目標は、S7セグメントの肝臓椎弓根を正確に解剖することです。肝心丘に沿ってS7セグメントの肝茎を解剖するには、肝臓内で比較的長い経路が必要であり、これにより、方向が失われ、S5およびS6セグメントの隣接する肝椎弓根が損傷するリスクが高まり、それによって肝臓切除面が損なわれます。ポジティブ染色法を使用して、超音波ガイド下(通常はS7およびS8セグメント)で対応する門脈を直接穿刺し、標的の肝臓セグメントを特異的に着色し、それによって肝実質の広範な切除を回避し、周囲の健康な肝臓組織への損傷を軽減しました。しかし、ポジティブ染色法では、術中処置において特定の基礎が必要であり、これは外科医にとって困難であり、一定の学習曲線があります。現在、腹腔鏡下肝切除術では、三次元再構成領域分析、術中超音波、インドシアニン緑色蛍光イメージングなどの技術が一般的であり、一般的に使用されています。このプロトコルでは、腹腔鏡下超音波ガイド下で、腫瘍盆地を肝臓の内臓および横隔膜の表面に穴を開けて、セグメント S7 を染色しました。門脈領域解剖学的肝臓内のセグメントS7の腹腔鏡下切除が成功し、この段階での腹腔鏡下肝臓切除における陽性蛍光染色の実現可能性と利点がさらに確認されました。
概要
原発性肝がんは現在、中国で4番目に多い悪性腫瘍であり、がん関連死因の第2位であり、世界中の人々の生命と健康に深刻な脅威をもたらしています1。肝細胞がん(HCC)の場合、外科的切除が長い間主要な治療選択肢でした。低侵襲技術の進歩に伴い、HCCを治療するための腹腔鏡下解剖学的肝臓切除に関する報告が増えています。特殊なセグメント (I、IVb、VII、および VIII) を含むさまざまな肝臓セグメントに位置する腹腔鏡下肝切除術の場合、関連する研究により、この方法が安全で効果的であることが示されています2。
解剖学的肝臓切除の概念は、1985年にMakuuchiらによって最初に提案されました3,4。正しい手順は、門脈領域染色に従ってセグメント化し、腫瘍が属する門脈領域染色の完全切除を行うことです5。HCC は主に門脈に沿って広がるため、理論的には、このアプローチはより優れた腫瘍学的有効性を提供し、さまざまな場所の腫瘍に対して真の解剖学的肝切除を達成できます6。しかし、従来は技術や設備の制約から、このような治療法は一般的ではありませんでした。ほとんどのセンターで、Couinaud liver segmentation法に基づいて解剖学的肝臓切除術が実施されました。腫瘍が複数の肝臓セグメントにまたがっている場合、解剖学的肝臓切除を行うと、健康な肝臓組織が過剰に切除され、手術リスクや術後合併症が増加する可能性があります。さらに、腫瘍門脈領域7,8の不完全な切除のために、潜在的な微小転移性病変が持続する可能性があります。
技術と設備の進歩により、術前の三次元再建に基づいて腫瘍門脈の領域を定義することができます。これにより、臨床医は切除範囲を決定し、手術中に腫瘍が属する門脈領域の染色枝の超音波ガイド下穿刺と染色を行い、インドシアニン緑色蛍光イメージングを使用して肝臓切片平面を決定し、より正確な解剖学的肝切除を達成することができます9。しかし、腹腔鏡下解剖学的肝臓切除術では、肝椎弓根が肝実質に深く隠れており、背側と頭側に近位に局在しているため、手術はより困難であり、手術時間が長くなり、外傷が大きくなります10。陽性染色法では、超音波ガイド下(通常は肝臓セグメントS7およびS8で使用される)で対応する門脈を直接穿刺し、標的肝臓セグメントを直接染色します。これにより、外科医は肝臓実質を過剰に切除するのを防ぎ、それによって機能的な肝臓容量11の保護を最大化します。ただし、ポジティブ染色法では、特定の術中超音波基礎、肝内管の正しい同定、および術中門脈穿刺技術の適切な使用が必要です。また、外科医には高い要求がかかり、前提条件となる学習曲線と関連しています。
ここで説明した患者では、腫瘍は肝臓のセグメントS7に位置していました。術前の三次元再構成により、門脈の枝が2つあることが明らかになった。S7 体幹は短く、セグメント S6 門脈の根元に近いため、肝臓の横隔膜表面と内臓表面に沿って穿刺されました。インドシアニングリーンを注射して標的の肝臓部分を染色し、手技を導く蛍光シグナルに従って肝臓を切除し、スムーズな操作を確保しました。
ここで示す肝臓 S7 セグメント切除法の目的は、門脈領域染色ガイド下解剖学的肝臓切除の概念をさらに促進し、S7 セグメント陽性染色切除の利点を強調することです。この手順は、腫瘍切除中に除去される健康な肝臓組織の量を最小限に抑えながら、腫瘍の除去効率を最大化します。
ケースプレゼンテーション:
30歳の男性が2023年2月2日に佛山復星長城病院に入院しました。患者は、1か月前に別の病院で肝臓にスペース占有病変があることがわかりましたが、不快感はありません。それ以外は健康だった。
診断、評価、計画:
診断:肝細胞がん。
評価: ALT(アラニンアミノトランスフェラーゼ):123 U/L、AST(アスパラギン酸アミノトランスフェラーゼ):34 U/L、ヘモグロビン:141 g/L、血小板数:125 x 109 細胞/L、アルブミン:40.5 g/L、総ビリルビン:10.1 μmol/L、クレアチニン:67 μmol/L、プロトロンビン時間(PT):14.1 s、B型肝炎表面抗原陽性、HBV DNA(B型肝炎ウイルスDNA):3.51 x 106 IU/L、異常プロトロンビン(PIVKA-II):21 mAU/mL、AFP(α-フェトプロテイン):56.29 μg/L、CA199(炭水化物抗原199):<0.8 U/mL、CEA(癌胎児性抗原):4.65 U/mL、コリンエステラーゼ:7128 U/L、Child-PughグレードA.上腹部のエンハンスメントCT(コンピューター断層撮影スキャン)およびエンハンステッド(ガドキセテート二ナトリウム)MRI(磁気共鳴画像法):肝臓S7セグメントの1cmの腫瘤、 3次元の再構築領域分析( 図1を参照)。肝臓の残量は78.8%でした。

図1:3次元再構成解析。 腫瘍の位置、腫瘍関連門脈と肝静脈の三次元再建、および腫瘍近くの重要な血管。略語:v7 =肝静脈の7つの枝のセグメント。PPC = 後門脈 C;PPD = 後門脈 D;IHV = 領域間肝静脈;RHV =右肝静脈。 この図の拡大版を表示するには、ここをクリックしてください。
計画:腹腔鏡下S7肝切除術と蛍光陽性染色が計画されました。ステップ1:テリトリー分析にはCTと3次元再構成を使用しました。腫瘍は肝臓のS7セグメントの後門脈C(PPc)および後門脈D(PPd)領域に所在していた(日本人研究者の右後門脈分類4を参照; 図2参照)。ステップ2:術中超音波検査では、腫瘍が属する門脈には2つの血管枝があることが示されました。ステップ3:標的の肝椎弓根PPcとPPdを切断し、肝領域S6とS7の間の静脈と右肝静脈を蛍光ガイダンス下で完全に露出させました。ステップ4:蛍光染色による腫瘍切除。

図 2.術前CTスキャン。 (A)PPdの腫瘍関連門脈のCT切片(赤矢印)。 (B) PPcの腫瘍関連門脈のCTセクションこの図の拡大版を表示するには、ここをクリックしてください。
プロトコル
このプロトコルは、佛山復星長城病院の人間研究倫理委員会のガイドラインに従っています。この研究への参加については、患者から書面によるインフォームド コンセントが得られました。
1. 術前準備
- 患者の準備:患者を仰臥位に置き、頭を持ち上げ、足を下げて左に約30°傾けました。気管挿管を含む全身麻酔が投与されました。腹部消毒と手術部位のドレーピングを行いました。
- トロカールレイアウト:へその右側1cmの皮膚を外科用ナイフで水平に1cm切った後、1.2cmのトロカール(観察穴)を挿入しました。次に、1.0 cmのトロカールを鎖骨中部の交点、右肋骨縁の5 cm下に挿入し、0.5 cmのトロカールを右肋骨縁と腋窩の下に挿入し、1.2 cmのトロカールを剣状突起の下に挿入し、臍と剣状突起を結ぶ線の中点から3 cm左に0.5 cmのトロカールを挿入しました。外科医は患者の右側に立ち、助手は患者の左側に立ちます。カメラは観察穴に設置されました。
- 腹部探索:術中超音波スキャンがポータルと肝静脈に沿って行われ、腫瘍と管との関係が決定され、3次元再構成によって確認されました。肝臓と腹腔の腹腔鏡下探索では、他の病変や転移は認められませんでした。前門脈(AP)とPPの超音波局在化により、PPはB型であることが明らかになりました。
注:術中超音波検査では、腫瘍のサイズ、位置、肝内転移、および周囲の血管との関係を評価します。
2.外科的処置
- 肝周囲靭帯の分離:超音波ナイフを使用して、肝臓の丸靭帯と鷹靭帯を切断しました。2番目の肝門脈が解剖され、右肝静脈の根元が露出しました。右冠状靭帯と右三角靭帯を切断した。ステッチを使用して、3つの短い肝静脈を下大静脈の右側に背側に結紮し、右肝臓を完全に解放しました。
- オクルージョンバンド:超音波ナイフを使用して胆嚢周囲の癒着を解放し、ベンチュリーの孔を露出させました。胃胃鉗子をベンチュリーの孔に沿って使用し、第1の肝門に閉塞帯を配置した。
- 穿刺と切除
- PPcは横隔膜面の右主操作ポートから見え、PPdは内臓面に見えました。PPcとPPdは、プローブと穿刺穴を備えた術中超音波検査ガイダンスを使用して穿刺されました。
- 横隔膜表面穿刺 (図 3 および 図 4): プローブを右肋骨縁の下の主手術穴に挿入しました。PPCは横隔膜表面に見え、PPCの長径が露出していました。PPCのルートからの穿刺ポイントが選択されました。21Gの経皮的経肝胆管(PTC)針を使用して胆管を刺しました。1つの顔、3つのポイント、および4つの水平指の方法を使用しました。
- 一方の側では、左右の調整ロッドの中点を照準点として術中超音波に使用され、プローブロッドを面内穿刺の垂直面として使用されました。選択された3つのポイントは、皮膚穿刺ポイント、術中プローブ穿刺穴、およびターゲット肝椎弓根穿刺ポイントでした。4本の水平フィンガーの長さは、プローブロッドの垂直面とトロカールの前の皮膚とのほぼ交点で皮膚穿刺点を測定するために使用されました。
- PTC針は、ベベルが腹側遠位側を向くように保持されました。針の芯を抜いて、0.025 mg/mL インドシアニン グリーン 3 mL をゆっくりと注入しました。横隔膜表面は、蛍光イメージングを使用して視覚化されました。
- 内臓表面穿刺(図5 および 図6):穿刺穴の位置は、プローブ挿入のための剣状突起プロセスの下で選択されました。穿刺点としてPPdを選択し、0.025 mg/mLのインドシアニングリーン希釈液3 mLをゆっくりと注入しました。
- このとき、肝臓S7セグメントの内臓表面を蛍光画像化し、切除断端を決定するために使用しました。弾性牽引ロープを使用して、肝臓S7セグメントを肝臓S6セグメントの下端から左下腹部に引っ張りました。
- 肝臓組織は、尾側から橈側まで、および蛍光セグメントと非蛍光セグメントの境界に沿って、肝臓セグメントS6とS7の間の領域間肝静脈(IVH)と右肝静脈に沿って切断されました(図7)。
- 右肝静脈の右端に沿って、肝臓S7逆流静脈を結紮クリップを使用して結紮し、肝臓切片S7の2つの枝肝椎弓根から切断しました。超音波メスとバイポーラ電気凝固術を使用して、麻酔支援低中心静脈圧下で蛍光イメージング境界を使用して肝臓組織を切断しました。
- 残存肝臓の止血:残存肝臓を注意深くチェックし、バイポーラ電気凝固術を使用して出血点を1つずつ閉じました。コーティングされたVicryl抗菌縫合糸を使用して、切開部を縫合しました。
- 術後の痛みに対しては、静脈内鎮痛薬が投与されました。術後の観察中に、肝機能とビリルビンレベルの変化が測定されました。

図3:横隔膜表面穿刺(A)術中超音波が主手術穴に沿って入ります。(B)腹腔鏡下PTC穿刺針は、術中超音波固定穴に沿って穿刺するために使用されます。(C)PTC穿刺針(白矢印)超音波ガイド下でのPPc門脈穿刺画像。この図の拡大版を表示するには、ここをクリックしてください。

図4:横隔膜表面穿刺陽性染色。 PPc門脈陽性染色画像と超音波ナイフで染色されたエッジに印を付けます。緑色の領域は、PPc が属するポータル領域を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
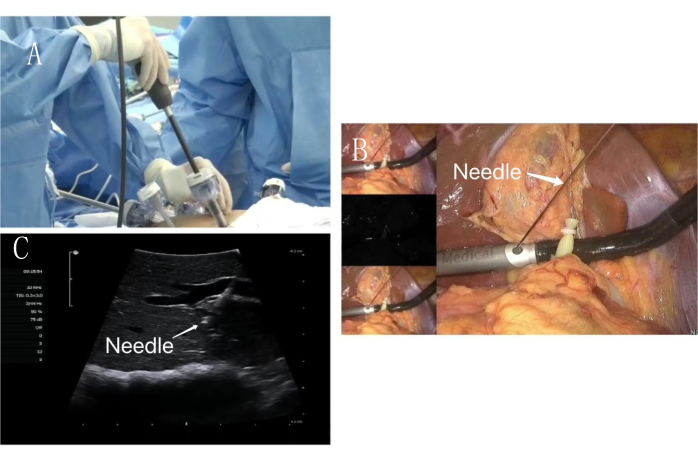
図5:内臓表面穿刺 (A)術中超音波は補助手術穴に沿って入ります。(B)腹腔鏡下PTC穿刺針は、術中超音波固定穴に沿って穿刺するために使用されます。(C)PTC穿刺針(白矢印)超音波ガイド下でのPPd門脈穿刺画像。 この図の拡大版を表示するには、ここをクリックしてください。
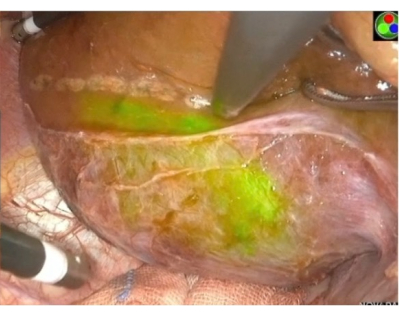
図6:内臓表面穿刺陽性染色。 PPd門脈陽性染色画像と超音波ナイフで染色されたエッジに印を付けます。緑色のエリアは、PPdが属するポータルテリトリーを示しています。 この図の拡大版を表示するには、ここをクリックしてください。

図7:IHVと右肝静脈。 紫色の領域は右肝静脈を示しています。緑色の領域は、肝静脈の7つの枝のセグメントを示しています。黄色の領域は、PPCとPPDの断面です。赤い部分は右後肝椎弓です。略語:v7-1 =肝静脈のS7セグメント枝の最初の1つ。v7-2= 肝静脈のS7セグメント枝の2番目のもの。RHV =右肝静脈;PPc:肝臓の右後葉にある門脈のC枝。PPd:肝臓の右後葉にある門脈のD枝。 この図の拡大版を表示するには、ここをクリックしてください。
結果
この症例報告では、腹腔鏡下門脈部染色ガイド下解剖学的肝臓切除術によるS7セグメントの切除が成功し、横隔膜表面と内臓表面に沿って陽性染色が行われました(図6および図7)。1cmの腫瘍1本を切除した。手術時間は210分で、術中の失血は100mLでした。術後の入院期間は7日間で、現在も継続的な経過観察が行われています。フォローアップは、肝機能検査、腫瘍マーカー検査、画像検査(超音波、CT、MRI)など、2か月ごとに2年間行われます。術後MRIを図8に示します。
検体検査:術後病理検査の結果、HCCグレードIII(中等度低分化型)で手術断端が陰性であった。免疫組織化学:AFP(+)、CK19(+)、グリピカン-3(+)、肝細胞(+)、CD10(-)、CD34(+、毛細血管形質転換)、CK7(-)、およびKi-67(+、ホットスポット領域で約30%)。

図8:術後MRIスキャン。 術後の患者のMRIスキャン。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
現在、肝臓手術は低侵襲手術の時代に突入しています。HCC患者における様々な肝臓部分の解剖学的切除の報告があり、この手術の安全性が確認されています2。腫瘍学におけるその有効性はますます注目されており、Shindohらが提唱する解剖学的肝切除術のアプローチは、腫瘍関連領域染色に基づく完全切除を伴うものである6。以前の技術や機器によって制限され、解剖学的切除と同様の概念を達成するためには、クイノー肝臓のセグメンテーションのみを使用できます。
HCCは主に門脈に沿って転移し、ほとんどの患者が門脈腫瘍血栓を発症することは十分に確立されています。第32回日本肝胆道・膵外科学会学術集会および低侵襲肝胆道・膵外科のための精密解剖学に関する専門家コンセンサス会議において、PT肝実質の完全切除である解剖学的肝切除術の定義が明確化され、統一された。解剖学的肝分節切除術は、第3レベルの肝茎が優勢な肝臓セグメントを染色する領域を完全に除去することとして明確に定義されています。三次元再構成領域染色分析とインドシアニン緑色蛍光イメージングの開発により、腫瘍担体門脈領域染色に基づく解剖学的肝切除術が達成されました9。門脈流域における解剖学的肝切除の切除範囲は、古典的な解剖学的肝切除のそれとは大きく異なることが、人々は発見し始めています。この逸脱は、門脈流域に微小転移が残存し、局所再発する可能性があります。腫瘍が複数の肝臓セグメントにまたがっている場合、古典的な解剖学的肝切除術の切除範囲は、門脈流域の解剖学的肝切除術の切除範囲よりも大幅に大きく、臨床ニーズを満たすための正確で低侵襲な切除を達成することは困難になります。
腹腔鏡下門脈領域染色ガイド下解剖学的肝切除術は、術前の三次元再構成を利用して、パーソナライズされた腫瘍含有門脈盆地を描写します。この方法は、手術中にインドシアニン緑色蛍光イメージングシステムと組み合わされ、正確な切除を確実にしました。
以前、古典的な解剖学的肝切除術のために、FerreroらはS7セグメントの肝茎を正確に制御するために背側から少量の肝臓組織を解剖し、頭側肝静脈アプローチを使用して右肝静脈の主幹を検索し、主幹をたどって肝臓を切断し、解剖学的肝臓S7切除2を完了しました。Moriseらは、胸部アプローチ9を用いて腹腔鏡下解剖学的S7肝臓切除を行い、GoroHondaらは背側尾側アプローチ12を用いて肝臓のS7セグメントを切除した。Chen et al. は、S713 を使用して腹腔鏡下同所性肝切除術を提唱しました。ただし、腹腔鏡下門脈領域染色ガイド下解剖学的 S7 セグメント肝切除の場合、標的の肝椎弓根が従来の外科的アプローチによって得られる場合、大量の肝実質を切断する必要があります。これに基づいて染色を行うと、腫瘍の分水界に属する一部の肝臓セグメントは、すでに切断された肝臓組織のために染色されない可能性があります。これは、染色と腫瘍除去の有効性に影響を与えます。
腹腔鏡下門脈領域染色ガイド下解剖学的 S7 セグメント肝切除における重要なステップは、術中超音波ガイダンス下で標的肝茎を正確に穿刺することです。腫瘍関連領域を確保し、枝を染色することによってのみ、手術をガイドするための蛍光染色を行うことができます。腹腔鏡下門脈穿刺染色法は学習曲線が急であるため、肝臓の解剖学的構造を理解する習熟度だけでなく、腹腔鏡検査中に超音波所見を解釈するための強固な基盤も必要です。したがって、この方法は国際的に認められた技術的課題を提示しています。
穿刺トンネルとプローブの間の角度が60°に固定されているため、初心者は一部の超音波装置の穿刺ガイド穴を使用してこの技術をすぐに学ぶことができますが、腹壁を通る穿刺ポイントを正確に選択する必要があります。そうしないと、パンク障害が発生する可能性があります14。これに対処するために、片側、3点、および4水平フィンガー法を提案します:一方の側では、左右の調整ロッドの中点を照準点として使用し、プローブロッドを面内穿刺の垂直面として使用しました。3つのポイントには、皮膚の穿刺ポイント、術中プローブの穿刺穴、およびターゲットの肝椎弓根の穿刺ポイントがあり、4本の水平指には皮膚があります。穿刺点は、プローブロッドの垂直面とトロカールの前の皮膚から、4本の水平フィンガーのほぼ交点に位置していました。門脈は、肝臓の横隔膜および内臓表面から穿刺され、腹腔鏡下門脈領域染色ガイド下 肝臓の解剖学的S7セグメントの切除を達成し、手術の実現可能性と安全性を検証しました。
穿刺手術全体を通して、穿刺針の種類、外科医の姿勢、針先の角度と方向、助手が薬を投与する速度など、注意が必要ないくつかの重要な詳細を強調しました。穿刺針のサイズは理想的には18Gから21G(0.8 mm-1.2 mm)の範囲である必要があり、注入流量は慎重に制御する必要があります。外科医のスタンスは、一般的に腫瘍の対側の原則に従います:腫瘍が肝臓の右側にある場合、外科医は左側に立ち、その逆も同様です。針先を上向きの角度で肝臓に挿入し、標的の肝椎弓根の遠位端に向けて、注射中の薬物逆流や他の枝の汚染を防ぎました。針先の向きは、1点、3つの斑点、4本の水平指で、肝臓に入る針は上を向いていました。針先が肝臓に入ると、肝臓の損傷を避けるために調整が最小限に抑えられ、処置中のプローブの変位により針先の方向が失われる可能性があります。次に、プローブをゆっくりと回転させて針の先端の位置を特定する必要があります 針の方向を超音波面に合わせて調整するのではなく。針先の向きが目的の肝椎弓根の向きと一致しない場合は、針先を引っ込めて超音波と組み合わせて、針を再度挿入することができます。投薬の投与速度に関しては、直接超音波視覚化の下で注射速度の制御を維持し、投薬が門脈の血流の方向に従うようにすることが重要です。
腹腔鏡下門脈穿刺染色の失敗は、主に2つの側面に分けられます:完全に染色できない腫瘍の枝が多すぎることと、薬物逆流によって引き起こされる染色失敗。これら 2 つの制限に関して、手術中に複数の門脈枝が腫瘍に血液を供給することが判明したが、術前の 3D 再構成がこれを反映していない場合、部分的な分水界染色と蛍光境界を使用して、肝実質を切断し、肝茎を特定してブロックし、虚血線または逆染色に従って残りの肝実質を剥離することができます。上記の詳細が考慮されず、薬物逆流が発生した場合、蛍光デバイスを白黒モードに調整してコントラストを向上させることができます。
しかし、現在の腹腔鏡下解剖学的肝臓セグメントS7およびS815と比較して、門脈吸引陽性染色法には以下の利点があります。理論的には、門脈流域の陽性染色された肝臓セグメントは、実際の解剖学的流域に最も近い症状であり、機能しない肝臓の残存量を効果的に回避し、腫瘍の微小転移と再発のリスクを減らすことができます16。肝門脈を解剖したり、肝実質を損傷したりすることなく、標的の肝椎弓根を正確に配置することで、胆汁漏出などの術後合併症を効果的に回避できます。染色が成功することを前提として、蛍光界面に沿った肝実質の完全な分離は、肝静脈の損傷を効果的に防止し、出血のリスクを低減します。
HCCの治療のための腹腔鏡下門脈領域解剖学的肝切除術のランダム化比較試験に関するさらなる研究を実施して、腫瘍学に対するこのアプローチの優位性を調査する必要があります。さらに、肝胆道手術における超音波の重要性はますます自明になってきています。
開示事項
著者は何も開示していません。
謝辞
著者は何も開示していません。
資料
| Name | Company | Catalog Number | Comments |
| Coated Vicryl Plus Antibacterial Suture | Ethicon, Inc. | 3650118 | The product is suitable for the placement and/or ligation of soft tissues |
| Color Doppler ultrasound diagnostic scanner | BK Medical | 20153251933 | intraoperative ultrasound |
| Disposable laparoscopic puncture device and puncture sheath | Jiangsu Fenghe Medical Equipment Co., Ltd | 20182021588 | Used for laparoscopic examination and surgical procedures, to puncture the abdominal wall tissue of the human body and establish a working channel for abdominal surgery |
| Four way curved electron convex array laparoscopic intraoperative probe | BK Medical | 20153251933 | Used for intraoperative examination and interventional treatment in various laparoscopic surgeries |
| HAKKO SONOGUIDE PTC NEEDLE | Baguang Trading (Shanghai) Co., Ltd | 20172146872 | Percutaneous liver bile duct puncture needle |
| Indocyanine Green for Injection | DANDONG YICHUANG PHARMACEUTICAL | ICP-09018669-1 | Assessment of liver reserve function and liver imaging |
| WECK Hem-o-lok | Teleflex Medical | 20143466018 | Ligation of blood vessels or tissues |
参考文献
- Han, B. F., et al. Cancer incidence and mortality in China, 2022. J Natl Cancer Cent. 4 (1), 47-53 (2024).
- Ishizawa, T., et al. Laparoscopic segmentectomy of the liver: from segment I to VIII. Ann Surg. 256 (6), 959-964 (2012).
- Makuuchi, M., et al. Ultrasonically guided subsegmentectomy. Surg Gynecol Obstet. 161 (4), 346-350 (1985).
- Takamoto, T., Makuuchi, M. Precision surgery for primary liver cancer. Cancer Biol Med. 16 (3), 475-485 (2019).
- Cho, A., et al. Relation between hepatic and portal veins in the right paramedian sector: proposal for anatomical reclassification of the liver. World J Surg. 28, 8-12 (2004).
- Shindoh, J., et al. Complete removal of the tumor-bearing portal territory decreases local tumor recurrence and improves disease-specific survival of patients with hepatocellular carcinoma. J Hepatol. 64 (3), 594-600 (2016).
- Shindoh, J., et al. The intersegmental plane of the liver is not always flat - tricks for anatomical liver resection. Ann Surg. 251 (5), 917-922 (2010).
- Ciria, R., et al. A snapshot of the 2020 conception of anatomic liver resections and their applicability on minimally invasive liver surgery. A preparatory survey for the expert consensus meeting on precision anatomy for minimally invasive HBP surgery. J Hepatobiliary Pancreat Sci. 29 (1), 41-50 (2022).
- Zheng, J., et al. Laparoscopic anatomical portal territory hepatectomy with cirrhosis by takasaki's approach and indocyanine green fluorescence navigation (with Video). Ann Surg Oncol. 27 (13), 5179-5180 (2020).
- Kawaguchi, Y., et al. Difficulty of laparoscopic liver resection: proposal for a new classification. Ann Surg. 267 (1), 13-17 (2018).
- Liang, X., et al. Laparoscopic anatomical portal territory hepatectomy using Glissonean pedicle approach (Takasaki approach) with indocyanine green fluorescence negative staining: how I do it. HPB. 23 (9), 1392-1399 (2021).
- Ferrero, A., et al. Laparoscopic right posterior anatomic liver resections with Glissonean pedicle -first and venous craniocaudal approach. Surg Endosc. 35 (1), 449-455 (2021).
- Morise, Z. Laparoscopic liver resection for posterosuperior tumors using caudal approach and postural changes: a new technical approach. World J Gastroenterol. 2016 (47), 10267-10274 (2016).
- Okuda, Y., et al. Intrahepatic Glissonean pedicle approach to segment 7 from the dorsal side during laparoscopic anatomic hepatectomy of the cranial part of the right liver. J Am Coll Surg. 226 (2), e1-e6 (2018).
- Cao, J., et al. Totally laparoscopic anatomic S7 segmentectomy using in situ split along the right intersectoral and intersegmental planes. Surg Endosc. 35 (1), 174-181 (2021).
- Wang, X., Tong, H., Li, J., Wang, H. I. Indocyanine green fluorescence-guided laparoscopic anatomical segmentectomy of liver segment 6: Surgical strategy and technical details. Ann Surg Oncol. 31 (10), 6546-6550 (2024).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved