Method Article
Использование возможностей микроРНК в небольших внеклеточных везикулах, высвобождаемых из свежезамороженных участков мозга человека
В этой статье
Резюме
В данной работе мы разрабатываем протокол с использованием минимального количества свежезамороженных срезов мозговой ткани и доступного высокоскоростного метода центрифугирования в сочетании с эксклюзионной хроматографией для получения небольших внеклеточных везикул в качестве источников микроРНК (микроРНК) биомаркеров неврологических расстройств.
Аннотация
Малые внеклеточные везикулы (sEVs) являются важнейшими медиаторами межклеточной коммуникации, транспортируя различные грузы, такие как белки, липиды и нуклеиновые кислоты (микроРНК, мРНК, ДНК). Груз микроРНК sEV имеет потенциальную полезность в качестве мощного неинвазивного биомаркера заболевания благодаря способности sEV преодолевать биологические барьеры (например, гематоэнцефалический барьер) и становиться доступным через различные жидкости организма. Несмотря на многочисленные исследования биомаркеров sEV в жидкостях организма, идентификация тканевых или клеточно-специфических субпопуляций sEV остается сложной задачей, особенно в мозге. Наше исследование решает эту проблему путем адаптации существующих методов выделения sEV из минимального количества замороженных участков мозга человека с помощью эксклюзионной хроматографии (SEC).
После этического одобрения около 250 г свежезамороженной ткани человеческого мозга (полученной из Манчестерского банка мозга [Великобритания]) были срезаны из трех донорских тканей и инкубированы в растворе коллагеназы типа 3/Hibernate-E с промежуточным перемешиванием, за которым последовали этапы центрифугирования и фильтрации. Затем sEV были выделены с использованием метода SEC и характеризовались следованием рекомендациям MISEV. Перед выделением РНК из этих sEV раствор обрабатывали Proteinase-K и RNase-A для удаления любых внеклеточных РНК, не относящихся к sEV. Количество и качество РНК проверяли и обрабатывали для экспериментов по количественной ПЦР и секвенированию малых РНК.
Присутствие sEVs было подтверждено с помощью флуоресцентного анализа наночастиц (fNTA) и вестерн-блоттинга для поверхностных маркеров (CD9, CD63, CD81). Распределение по размерам (50-200 нм) было подтверждено методами NTA и электронной микроскопии. Общая концентрация РНК в лизированных sEV варьировалась от 3 до 9 нг/мкл и использовалась для успешного количественного определения с помощью количественной ПЦР для выбранных потенциальных микроРНК. Секвенирование малых РНК на MiSeq дало данные высокого качества (Q >32) с 1,4-5 миллионами прочтений на образец.
Этот метод позволяет эффективно выделять и характеризовать sEVs из минимальных объемов ткани мозга, облегчая неинвазивные исследования биомаркеров и обещая справедливые исследования биомаркеров заболеваний, предлагая понимание нейродегенеративных заболеваний и потенциально других расстройств.
Введение
Внеклеточные везикулы (ВВ) являются одним из ключевых игроков в межклеточной коммуникации у всех многоклеточных организмов1. ВВ представляют собой липидные двухслойные мембранные частицы клеточного происхождения, которые могут способствовать переносу различных грузовых нагрузок, таких как белки, липиды и нуклеиновые кислоты, к клеткам-реципиентам. ВВ могут иметь широкий диапазон размеров в диапазоне от 30 нм до 1 мкм. Малые ВВ (sEV), определяемые как связанные с липидами везикулы со средним диаметром <200 нм, обладают способностью преодолевать гематоэнцефалический барьер; следовательно, они были вовлечены в прионоподобное распространение и обострение нейродегенеративных заболеваний и других состояний, таких как болезнь Альцгеймера (БА), лобно-височная деменция (ЛВД), болезнь Паркинсона (БП) и рак 2,3. Кроме того, поскольку sEV можно найти в ряде биожидкостей, таких как кровь, спинномозговая жидкость (СМЖ), слюна и даже моча, их полезное использование может охватывать область биомаркеров и неинвазивной диагностики. Например, исследования болезни Альцгеймера могут указывать на использование соотношений патогенных белков биожидкости, таких как тау/Aβ или даже Aβ42/Aβ404.
Одним из известных грузов sEV является микроРНК (miRNA), группа небольших некодирующих молекул РНК длиной около 22 нуклеотидов, которые связываются с 3'-UTR-областями мРНК и обычно негативно регулируют экспрессию белков. Участвующие во многих клеточных ролях, микроРНК также участвуют в патогенезе различных заболеваний, включая рак и нейродегенеративные заболевания. Cheng et al. провели высокопроизводительный анализ секвенирования сигнатур экспрессии микроРНК sEV, полученных из сыворотки крови, у пациентов с болезнью Альцгеймера5. В сочетании с данными нейровизуализации и известными факторами риска возраста, пола и проявления аллеля APOE ε4 было обнаружено, что результаты предсказывают болезнь Альцгеймера с 87% чувствительностью и 77% специфичностью. Кроме того, исследования выявили две повышенные микроРНК спинномозговой жидкости (miR-151a-3p, let-7f-5p) и 3 подавленные микроРНК (miR-27a-3p, miR-125a-5p и miR-423-5p), которые потенциально могут диагностировать раннюю стадию БП6. При патологических заболеваниях патологический статус может предшествовать определенным характерным симптомам заболеваний, тогда как при нейродегенерации накопление патологических признаков происходит гораздо раньше, чем снижение когнитивных функций.
МикроРНК потенциально являются более эффективным биомаркером, чем белки, благодаря их разнообразным функциям и эпигенетической регуляции более высокого порядка. Используя ткани мозга, исследователи потенциально могут идентифицировать специфические сигнатуры микроРНК sEV (BDsEV) мозга для заболеваний и их подтипов. Например, sEVs с нейрональными и глиальными маркерами могут представлять различный груз микроРНК, и анализ может привести к более точным методам выявления заболеваний. Кроме того, предполагается, что BDsEVs играют большую роль в транссинаптическом распространении нейропатогенных белков7. В предыдущих отчетах предлагалось ультрацентрифугирование с помощью иммунопреципитации и градиента плотности (градиента сахарозы) для получения sEV из свежезамороженной ткани мозга 8,9. Однако эти подходы требуют специфической инфраструктуры с ультрацентрифугами и методами последующей очистки для получения высококачественных образцов sEV10. В более поздних отчетах предлагается несколько модификаций и улучшений подхода 11,12,13; однако, несмотря на это, выделение и изучение микроРНК, полученных из sEV, из тканей человека до сих пор не получили широкого распространения. Подход, описанный в этом протоколе, направлен на предоставление усовершенствованного, пошагового протокола для исследования sEV, полученного из мозга, чтобы повысить доступность этого метода. Мы разработали протокол с использованием минимального количества ткани мозга, из которой мы выделили чистые sEV с помощью эксклюзионной хроматографии и показали высококачественные данные секвенирования нового поколения из груза микроРНК этих sEV.
протокол
Работа была этически одобрена Манчестерским банком мозга (номер REC 09/H0906/52) и комитетом по этике Университета Солфорда (номер заявки: 3408).
1. Расщепление внутриклеточного матрикса с помощью коллагеназы на замороженных срезах ткани мозга
- Тонкими ломтиками нарежьте 250 мг замороженной ткани мозга (фрагменты толщиной около 0,4 мм) с помощью стерилизованного скальпеля на холодной пластине и добавьте 2 мл 75 ЕД/мл раствора коллагеназы типа-III/гиберната-E.
- Инкубируйте каждый образец на водяной бане при температуре 37 °C в течение 20 минут. На 5-минутной отметке переверните каждый образец два раза, чтобы перемешать; В течение 10 минут осторожно пипетируйте каждый образец три раза с помощью пластиковой одноразовой полоски объемом 10 мл.
- Поместите каждый образец на лед и добавьте 1 коктейль ингибиторов протеазы и 1 ингибитор фосфатазы. Это останавливает ферментативную реакцию и является конечной точкой пищеварения с использованием коллагеназы типа III.
- Центрифугируйте каждый образец ткани мозга при 300x g в течение 10 минут при 4 °C. Соберите каждую надосадочную жидкость и далее центрифугируйте при 2000 x g в течение 15 минут при 4 °C.
- Снова соберите каждую надосадочную жидкость и отфильтруйте через фильтр 0,22 мкм. Центрифугируйте каждый фильтрат при давлении 10 000 x g в течение 48 мин при 4 °C.
- Соберите надосадочную жидкость и добавьте буфер осадков в соотношении 2:1 к каждой пробе. Выдерживать в течение ночи при температуре 4 °C.
- Центрифугируйте каждый образец при давлении 10 000 x g в течение 96 мин при 4 °C и ресуспендируйте гранулу в 100 мкл PBS, свободного от внеклеточных везикул (EV).
2. Подготовка колонок эксклюзионной хроматографии
- Перед использованием уравновесьте предварительно подготовленную колонку SEC при комнатной температуре (RT) в течение 15 минут.
ПРИМЕЧАНИЕ: Нижняя крышка должна быть снята до завинчивающейся крышки. - После уравновешивания удалите консервирующий буфер с верхней части колонки и дважды промойте колонку, используя 250 мкл PBS, не содержащего EV. Каждая промывка PBS остается для подачи в колонну под действием силы тяжести.
3. Выделение малых внеклеточных везикул с помощью эксклюзионной хроматографии
- Добавьте ресуспензированную гранулу в верхнюю часть колонны SEC и центрифугируйте колонку при давлении 50 x g в течение 30 с. Откажитесь от проточного потока.
- Добавьте 180 μL PBS без EV в верхнюю часть колонки SEC и центрифугируйте колонку при 50 x g в течение 1 минуты, позволяя полученным из мозга sEV вымываться из колонки.
ПРИМЕЧАНИЕ: Часть протокола, описанная выше, кратко изложена на рисунке 1.
4. Подтверждение маркеров малых внеклеточных везикул методом вестерн-блоттинга
- Для лизиса sEVs перед вестерн-блоттингом (чтобы убедиться в анализе всех мембранных и цитозольных грузов) разведите изолированный образец sEV в соотношении 1:1 в буфере для лизиса и экстракции (1x ингибитор протеазы и 1x ингибитор фосфатазы).
- Взбалтывайте образец при температуре 4 °C в течение 30 минут.
- Центрифуга пробы при 14 000 x g в течение 15 мин.
- Соберите надосадочную жидкость белка и измерьте концентрацию белка с помощью набора для анализа белка.
- Смешайте образцы с 4 буферами Laemmli и загрузите по 20 г белка в каждую лунку по предварительно окрашенной белковой лестнице.
- После рассасывания перенесите белки на нитроцеллюлозную мембрану размером 0,45 мкм. После переноса заблокируйте мембрану на 2 ч в 5% BSA.
- Инкубируйте мембраны с первичными антителами (Таблица 1) в течение ночи.
- Промойте мембрану три раза промывочным буфером (1% Tween20 в PBS) и окрасьте с помощью вторичного антитела против мыши. После этого трижды промойте с помощью буфера для стирки (1% Tween20 в PBS).
- Выполните описанные выше действия, описанные в рукописи, прежде чем делать снимки клякс.
- Изображение с использованием субстрата пероксидазы хрена (HRP).
5. Подтверждение малых внеклеточных везикул с помощью анализа с отслеживанием наночастиц (NTA)
- Выполнение NTA для анализа концентрации и размера всех частиц в образце. Для этого необходимо разбавить каждый образец в PBS с коэффициентом разбавления 1:1000.
- Введите образец в прибор NTA и считайте образец на длине волны 550 нм. На этом этапе используйте количество частиц для измерения количества белка на частицу (обычно выраженного в фемтограмме) в соответствии с рекомендациями MISEV.
- Затем для флуоресцентного NTA разбавляют клеточную маску оранжевым цветом (CMO) (окрашивает все биологические частицы в образце) в PBS с коэффициентом разбавления 1:1000. После этого разбавьте краситель CMO с использованием образца sEV с коэффициентом разбавления 1:10 - Инкубируйте эту стадию разбавления в темноте в течение 30 минут при 4 °C.
- Разбавьте второе разведение CMO с использованием PBS с коэффициентом разбавления 1:1000.
ПРИМЕЧАНИЕ: Окончательное разведение красителя CMO должно составлять 1:10 000 000. - Считывание CMO каждого образца sEV на длине волны 550 нм с помощью прибора NTA.
- Для флуоресцентных антител тетраспанина (см. Таблицу материалов) сначала разбавляют каждое соответствующее антитело в PBS с коэффициентом разведения 1:10. Исходя из этого, разбавьте каждый из красителей с помощью образца sEV с коэффициентом разбавления 1:10 - Инкубируйте стадию разбавления в темноте в течение 2 ч при 4 °C.
- Разбавляют второе разведение антител с помощью PBS с коэффициентом разведения 1:1000.
ПРИМЕЧАНИЕ: Окончательное разведение каждого антитела тетраспанина должно составлять 1:100 000. - Считывание показаний флуоресцентных антител образца sEV на длине волны 550 нм с помощью прибора NTA.
6. Подтверждение малых внеклеточных везикул методом просвечивающей электронной микроскопии (ПЭМ)
ПРИМЕЧАНИЕ: Этот протокол был выполнен Центром биомедицинской микроскопии Ливерпульского университета.
- Во-первых, закрепите образцы sEV с помощью глутарового альдегида и окрасите уранилацетатом.
- С помощью градуированного ряда спиртов обезвожьте образец, готовый к ПЭМ.
- Изображения образцов с помощью подходящего просвечивающего электронного микроскопа.
7. Лечение протеиразой К и РНКазой А
- К 50 мкл выделенных производных из мозга EVs добавьте 1 мкл 20 мкг/мкл протеиназы K и инкубируйте при 37 °C в течение 30 мин.
- Останавливайте каждую реакцию, добавляя 1x коктейль ингибиторов протеиназы и инкубируйте на льду в течение 10 минут.
- После инкубации добавьте 1 мкл 10 мкг/мкл РНКазы А в каждый образец и далее инкубируйте при 37 °C в течение 30 мин.
ПРИМЕЧАНИЕ: Немедленно переходите к разделу 8.
8. Выделение полной РНК из мелких внеклеточных везикул
- Чтобы выделить общую РНК, добавьте 700 мкл высококачественного реагента для лизиса восстановления РНК к 50 мкл образца EV, полученного из мозга (BDsEV). Взбалтывайте каждый образец в течение 1 ч.
- Добавьте 140 μл хлороформа, энергично встряхните каждый образец в течение 20 секунд и оставьте инкубироваться при RT на 3 минуты.
- Центрифугируйте образец при 12 000 x g в течение 15 минут при 4 °C и соберите промежуточную фазу из образца. Добавьте в 1,5 раза больше 100% этанола.
- Добавьте 700 мкл интерфазы/смеси этанола, колонки для выделения РНК и центрифугуйте при ≥8000 x g в течение 15 с при RT.
ПРИМЕЧАНИЕ: Повторите этот шаг, используя все образцы интерфазы/этанола. - В колонку добавьте 700 μл промывочного буфера и центрифугуйте при ≥8000 x g в течение 15 с. Откажитесь от проточного потока.
- Добавьте 500 μл буферного RPE и снова центрифугируйте при ≥8000 x g в течение 15 с. Откажитесь от проточного потока.
- Добавьте 500 μл 80% этанола и центрифугируйте при ≥8000 x g в течение 2 минут. Откажитесь от проточного потока.
- На этом этапе высушите мембрану колонны, центрифугируя колонны на полной скорости (>8000 x g) в течение 5 минут при открытой крышке.
- Перенесите колонку в новую пробирку для сбора, добавьте 14 μL воды, не содержащей РНКазы, непосредственно в мембрану колонки и центрифугируйте при ≥8000 x g в течение 1 минуты для элюирования общей РНК из BDsEVs.
- Количественно оценивайте общее количество микроРНК с образцами с помощью набора для количественного анализа микроРНК, где образцы измеряли на флуориметре количественного анализа, выбирая тип анализа микроРНК.
9. Секвенирование малых РНК
- После количественного определения микроРНК в образце синтезируйте библиотеку кДНК с помощью набора для подготовки библиотеки малых РНК-Seq.
Примечание: При использовании этого протокола создание библиотеки включало четыре этапа: 3'-лигирование адаптера, очистка, 5'-лигирование адаптера и обратная транскрипция, где, в конечном итоге, формируется библиотека РНК/кДНК. После генерации библиотеки происходит апплификация ПЦР в конечной точке с добавлением индексных праймеров (используемых для мультиплексирования), после чего образцы очищаются. - Чтобы проверить качество РНК, используйте прикладной анализ для контроля качества с подробным описанием размера каждого препарата и пиковой интенсивности.
- Чтобы проверить концентрацию ДНК, измерьте количественное определение ДНК на флюориметре количественного анализа, выбрав тип анализа дцДНК.
- Подготовьте образцы для секвенирования малых РНК с помощью набора реагентов, после чего образцы загружаются в проточную ячейку.
Результаты
Чтобы подтвердить наличие BDsEVs, были использованы три метода: вестерн-блоттинг, NTA и TEM (рис. 3). Результаты вестерн-блоттинга (Рисунок 3A и Дополнительный файл 1) показывают наличие всех пяти положительных маркеров (CD9, CD63, CD81, Flot-1 и TSG101) и отсутствие Calnexin в sEVs (используемых в качестве отрицательного контроля), что подтверждает отсутствие загрязнения клеточным содержимым. Как и ожидалось, гомогенаты мозга (BH) показывают больше белка, чем наблюдалось в sEV для тестируемых маркеров. Изображения ПЭМ подтвердили морфологию BDsEV и их относительный размер в образце (рисунок 3B), что было дополнительно подтверждено анализом отслеживания наночастиц (рисунок 3C).
На рисунке 3C (верхняя панель) показаны размеры изолированных частиц в диапазоне 50-200 нм. Исходя из данных NTA, принимая результат рассеяния как 100% представленных частиц, CMO предполагает, что около 52,35% частиц (рис. 3C, нижняя панель) имеют липидный бислой. Из этих КМО-окрашенных частиц 34,66% содержали CD9, 15,49% — CD63 и 12,01% — CD81. Данные по контролю NTA см. в дополнительном файле 2 .
Данные количественного определения выделенной РНК (Таблица 2) показывают уровни в диапазоне от 3,24 до 8,76 (нг/мкл), значения, которые были нормализованы при создании библиотек кДНК. Результаты анализа TapeStation (Рисунок 4) показывают основные пики около 120-160.о., с меньшими пиками ниже этого значения около 50.о. и другими меньшими пиками, которые выше около 484.о.
Проверка качества данных секвенирования следующего поколения показывает очень высокое качество чтения после обрезки адаптера (рис. 5A). Все позиции последовательностей показывают показатель Phred >30, что указывает на частоту ошибок менее 1 на 1000 нуклеотидов. На рисунке 5B показано, что большинство последовательностей имеют длину около 21-22.н., что соответствует ожидаемому диапазону размеров микроРНК. Путем дальнейшего картирования (с использованием BowTie2) с использованием биоинструмента анализа флагстата Samtools из 1 304 100 выровненных последовательностей 1 116 264 (85%) были картированы на участки микроРНК в геноме человека (сборка hg38; Таблица 3).
Из общего числа микроРНК 808 микроРНК экспрессировались во всех 3 образцах, при этом 344 микроРНК были общими для всех трех образцов (~43%), 5 — для контроля 1 и контроля 2, 183 — для контроля 1 и контроля 3 и 16 — для контроля 2 и контроля 3 (рис. 6). Согласно этим данным, наиболее высоко экспрессируемыми микроРНК у всех трех BDsEV являются has-let-7b-5p, has-miR-143-3p, has-miR-30a-5p, has-miR-221-3p и has-let7i-5p. Аналогичным образом, в топ-5 наименее дифференциально экспрессируемых микроРНК в образцах BDsEVs (читается >10) являются has-miR-128-2-5p, has-miR-182-5p, has-miR-193b-5p, has-miR-448 и has-miR-505-3p. Все исходные и нормализованные счетчики прочтений приведены в дополнительном файле 3.

Рисунок 1: Рабочий процесс обработки тканей. На рисунке показан поэтапный процесс выделения полученных из мозга sEV (BDsEVs) из свежезамороженных срезов мозга с помощью эксклюзионной хроматографии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Рабочий процесс выделения РНК из BDsEV. На рисунке показан поэтапный процесс выделения общей РНК из BDsEVs, включая этап предварительной обработки по удалению любой внеклеточной РНК с использованием протеиназы К и РНКазы А. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
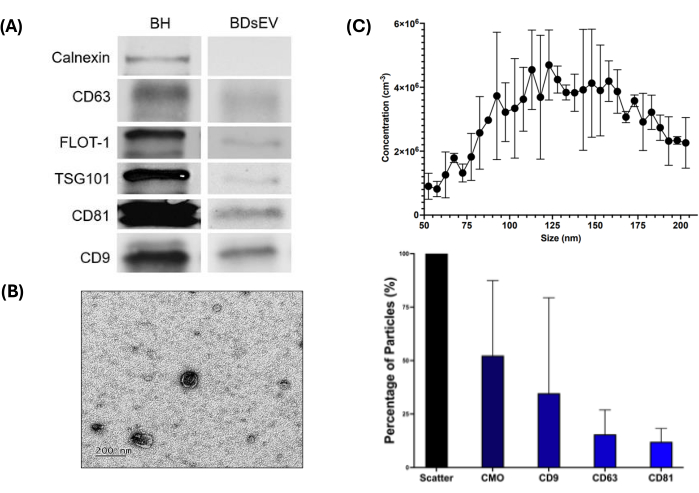
Рисунок 3: Рабочий процесс определения характеристик BDsEV. На рисунке показаны различные методы определения характеристик BDsEV. (A) Вестерн-блоттинг для обнаружения маркеров белка, специфичных для sEV. BH Гомогенат мозга. Кальнексин является отрицательным контролем для sEVs - отсутствие в sEV и присутствие в BH подтверждает чистоту образца sEV. Что касается других маркеров, как и ожидалось, количество белка в BH выше, чем в образцах sEV (20 мкг белка загружено в лунку). (B) Репрезентативное изображение просвечивающей электронной микроскопии (ПЭМ) для BDsEV в масштабе 200 μM, подтверждающее ожидаемую морфологию с липидной бислойной мембраной. (C) График распределения по размерам для анализа отслеживания наночастиц (NTA) для всех частиц (верхняя панель). Каждая точка данных представляет собой вариацию в трех репликациях. Нормализованные пропорции для биологических частиц (sEVs) и относительные пропорции для удельных поверхностных маркеров (нижняя панель) (данные показаны как среднее значение ± SEM для тройных лунок (n = 3)). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Проверка качества подготовки библиотеки кДНК. Анализ ленточных станций для отдельных образцов после подготовки библиотеки кДНК. Пики, отображаемые на каждом графике, отображают размер каждого препарата (горизонтальная ось, в.н.) и соответствующую интенсивность каждого пика (вертикальная ось, FU). Ожидаемый пик малой библиотеки РНК составляет около 120-160.о., как видно на рисунке. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Проверка качества секвенирования miRnome. (A) График FASTQC для качества считывания отдельных образцов после обрезки адаптера. Горизонтальная ось предназначена для положения нуклеотидов, а вертикальная ось — для баллов Phred. Ящичковые диаграммы для каждой позиции показывают распределение показателя Phred по всем чтениям для каждой позиции. Все распределения в пределах «зеленой зоны» подтверждают очень высокое качество данных (>Q30), что предполагает высококачественную пробоподготовку. (B) Распределение длины последовательности для каждого образца показывает, что для всех трех образцов большинство прочтений было около 21-22 нуклеотидов - ожидаемый диапазон размеров для микроРНК. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Перекрытие экспрессии микроРНК во всех образцах. Количество микроРНК, обнаруженных в каждом образце (количество прочтений ≥ 10) и конкретных микроРНК, общих для более чем одного образца, показано на диаграмме Венна. Все необработанные и нормализованные чтения показаны в дополнительном файле 3. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Эпитоп антител | Коэффициент разведения антител |
| Мышь Anti-CD9 | 1:2000 |
| Мышь Anti-CD63 | 1:2000 |
| Мышь Anti-CD81 | 1:2000 |
| Мышь Антифлотилин 1 | 1:2000 |
| Мышь Anti-TSG101 | 1:1000 |
| Мышиный антикальнексин | 1:10 000 |
| Вторичное антитело против мыши | 1:3000 |
Таблица 1: Эпитопы антител, используемые для определения характеристик BDsEV и их соответствующих коэффициентов разведения.
| Образец | Концентрация микроРНК (нг/мкл) |
| 1 | 8.76 |
| 2 | 3.24 |
| 3 | 5.33 |
Таблица 2: Данные количественного определения выделенной РНК.
| Образец | Выровненные последовательности | Картированная микроРНК | Процент (%) |
| Контрольный образец 1 | 1 444 665 | 1 133 437 | 78.46 |
| Контрольный образец 2 | 442 808 | 381 631 | 86.18 |
| Контрольный образец 3 | 2 024 828 | 1 983 726 | 97.97 |
| Средний | 1 304 100.33 | 1 166 264.67 | 89.43 |
Таблица 3: Количество выровненных и успешно картированных последовательностей микроРНК.
Дополнительный файл 1: Дополнительные данные анализа вестерн-блоттинга. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2: Дополнительные контрольные данные NTA. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 3: Исходные и нормализованные данные анализа экспрессии микроРНК. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 4: Дополнительные данные о концентрации белка. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Этот модифицированный и улучшенный протокол выделения малых внеклеточных везикул мозга и их микроРНК демонстрирует возможность использования минимального количества ткани без ущерба для качества и количества продуктов на последующих этапах. В области открытия биомаркеров идентификация молекулярных идентификаторов, специфичных для типов клеток и тканей, может привести к более доступным средствам неинвазивных диагностических тестов с использованием жидкостей организма. Кроме того, описанный здесь подход обеспечивает основу для идентификации специфических субпопуляций sEV в различных типах клеток (нейронных и глиальных), типах тканей (ткань гиппокампа против ткани префронтальной коры) и биожидкостях, что обеспечит более глубокое понимание сигнатур груза, патофизиологии и степени заболевания. Ранее в работе Vella et al. было высказано предположение, что для выделения BDsEV следует использовать от 450 мг до 1 г в сочетании с ультрацентрифугированием с градиентом плотности (с использованием скоростей до 180 000 x g)8. В этой методологии sEV были успешно выделены с использованием меньших количеств (снижение на >50%) свежезамороженных образцов ткани мозга (250-450 мг). Уменьшение количества мозговой ткани, используемой для выделения sEV, приводит к снижению затрат и расходных материалов. Кроме того, протокол стал более доступным благодаря применению SEC в сочетании с высокоскоростным центрифугированием (10 000 x g) вместо ультрацентрифугирования (180 000 x g).
Используя fNTA и TEM, мы установили, что профиль диапазона размеров sEVs находится в характерном диапазоне размеров 30-200 нм, как рекомендовано в рекомендациях MISEV 13,14, при этом TEM обеспечивает морфологическое подтверждение полученных sEVs. Как показано на рисунке 3C и в дополнительном файле 4, >87% частиц имеют диапазон размеров <250 нм, а образцы в среднем показывают 10,56 fg белка/BDsEV. Конкретные виды малых внеклеточных везикул различаются по размеру и форме, при этом характерно более мелкие субпопуляции, такие как экзосомы, имеют однородную морфологию по сравнению с микровезикулами, которые, как говорят, имеют неправильную структуру из-за своей природы биогенеза. Для fNTA были получены показания рассеяния (520 нм) для анализа общего количества частиц в образцах, что позволило получить подробную информацию о профиле размера и концентрациях. Показания показывают, что более 50% частиц были биологическими (за счет окрашивания CMO), при этом популяции биологических частиц, которые попадают в диапазон размеров sEV, демонстрируют маркеры тетраспанина, причем CD9 является наиболее преобладающим в наших контрольных образцах (34,66%). В то время как при вестерн-блоттинге наличие характерных мембран и цитозольных белковых грузов свидетельствовало о присутствии sEV, а отсутствие кальнексина подтверждало, что BDsEV не содержат какого-либо клеточного загрязнения. Чтобы дополнительно убедиться в том, что микроРНК, доступные для последующей обработки, являются частью груза sEV (а не другой внеклеточной РНК), мы обрабатывали sEVs ферментами протеиназы К и РНКазы А перед разрушением мембран sEV для деградации любого белка и РНК, которые внешне присутствовали во внеклеточном пространстве за пределами BDsEVs16.
Общая РНК была выделена из sEVs и подготовлена для последующих применений, таких как qRT-PCR и секвенирование нового поколения (для малых РНК). Стандартные проверки с использованием анализов контроля качества показали высокое качество образцов и библиотек кДНК, готовых к секвенированию. Пик в библиотеках кДНК составляет около 120-160.н., что связано с пиками кДНК, полученными из микроРНК, с последовательностями адаптеров различной длины, при этом любые меньшие пики потенциально представляют собой димеры адаптеров.
Анализ данных секвенирования нового поколения с использованием FASTQC и CutAdapt показывает высококачественные результаты, полученные от микроРНК BDsEV. Как показано на рисунке 5, каждая считанная позиция имеет оценку Q выше 30 (Q30), что указывает на вероятность ошибки 0,001-0,0001 (1 из 1000-10 000). Кроме того, анализ распределения длины последовательности (рис. 6) показывает, что преобладающие пики попадают в характерный диапазон микроРНК (19-25.н.), что свидетельствует о высоком качестве и специфичности полученных данных.
Многие будущие исследования выиграют от этого метода из-за его улучшенной доступности, а также экономии затрат и ресурсов за счет сокращения не только количества образцов ткани, но и экономии на стоимости реагентов. Уменьшение (>50%) необходимого количества ткани делает этот метод еще и более этичным. В соответствии с глобальными усилиями в области точной медицины, улучшенный рабочий процесс, описанный здесь, предоставляет сравнительно более доступные инструменты для получения точных биомаркеров, специфичных для типа клеток, с помощью неинвазивных (или минимально инвазивных) маршрутов с использованием BDsEV и их грузов. Это может быть использовано для широкого спектра неврологических заболеваний. Возможное ограничение этого метода заключается в том, что протокол потребует корректировки, если исследователи хотят использовать ткань, отличную от человеческого мозга, для выделения sEV. В долгосрочной перспективе этот усовершенствованный метод сделает неинвазивный, тканеспецифичный поиск и валидацию биомаркеров более справедливыми и доступными во всем мире.
Раскрытие информации
Ни у кого из авторов нет конфликта интересов.
Благодарности
Эта работа была профинансирована аспирантурой Джозефа Моргана из Общества Альцгеймера в Великобритании (грант No 549/SERA-52) и фондами инновационной стратегии Университета Солфорда (грант SEFA-39). Мозговая ткань была получена из Манчестерского банка мозга (REC Reference 09/H0906/52) сети «Мозги для лечения деменции».
Материалы
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin | Merck | A9418-100G | |
| Cell Mask Orange Plasma Membrane Stain | ThermoFisher Scientific | C10045 | |
| Collagenase Type-III | StemCell Technologies | 07422 | |
| ExoSpin Columns and Buffer | Cell Guidance Systems Ltd. | EX01-50 | This kit contains SEC columns used in this experiment, precipitation buffer and EV free PBS. |
| Halt Protease Inhibitor Cocktail (100x) | ThermoFisher Scientific | 78429 | |
| Hibernate-E Medium | ThermoFisher Scientific | A1247601 | |
| Laemmli Sample Buffer (4x) | BioRad | 1610747 | |
| Lexogen Small RNA-Seq Library Prep Kit | Lexogen | 052.24 | This kit contains Small RNA preparation reagent box with i7 Index primer plate. |
| miRNeasy Micro Kit (50) | Qiagen | 217084 | This kit contains high-quality RNA recovery lysis reagent (Qiazol), RNA isolation columns, isolation buffers (RWT, RPE) and RNase free water. |
| MiSeq Reagent Kit v3 | Illumina | MS-102-3001 | This is the Illumina Preparation Kit |
| Nitrocellulose Membrane, 0.45 μm | ThermoFisher Scientific | 88018 | |
| PE/Dazzle 594 anti-human CD63 Antibody | BioLegend | 143914 | Used for fNTA Analysis |
| PE/Dazzle 594 anti-human CD81 Antibody | BioLegend | 349520 | Used for fNTA Analysis |
| PE/Dazzle 594 anti-human CD9 Antibody | BioLegend | 312118 | Used for fNTA Analysis |
| PhosSTOP | Merck | 4906845001 | |
| Pierce BCA Protein Assay Kit | ThermoFisher Scientific | 23225 | |
| Proteinase K | ThermoFisher Scientific | 25530049 | |
| Qubit microRNA Assay Kit | ThermoFisher Scientific | Q32880 | |
| Qubit 1X dsDNA HS assay kit | ThermoFisher Scientific | Q33230 | |
| Qubit 3.0 Fluorometer | ThermoFisher Scientific | Q33216 | |
| RIPA Lysis and Extraction Buffer | ThermoFisher Scientific | 89901 | |
| RNase A | ThermoFisher Scientific | EN0531 | |
| SuperSignal West Femto Maximum Sensitivity Substrate | ThermoFisher Scientific | 34094 |
Ссылки
- Jia, Y., et al. Small extracellular vesicles isolation and separation: Current techniques, pending questions and clinical applications. Theranostics. 12 (15), 6548-6575 (2022).
- Fornari, S., Schäfer, A., Jucker, M., Goriely, A., Kuhl, E. Prion-like spreading of Alzheimer's disease within the brain's connectome. J R Soc Interface. 16 (159), 20190356(2019).
- Zhang, P., et al. Tumor-derived small extracellular vesicles in cancer invasion and metastasis: molecular mechanisms, and clinical significance. Mol Cancer. 23 (1), 18(2024).
- Constantinides, V., et al. CSF Aβ42 and Aβ42/ Aβ40 ratio in Alzheimer's disease and frontotemporal dementia. Diagnostics. 13 (4), 783(2023).
- Cheng, L., et al. Prognostic serum miRNA biomarkers associated with Alzheimer's disease shows concordance with neuropsychological and neuroimaging assessment. Mol Psychiatry. 20 (10), 1188-1196 (2015).
- Roser, A. E., Caldi Gomes, L., Schünemann, J., Maass, F., Lingor, P. Circulating miRNAs as diagnostic biomarkers for Parkinson's disease. Front Neurosci. 12, 625(2018).
- Jackson, N., Guerrero-Muñoz, M. J., Castillo-Carranza, D. L. The prion-like transmission of tau oligomers via exosomes. Front Aging Neurosci. 14, 974414(2022).
- Vella, L., et al. A rigorous method to enrich for exosomes from brain tissue. J Extracell Vesicles. 6 (1), 1348885(2017).
- Yousif, G., Qadri, S., Parray, A., Akhthar, N., Shuaib, A., Haik, Y. Exosomes derived neuronal markers: Immunoaffinity isolation and characterization. Neuromolecular Med. 24 (3), 339-351 (2022).
- Kumar, K., et al. Recent advances in microfluidic approaches for the isolation and detection of exosomes. TRAC-Trend Anal Chem. 159, 116912(2023).
- Ransom, L., et al. Human brain small extracellular vesicles contain selectively packaged, full-length mRNA. Cell Rep. 43 (4), 114061(2024).
- Gomes, P., et al. A novel isolation method for spontaneously released extracellular vesicles from brain tissue and its implication for stress-driven brain pathology. Cell Commun Signal. 21 (1), 35(2023).
- Welsh, J., et al. Minimal information for studies of extracellular vesicles (MISEV 2023): From basic to advanced approaches. J Extracell Vesicles. 13 (2), e12404(2023).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J Extracell Vesicles. 7 (1), 1535750(2018).
- Pirisinu, M. The long journey of extracellular vesicles towards global scientific acclamation. Adv Pharm Bull. 13 (3), 489-501 (2023).
- Bender, A., Sullivan, B. P., Lillis, L., Posner, J. D. Enzymatic and chemical-based methods to inactivate endogenous blood ribonucleases for nucleic acid diagnostics. J Mol Diagn. 22 (8), 1030-1040 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены