Method Article
Простой, быстрый и эффективный метод анализа ксенотрансплантации опухолей у прозрачных эмбрионов рыбок данио
В этой статье
Резюме
Мы описываем протокол ксенотрансплантации в желток прозрачных эмбрионов данио-рерио, который оптимизируется с помощью простого и быстрого метода стадирования. Постинъекционный анализ включает в себя выживаемость и оценку бремени болезни ксенотрансплантированных клеток с помощью проточной цитометрии.
Аннотация
Исследования поведения опухоли in vivo являются одним из основных элементов исследований рака; Тем не менее, использование мышей сопряжено со значительными проблемами с точки зрения затрат и времени. Здесь мы представляем личинок данио-рерио в качестве модели для трансплантации, которая имеет множество преимуществ по сравнению с мышиными моделями, включая простоту в обращении, низкую стоимость и короткую продолжительность эксперимента. Более того, отсутствие адаптивной иммунной системы на личиночной стадии избавляет от необходимости генерировать и использовать иммунодефицитные штаммы. Несмотря на то, что существуют установленные протоколы ксенотрансплантации эмбрионов рыбок данио, мы представляем здесь усовершенствованный метод, включающий стадирование эмбрионов для более быстрого переноса, анализ выживаемости и использование проточной цитометрии для оценки бремени заболевания. Эмбрионы стадируются для обеспечения быстрой инъекции клеток в желток личинок и маркировки клеток для контроля консистенции вводимого клеточного болюса. После инъекции анализ выживаемости эмбрионов оценивается в течение 7 дней после инъекции (dpi). Наконец, бремя болезни также оценивается путем маркировки перенесенных клеток флуоресцентным белком и анализа с помощью проточной цитометрии. Проточная цитометрия стала возможной благодаря стандартизированному методу получения клеточных суспензий из эмбрионов рыбок данио, которые также могут быть использованы для создания первичной культуры клеток рыбок данио. Таким образом, описанная здесь процедура позволяет более быстро оценить поведение опухолевых клеток in vivo с большим числом животных на исследуемую группу и более экономически эффективным способом.
Введение
Анализ поведения опухолей в ответ на генетические изменения или медикаментозное лечение in vivo является важным элементом исследования рака 1,2,3,4. В таких исследованиях чаще всего используются модели мышей с ослабленным иммунитетом (Mus musculus)5; Тем не менее, исследования ксенотрансплантации на мышах ограничены во многих отношениях, включая ограниченные возможности, увеличенную продолжительность, значительную стоимость и потребность в сложном оборудовании для визуализации для мониторинга прогрессирования внутренних опухолей 6,7. В отличие от этого, модель рыбок данио (Danio rerio) обеспечивает большую емкость, более короткую продолжительность, меньшие затраты и, благодаря своей прозрачности, простой мониторинг прогрессирования заболевания 8,9.
Данио-рерио представляет собой хорошо развитую модельную систему позвоночных с внутриутробным развитием и высокой плодовитостью, при этом отдельные самки производят более100 эмбрионов10. Кроме того, эмбрионы рыбок данио прозрачны, что позволяет легко визуализировать процессы развития с помощью методов, связанных с флуоресценцией, таких как репортеры. Наконец, сохранение критических процессов развития делает их идеальной моделью для многих типов исследований, включая поведение трансплантированных злокачественныхклеток. Эмбрионы рыбок данио дикого типа развивают меланоциты, которые делают их оптически непрозрачными к 2-недельному возрасту, но это было преодолено за счет генерации эмбрионов каспера (roya9; mitfaw2), которые остаются прозрачными на протяжении всей жизни13. Благодаря своим оптическим свойствам, рыбки данио являются идеальными реципиентами трансплантированных опухолевых клеток 14,15,16. Ксенотрансплантация опухолевых клеток рыбкам данио приобрела значение в последние 2 десятилетия 17,18,19,20,21. Эмбрионы рыбок данио обладают врожденным иммунитетом; Тем не менее, у них отсутствует адаптивный иммунитет на личиночной стадии, что делает их функционально ослабленными, что позволяет им служить эффективными хозяевами для трансплантированных опухолевых ксенотрансплантатов22.
Были разработаны протоколы приживления опухолей у эмбрионов рыбок данио, а также у взрослых особей, которые учитывали ряд различных переменных 23,24,25,26,27. Они исследовали многочисленные участки отложения опухолей у рыбок данио, включая инъекции в желток, перивителлиновое пространство и сердце, а также на разных стадиях развития 16,28. Температура окружающей среды в аквакультуре для ксенотрансплантатов данио-рерио также важна, поскольку выращивание рыбок данио обычно происходит при 28 °C, в то время как клетки млекопитающих растут при 37 °C. Следовательно, должна быть использована компромиссная температура, которая хорошо переносится рыбами, но способствует росту опухоли, и 34 °C, по-видимому, достигает обеих целей. Анализ поведения и прогрессирования опухолей после ксенотрансплантации является еще одной важной областью внимания, и это включает в себя использование различных методов визуализации, атакже анализ выживаемости. Одним из основных преимуществ модели рыбок данио является наличие большого количества исследуемых животных, что обеспечивает огромную статистическую мощность для исследований поведения опухолей in vivo; Однако предыдущие подходы сильно ограничивали этот потенциал из-за необходимости утомительных процедур монтажа для инъекций.
В данной работе мы устраняем это ограничение, разрабатывая простой и быстрый метод определения стадии эмбрионов, который обеспечивает высокую производительность и контроль качества инъекций с использованием прозрачной линии casper данио-рерио. Это влечет за собой введение ксенотрансплантатов в желточный мешок эмбрионов каспера данио-рерио через 2 дня после оплодотворения (DPF). Мы наблюдаем за выживаемостью эмбрионов после ксенотрансплантации в рамках анализа поведения опухоли. Кроме того, мы показываем оценку бремени болезни после ксенотрансплантации путем создания суспензий одиночных клеток и анализа с помощью проточной цитометрии (рис. 1).
протокол
Содержание, кормление и разведение рыбок данио-рерио происходило в стандартных условиях аквакультуры при температуре 28,5 °C, как описано31. Все эксперименты, связанные с рыбками данио, проводились при этой температуре; однако после ксенотрансплантации животных культивировали при температуре 34 °C в течение всего эксперимента в соответствии с процедурами, утвержденными Комитетом по институциональному уходу за животными и их использованию (IACUC).
1. Разведение (за 3 дня до инъекции)
- Обеспечьте сухими кормами (дополнительный корм; 5-6 гранул на рыбу) пары рыб за неделю до размножения, чтобы максимизировать здоровье животных и увеличить количество эмбрионов, производимых размножающимися парами.
- Вечером накануне сбора эмбрионов установите племенных животных в аквариумах для разведения с разделителем, разделяющим самцов и самок рыб, используя гаремные спаривания по 2 самки для каждого самца.
ПРИМЕЧАНИЕ: Для экспериментов с 4 руками по 100 животных в каждой руке используйте 20 племенных пар в каждом эксперименте. Чтобы определить необходимое количество размножающихся пар, хорошей оценкой является 50 эмбрионов на одну размножающуюся пару. Другой вариант заключается в использовании более прочного, пигментированного штамма данио-рерио и обработке 1-фенил2-тиомочевиной (PTU) для предотвращения пигментации31. На практике эксперимент должен быть масштабирован таким образом, чтобы у одного из них было достаточно эмбрионов для введения в два раза большего количества эмбрионов через 1 день после инъекции (dpi).
2. Забор эмбрионов (за 2 дня до инъекции)
- На следующее утро снимите перегородки, позволив рыбкам размножаться.
- Визуализируйте эмбрионы в резервуарах через 20 минут (мин) после удаления разделителей.
- Соберите эмбрионы с помощью сита в чашке Петри диаметром 90 мм с водой для эмбрионов, приготовленной, как описано в Книге31 «Данио-рерио».
- Чтобы приготовить зародышевую воду, добавьте 1,5 мл исходных солей в 1 л дистиллированной воды и метиленовый синий до 0,1% конечных. Приготовьте исходный раствор соли, растворив 40 г морской соли (Таблица материалов) в 1 л дистиллированной воды. Ионный состав зародышевой воды выглядит следующим образом: K+ (0,68 мг/л), Cl− (31,86 мг/л), Na+ (17,77 мг/л), SO4− (4,47 мг/л), Mg2+ (2,14 мг/л) и Ca2+ (0,68 мг/л).
- Дайте рыбкам данио размножиться в течение лишнего часа и соберите полученные эмбрионы.
- Объедините эмбрионы для эксперимента.
- Вечером удалите все неоплодотворенные или мертвые эмбрионы, которые можно узнать по их аномальной морфологии, и обеспечьте свежую воду для эмбрионов.
3. Поддержание эмбриона и подготовка инструмента к инъекциям (за 1 сутки до инъекции)
- На следующее утро удалите все дополнительные мертвые эмбрионы и дайте свежую воду для эмбрионов.
- Приготовьте агарозную пластину, нагрев 1,5% агарозу в зародышевой воде и вылейте подогретую смесь в 90-миллиметровую пластину Петри. На одну чашку диаметром 90 мм требуется 30-35 мл смеси.
- Вытяните нефиламентные иглы из стеклянных капилляров (боросиликат) с помощью съемника игл. Иглы вытягиваются (под тепловым давлением) с образованием закрытого конца; Зафиксируйте их щипцами, чтобы создать оптимальное отверстие. Оцените пригодность отверстия иглы, определив объем вытесняемой жидкости в единицу времени (см. ниже, раздел 6.3).
ПРИМЕЧАНИЕ: Стеклянные капилляры можно приобрести с центральными нитями накала или без них. Капилляры с отсутствующими центральными филаментами предпочтительны для клеточных инъекций. - Поместите иглы в закрытую 90-миллиметровую пластину Петри в углубления, сделанные из глины (детский пластилин) до использования (рисунок 2А).
4. Подготовка и мечение клеток лейкемии с помощью CM-Dil (день инъекции)
- Поддерживайте клетки, подлежащие трансплантации, в условиях, оптимальных для их роста. Использованных здесь клеток мышиной лейкемии было либо достаточно (M82; Rpl22+/+) или с недостатком (M109; Rpl22-/-) для рибосомального белка Rpl22, который функционирует как супрессор опухолей32.
- Пеллетные ячейки в конической пробирке объемом 50 мл. Подсчитайте, затем центрифугируйте при 300 x g при комнатной температуре (RT) в течение 5 минут. Выбросьте надосадочную жидкость.
Примечание: Количество необходимых клеток будет продиктовано масштабом эксперимента и условиями, но 1 x 106 клеток является хорошей отправной точкой. - Выполнить окрашивание CM-Dil
ПРИМЕЧАНИЕ: Окрашивание CM-Dil позволяет контролировать инъекционный болюс.- Приготовьте стоковый раствор CM-Dil, повторно суспендируя флакон 50 мкг CM-Dil в 50 мкл диметилсульфоксида (ДМСО; 1 мг/мл или ~1 мМ конечный).
- Получите рабочий раствор, разбавив бульон (4,8 мкл красителя/мл) в 1% фетальной бычьей сыворотке (FBS)/сбалансированном солевом растворе Хэнка (HBSS), содержащем любые вспомогательные добавки, необходимые используемым клеткам.
- Ресуспендируйте клетки в дозе 1 х 106/100 мкл в рабочем растворе красителя.
- Выдерживать при температуре 37 °C в течение 10 минут.
ПРИМЕЧАНИЕ: Условия окрашивания должны быть оптимизированы для используемых ячеек (время и т.д.). Для достижения оптимального окрашивания использованных здесь клеток потребовалось две отдельные 10-минутные инкубации при разных температурах. - Умойтесь 10 мл 1x HBSS при комнатной температуре (RT).
- Пеллетные ячейки (центрифугирование при 300 x g в течение 5 мин при RT), сцедите надосадочную жидкость, затем повторно суспендируйте 10 мл HBSS и повторите то же самое для второй промывки.
- Ресуспендируйте окрашенные опухолевые клетки при концентрации 40 000 клеток/мкл в 1% FBS/PBS и любых необходимых вспомогательных добавках и поддерживайте клеточную суспензию при 34 °C до инъекции.
Примечание: Для поддержания клеточных линий, используемых в этом исследовании, требовались поддерживающие добавки (например, 1% FBS и цитокины). Добавки и ксенотрансплантацию может потребоваться адаптировать к конкретным изучаемым клеточным линиям. Здесь был выбран PBS, а не среда, чтобы избежать любой потенциальной токсичности в желтке.
5. Дехорионация
- Дехорионате эмбрионов каспера данио-рерио вручную при 2 dpf с помощью инсулиновых инъекционных шприцев с 2-кратным увеличением в световом микроскопе. Проткните хорион одной иглой, в то время как другой иглой обездвижите хорион.
ПРИМЕЧАНИЕ: Использование проназы для лечения дехорионации не рекомендуется, потому что иногда это приводит к ухудшению здоровья эмбриона. Дехорионизация эмбрионов при 2 dpf предпочтительнее, потому что это проще, и эмбрионы менее хрупкие, чем в более ранние сроки (1 dpf). - Во время дехорионации будьте осторожны, чтобы не прикасаться иглами к эмбрионам. Прикосновение или повреждение желтка эмбрионов при непреднамеренном контакте с иглами может привести к смерти.
- Удалите очищенные хорионы, изменив воду для эмбриона.
6. Настройка микроинъектора и иглы
- Включите микроинъектор и насос и настройте условия, подходящие для микроинъекций клеток. Давление впрыска 9-11 фунтов на квадратный дюйм и время впрыска 0,5 секунды (с) являются хорошей отправной точкой для зажима иглы и установки отверстия.
- Осторожно загрузите суспензию опухолевой клеточной линии (~5 μл) в микроиглу за один проход, не допуская образования пузырьков воздуха, которые нарушат клеточный поток внутри иглы.
- Разрежьте конец иглы щипцами (Дюмон No 5), чтобы получить отверстие, которое будет поддерживать выброс 10-15 нанолитров (нл) клеточной суспензии за 0,2-0,3 с.
ПРИМЕЧАНИЕ: Приведенный выше расчет объема нл производится с помощью калибровочных капилляров, где 1 мм = 30 нл. Вкратце, установите время на 0,5 с, и после каждого зажима иглы нажимайте кнопку инъекции и собирайте объем в калибровочном капилляре. Затем с помощью шкалы под микроскопом измеряют длину собранного объема, а при введении 30 нл за 0,5 с прекращают клипсирование иглы. Затем установите время инъекций 0,2-0,3 с. (введение ~10-15 нл клеток)
7. Подготовка эмбриона к инъекциям
- Отбирайте здоровые эмбрионы под микроскопом, отбраковывая любые с аномалиями развития, такими как отек сердца или короткий или изогнутый ствол.
- Обезболите эмбрионы с помощью трикаина метансульфоната (MS-222; 0,16 г/л эмбриональной воды) в течение 1 минуты в 90 мм пластине Петри.
- Используйте стеклянную пипетку Пастера, чтобы забрать эмбрионы. Расположите 10-15 эмбрионов в боковом положении на пластине с 1,5% агарозой (рисунок 2B-D).
- Удалите лишнюю воду с помощью пипетки Пастера, оставив минимальное количество воды для эмбрионов, необходимое для поддержания жизни эмбрионов.
8. Процедура инъекции
- Проверьте под световым микроскопом, чтобы убедиться, что клетки скопились на кончике иглы.
- Вводят эмбрионы с помощью калиброванной иглы в течение 0,2-0,3 с (при этом 10-15 нл соответствует 400-600 клеткам) в желток эмбрионов.
- Повторите инъекцию для всех эмбрионов, затем соберите их в свежую воду для эмбрионов.
ПРИМЕЧАНИЕ: Поскольку клетки имеют тенденцию накапливаться на кончике иглы, кончик нужно будет немного откидывать каждые 15-20 инъекций. Это также потребует сброса давления и времени при каждом повторном зажиме, чтобы обеспечить впрыскивание аналогичного объема. - Чтобы убедиться в правильности сравнения поведения двух различных наборов переносимых клеток, контролируйте болюс переданных клеток. Это достигается путем сортировки эмбрионов на основе окрашивания CM-Dil (в канале RFP) через 1 час после инъекции (hpi), отделяя эмбрионы с оптимальным окрашиванием («хороший болюс») от эмбрионов с более низким окрашиванием («нижний болюс»; Рисунок 3, желтая стрелка).
- Отбракуйте эмбрионы с более низким болюсом или используйте их для оценки влияния другой дозы клеток на прогрессирование заболевания.
- Удалите все мертвые эмбрионы к концу дня, так как их смерть связана с инъекционной травмой, а не с ростом опухоли. Удалите из анализа эмбрионы, которые не сохраняют клетки, так как клетки, вероятно, вытекли из места инъекции.
- Поддерживайте введенные эмбрионы при температуре 34 °C в течение всего эксперимента в чашке диаметром 90 мм с ~60 эмбрионами на тарелке.
ПРИМЕЧАНИЕ: После 5 dpf желток будет съеден растущими эмбрионами, поэтому эмбрионы должны быть обеспечены пищей paramecium на протяжении всего эксперимента. Чтобы обеспечить правильное питание, парамецию следует давать эмбрионам ежедневно в диапазоне от 6 dpf (4 dpi) до 9 dpf (7 dpi). Парамеции размножают культивированием в колбах при оптимальном питании и температурных условиях, как описано31.
9. Анализ выживаемости
- Следите за эмбрионами в течение следующих 7 dpi, ежедневно меняя воду для эмбрионов. Подмена воды может быть сокращена до чередования дней для удобства, если исследование включает медикаментозное лечение.
- Проверьте здоровье эмбриона и оцените его смертность на протяжении всего анализа.
Примечание: Продолжительность эксперимента составила 7 дней для этого эксперимента, но может быть короче или дольше в зависимости от агрессивности ксенотрансплантированной опухоли. - Используйте флуоресценцию CM-Dil для оценки бремени болезни (рис. 4A) и определения влияния генетических изменений или медикаментозного лечения на выживаемость с помощью анализа Каплана Мейера и изобразите графически (например, с помощью GraphPad Prism; Рисунок 4В) 33.
10. Одноклеточная суспензия эмбрионов для анализа проточной цитометрии
ПРИМЕЧАНИЕ: Бремя болезни можно оценить с помощью анализа проточной цитометрии после ксенотрансплантации; Однако для этого требуется нестираемая маркировка опухолевых клеток. Ретровирусно или лентивирально доставляемый красный флуоресцентный белок (RFP) или mCherry эффективен, поскольку он обеспечивает хороший сигнал через автофлуоресценцию клеток данио-рерио, которая затемняет сигнал от зеленого флуоресцентного белка.
- Изолируйте эмбрионы на стадии выбора dpi. Здесь отображается разрешение 5 точек на дюйм (рис. 5).
- Соберите 30-40 эмбрионов для каждого условия в качестве отправной точки, но количество эмбрионов может отличаться в зависимости от стадии и агрессивности трансплантируемых клеток. Обезболите эмбрионы, как описано выше.
ПРИМЕЧАНИЕ: Эмбрионы могут быть разделены на реплики для обеспечения статистической значимости, как показано здесь (Рисунок 5B). - Перенесите эмбрионы в центрифужные пробирки объемом 1,5 мл.
- Используйте 100 мкл раствора Рингера без кальция (рецепт31) на образец для растворения желтка, так как низкое содержание кальция размягчает эмбриональные ткани, обеспечивая более эффективную диссоциацию тканей.
- Периодически проводите пипеткой вверх и вниз в течение 5 минут, чтобы удалить желток с помощью наконечника для дозатора объемом 200 мкл.
- Предварительно нагрейте 0,05% трипсин/PBS (без фенольного красного индикатора) до 29 °C и добавьте 27 мкл коллагеназы в/в (100 мг/мл) на мл раствора трипсина. На каждый образец эмбрионов понадобится объем в 1 мл раствора.
- Добавьте 1 мл раствора трипсина/коллагеназы в каждый образец дежелтковых эмбрионов и инкубируйте при 29 °C в течение 30-35 минут.
- Пипетируйте эмбрионы вверх и вниз в этом растворе с помощью наконечника для пипетки объемом 1 мл каждые 5 минут до тех пор, пока структура эмбрионов (позвоночник) не исчезнет.
- Остановите реакцию с помощью 200 μл FBS.
- Хорошо перемешайте и инкубируйте при температуре 29 °C еще 5 минут, чтобы обеспечить полную инактивацию трипсина.
ПРИМЕЧАНИЕ: Для протокола диссоциации тканей используется температура 29 °C, чтобы предотвратить гибель клеток данио-рерио, вызванную тепловым шоком, которая происходит при 37 °C; однако, если сохранение клеток рыбок данио не требуется, пищеварение можно проводить при 37 °C. - Гранулируйте клеточную суспензию при 300 х г в течение 5 минут при 4 °C и выбросьте надосадочную жидкость.
- Повторно суспендируйте клеточную таблетку при 4 °C PBS и гранулу, как указано выше.
- Повторите промывку, затем процедите клетки через ситечко 70 мкм.
- Гранулы и приступайте к окрашиванию для анализа проточной цитометрии.
ПРИМЕЧАНИЕ: Если требуется культивирование первичных клеток данио-рерио, промойте еще дважды 4 °C PBS и повторно суспендируйте в среде L15 (с антибиотиками и 10% FBS).
11. Флуоресцентно-активируемая сортировка клеток (FACS): окрашивание и сортировка ксенотрансплантированных клеток
- Суспендируйте клеточную суспензию в красящей среде (HBSS с 1% FBS) и гранулируйте при 300 x g в течение 5 минут.
- Ресуспендируйте клеточную гранулу в окрашивающей среде с антителом, реактивным с трансплантированными клетками, чтобы получить второй маркер (в дополнение к RFP или mCherry), с помощью которого можно отличить трансплантированные клетки от клеток рыбок данио. Здесь использовали 50 мкл антимышиного CD45 (APC-CD45) на образец в соотношении 1:50 (рис. 5).
- Инкубировать в течение 20 минут при 4 °C перед промывкой, как указано выше, с 1 мл красящей среды для удаления несвязанных антител.
- После удаления надосадочной жидкости повторно суспендируйте клеточную гранулу в 200 мкл красящей среды, содержащей жизненно важный краситель Helix NP Blue (1 мкМ), что позволит различать живых/мертвых.
- Переложите клеточную смесь в поликарбонатные пробирки с круглым дном объемом 5 мл для анализа проточной цитометрии.
ПРИМЕЧАНИЕ: Параллельное окрашивание контрольной опухолевой клетки обеспечивает четкость рисования ворот во время анализа проточной цитометрии.
12. Проточная цитометрия
- Включите проточный цитометр, который доступен при низкой скорости потока (500 событий в секунду или менее), чтобы задать параметры.
- Используйте контроль опухолевых клеток (те же клетки, которые используются для ксенотрансплантации) для установки напряжения для каналов FSC (прямое рассеяние), SSC (боковое рассеяние), BV421/CasB (жизнеспособность), CE-594 (mCherry) и APC (CD45.2).
ПРИМЕЧАНИЕ: Для образцов с однократным окрашиванием необходимо установить настройки компенсации, которые устраняют наложение флуорохрома между различными пятнами. - Используйте образец неинъекционного эмбриона, чтобы создать условия, в которых могут разместиться как трансплантированные, так и данио-рерио.
- Увеличьте скорость потока до 8000 событий в секунду и запишите 1 миллион событий для каждой выборки.
- Проанализируйте полученные данные с помощью соответствующего аналитического программного обеспечения, сначала выбрав синглеты, построив график FSC-H против FSC-A (высота v/s площадь), а затем график для выбора жизнеспособных ячеек. Для такого анализа широко используется программное обеспечение FlowJo.
- Используя контроль опухолевых клеток, нарисуйте ворота вокруг трансплантированных клеток с помощью FSC-A v/s SSC-A, затем используйте индикаторные красители, в данном случае CD45 и mCherry (рис. 5B).
Примечание: Размерные ворота, выбранные для опухоли, также будут содержать клетки рыбок данио, что обеспечивает основу для нормализации и определения бремени заболевания. - Проанализируйте образцы эмбрионов, используя те же настройки ворот, что и выше. Окончательный график окрашивания опухоли и индикатор флуоресцентного белка позволят измерить бремя болезни (рисунок 5C).
Примечание: Здесь была построена диаграмма разницы в бремени болезни для эмбрионов, получавших хороший болюс инъецированных клеток, и для тех, кто получал более низкий болюс. - При необходимости отсортируйте опухолевые клетки у эмбрионов с помощью проточной цитометрии для последующего молекулярного анализа.
Результаты
Ксенотрансплантация
На рисунке 1 представлен полный обзор всего эксперимента и анализа, охватывающего все этапы от производства эмбрионов до оценки прогрессирования заболевания с помощью анализа выживаемости и бремени заболевания с помощью проточной цитометрии. Этот подход обеспечивает ряд улучшений, которые повышают воспроизводимость и масштабируемость ксенотрансплантации, а также добавляют новый способ оценки бремени заболеваний. Успех этих экспериментов в значительной степени зависит от здоровья трансплантированных клеток, так как клетки, которые не являются здоровыми и находятся в логарифмической фазе, не могут размножаться после трансплантации. Продолжительность сеанса инъекции также является критическим параметром. После того, как опухолевые клетки подготовлены, очень важно завершить инъекцию рыбкам данио в течение 3-4 часов. Подход, использованный в этом исследовании, позволяет вводить большее количество эмбрионов в течение этого периода времени за счет простой модификации путем их размещения непосредственно на боку на агарозной пластине и введения их в желток (рис. 2C, D). Кроме того, крайне важно, чтобы оптимальное отверстие иглы было выбрано таким образом, чтобы было введено достаточное количество клеток (400-600 клеток), но чтобы отверстие не было настолько большим, чтобы эмбрионы могли повредиться. Еще одним фактором является давление впрыска. Мы обнаружили, что давление выше 12-13 фунтов на квадратный дюйм разрушает желток эмбрионов, вызывая смерть. Наконец, еще одной вариативностью, присущей этой процедуре, является консистенция инъекций. Вводимые клетки оседают на конце инъекционной иглы, что затрудняет точное управление в болюсе для инъекции. Когда клетки ксенотрансплантированы, все эмбрионы имеют потенциал для получения одной и той же инъекционной болюсной инъекции, но на практике это не происходит (рис. 3). Количество переносимых клеток может сильно различаться в зависимости от поведения опухолевых клеток (например, сгущение) и уровня квалификации оператора. Мы устранили эту неопределенность с помощью окрашивания CM-Dil/мечения mCherry, которое позволяет классифицировать животных после инъекции, получивших соответствующий и последовательный болюсный болюс, а также тех, кто получил более низкий болюс. Окрашивание CM-Dil, но более эффективное маркирование флуоресцентным белком, имеет дополнительное преимущество, облегчающее мониторинг прогрессирования заболевания либо с помощью микроскопии, либо с помощью проточной цитометрии (Рисунок 4 и Рисунок 5).
Анализ поведения опухоли
Прогрессирование опухоли можно легко контролировать с помощью простой флуоресцентной микроскопии, сфокусированной на RFP (рис. 4A). Аналогичным образом, традиционный мониторинг выживаемости может быть выполнен с помощью анализа Каплана-Мейера (Log-rank и критерий Вилкоксона) (рис. 4B). Впечатляет, что в отличие от исследований ксенотрансплантации на мышах, где обычно приходится 8-10 животных на исследуемую группу, используя описанный здесь метод рыбок данио, нетрудно получить исследование с более чем 60 животными в каждой (рис. 4B). Это заметно повышает разрешающую способность исследований in vivo . Наконец, мы реализовали еще один подход к анализу бремени болезней с помощью проточной цитометрии. Это влечет за собой разрушение эквивалентного количества эмбрионов и анализ содержания опухолевых клеток полученной одноклеточной суспензии методом проточной цитометрии. Комбинируя опухолеспецифичный маркер клеточной поверхности с индикатором флуоресцентного белка, ксенотрансплантированные клетки мышей/человека могут быть уверенно идентифицированы с помощью проточной цитометрии в качестве подхода к оценке бремени заболевания (рис. 5). Для этой цели лучше подходят красные флуоресцентные белки, так как зеленые флуоресцентные белки не смогли обеспечить сигнал по автофлуоресценции клеток данио-рерио. Здесь mCherry был использован для маркировки клеток и мониторинга в ходе ксенотрансплантации для анализа FACS вместе с CD45. Двойная маркировка позволила нам измерить различия в опухолевой нагрузке между хорошей и низкой болюсной инокуляцией (рис. 5B, C).
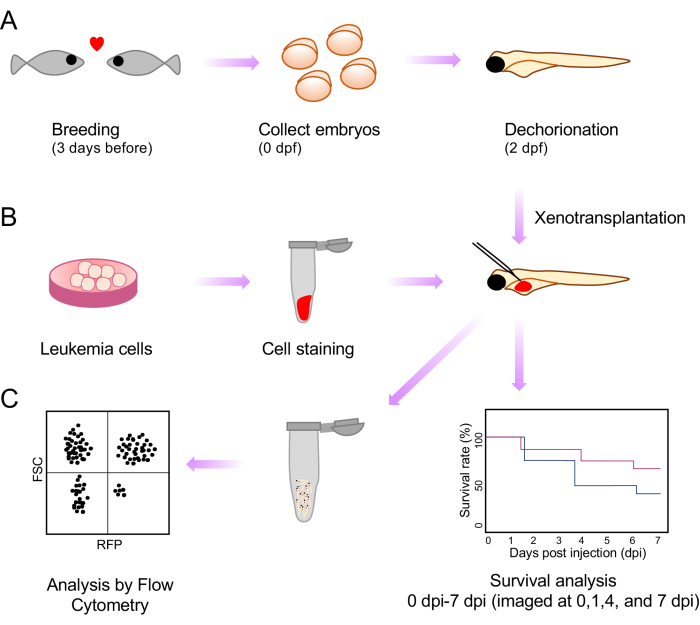
Рисунок 1: Схема всех процедур ксенотрансплантации и постинъекционного анализа. (A) Схема разведения, сбора эмбрионов и морфологии через 2 дня после оплодотворения (dpf). (В) Подготовка, окрашивание и инъекции клеток лейкемии для ксенотрансплантации в желток эмбрионов рыбок данио. (C) Анализы после ксенотрансплантации, включая выживаемость и проточную цитометрию. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
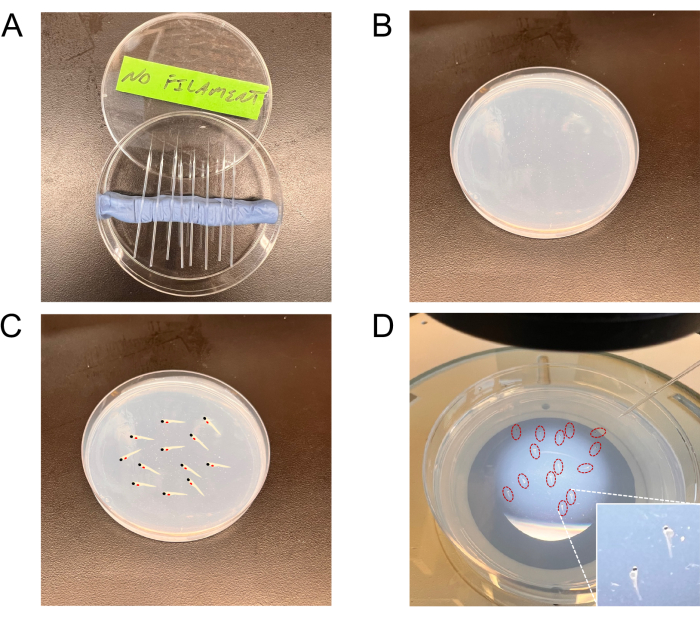
Рисунок 2: Репрезентативные изображения инструментов, используемых для инъекций. (A) Вытащенные иглы в пластине Петри. (B) Агарозная пластина для определения стадии эмбриона. (К,Г) Пластина, показывающая стадию эмбрионов (репрезентативная диаграмма на панели C и реальные эмбрионы (обведены красным) на панели D) для инъекций на планшет для загрузки эмбрионов. Врезка в правом нижнем углу панели D показывает более высокое увеличение стадийных эмбрионов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
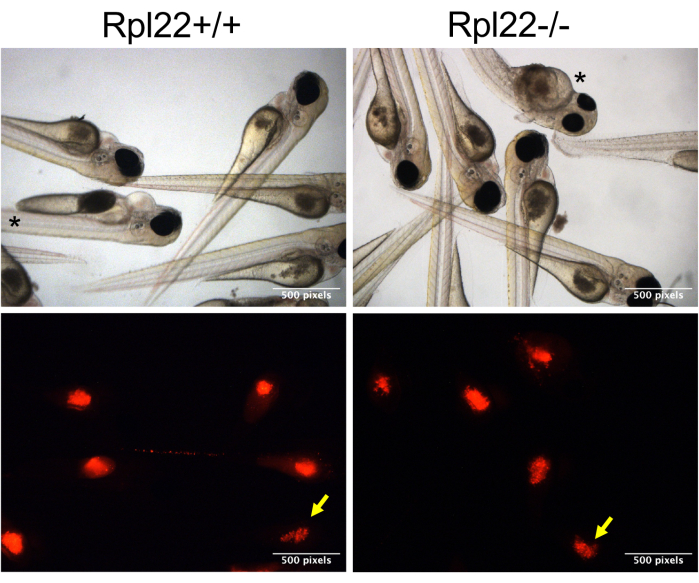
Рисунок 3: Репрезентативные изображения ксенотрансплантированных эмбрионов. Светлые и иммунофлуоресцентные изображения окрашенных (красных)-положительных клеток CM-Dil в желтке эмбрионов каспера с разрешением 1 dpi (изображение кладки). Эмбрионы с нижним болюсом обозначаются желтой стрелкой, а эмбрионы с нарушенной морфологией – звездочкой. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
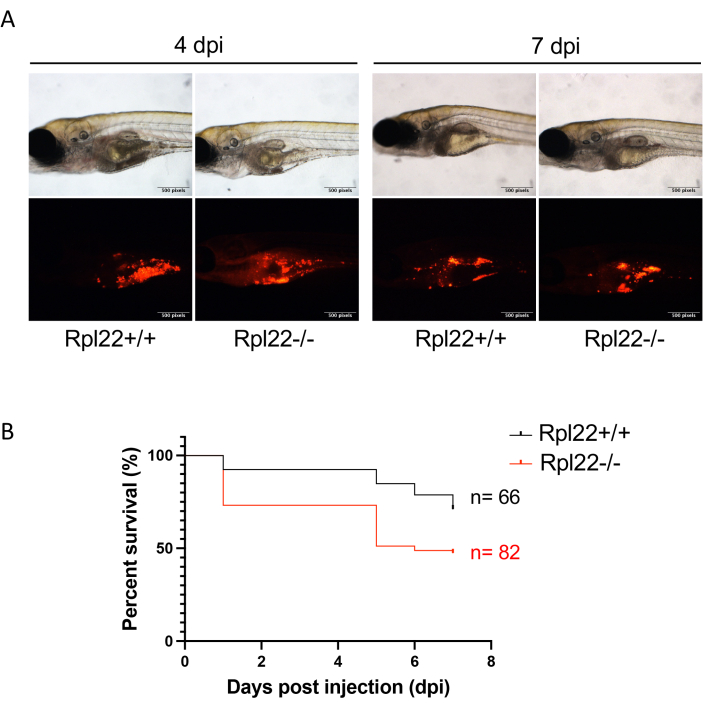
Рисунок 4: Оценка прогрессирования заболевания с помощью флуоресцентной визуализации и анализа выживаемости. (A) Репрезентативное изображение ксенотрансплантированных эмбрионов с разрешением 4 dpi и 7 dpi. (Б) График Каплана Мейера, показывающий анализ выживаемости эмбрионов с двумя генетически различными линиями лейкемии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
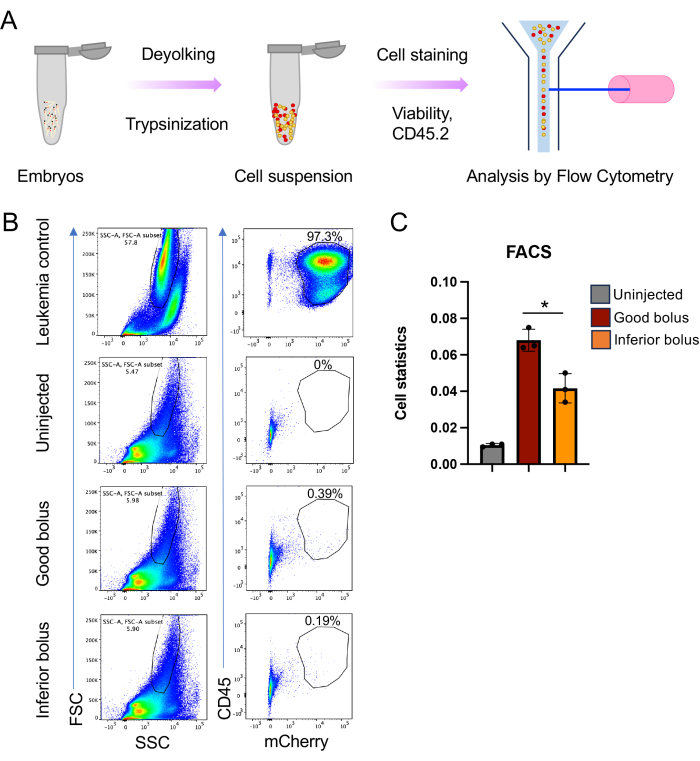
Рисунок 5: Проточный цитометрический анализ бремени болезни у ксенотрансплантированных рыбок данио . (A) Схематическое изображение приготовления клеточной суспензии и анализ проточной цитометрии. Вкратце, эмбрионы с разрешением 4 dpi дезагрегируются на одиночные клеточные суспензии с использованием трипсина и коллагеназы с последующей проточной цитометрией. (B) Репрезентативные графики для анализа проточной цитометрии, где левое изображение на каждой панели представляет собой график FSC-A против SSC-A, а правое изображение представляет собой сигналы mCherry CD45 v/s. (C) Гистограмма, показывающая клеточную статистику для ксенотрансплантированных клеток, полученную из графика CD45 v/s mCherry для неинъецированных, хороших и низших эмбрионов (n = 45, 40 и 40 для каждой репликации (n = 3); значение p * ≤ 0,05, рассчитанное с использованием непарного t-критерия с поправкой Уэлча в GraphPad Prism 9). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Ксенотрансплантация данио-рерио стала быстрой, надежной и экономически эффективной альтернативой исследованиям на мышах12. Несмотря на то, что сообщалось о нескольких подходах к ксенотрансплантации рыбок данио, наша адаптация привела к значительным улучшениям. В дополнение к стандартизации параметров, связанных с процедурой, эти усовершенствования направлены на ускорение скорости выполнения инъекций опухоли, что позволяет увеличить количество животных на исследуемую группу и использовать мечение опухоли для мониторинга качества инъекции и поведения после инъекции.
В то время как описанные здесь усовершенствования этого метода имеют большой потенциал, успешное выполнение этой стратегии потребует квалифицированного специалиста и оптимизации для конкретного приложения. Мы использовали клетки лейкемии. Следовательно, использование солидных раковых опухолей может принести дополнительные проблемы. Такие опухоли могут быть склонны к агрегации, что создает вариабельность доставки болюсной клетки в клетки; однако даже в таких обстоятельствах маркировка RFP должна обеспечивать адекватный контроль качества болюса после инъекции. Это превосходит маркировку GFP или зеленые красители, которые затемняются автофлуоресценцией. Наконец, описанная здесь стандартизация большинства параметров, влияющих на успех (здоровье эмбриона, температура аквакультуры, отверстие иглы, давление впрыска и т. д.), сводит к минимуму изменчивость этого процесса.
Основным фактором для экспериментов по ксенотрансплантации у рыбок данио является место инъекции. Здесь мы показали, что инъекции в желток довольно просты по сравнению с другими, более технически сложными участками, такими как перивителиновое пространство34, проток Кювье35 и интракардиальная инъекция (сердечный желудочек)36. Недостатком инъекции желтка является то, что это жизненно важный орган для растущих эмбрионов, поэтому необходимо следить за тем, чтобы диаметр иглы и давление тщательно контролировались, чтобы эмбрион не погиб из-за инъекционной травмы. Описанный здесь подход смягчает эту проблему, сводя к минимуму травмы и отбрасывая любые очевидные травмы или смерть на 1 dpi, поскольку эти проблемы не связаны с ростом опухоли. Последнее соображение относительно места инъекции заключается в том, что различные микроокружения могут иметь большую или меньшую способность поддерживать размножение ксенотрансплантированных опухолей. Следовательно, возможно, инъекции желтка могут быть выполнены в первую очередь, прежде чем переходить к более сложным ортотопическим инъекциям. Основным преимуществом инъекции желтка является то, что она не требует точного определения стадии эмбриона и, таким образом, позволяет более быстро вводить большее количество эмбрионов, тем самым лучше сохраняя их здоровье и увеличивая статистическую мощность для устранения различий в поведении трансплантированных опухолевых клеток.
Постинъекционный мониторинг прогрессирования заболевания обычно оценивается через влияние на выживаемость с помощью анализа Каплана-Мейера37; Тем не менее, тестирование бремени болезней также может быть весьма информативным. Для трансплантированных клеток, которые остаются в месте инъекции, опухолевая нагрузка может быть количественно определена с помощью различных методов микроскопии при условии, что метод мечения опухолевых клеток не затемняется автофлуоресценцией29. Окрашивание CM-Dil легко растворяется и не подвержено влиянию аутофлуоресценции, поэтому оно хорошо подходит для количественной оценки опухолевой нагрузки локализованных клеток. Проблема возникает, когда опухолевые клетки не остаются в месте инъекции и не распространяются. В таких случаях проточная цитометрия в сочетании с нестираемой генетической маркировкой с использованием красных флуоресцентных белков является очень эффективным способом мониторинга бремени болезни в стандартизированных кладках эмбрионов, поскольку меченая опухоль может быть проанализирована с использованием видоспецифичных красителей, отличных от клеток рыбок данио. Одним из недостатков CM-Dil является то, что он разбавляется делением38 клеток. Соответственно, адаптация с помощью генетической маркировки опухолей с помощью RFP или mCherry несет в себе значительные преимущества. Экспрессия mCherry в сочетании с опухолеспецифичными антителами позволяет уверенно идентифицировать трансплантированные клетки среди того, что может быть сложным паттерном фоновых сигналов, предоставляемых клетками данио-рерио.
В совокупности оптимизированный подход к ксенотрансплантации рыбок данио и метод анализа, использованный в этом исследовании, обеспечивают существенное улучшение и без того мощной экспериментальной платформы.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Эта работа была поддержана грантами NIH R37AI110985 и P30CA006927, ассигнованиями от Содружества Пенсильвании, Общества лейкемии и лимфомы и Фонда Бишопа. Это исследование также было поддержано основными объектами Fox Chase, включая Cell Culture, Flow Cytometry и Laboratory Animal facility. Мы благодарим доктора Дженнифер Роудс за содержание рыбок данио и микроинъекций в FCCC.
Материалы
| Name | Company | Catalog Number | Comments |
| 1-phenyl 2-thiourea (PTU) | Sigma | P7629 | |
| 70 micron cell strainer | Corning | CLS431751-50EA | |
| 90 mm Petri dish | Thermo Fisher Scientific | S43565 | |
| Agarose | Apex bioresearch | 20-102GP | |
| APC APC anti-mouse CD45.2 Antibody | Biolegend | 109814 | |
| BD FACSymphony A5 Cell Analyzer | BD Biosciences | BD FACSymphony A5 | |
| calibration capillaries | Sigma | P1424-1PAK | |
| Cell tracker CM-dil dye | Invitrogen | C7001 | |
| Collageanse IV | Gibco | 17104019 | |
| Dumont forceps number 55 | Fine science tools | 11255-20 | |
| FBS | Corning | 35-015-CV | |
| Fluorescence microscope | Nikon | model SMZ1500 | |
| Glass capillaries (Borosilicate) | World precision instruments | 1B100-4 | |
| HBSS | Corning | 21-023-CV | |
| Helix NP Blue | Biolegend | 425305 | |
| Instant Ocean Sea Salt | Instant ocean | SS15-10 | |
| Light microscope | Nikon | model SMZ1000 | |
| Methylene blue | Sigma | M9140-100G | |
| Microloader (long tips for laoding cells) | eppendorf | 930001007 | |
| P1000 micropipette puller | Sutter instruments | model P-97 | |
| PM 1000 cell microinjector | MicroData Instruments, Inc. (MDI) | PM1000 | |
| Tricaine methanesulphate (Ethyl 3- aminobenzoate methanesulphate) | Sigma | E10521-10G | |
| Trypsin-EDTA (0.5%), no phenol red | Gibco | 15400054 | |
| Zebrafish adult irradiated diet (dry feed) | Zeigler | 388763 |
Ссылки
- Sharma, G., Goyal, Y., Bhatia, S. Handbook of Animal Models and its Uses in Cancer Research. Preclinical Animal Models of Cancer: Applications and Limitations. , (2022).
- Singhal, S. S., et al. Recent advancement in breast cancer research: Insights from model organisms-Mouse models to zebrafish. Cancers. 15 (11), 2961 (2023).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduction and Targeted Therapy. 8 (1), 160 (2023).
- Fuochi, S., Galligioni, V. Disease Animal Models for Cancer Research. Cancer Cell Culture: Methods and Protocols. , (2023).
- Shaw, T. J., Senterman, M. K., Dawson, K., Crane, C. A., Vanderhyden, B. C. Characterization of intraperitoneal, orthotopic, and metastatic xenograft models of human ovarian cancer. Mol Ther. 10 (6), 1032-1042 (2004).
- Deroose, C. M., et al. Multimodality imaging of tumor xenografts and metastases in mice with combined small-animal PET, small-animal CT, and bioluminescence imaging. J Nucl Med. 48 (2), 295-303 (2007).
- Zeng, M., et al. Generation, evolution, interfering factors, applications, and challenges of patient-derived xenograft models in immunodeficient mice. Cancer Cell Int. 23 (1), 120 (2023).
- Adhish, M., Manjubala, I. Effectiveness of zebrafish models in understanding human diseases-A review of models. Heliyon. 9 (3), e14557 (2023).
- MacRae, C. A., Peterson, R. T. Zebrafish as a mainstream model for in vivo systems pharmacology and toxicology. Ann Rev Pharmacol Toxicol. 63, 43-64 (2023).
- Choe, S. -. K., Kim, C. -. H. Zebrafish: A powerful model for genetics and genomics. Int J Mol Sci. 24 (9), 8169 (2023).
- White, R., Rose, K., Zon, L. Zebrafish cancer: the state of the art and the path forward. Nat Rev Cancer. 13 (9), 624-636 (2013).
- Al-Hamaly, M. A., Turner, L. T., Rivera-Martinez, A., Rodriguez, A., Blackburn, J. S. Zebrafish cancer avatars: A translational platform for analyzing tumor heterogeneity and predicting patient outcomes. Int J Mol Sci. 24 (3), 2288 (2023).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Hill, D., Chen, L., Snaar-Jagalska, E., Chaudhry, B. Embryonic zebrafish xenograft assay of human cancer metastasis. F1000Res. 7, 1682 (2018).
- Corkery, D. P., Dellaire, G., Berman, J. N. Leukaemia xenotransplantation in zebrafish--chemotherapy response assay in vivo. Br J Haematol. 153 (6), 786-789 (2011).
- Lin, J., et al. A clinically relevant in vivo zebrafish model of human multiple myeloma to study preclinical therapeutic efficacy. Blood. 128 (2), 249-252 (2016).
- Grissenberger, S., et al. High-content drug screening in zebrafish xenografts reveals high efficacy of dual MCL-1/BCL-XL inhibition against Ewing sarcoma. Cancer Lett. 554, 216028 (2023).
- Baxi, D. Zebrafish: A Versatile Animal Model to Study Tumorigenesis Process and Effective Preclinical Drug Screening for Human Cancer Research. Handbook of Animal Models and its Uses in Cancer Research. , (2022).
- Li, X., Li, M. The application of zebrafish patient-derived xenograft tumor models in the development of antitumor agents. Med Res Rev. 43 (1), 212-236 (2023).
- Yin, J., et al. Zebrafish patient-derived xenograft model as a preclinical platform for uveal melanoma drug discovery. Pharmaceuticals. 16 (4), 598 (2023).
- Nakayama, J., Makinoshima, H., Gong, Z. In vivo drug screening to identify anti-metastatic drugs in Twist1a-ER(T2) transgenic zebrafish. Bio Protoc. 13 (10), e4673-e4673 (2023).
- Lam, S., Chua, H., Gong, Z., Lam, T., Sin, Y. Development and maturation of the immune system in zebrafish, Danio rerio: a gene expression profiling, in situ hybridization and immunological study. Dev Comp Immunol. 28 (1), 9-28 (2004).
- Nicoli, S., Presta, M. The zebrafish/tumor xenograft angiogenesis assay. Nat Protoc. 2 (11), 2918-2923 (2007).
- Casey, M. J., et al. Transplantation of zebrafish pediatric brain tumors into immune-competent hosts for long-term study of tumor cell behavior and drug response. J Vis Exp. (123), e55712 (2017).
- Soh, G. H., Kögler, A. C., Müller, P. A simple and effective transplantation device for zebrafish embryos. J Vis Exp. (174), e62767 (2021).
- Martinez-Lopez, M., Póvoa, V., Fior, R. Generation of zebrafish larval xenografts and tumor behavior analysis. J Vis Exp. (172), e62373 (2021).
- Ren, J., Liu, S., Cui, C., Ten Dijke, P. Invasive behavior of human breast cancer cells in embryonic zebrafish. J Vis Exp. (122), e55459 (2017).
- Zhao, C., et al. A novel xenograft model in zebrafish for high-resolution investigating dynamics of neovascularization in tumors. PloS One. 6 (7), e21768 (2011).
- Cabezas-Sáinz, P., Pensado-López, A., Sáinz Jr, B., Sánchez, L. Modeling cancer using zebrafish xenografts: drawbacks for mimicking the human microenvironment. Cells. 9 (9), 1978 (2020).
- Haraoka, Y., Akieda, Y., Ishitani, T. Live-imaging analyses using small fish models reveal new mechanisms that regulate primary tumorigenesis. Yakugaku Zasshi. 139 (5), 733-741 (2019).
- Westerfield, M. . The Zebrafish Book. A Guide for the Laboratory Use of Zebrafish (Danio rerio). , (2000).
- Rao, S., et al. Inactivation of ribosomal protein L22 promotes transformation by induction of the stemness factor, Lin28B. Blood. 120 (18), 3764-3773 (2012).
- Goel, M. K., Khanna, P., Kishore, J. Understanding survival analysis: Kaplan-Meier estimate. Int J Ayurveda Res. 1 (4), 274-278 (2010).
- Usai, A., Di Franco, G., Gabellini, C., Morelli, L., Raffa, V. Establishment of zebrafish patient-derived xenografts from pancreatic cancer for chemosensitivity testing. J Vis Exp. (195), e63744 (2023).
- Murali Shankar, N., et al. Preclinical assessment of CAR-NK cell-mediated killing efficacy and pharmacokinetics in a rapid zebrafish xenograft model of metastatic breast cancer. Front Immunol. 14, 1254821 (2023).
- Takahi, M., et al. Xenograft of human pluripotent stem cell-derived cardiac lineage cells on zebrafish embryo heart. Biochem Biophys Res Commun. 674, 190-198 (2023).
- Rudner, L. A., et al. Shared acquired genomic changes in zebrafish and human T-ALL. Oncogene. 30 (41), 4289-4296 (2011).
- Regan, J. L., et al. RNA sequencing of long-term label-retaining colon cancer stem cells identifies novel regulators of quiescence. iScience. 24 (6), 102618 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены