Method Article
שיטה פשוטה, מהירה ויעילה לניתוח השתלת גידול בעוברים שקופים של דגי זברה
In This Article
Summary
אנו מתארים פרוטוקול להשתלת קסנו בחלמון של עוברי דגי זברה שקופים המותאם בשיטת היערכות פשוטה ומהירה. ניתוחים לאחר הזרקה כוללים הישרדות והערכת נטל המחלה של תאים מושתלים על ידי ציטומטריית זרימה.
Abstract
מחקרי In vivo של התנהגות גידולים הם מצרך עיקרי בחקר הסרטן; עם זאת, השימוש בעכברים מציב אתגרים משמעותיים בעלות ובזמן. כאן, אנו מציגים את דגי הזברה הזחלים כמודל השתלה שיש לו יתרונות רבים על פני מודלים מורינים, כולל קלות טיפול, הוצאות נמוכות ומשך ניסוי קצר. יתר על כן, היעדר מערכת חיסון נרכשת בשלבי הזחל מייתר את הצורך לייצר זנים מדוכאי חיסון ולהשתמש בהם. בעוד פרוטוקולים מבוססים להשתלת קסנו בעוברים של דגי זברה קיימים, אנו מציגים כאן שיטה משופרת הכוללת היערכות עוברים להעברה מהירה יותר, ניתוח הישרדות ושימוש בציטומטריית זרימה להערכת נטל המחלה. עוברים מבוימים כדי להקל על הזרקת תאים מהירה לחלמון הזחלים וסימון תאים כדי לפקח על עקביות בולוס התא המוזרק. לאחר ההזרקה, ניתוח הישרדות העובר מוערך עד 7 ימים לאחר ההזרקה (dpi). לבסוף, נטל המחלה מוערך גם על ידי סימון תאים מועברים עם חלבון פלואורסצנטי וניתוח על ידי ציטומטריית זרימה. ציטומטריית זרימה מתאפשרת על ידי שיטה סטנדרטית להכנת תרחיפים של תאים מעוברי דגי זברה, אשר יכולה לשמש גם בביסוס התרבית הראשונית של תאי דגי זברה. לסיכום, ההליך המתואר כאן מאפשר הערכה מהירה יותר של התנהגות תאי הגידול in vivo עם מספר גדול יותר של בעלי חיים לכל זרוע מחקר ובאופן חסכוני יותר.
Introduction
ניתוח התנהגות גידולים בתגובה לשינוי גנטי או טיפול תרופתי in vivo הוא מרכיב חיוני בחקר הסרטן 1,2,3,4. מחקרים כאלה כוללים לרוב שימוש במודלים של עכבר מדוכא חיסון (Mus musculus)5; עם זאת, מחקרי השתלת קסנו בעכברים מוגבלים במובנים רבים, כולל קיבולת מוגבלת, משך זמן ממושך, הוצאות משמעותיות והדרישה לציוד הדמיה מתוחכם למעקב אחר התקדמות גידולים פנימיים 6,7. לעומת זאת, מודל דגי הזברה (Danio rerio) מאפשר קיבולת גדולה יותר, משך זמן קצר יותר, הוצאות נמוכות יותר, ובשל שקיפותם, ניטור פשוט של התקדמות המחלה 8,9.
דגי זברה היא מערכת מודל מפותחת של בעלי חוליות עם התפתחות רחם לשעבר ופריון גבוה, כאשר נקבות בודדות מייצרות יותר מ-100 עוברים10. יתר על כן, עוברים של דגי זברה הם שקופים, ומאפשרים הדמיה קלה של תהליכים התפתחותיים באמצעות טכניקות הקשורות לפלואורסצנטיות כגון כתבים. לבסוף, שימור תהליכים התפתחותיים קריטיים הופך אותם למודל אידיאלי עבור סוגים רבים של מחקרים, כולל ההתנהגות של תאים ממאירים מושתלים11,12. עוברי דגי זברה מסוג בר מפתחים מלנוציטים, מה שהופך אותם אטומים אופטית עד גיל שבועיים, אך זה כבר התגבר על ידי הדור של עוברי קספר (RoyA9; MitfaW2), שנשארים שקופים לאורך כל החיים13. בגלל התכונות האופטיות שלהם, דגי זברה קספר הם מושתלים אידיאליים של תאי גידול מושתלים 14,15,16. השתלת קסנו של תאי גידול בדגי זברה צברה חשיבות בשני העשורים האחרונים 17,18,19,20,21. לעוברים של דגי זברה יש חסינות מולדת; עם זאת, הם חסרים חסינות נרכשת בשלב הזחל שלהם, מה שהופך אותם מדוכאי חיסון תפקודיים, מה שמאפשר להם לשמש כמארחים יעילים עבור xenografts גידול מושתל22.
פותחו פרוטוקולים לקליטת גידולים בעוברים של דגי זברה וכן במבוגרים שלקחו בחשבון מספר משתנים שונים 23,24,25,26,27. אלה חקרו אתרים רבים של שקיעת גידולים בדגי זברה, כולל זריקות בחלמון, בחלל פרי-ויטלין ובלב ובשלבי התפתחות שונים16,28. טמפרטורת הסביבה של חקלאות ימית עבור xenografts דגי זברה חשוב גם כמו גידול דגי זברה מתרחשת בדרך כלל ב 28 °C (75 °F), בעוד תאים יונקים לגדול ב 37 °C (77 °F). כתוצאה מכך, יש להשתמש בטמפרטורת פשרה שנסבלת על ידי הדג אך תומכת בצמיחת הגידול, ונראה כי 34 מעלות צלזיוס משיגות את שתי המטרות29. ניתוח ההתנהגות וההתקדמות של גידולים לאחר השתלת קסנו הוא תחום מרכזי נוסף של התמקדות, וזה כרוך בשימוש במגוון שיטות הדמיה, כמו גם ניתוח הישרדות30. אחד היתרונות העיקריים של מודל דגי הזברה הוא זמינותם של מספר רב של חיות מחקר כדי לספק כוח סטטיסטי עצום למחקרי in vivo של התנהגות גידולים; עם זאת, גישות קודמות הגבילו מאוד את הפוטנציאל הזה בגלל הדרישה של הליכי הרכבה מייגעים לזריקות.
כאן, אנו מתמודדים עם מגבלה זו באמצעות פיתוח שיטה פשוטה ומהירה לשלב עוברים המאפשרת תפוקה גבוהה וניטור של איכות ההזרקה באמצעות קו דגי הזברה השקופים של קספר . זה כרוך בהזרקה של xenografts לתוך שק החלמון של עוברי דג זברה קספר ב 2 ימים לאחר ההפריה (dpf). אנו צופים בהישרדות העוברים לאחר השתלת קסנו כחלק מניתוח התנהגות הגידול. אנו גם מראים את הערכת נטל המחלה לאחר השתלת קסנו על-ידי ביצוע תרחיפים של תאים בודדים וניתוח על-ידי ציטומטריית זרימה (איור 1).
Protocol
תחזוקה, האכלה וגידול של דגי זברה התרחשו בתנאי חקלאות ימית סטנדרטיים של 28.5 מעלות צלזיוס, כמתואר31. כל הניסויים הקשורים לדגי זברה נעשו בטמפרטורה זו; עם זאת, לאחר השתלת קסנו, בעלי החיים גודלו בתרבית בטמפרטורה של 34 מעלות צלזיוס למשך הניסוי, בהתאם לנהלים שאושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC).
1. רבייה (3 ימים לפני ההזרקה)
- לספק מזון יבש (מזון נוסף; 5-6 גרגירים לכל דג) לזוגות דגים שבוע לפני הרבייה כדי למקסם את בריאות בעלי החיים ולהגדיל את מספר העוברים המיוצרים על ידי זוגות רבייה.
- בערב שלפני קציר העוברים, הקימו חיות רבייה במכלי רבייה עם מחיצה המפרידה בין דגים זכרים לנקבות, באמצעות הזדווגות הרמון של 2 נקבות לכל זכר.
הערה: עבור ניסויים עם 4 זרועות של 100 בעלי חיים לכל זרוע, להעסיק 20 זוגות רבייה בכל ניסוי. כדי לקבוע את מספר זוגות הרבייה הדרושים, הערכה טובה היא 50 עוברים לכל זוג רבייה של קספר . אפשרות נוספת היא להשתמש בזן חזק יותר של דג זברה פיגמנטי ולטפל ב-1-פניל 2-תיאוריאה (PTU) למניעת פיגמנטציה31. בפועל, יש להגדיל את הניסוי כך שיהיו מספיק עוברים כדי להזריק פי שניים מהמספר הרצוי ביום אחד לאחר ההזרקה (dpi).
2. איסוף עוברים (יומיים לפני ההזרקה)
- למחרת בבוקר, הסירו את המחיצות, ואפשרו לדגים להתרבות.
- דמיינו את העוברים במיכלים 20 דקות (דקות) לאחר הסרת החוצצים.
- אספו את העוברים באמצעות מסננת בצלוחית פטרי בקוטר 90 מ"מ המכילה מי עוברים המיוצרים כמתואר בספר דגי הזברה31.
- להכנת מים עובריים, הוסיפו 1.5 מ"ל מלחי ציר לליטר אחד של מים מזוקקים ומתילן כחול ל-0.1% סופי. הפוך את תמיסת מלח ציר על ידי המסת 40 גרם של מלחי ים (טבלה של חומרים) ב 1 ליטר של מים מזוקקים. ההרכב היוני של מי העובר הוא K+ (0.68 מ"ג/ליטר), Cl− (31.86 מ"ג/ל'), Na+ (17.77 מ"ג/ל'), SO4− (4.47 מ"ג/ל'), מ"ג2+ (2.14 מ"ג/ל') ו-Ca2+ (0.68 מ"ג/ל').
- אפשרו לדגי הזברה להתרבות במשך שעה נוספת ואספו את העוברים שנוצרו.
- אגרו את העוברים לצורך הניסוי.
- בערב, הסר את כל העוברים הלא מופרים או המתים, הניתנים לזיהוי על ידי המורפולוגיה החריגה שלהם, וספק מים עוברים טריים.
3. תחזוקת עוברים והכנת כלים להזרקות (יום לפני ההזרקה)
- למחרת בבוקר, הוציאו עוברים מתים נוספים וספקו מים לעוברים טריים.
- מכינים צלחת אגרוז על ידי חימום 1.5% אגרוז במי עובר ויוצקים את התערובת המחוממת לצלחת פטרי 90 מ"מ. צלחת אחת של 90 מ"מ דורשת 30-35 מ"ל של התערובת.
- משוך מחטים ללא נימה מנימי זכוכית (Borosilicate) באמצעות מושך המחטים. מחטים נמשכות (תחת לחץ חום) ומייצרות קצה סגור; קוצצים אותם עם מלקחיים כדי ליצור פתח אופטימלי. להעריך את התאמת פתח המחט על ידי קביעת נפח הנוזל שנעקר ליחידת זמן (ראה להלן, סעיף 6.3).
הערה: ניתן לרכוש נימי זכוכית עם או בלי חוטים מרכזיים. נימים חסרי חוטים מרכזיים מועדפים להזרקות תאים. - הניחו את המחטים בתוך צלחת פטרי מכוסה בקוטר 90 מ"מ בחריצים המיוצרים מחימר (חימר לדוגמה לילדים) עד לשימוש (איור 2A).
4. הכנה ותיוג של תאי לוקמיה עם CM-Dil (יום ההזרקה)
- לשמור על התאים להשתלה בתנאים אופטימליים לגידולם. תאי הלוקמיה של מורין שהופעלו כאן הספיקו (M82; Rpl22+/+) או חסר (M109; Rpl22-/-) עבור החלבון הריבוזומלי Rpl22, המתפקד כמדכא גידול32.
- תאי גלולה בצינור חרוטי 50 מ"ל. ספירה, ולאחר מכן צנטריפוגה ב 300 x גרם בטמפרטורת החדר (RT) במשך 5 דקות. השליכו את הסופרנטנט.
הערה: מספר התאים הדרוש יוכתב על ידי היקף הניסוי ותנאים, אך 1 x 106 תאים הם נקודת התחלה טובה. - ביצוע צביעת CM-Dil
הערה: צביעת CM-Dil מאפשרת ניטור של בולוס ההזרקה.- צור תמיסת מלאי של CM-דיל על ידי השעיה מחדש של בקבוקון 50 מיקרוגרם של CM-דיל ב- 50 מיקרוליטר של דימתיל סולפוקסיד (DMSO; 1 מ"ג / מ"ל או ~ 1 מילימטר סופי).
- לייצר תמיסה עובדת על ידי דילול הציר (4.8 μL של כתם/מ"ל) בסרום בקר עוברי 1% (FBS)/תמיסת מלח מאוזנת של האנק (HBSS) המכילה את כל התוספים התומכים הדרושים לתאים לשימוש.
- תאי השעיה מחדש ב 1 x 106/100 μL בתמיסת העבודה של הכתם.
- יש לדגור בטמפרטורה של 37°C למשך 10 דקות.
הערה: תנאי הצביעה חייבים להיות מותאמים לתאים המועסקים (זמן וכו '). התאים המשמשים כאן דרשו שתי דגירות נפרדות של 10 דקות בטמפרטורות שונות כדי להשיג צביעה אופטימלית. - יש לשטוף עם 10 מ"ל של HBSS אחד בטמפרטורת החדר (RT).
- תאי גלולה (צנטריפוגה ב 300 x גרם במשך 5 דקות ב RT), decant supernatant, ולאחר מכן resuspend עם 10 מ"ל של HBSS ולחזור על אותו הדבר במשך שטיפה שנייה.
- יש להשהות מחדש את תאי הגידול המוכתמים ב-40,000 תאים/μL ב-1% FBS/PBS וכל תוסף תומך הדרוש ולשמור על תרחיף התאים ב-34°C עד להזרקה.
הערה: תוספים תומכים נדרשו לתחזוקת קווי התאים ששימשו במחקר זה (למשל, 1% FBS וציטוקינים). ייתכן שיהיה צורך להתאים את התוספים ואת xenotransplantation לשורות תאים מסוימים תחת מחקר. PBS נבחרה כאן במקום המדיה כדי למנוע רעילות פוטנציאלית בחלמון.
5. דכוריונציה
- נטרלו את עוברי דגי הזברה של קספר באופן ידני ב 2 dpf באמצעות מזרקי הזרקת אינסולין תחת הגדלה פי 2 במיקרוסקופ אור. נקבו את הכוריון עם מחט אחת תוך שימוש במחט השנייה כדי לשתק את הכוריון.
הערה: שימוש בפרונאז לדכוריונציה אינו מומלץ מכיוון שלעיתים הוא גורם לבריאות מופחתת של העובר. דכוריונציה של העוברים ב 2 dpf עדיפה מכיוון שהיא קלה יותר, והעוברים פחות שבירים מאשר בזמנים מוקדמים יותר (1 dpf). - בעת dechorionating, יש להיזהר לא לגעת בעוברים עם המחטים. נגיעה או פגיעה בחלמון העוברים על ידי מגע לא מכוון עם המחטים עלולה לגרום למוות.
- הסר את הכוריות שהופשטו על ידי החלפת מי העובר.
6. הגדרת המיקרו-מזרק והמחט
- הפעל את המיקרו-מזרק ואת המשאבה והגדר את התנאים המתאימים למיקרו-הזרקות של תאים. לחץ הזרקה של 9-11 psi וזמן הזרקה של 0.5 שניות (s) הם נקודת התחלה טובה לחיתוך המחט וקיבוע הפתח.
- טען את תרחיף קו תאי הגידול (~ 5 μL) לתוך המחט בזהירות במעבר אחד, הימנעות היווצרות של בועות אוויר, אשר ישבשו את זרם התא בתוך המחט.
- חתכו את קצה המחט במלקחיים (Dumont מספר 5) כדי לייצר פתח שיתמוך בפליטה של 10-15 ננוליטר (nL) של תרחיף תאים לכל 0.2-0.3 שניות.
הערה: החישוב לעיל של נפח nL נעשה באמצעות נימי כיול, כאשר 1 מ"מ = 30 nL. בקיצור, הגדר את הזמן ל 0.5 שניות, ולאחר כל קליפ של המחט, לחץ על הזרקה ולאסוף את עוצמת הקול בנימי הכיול. לאחר מכן, אורך הנפח שנאסף נמדד באמצעות הסולם תחת מיקרוסקופ, וגזירת המחט נעצרת כאשר 30 nL מוזרק ב 0.5 שניות. לאחר מכן, הגדר את זמן הזריקות כ 0.2-0.3 s. (הזרקת ~ 10-15 nL של תאים)
7. הכנת עוברים להזרקה
- בחרו עוברים בריאים תחת המיקרוסקופ, ובדקו כל עובר עם חריגות התפתחותיות כגון בצקת לב או גזע קצר או מעוקל.
- מרדימים את העוברים באמצעות טריקאין מתאן-סולפונט (MS-222; 0.16 גרם לליטר מי עובר) למשך דקה אחת בצלחת פטרי 90 מ"מ.
- השתמשו בפיפטת פסטר מזכוכית כדי לאסוף את העוברים. סדרו 10-15 עוברים בתנוחה צידית על לוחית אגרוז 1.5% (איור 2B-D).
- הסר את עודפי המים באמצעות פיפטת פסטר, והשאר את הכמות המינימלית של מי העובר הדרושים כדי לשמור על העוברים בחיים.
8. הליך הזרקה
- בדוק תחת מיקרוסקופ האור כדי לוודא שהתאים הצטברו בקצה המחט.
- הזריקו את העוברים באמצעות המחט המכוילת במשך 0.2-0.3 שניות (עם 10-15 nL המתאימים ל-400-600 תאים) בחלמון העוברים.
- חזור על הזריקה עבור כל העוברים, ולאחר מכן לאסוף אותם במי עובר טריים.
הערה: מכיוון שתאים נוטים להצטבר על קצה המחט, יהיה צורך להחזיר מעט את הקצה כל 15-20 זריקות. זה גם ידרוש איפוס הלחץ והזמן עם כל חיתוך מחדש כדי להבטיח כי נפח דומה מוזרק. - כדי להבטיח שההשוואה בין ההתנהגות של שתי קבוצות נפרדות של תאים מועברים תקפה, עקוב אחר בולוס התאים המועברים. עשו זאת על ידי מיון העוברים על בסיס צביעת CM-Dil (בתעלת RFP) שעה לאחר ההזרקה (hpi), תוך הפרדת אלה עם צביעה אופטימלית ("בולוס טוב") מאלה עם כתמים נחותים ("בולוס נחות"; איור 3, חץ צהוב).
- השליכו את העוברים עם בולוס נחות או השתמשו בהם כדי להעריך את ההשפעה של מינון תאים שונה על התקדמות המחלה.
- הסר עוברים מתים עד סוף היום מכיוון שמותם קשור לטראומה בזריקה ולא לצמיחת גידול. הסר מניתוח עוברים שאינם שומרים תאים מכיוון שהתאים ככל הנראה דלפו מאתר ההזרקה.
- שמור על העוברים המוזרקים ב 34 ° C למשך הניסוי בצלחת 90 מ"מ עם ~ 60 עוברים לכל צלחת.
הערה: לאחר 5 dpf, החלמון ייאכל על ידי העוברים הגדלים, ולכן יש לספק לעוברים מזון פרמציום למשך הניסוי. כדי להבטיח תזונה נכונה, paramecia צריך להינתן לעוברים מדי יום מ 6 dpf (4 dpi) ל 9 dpf (7 dpi). Paramecia מופצים על ידי גידול בצלוחיות בתנאי תזונה וטמפרטורה אופטימליים, כמתואר31.
9. ניתוח הישרדות
- עקוב אחר העוברים במשך 7 dpi הבאים, ושנה את מי העובר מדי יום. שינויים במים עשויים להיות מופחתים לימים חלופיים מטעמי נוחות אם המחקר כולל טיפול תרופתי.
- בדוק את בריאות העובר וציון מוות למשך הניתוח.
הערה: משך הניסוי היה 7 ימים עבור ניסוי זה אך עשוי להיות קצר או ארוך יותר בהתאם לאגרסיביות של הגידול המושתל xenotransplanted. - השתמשו בפלואורסצנטיות CM-Dil כדי להעריך את נטל המחלה (איור 4A) ולקבוע את ההשפעה של שינויים גנטיים או טיפולים תרופתיים על הישרדות באמצעות ניתוח קפלן מאייר ותיאור גרפי (למשל, עם GraphPad Prism; איור 4B) 33.
10. השעיה חד-תאית של עוברים לצורך ניתוח ציטומטריית זרימה
הערה: ניתן להעריך את נטל המחלה על ידי ניתוח ציטומטריית זרימה לאחר השתלת קסנו; עם זאת, פעולה זו דורשת סימון בל יימחה של תאי הגידול. חלבון פלואורסצנטי אדום (RFP) או mCherry המועבר רטרו-ויראלית או לנטיויראלי יעיל מכיוון שהוא מספק אות טוב על פני האוטופלואורסצנטיות של תאי דגי זברה, אשר מסתיר אות מחלבון פלואורסצנטי ירוק.
- בודדו עוברים בשלב dpi של בחירה. 5 dpi מוצג כאן (איור 5).
- לאסוף 30-40 עוברים לכל מצב כנקודת התחלה, אבל מספר העובר עשוי להשתנות בהתאם לשלב ואת האגרסיביות של התאים המושתלים. להרדים את העוברים כמתואר לעיל.
הערה: ניתן לחלק את העוברים להעתקים כדי לספק מובהקות סטטיסטית, כפי שמוצג כאן (איור 5B). - מעבירים את העוברים לצינורות צנטריפוגות בנפח 1.5 מ"ל.
- השתמשו ב-100 מיקרוליטר של תמיסת רינגר נטולת סידן (מתכון31) לכל דגימה כדי להמיס את החלמון, שכן סידן נמוך מרכך את הרקמות העובריות, ומאפשר דיסוציאציה יעילה יותר של רקמות.
- פיפטה למעלה ולמטה לסירוגין במשך 5 דקות כדי להסיר את החלמון באמצעות קצה פיפטה 200 μL.
- יש לחמם מראש 0.05% טריפסין/PBS (ללא מחוון פנול אדום) ל-29°C ולהשלים אותו עם 27 μL של collagenase IV (100 מ"ג/מ"ל) לכל מ"ל של תמיסת טריפסין. נפח של 1 מ"ל של פתרון יהיה צורך עבור כל מדגם של עוברים.
- יש להוסיף 1 מ"ל של תמיסת טריפסין/קולגנאז לכל דגימה של עוברים חלמונים ולדגור בטמפרטורה של 29°C למשך 30-35 דקות.
- פיפטה את העוברים למעלה ולמטה בתמיסה זו באמצעות קצה פיפטה 1 מ"ל כל 5 דקות עד שמבנה העוברים (עמוד השדרה) אינו נראה עוד.
- עצור את התגובה באמצעות 200 μL של FBS.
- יש לערבב היטב ולדגור בטמפרטורה של 29°C למשך 5 דקות נוספות כדי להבטיח השבתה מוחלטת של הטריפסין.
הערה: טמפרטורה של 29 °C משמשת לפרוטוקול דיסוציאציה של רקמות כדי למנוע מוות כתוצאה מהלם חום של תאי דגי זברה, המתרחש ב -37 °C; עם זאת, אם שימור של תאי דג זברה אינו נדרש, העיכול יכול להתבצע ב 37 מעלות צלזיוס. - משחררים את תרחיף התא ב 300 x גרם למשך 5 דקות ב 4 ° C ומשליכים את supernatant.
- השהה מחדש את גלולת התא ב 4 ° C PBS ואת הגלולה כנ"ל.
- חזור על השטיפה, ולאחר מכן סנן את התאים דרך מסננת תאים 70 מיקרומטר.
- גלולה ולהמשיך עם צביעה לניתוח ציטומטריית זרימה.
הערה: אם נדרשת תרבית של תאי דג זברה ראשוניים, יש לשטוף פעמיים נוספות עם PBS של 4°C ולהשהות מחדש במדיה L15 (עם אנטיביוטיקה ו-10% FBS).
11. מיון תאים המופעלים על ידי פלואורסצנטיות (FACS): צביעה ומיון של תאים מושתלים
- השהה מחדש את מתלה התא במדיום צביעה (HBSS עם 1% FBS) וגלולה ב 300 x גרם למשך 5 דקות.
- השהה מחדש את גלולת התא בתווך הצביעה עם נוגדן תגובתי עם התאים המושתלים כדי לספק סמן שני (בנוסף RFP או mCherry) שבו ניתן להבחין בין תאים מושתלים מתאי דג זברה. כאן, 50 μL של CD45 נגד עכברים (APC-CD45) לכל דגימה הופעל בדילול של 1:50 (איור 5).
- יש לדגור במשך 20 דקות ב-4°C לפני הכביסה כנ"ל עם 1 מ"ל של מדיום הכתמים כדי להסיר את הנוגדן הלא קשור.
- לאחר השלכת הסופרנטנט, יש להשהות מחדש את כדורית התא ב-200 מיקרוליטר של מדיום צביעה המכיל את הצבע החיוני Helix NP Blue (1 μM), שיאפשר הבחנה בין חיים למתים.
- העבר את תערובת התאים לצינורות פוליקרבונט תחתונים עגולים של 5 מ"ל לצורך ניתוח ציטומטריית זרימה.
הערה: צביעת בקרת תאי גידול במקביל מספקת בהירות לשרטוט שערים במהלך ניתוח ציטומטריית זרימה.
12. ציטומטריית זרימה
- הפעל את ציטומטר הזרימה הזמין באמצעות קצב זרימה נמוך (500 אירועים לשנייה או פחות) כדי להגדיר את הפרמטרים.
- השתמש בבקרת תאי הגידול (אותם תאים המשמשים להשתלת קסנו) כדי להגדיר את המתח עבור ערוצי FSC (פיזור קדמי), SSC (פיזור צד), BV421/CasB (כדאיות), CE-594 (mCherry) ו- APC (CD45.2).
הערה: דגימות מוכתמות בודדות יידרשו כדי לקבוע את הגדרות הפיצוי המבטלות חפיפה פלואורוכרום בין כתמים נפרדים. - השתמש בדגימת העובר הלא מורשה כדי לקבוע הגדרות המתאימות הן לתאי דג השתלה והן לתאי דג זברה.
- הגדל את קצב הזרימה ל- 8000 אירועים לשנייה ורשום מיליון אירועים עבור כל דגימה.
- נתח את הנתונים המתקבלים באמצעות תוכנת ניתוח מתאימה, תחילה בחירת סינגלים על ידי התוויית FSC-H לעומת / s FSC-A (גובה לעומת שטח s), ולאחר מכן תרשים לבחירת תאים קיימא. תוכנת FlowJo נמצאת בשימוש נרחב לניתוח כזה.
- באמצעות בקרת תאי הגידול, ציירו שער סביב התאים המושתלים על-ידי FSC-A לעומת SSC-A, ואז השתמשו בכתמי החיווי, במקרה זה, CD45 ו-mCherry (איור 5B).
הערה: שער הגודל שנבחר לגידול יכיל גם תאי דגי זברה, המספקים את הבסיס לנורמליזציה ולקביעת נטל המחלה. - נתח את דגימות העוברים באמצעות אותן הגדרות שער כמו לעיל. התרשים הסופי של כתם הגידול ומחוון החלבון הפלואורסצנטי יספק מדד לנטל המחלה (איור 5C).
הערה: כאן, ההבדל בנטל המחלה נקבע עבור עוברים שקיבלו בולוס טוב של תאים מוזרקים לעומת אלה שקיבלו בולוס נחות. - במידת הצורך, מיין את תאי הגידול בעוברים לפי ציטומטריית זרימה לצורך אנליזה מולקולרית במורד הזרם.
תוצאות
השתלת קסנו
מבט מקיף על כל הניסוי והניתוח מתואר באיור 1, החל מייצור עוברים ועד להערכת התקדמות המחלה הן על ידי הישרדות והן על ידי ניתוח נטל המחלה באמצעות ציטומטריית זרימה. גישה זו מביאה מספר שיפורים המשפרים את יכולת השחזור והמדרגיות של השתלת קסנו, כמו גם הוספת דרך חדשה להעריך את נטל המחלה. הצלחת ניסויים אלה תלויה מאוד בבריאות התאים המושתלים, שכן תאים שאינם בריאים ובשלב היומן אינם מצליחים להתרבות עם ההשתלה. משך ההזרקה הוא גם פרמטר קריטי. לאחר הכנת תאי הגידול, קריטי להשלים את ההזרקה לדגי זברה תוך 3-4 שעות. הגישה שבה נעשה שימוש במחקר זה מאפשרת להזריק מספר גדול יותר של עוברים במהלך פרק הזמן הזה באמצעות שינוי פשוט של הצבתם ישירות על צדם על צלחת אגרוז והזרקתם לחלמון (איור 2C,D). יתר על כן, זה הכרחי כי פתח המחט אופטימלי נבחר כך מספיק תאים מוזרקים (400-600 תאים) אבל הפתח הוא לא כל כך גדול כי העוברים נפגעים. שיקול נוסף הוא לחץ ההזרקה. אנו מוצאים כי לחצים גדולים מ 12-13 psi לשבש את החלמון של עוברים, גרימת מוות. לבסוף, שונות נוספת הטבועה בהליך זה היא עקביות ההזרקה. התאים שיש להזריק מתיישבים בקצה מחט ההזרקה, מה שהופך את השליטה המדויקת בבולוס ההזרקה למאתגרת. כאשר התאים מושתלים, לכל העוברים יש פוטנציאל לקבל את אותו בולוס בזריקה, אולם בפועל הם אינם מקבלים (איור 3). מספר התאים המועברים יכול להשתנות במידה רבה בהתאם להתנהגות תאי הגידול (למשל, גושים) ורמת המיומנות של המפעיל. התמודדנו עם חוסר ודאות זה באמצעות סימון צביעת CM-Dil / mCherry, המאפשר סיווג לאחר הזרקה של בעלי חיים שקיבלו בולוס תאים מתאים ועקבי, כמו גם אלה שקיבלו בולוס נחות. לצביעת CM-Dil, אך סימון יעיל יותר בחלבון פלואורסצנטי, יש יתרון נוסף בכך שהוא מאפשר מעקב אחר התקדמות המחלה, בין אם באמצעות מיקרוסקופיה או באמצעות ציטומטריית זרימה (איור 4 ואיור 5).
ניתוח התנהגות הגידול
ניתן לעקוב בקלות אחר התקדמות הגידול באמצעות מיקרוסקופ פלואורסצנטי פשוט המתמקד ב-RFP (איור 4A). באופן דומה, ניטור הישרדות מסורתי יכול להתבצע באמצעות ניתוח קפלן-מאייר (מבחן לוג-דרג ווילקוקסון) (איור 4B). באופן מרשים, בניגוד למחקרי השתלת קסנו מבוססי עכבר שבהם יש בדרך כלל 8-10 חיות בכל זרוע מחקר, בשיטת דגי הזברה שתוארה כאן, לא קשה להשיג זרועות מחקר עם יותר מ-60 חיות כל אחת (איור 4B). זה משפר באופן ניכר את כוח הפתרון של מחקרי in vivo. לבסוף, יישמנו גישה נוספת לניתוח נטל המחלה באמצעות ציטומטריית זרימה. זה כרוך בשיבוש של מספר שווה ערך של עוברים וניתוח התוכן התא הגידול של ההשעיה התאית הבודדת המתקבלת על ידי ציטומטריית זרימה. על-ידי שילוב סמן פני השטח של התא הספציפי לגידול עם מחוון החלבון הפלואורסצנטי, ניתן לזהות בביטחון עכברים/תאים אנושיים מושתלי קסנו באמצעות ציטומטריית זרימה כגישה להערכת נטל המחלה (איור 5). למטרה זו, חלבונים פלואורסצנטיים אדומים עדיפים מאחר שהחלבונים הפלואורסצנטיים הירוקים לא הצליחו לספק אות על פני האוטופלואורסצנטיות של תאי דג הזברה המארח. כאן, mCherry שימש עבור תיוג תאים וניטור במהלך xenotransplantation עבור ניתוח FACS יחד עם CD45. הסימון הכפול אפשר לנו למדוד הבדלים בנטל הגידול בין חיסון בולוס טוב לעומת נחות (איור 5B,C).
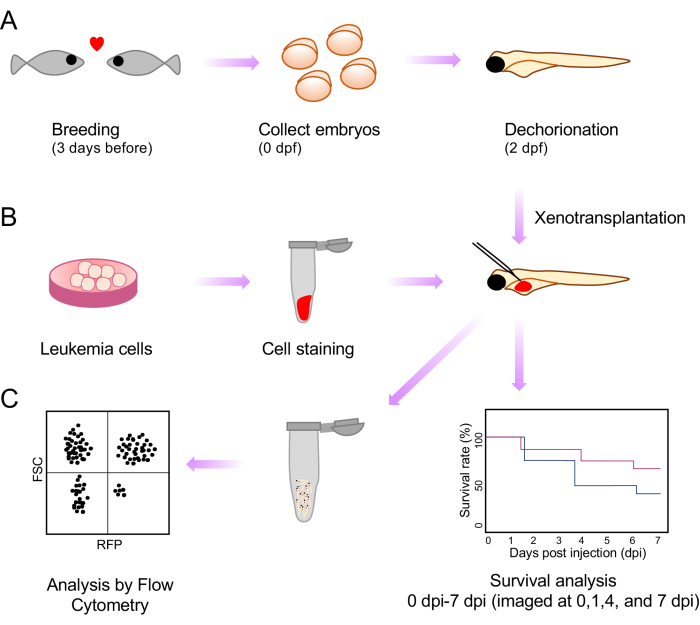
איור 1: סכמה של כל הליכי הניתוח של השתלת קסנו ולאחר הזרקה. (A) מערך הרבייה, איסוף העוברים ומורפולוגיה של יומיים לאחר ההפריה (dpf) סכמטיים. (B) הכנה, צביעה והזרקה של תאי לוקמיה להשתלת קסנו בחלמון של עוברי דגי זברה. (C) ניתוחים לאחר השתלת קסנו, כולל ציטומטריית הישרדות וזרימה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
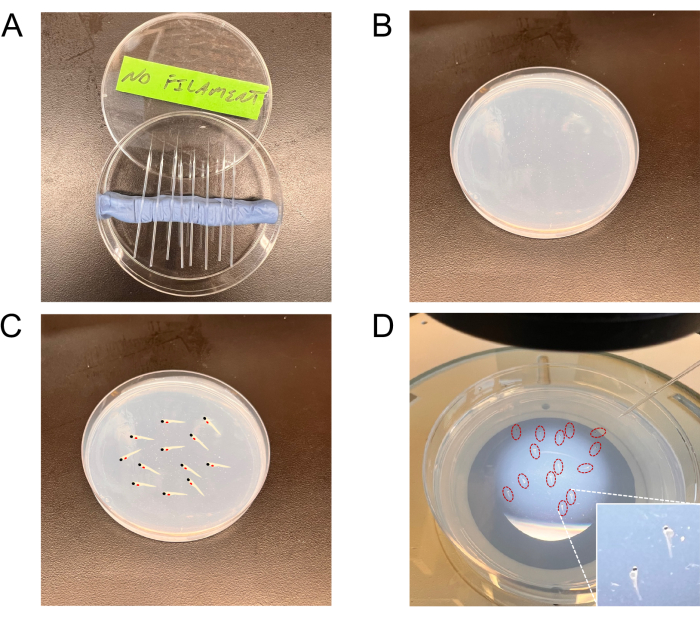
איור 2: תמונות מייצגות של הכלים ששימשו להזרקות. (A) מחטים משוכות בצלחת פטרי. (B) לוחית האגרוז לבימוי עוברים. (ג,ד) לוחית המציגה עוברים מבוימים (תרשים מייצג בלוח C ועוברים אמיתיים (מוקפים באדום) בלוח D) להזרקות על צלחת העמסת העוברים. הכניסה בפינה הימנית התחתונה של לוח D מציגה תצוגת הגדלה גבוהה יותר של העוברים בשלבים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
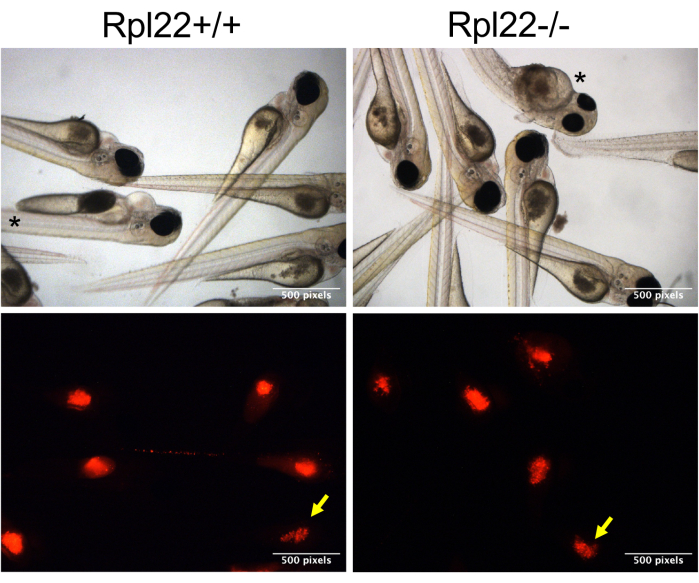
איור 3: תמונות מייצגות של עוברים מושתלי קסנו. מוצגות תמונות שדה בהיר ואימונופלואורסצנטי של תאים חיוביים לכתם CM-Dil (אדום) בחלמון עוברי קספר ברזולוציה של 1 dpi (תמונת מצמד). עוברים עם בולוס נחות מסומנים בחץ צהוב, ואילו עוברים עם מורפולוגיה מופרעת מסומנים בכוכבית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
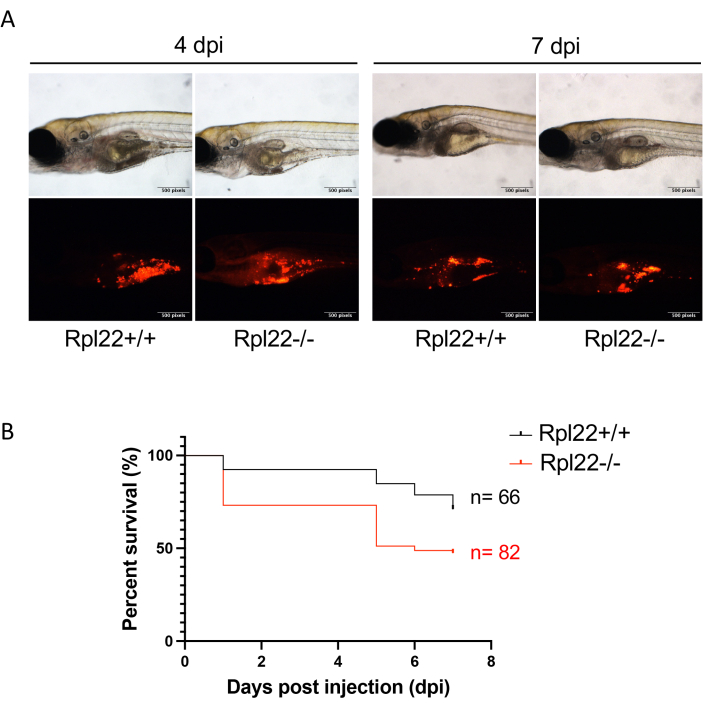
איור 4: הערכת התקדמות המחלה באמצעות הדמיה פלואורסצנטית וניתוח הישרדות. (A) תמונה מייצגת של עוברים מושתלים ב- 4 dpi ו- 7 dpi. (B) עלילת קפלן מאייר המציגה ניתוח הישרדות של עוברים בעלי שני קווי לוקמיה שונים גנטית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
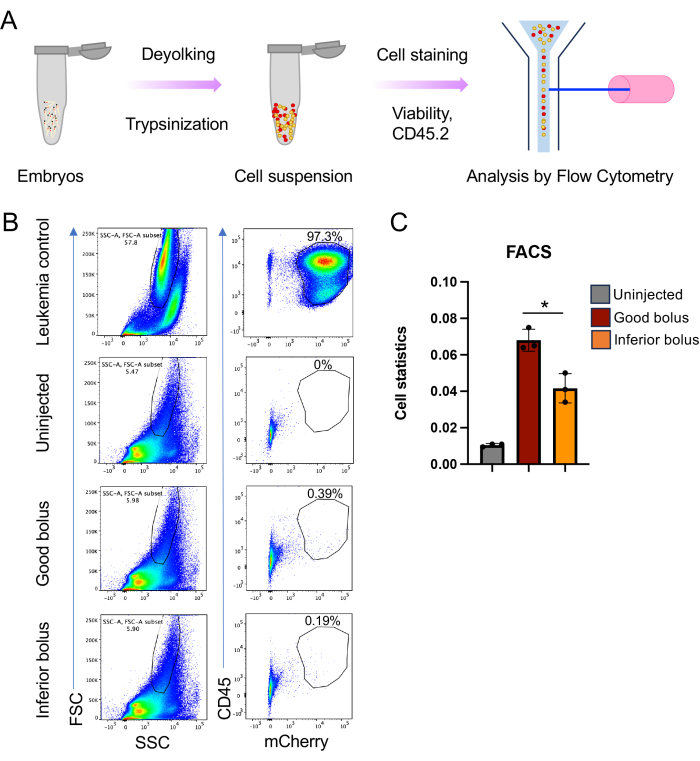
איור 5: ניתוח ציטומטרי של זרימה של נטל המחלה בדגי זברה מושתלים. (A) ייצוג סכמטי של הכנת תרחיף תאים וניתוח ציטומטריית זרימה. בקצרה, עוברים ב 4 dpi מפורקים לתרחיפים חד-תאיים באמצעות טריפסין וקולגנאז, ולאחר מכן ציטומטריית זרימה. (B) תרשימים מייצגים לניתוח ציטומטריית זרימה, כאשר התמונה השמאלית בכל פאנל היא FSC-A לעומת SSC-A והתמונה הימנית היא CD45 v/s mCherry signals. (C) גרף עמודות המציג את סטטיסטיקת התאים עבור תאים מושתלים קסנו כפי שהתקבלו מתרשים CD45 לעומת ms mCherry עבור עוברים חד פעמיים, טובים ונחותים (n = 45, 40 ו- 40 עבור כל משוכפל (n = 3); ערך p * ≤ 0.05, מחושב באמצעות מבחן t לא מזווג עם התיקון של וולש ב- GraphPad Prism 9). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
השתלת שדגי זברה התגלתה כחלופה מהירה, חזקה וחסכונית למחקרי עכברים12. למרות שדווחו מספר גישות להשתלת קסנו של דגי זברה, ההסתגלות שלנו הביאה לשיפור משמעותי. בנוסף לסטנדרטיזציה של הפרמטרים סביב ההליך, שיפורים אלה מתמקדים באופן ספציפי בהאצת הקצב שבו ניתן לבצע זריקות גידול, ובכך מאפשרים להגדיל את מספר בעלי החיים בכל זרוע מחקר ולהשתמש בסימון הגידול כדי לפקח על איכות ההזרקה וההתנהגות שלאחר ההזרקה.
בעוד שלשיפורים בשיטה זו המתוארים כאן יש פוטנציאל גדול, ביצוע מוצלח של אסטרטגיה זו ידרוש מתרגל מיומן ואופטימיזציה עבור היישום הספציפי. השתמשנו בתאי לוקמיה. כתוצאה מכך, השימוש בסרטן מוצק עשוי להביא אתגרים נוספים. גידולים כאלה עשויים להיות מועדים לצבירה, אשר תיצור שונות במסירת בולוס התא; עם זאת, גם בנסיבות כאלה, תיוג RFP אמור לאפשר בקרת איכות נאותה לאחר ההזרקה של הבולוס. זה עדיף על תיוג GFP או צבעים ירוקים, אשר מוסתרים על ידי autofluorescence. לבסוף, הסטנדרטיזציה המתוארת כאן של רוב הפרמטרים המשפיעים על ההצלחה (בריאות העובר, טמפרטורת החקלאות הימית, פתח המחט, לחץ ההזרקה וכו ') ממזערת את השונות של תהליך זה.
שיקול מרכזי בניסויי השתלת קסנו בדגי זברה הוא אתר ההזרקה. כאן, הראינו כי הזריקות בחלמון הן די קלות יחסית לאתרים אחרים מאתגרים יותר מבחינה טכנית, כמו חלל פריביטלין34, צינור של קיווייה35, והזרקה תוך לבבית (חדר הלב)36. החיסרון של הזרקת חלמון הוא שמדובר באיבר חיוני לעוברים הגדלים, ולכן יש להקפיד על שליטה קפדנית בקוטר המחט ובלחץ כדי שהעובר לא ימות עקב טראומה בהזרקה. הגישה המתוארת כאן מפחיתה חשש זה על ידי מזעור הפציעה והשלכת כל פציעה ברורה או מוות על ידי 1 dpi מכיוון שנושאים אלה אינם קשורים לצמיחת הגידול. השיקול האחרון לגבי אתר ההזרקה הוא שלמיקרו-סביבות שונות עשויה להיות יכולת גדולה יותר או פחותה לתמוך בהתפשטות גידולים מושתלים. כתוצאה מכך, אולי ניתן לבצע תחילה זריקות חלמון לפני שממשיכים לזריקות אורתוטופיות מאתגרות יותר. היתרון הגדול של הזרקת החלמון הוא בכך שהיא אינה דורשת היערכות מדויקת של העוברים ולכן מאפשרת הזרקה מהירה יותר של מספר גדול יותר של עוברים, ובכך שומרת טוב יותר על בריאותם ומגדילה את הכוח הסטטיסטי לפתור הבדלים בהתנהגות תאי הגידול המושתלים.
מעקב לאחר הזרקה אחר התקדמות המחלה מוערך בדרך כלל באמצעות השפעות על הישרדות באמצעות ניתוח קפלן-מאייר37; עם זאת, בדיקת נטל המחלה יכולה גם להיות אינפורמטיבית למדי. עבור תאים מושתלים הנותרים באתר ההזרקה, ניתן לכמת את נטל הגידול בשיטות מיקרוסקופיה שונות, בתנאי ששיטת הסימון של תאי הגידול אינה מוסתרת על ידי אוטופלואורסנציה29. כתם CM-Dil נפתר בקלות ואינו מושפע מאוטופלואורסצנציה, ולכן הוא פועל היטב לכימות נטל הגידול של תאים מקומיים. האתגר מתרחש כאשר תאי הגידול אינם נשארים באתר ההזרקה ומפיצים. במקרים כאלה, ציטומטריית זרימה, יחד עם סימון גנטי בל יימחה באמצעות חלבונים פלואורסצנטיים אדומים, היא דרך יעילה מאוד לניטור נטל המחלה במצמדים מתוקננים של עוברים, שכן ניתן לנתח את הגידול המסומן באמצעות כתמים ספציפיים למין שונים מתאי דגי הזברה. חסרון אחד של CM-דיל הוא שהוא מדולל על ידי חלוקת התא38. בהתאם לכך, הסתגלות באמצעות סימון גנטי של הגידולים באמצעות RFP או mCherry נושאת יתרונות משמעותיים. ביטוי mCherry, יחד עם נוגדן ספציפי לגידול, מאפשר זיהוי בטוח של תאים מושתלים בין מה שיכול להיות דפוס מורכב של אותות רקע המסופקים על ידי תאי דג הזברה המארח.
יחד, הגישה הממוטבת להשתלת קסנו של דגי זברה ושיטת הניתוח המשמשות במחקר זה מספקות שיפור משמעותי לפלטפורמה ניסיונית רבת עוצמה כבר.
Disclosures
המחברים מצהירים כי אין אינטרסים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי מענקי NIH R37AI110985 ו-P30CA006927, הקצאה מחבר העמים של פנסילבניה, האגודה ללוקמיה ולימפומה וקרן בישופ. מחקר זה נתמך גם על ידי מתקני הליבה של פוקס צ'ייס, כולל Cell Culture, Flow Cytometry ומתקן חיות מעבדה. אנו מודים לד"ר ג'ניפר רודס על תחזוקת דגי הזברה ומתקן המיקרו-הזרקה ב-FCCC.
Materials
| Name | Company | Catalog Number | Comments |
| 1-phenyl 2-thiourea (PTU) | Sigma | P7629 | |
| 70 micron cell strainer | Corning | CLS431751-50EA | |
| 90 mm Petri dish | Thermo Fisher Scientific | S43565 | |
| Agarose | Apex bioresearch | 20-102GP | |
| APC APC anti-mouse CD45.2 Antibody | Biolegend | 109814 | |
| BD FACSymphony A5 Cell Analyzer | BD Biosciences | BD FACSymphony A5 | |
| calibration capillaries | Sigma | P1424-1PAK | |
| Cell tracker CM-dil dye | Invitrogen | C7001 | |
| Collageanse IV | Gibco | 17104019 | |
| Dumont forceps number 55 | Fine science tools | 11255-20 | |
| FBS | Corning | 35-015-CV | |
| Fluorescence microscope | Nikon | model SMZ1500 | |
| Glass capillaries (Borosilicate) | World precision instruments | 1B100-4 | |
| HBSS | Corning | 21-023-CV | |
| Helix NP Blue | Biolegend | 425305 | |
| Instant Ocean Sea Salt | Instant ocean | SS15-10 | |
| Light microscope | Nikon | model SMZ1000 | |
| Methylene blue | Sigma | M9140-100G | |
| Microloader (long tips for laoding cells) | eppendorf | 930001007 | |
| P1000 micropipette puller | Sutter instruments | model P-97 | |
| PM 1000 cell microinjector | MicroData Instruments, Inc. (MDI) | PM1000 | |
| Tricaine methanesulphate (Ethyl 3- aminobenzoate methanesulphate) | Sigma | E10521-10G | |
| Trypsin-EDTA (0.5%), no phenol red | Gibco | 15400054 | |
| Zebrafish adult irradiated diet (dry feed) | Zeigler | 388763 |
References
- Sharma, G., Goyal, Y., Bhatia, S. Handbook of Animal Models and its Uses in Cancer Research. Preclinical Animal Models of Cancer: Applications and Limitations. , (2022).
- Singhal, S. S., et al. Recent advancement in breast cancer research: Insights from model organisms-Mouse models to zebrafish. Cancers. 15 (11), 2961 (2023).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduction and Targeted Therapy. 8 (1), 160 (2023).
- Fuochi, S., Galligioni, V. Disease Animal Models for Cancer Research. Cancer Cell Culture: Methods and Protocols. , (2023).
- Shaw, T. J., Senterman, M. K., Dawson, K., Crane, C. A., Vanderhyden, B. C. Characterization of intraperitoneal, orthotopic, and metastatic xenograft models of human ovarian cancer. Mol Ther. 10 (6), 1032-1042 (2004).
- Deroose, C. M., et al. Multimodality imaging of tumor xenografts and metastases in mice with combined small-animal PET, small-animal CT, and bioluminescence imaging. J Nucl Med. 48 (2), 295-303 (2007).
- Zeng, M., et al. Generation, evolution, interfering factors, applications, and challenges of patient-derived xenograft models in immunodeficient mice. Cancer Cell Int. 23 (1), 120 (2023).
- Adhish, M., Manjubala, I. Effectiveness of zebrafish models in understanding human diseases-A review of models. Heliyon. 9 (3), e14557 (2023).
- MacRae, C. A., Peterson, R. T. Zebrafish as a mainstream model for in vivo systems pharmacology and toxicology. Ann Rev Pharmacol Toxicol. 63, 43-64 (2023).
- Choe, S. -. K., Kim, C. -. H. Zebrafish: A powerful model for genetics and genomics. Int J Mol Sci. 24 (9), 8169 (2023).
- White, R., Rose, K., Zon, L. Zebrafish cancer: the state of the art and the path forward. Nat Rev Cancer. 13 (9), 624-636 (2013).
- Al-Hamaly, M. A., Turner, L. T., Rivera-Martinez, A., Rodriguez, A., Blackburn, J. S. Zebrafish cancer avatars: A translational platform for analyzing tumor heterogeneity and predicting patient outcomes. Int J Mol Sci. 24 (3), 2288 (2023).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Hill, D., Chen, L., Snaar-Jagalska, E., Chaudhry, B. Embryonic zebrafish xenograft assay of human cancer metastasis. F1000Res. 7, 1682 (2018).
- Corkery, D. P., Dellaire, G., Berman, J. N. Leukaemia xenotransplantation in zebrafish--chemotherapy response assay in vivo. Br J Haematol. 153 (6), 786-789 (2011).
- Lin, J., et al. A clinically relevant in vivo zebrafish model of human multiple myeloma to study preclinical therapeutic efficacy. Blood. 128 (2), 249-252 (2016).
- Grissenberger, S., et al. High-content drug screening in zebrafish xenografts reveals high efficacy of dual MCL-1/BCL-XL inhibition against Ewing sarcoma. Cancer Lett. 554, 216028 (2023).
- Baxi, D. Zebrafish: A Versatile Animal Model to Study Tumorigenesis Process and Effective Preclinical Drug Screening for Human Cancer Research. Handbook of Animal Models and its Uses in Cancer Research. , (2022).
- Li, X., Li, M. The application of zebrafish patient-derived xenograft tumor models in the development of antitumor agents. Med Res Rev. 43 (1), 212-236 (2023).
- Yin, J., et al. Zebrafish patient-derived xenograft model as a preclinical platform for uveal melanoma drug discovery. Pharmaceuticals. 16 (4), 598 (2023).
- Nakayama, J., Makinoshima, H., Gong, Z. In vivo drug screening to identify anti-metastatic drugs in Twist1a-ER(T2) transgenic zebrafish. Bio Protoc. 13 (10), e4673-e4673 (2023).
- Lam, S., Chua, H., Gong, Z., Lam, T., Sin, Y. Development and maturation of the immune system in zebrafish, Danio rerio: a gene expression profiling, in situ hybridization and immunological study. Dev Comp Immunol. 28 (1), 9-28 (2004).
- Nicoli, S., Presta, M. The zebrafish/tumor xenograft angiogenesis assay. Nat Protoc. 2 (11), 2918-2923 (2007).
- Casey, M. J., et al. Transplantation of zebrafish pediatric brain tumors into immune-competent hosts for long-term study of tumor cell behavior and drug response. J Vis Exp. (123), e55712 (2017).
- Soh, G. H., Kögler, A. C., Müller, P. A simple and effective transplantation device for zebrafish embryos. J Vis Exp. (174), e62767 (2021).
- Martinez-Lopez, M., Póvoa, V., Fior, R. Generation of zebrafish larval xenografts and tumor behavior analysis. J Vis Exp. (172), e62373 (2021).
- Ren, J., Liu, S., Cui, C., Ten Dijke, P. Invasive behavior of human breast cancer cells in embryonic zebrafish. J Vis Exp. (122), e55459 (2017).
- Zhao, C., et al. A novel xenograft model in zebrafish for high-resolution investigating dynamics of neovascularization in tumors. PloS One. 6 (7), e21768 (2011).
- Cabezas-Sáinz, P., Pensado-López, A., Sáinz Jr, B., Sánchez, L. Modeling cancer using zebrafish xenografts: drawbacks for mimicking the human microenvironment. Cells. 9 (9), 1978 (2020).
- Haraoka, Y., Akieda, Y., Ishitani, T. Live-imaging analyses using small fish models reveal new mechanisms that regulate primary tumorigenesis. Yakugaku Zasshi. 139 (5), 733-741 (2019).
- Westerfield, M. . The Zebrafish Book. A Guide for the Laboratory Use of Zebrafish (Danio rerio). , (2000).
- Rao, S., et al. Inactivation of ribosomal protein L22 promotes transformation by induction of the stemness factor, Lin28B. Blood. 120 (18), 3764-3773 (2012).
- Goel, M. K., Khanna, P., Kishore, J. Understanding survival analysis: Kaplan-Meier estimate. Int J Ayurveda Res. 1 (4), 274-278 (2010).
- Usai, A., Di Franco, G., Gabellini, C., Morelli, L., Raffa, V. Establishment of zebrafish patient-derived xenografts from pancreatic cancer for chemosensitivity testing. J Vis Exp. (195), e63744 (2023).
- Murali Shankar, N., et al. Preclinical assessment of CAR-NK cell-mediated killing efficacy and pharmacokinetics in a rapid zebrafish xenograft model of metastatic breast cancer. Front Immunol. 14, 1254821 (2023).
- Takahi, M., et al. Xenograft of human pluripotent stem cell-derived cardiac lineage cells on zebrafish embryo heart. Biochem Biophys Res Commun. 674, 190-198 (2023).
- Rudner, L. A., et al. Shared acquired genomic changes in zebrafish and human T-ALL. Oncogene. 30 (41), 4289-4296 (2011).
- Regan, J. L., et al. RNA sequencing of long-term label-retaining colon cancer stem cells identifies novel regulators of quiescence. iScience. 24 (6), 102618 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved