Method Article
一种简单、快速、有效的透明斑马鱼胚胎肿瘤异种移植分析方法
摘要
我们描述了一种将异种移植到透明斑马鱼胚胎卵黄中的方案,该方案通过一种简单、快速的分期方法进行了优化。注射后分析包括存活率和通过流式细胞术评估异种移植细胞的疾病负荷。
摘要
肿瘤行为的体内研究是癌症研究的主要内容;然而,小鼠的使用在成本和时间上提出了重大挑战。在这里,我们将斑马鱼幼虫作为一种移植模型,与鼠类模型相比,该模型具有许多优点,包括易于处理、成本低和实验时间短。此外,在幼虫阶段缺乏适应性免疫系统,因此无需产生和使用免疫缺陷菌株。虽然存在斑马鱼胚胎异种移植的既定方案,但我们在这里提出了一种改进的方法,包括胚胎分期以加快移植、存活分析以及使用流式细胞术评估疾病负担。对胚胎进行分期以促进细胞快速注射到幼虫的卵黄中,并进行细胞标记以监测注射细胞团的一致性。注射后,在注射后 7 天 (dpi) 评估胚胎存活分析。最后,还通过用荧光蛋白标记转移的细胞并通过流式细胞术进行分析来评估疾病负担。流式细胞术是通过从斑马鱼胚胎制备细胞悬液的标准化方法实现的,该方法也可用于建立斑马鱼细胞的原代培养物。总之,此处描述的程序允许更快速地评估肿瘤细胞在体内的行为,每个研究组的动物数量更多,并且以更具成本效益的方式。
引言
分析肿瘤对体内基因改变或药物治疗的反应是癌症研究的基本要素1,2,3,4。此类研究最常涉及使用免疫功能低下的小鼠(Mus musculus)模型5;然而,小鼠异种移植研究在许多方面都存在局限性,包括容量有限、持续时间延长、费用高昂以及需要复杂的成像设备来监测内部肿瘤的进展 6,7。相比之下,斑马鱼模型(Danio rerio)可实现更大的容量、更短的持续时间、更低的费用,并且由于其透明度,可以简单地监测疾病进展8,9。
斑马鱼是一种发达的脊椎动物模型系统,具有子宫外发育和高繁殖力,单个雌性产生 100 多个胚胎10.此外,斑马鱼胚胎是透明的,可以使用荧光相关技术(如报告基因)轻松可视化发育过程。最后,关键发育过程的保守性使它们成为许多类型研究的理想模型,包括移植恶性细胞的行为11,12。野生型斑马鱼胚胎发育出黑素细胞,使它们在 2 周大时光学不透明,但这已被 casper 胚胎的产生所克服(roya9;MITFAW2),它们在整个生命周期内保持透明13.由于其光学特性,卡斯珀斑马鱼是移植肿瘤细胞的理想受体14,15,16。将肿瘤细胞异种移植到斑马鱼中在过去 2 年中变得越来越重要 17,18,19,20,21。斑马鱼胚胎具有先天免疫力;然而,它们在幼虫阶段缺乏适应性免疫,使它们在功能性免疫功能上受损,这使它们能够作为移植肿瘤异种移植物的有效宿主22。
已经制定了用于斑马鱼胚胎和成虫胚胎中肿瘤植入的方案,这些方案考虑了许多不同的变量 23,24,25,26,27。这些研究探索了斑马鱼肿瘤沉积的许多位点,包括在卵黄、卵黄周间隙和心脏以及不同发育阶段的注射16,28。斑马鱼异种移植物水产养殖的环境温度也很重要,因为斑马鱼的饲养通常在28°C下进行,而哺乳动物细胞在37°C下生长。 因此,必须采用鱼能耐受但又支持肿瘤生长的折衷温度,而 34 °C 似乎可以实现这两个目标29.异种移植后肿瘤行为和进展的分析是另一个重点领域,这涉及使用各种成像模式以及生存分析30。斑马鱼模型的主要优点之一是可以获得大量研究动物,为肿瘤行为的体内研究提供巨大的统计能力;然而,由于注射需要繁琐的安装程序,以前的方法严重限制了这种潜力。
在这里,我们通过开发一种简单、快速的方法来解决这一限制,该方法可用于分期胚胎,从而实现高通量并使用透明 的casper 斑马鱼系监测注射质量。这需要在受精后 2 天 (dpf) 将异种移植物注射到 casper 斑马鱼胚胎的卵黄囊中。作为肿瘤行为分析的一部分,我们观察异种移植后胚胎的存活情况。我们通过制作单细胞悬浮液和流式细胞术分析进一步展示了异种移植后疾病负担的评估(图1)。
研究方案
斑马鱼的维持、摄食和饲养是在28.5°C的标准水产养殖条件下进行的,如所述31。所有与斑马鱼相关的实验都是在这个温度下进行的;然而,在异种移植之后,根据机构动物护理和使用委员会(IACUC)批准的程序,在实验期间将动物在34°C下培养。
1.养殖(注射前3天)
- 在繁殖前一周为鱼对提供干饲料(额外饲料;每条鱼5-6个颗粒),以最大限度地提高动物健康并增加繁殖对产生的胚胎数量。
- 在胚胎收获的前一天晚上,将繁殖动物设置在繁殖池中,用分隔器将雄性和雌性鱼分开,使用后宫交配,每个雄性2只雌性。
注意:对于每组 100 只动物的 4 对实验,每个实验使用 20 对育种对。为了确定所需的育种对数量,一个很好的估计是每个 casper 育种对有50个胚胎。另一种选择是采用更坚固的色素斑马鱼品系,并用 1-苯基 2-硫脲 (PTU) 处理以防止色素沉着31。在实践中,实验应该扩大规模,以便有足够的胚胎在注射后 1 天 (dpi) 注射两倍于所需数量。
2.胚胎采集(注射前2天)
- 第二天早上,取下分隔板,让鱼繁殖。
- 在移除分隔器后 20 分钟(分钟)观察罐中的胚胎。
- 在含有胚胎水的90毫米培养皿中使用筛子收集胚胎胚胎,如《斑马鱼》第31册所述。
- 要制备胚胎水,将 1.5 mL 储备盐加入 1 L 蒸馏水中,将亚甲蓝加入 0.1% 最终。通过将 40 克海盐(材料表)溶解在 1 升蒸馏水中来制备储备盐溶液。胚胎水的离子组成为K+ (0.68 mg/L)、Cl− (31.86 mg/L)、Na+ (17.77 mg/L)、SO4− (4.47 mg/L)、Mg2+ (2.14 mg/L)和Ca2+ (0.68 mg/L)。
- 让斑马鱼多繁殖一个小时,并收集产生的胚胎。
- 将胚胎集中进行实验。
- 晚上,取出所有未受精或死亡的胚胎,这些胚胎可以通过其异常形态来识别,并提供新鲜的胚胎水。
3.胚胎维护和注射工具准备(注射前1天)
- 第二天早上,取出任何额外的死胚胎,并提供新鲜的胚胎水。
- 通过在胚胎水中加热1.5%琼脂糖来制备琼脂糖板,并将加热的混合物倒入90mm培养皿中。一个 90 mM 培养皿需要 30-35 mL 的混合物。
- 使用拉针器从玻璃毛细管(硼硅酸盐)中拉出非丝针。针头被拉动(在热压下),产生一个封闭的一端;用镊子夹住它们以产生最佳孔口。通过确定每单位时间内排出的流体量来评估针孔的适用性(见下文,第 6.3 节)。
注意:玻璃毛细管可以带或不带中心细丝购买。缺乏中心细丝的毛细管是细胞注射的首选。 - 将针头放入有盖的90毫米培养皿中,放在用粘土(儿童造型粘土)制成的凹槽中,直至使用(图2A)。
4.用CM-Dil(注射日)制备和标记白血病细胞
- 将待移植细胞保持在最适合其生长的条件下。这里使用的鼠白血病细胞要么是足够的(M82;Rpl22+/+)或缺乏(M109;Rpl22-/-)为核糖体蛋白Rpl22,其起肿瘤抑制因子32的作用。
- 在 50 mL 锥形管中沉淀细胞。计数,然后在室温(RT)下以300× g 离心5分钟。丢弃上清液。
注意:所需的细胞数量将由实验范围和条件决定,但 1 x 106 细胞是一个很好的起点。 - 执行 CM-Dil 染色
注意:CM-Dil 染色可以监测注射推注。- 通过将 50 μg 小瓶 CM-Dil 重悬于 50 μL 二甲基亚砜 (DMSO;1 mg/mL 或 ~1 mM 最终) 中,制备 CM-Dil 储备溶液。
- 通过在含有细胞所需的任何支持性补充剂的 1% 胎牛血清 (FBS)/Hank 平衡盐溶液 (HBSS) 中稀释储备液(4.8 μL 染色剂/mL)来制备工作溶液。
- 将细胞以 1 x 106/100 μL 重悬于染色剂的工作溶液中。
- 在37°C孵育10分钟。
注意:染色条件必须针对所用的细胞(时间等)进行优化。此处使用的细胞需要在不同温度下进行两次不同的 10 分钟孵育,以获得最佳染色。 - 在室温 (RT) 下用 10 mL 1x HBSS 洗涤。
- 沉淀细胞(在室温下以 300 x g 离心 5 分钟),倒出上清液,然后用 10 mL HBSS 重悬并重复相同的第二次洗涤。
- 将染色的肿瘤细胞以 40,000 个细胞/μL 重悬于 1% FBS/PBS 和所需的任何支持性补充剂中,并将细胞悬浮液保持在 34 °C 直至注射。
注意:需要支持性补充剂来维持本研究中使用的细胞系(例如,1% FBS 和细胞因子)。补充剂和异种移植可能需要适应正在研究的特定细胞系。这里选择PBS而不是培养基,以避免蛋黄中的任何潜在毒性。
5. 疏松
- 在光学显微镜下,使用胰岛素注射器在2倍放大镜下以2dpf手动对 casper 斑马鱼胚胎进行去毛茸茸。用一根针刺穿绒毛膜,同时用另一根针固定绒毛膜。
注意:不建议使用鱼跃酶进行去角膜,因为它有时会导致胚胎健康降低。在 2 dpf 时对胚胎进行去角膜是首选,因为它更容易,并且胚胎比早期 (1 dpf) 更不脆弱。 - 去毛茸茸时,注意不要用针头接触胚胎。因无意中接触针头而触摸或损坏胚胎的卵黄可能会导致死亡。
- 通过更换胚胎水去除剥离的绒毛膜。
6. 设置显微注射器和针头
- 打开显微注射器和泵,并设置适合细胞显微注射的条件。9-11 psi 的注射压力和 0.5 秒 (s) 的注射时间是夹住针头和设置孔口的良好起点。
- 小心地将肿瘤细胞系悬浮液 (~5 μL) 一次性加载到微针中,避免形成气泡,这会破坏针内的细胞流。
- 用镊子(Dumont 5 号)切开针头的末端以产生一个孔口,该孔口将支持每 0.2-0.3 秒喷射 10-15 纳升 (nL) 细胞悬浮液。
注意:上述 nL 体积的计算是使用校准毛细管完成的,其中 1 mm = 30 nL。简而言之,将时间设置为 0.5 秒,每次夹针后,按压注入并在校准毛细管中收集体积。然后,在显微镜下使用刻度测量收集体积的长度,并在0.5秒内注射30nL时停止针夹。然后,将注射时间设置为 0.2-0.3 秒(注射 ~10-15 nL 细胞)
7. 胚胎注射准备
- 在显微镜下选择健康的胚胎,剔除任何有发育异常的胚胎,如心脏水肿或躯干短或弯曲。
- 在90mm培养皿中使用甲磺酸三卡因(MS-222;0.16g / L胚胎水)麻醉胚胎1分钟。
- 使用玻璃巴斯德移液管吸取胚胎。将10-15个胚胎在1.5%琼脂糖平板上横向排列(图2B-D)。
- 使用巴斯德移液管去除多余的水,留下保持胚胎存活所需的最少量胚胎水。
8. 注射程序
- 在光学显微镜下检查,确保细胞已积聚在针尖中。
- 使用校准的针头将胚胎注射0.2-0.3秒(10-15nL对应于400-600个细胞)在胚胎的卵黄中。
- 对所有胚胎重复注射,然后将它们收集在新鲜的胚胎水中。
注意:由于细胞往往会积聚在针尖上,因此每注射 15-20 次时需要稍微重新夹住针尖。这还需要在每次重新夹紧时重置压力和时间,以确保注入相似的体积。 - 为确保两组不同转移细胞的行为比较是有效的,请监测转移细胞的推注。通过在注射后 1 小时 (hpi) 根据 CM-Dil 染色(在 RFP 通道中)对胚胎进行分选来做到这一点,将具有最佳染色("良好推注")的胚胎与具有较差染色("劣质推注"; 图3,黄色箭头)。
- 丢弃劣质团块的胚胎,或使用它们来评估不同细胞剂量对疾病进展的影响。
- 在一天结束时取出任何死去的胚胎,因为它们的死亡与注射创伤有关,而不是肿瘤生长。从分析中取出不保留细胞的胚胎,因为细胞可能从注射部位泄漏出来。
- 在实验期间,将注射的胚胎保持在34°C,在90mm培养皿中,每个培养皿有~60个胚胎。
注意:5 dpf 后,卵黄将被生长中的胚胎消耗掉,因此在实验期间必须为胚胎提供草履虫食物。为确保适当的营养,草履虫应每天给胚胎注射 6 dpf (4 dpi) 至 9 dpf (7 dpi)。草履虫是通过在最佳营养和温度条件下在烧瓶中培养来繁殖的,如所述31。
9. 生存分析
- 监测胚胎接下来的 7 dpi,每天更换胚胎水。为方便起见,如果研究涉及药物治疗,换水时间可以减少到隔天。
- 在分析期间检查胚胎健康状况并对死亡进行评分。
注意:该实验的实验持续时间为 7 天,但根据异种移植肿瘤的侵袭性,实验持续时间可能更短或更长。 - 使用CM-Dil荧光评估疾病负担(图4A),并使用Kaplan Meier分析确定基因改变或药物治疗对生存率的影响,并以图形方式描述(例如,使用GraphPad Prism; 图4B)33.
10. 用于流式细胞术分析的胚胎单细胞悬浮液
注意:疾病负担可以通过异种移植后的流式细胞术分析来评估;然而,这样做需要对肿瘤细胞进行不可磨灭的标记。逆转录病毒或慢病毒递送的红色荧光蛋白 (RFP) 或 mCherry 是有效的,因为它在斑马鱼细胞的自发荧光上提供了良好的信号,从而掩盖了绿色荧光蛋白的信号。
- 在选择的dpi阶段分离胚胎。此处显示 5 dpi(图 5)。
- 每种条件收集 30-40 个胚胎作为起点,但胚胎数量可能因移植细胞的阶段和侵袭性而异。如上所述麻醉胚胎。
注意:胚胎可以细分为重复以提供统计显着性,如此处所示(图5B)。 - 将胚胎转移到 1.5 mL 离心管中。
- 每个样品使用 100 μL 无钙林格氏溶液(配方31)溶解蛋黄,因为低钙会软化胚胎组织,从而实现更有效的组织解离。
- 间歇地上下移液器 5 分钟,使用 200 μL 移液器吸头去除蛋黄。
- 将0.05%胰蛋白酶/ PBS(不含酚红指示剂)预热至29°C,并补充每mL胰蛋白酶溶液27μL胶原酶IV(100mg / mL)。每个胚胎样本需要 1 mL 溶液的体积。
- 向每个脱黄胚胎样品中加入1mL胰蛋白酶/胶原酶溶液,并在29°C下孵育30-35分钟。
- 每 5 分钟使用 1 mL 移液器吸头在该溶液中上下移液胚胎,直到胚胎的结构(骨架)不再可见。
- 使用 200 μL FBS 终止反应。
- 充分混合并在29°C下再孵育5分钟,以确保胰蛋白酶完全失活。
注:组织解离方案采用29°C的温度,以防止热休克诱导的斑马鱼细胞死亡,亡发生在37°C时;但是,如果不需要保存斑马鱼细胞,则可以在37°C下进行消化。 - 在4°C下以300× g 沉淀细胞悬浮液5分钟,并弃去上清液。
- 将细胞沉淀重悬于4°C PBS中,并如上所述沉淀。
- 重复洗涤,然后通过70μm细胞过滤器过滤细胞。
- 沉淀并进行染色以进行流式细胞术分析。
注意:如果需要培养原代斑马鱼细胞,用4°C PBS再洗涤两次,并重悬于L15培养基(用抗生素和10%FBS)中。
11. 荧光激活细胞分选(FACS):异种移植细胞的染色和分选
- 将细胞悬浮液重悬于染色培养基(含1%FBS)中,并以300× g 沉淀5分钟。
- 用与移植细胞反应的抗体将细胞沉淀重悬于染色培养基中,以提供第二个标记物(除了 RFP 或 mCherry)以区分移植细胞和斑马鱼细胞。在这里,每个样品采用50μL抗小鼠CD45(APC-CD45),稀释度为1:50(图5)。
- 在4°C下孵育20分钟,然后如上所述用1mL染色培养基洗涤以除去未结合的抗体。
- 丢弃上清液后,将细胞沉淀重悬于含有重要染料 Helix NP Blue (1 μM) 的 200 μL 染色培养基中,这将能够区分活/死。
- 将细胞混合物转移到 5 mL 圆底聚碳酸酯管中进行流式细胞术分析。
注:平行对肿瘤细胞对照进行染色可使流式细胞术分析期间的拉样门清晰。
12. 流式细胞术
- 打开可以使用低流速(每秒 500 个事件或更少)的流式细胞仪来设置参数。
- 使用肿瘤细胞对照(用于异种移植的相同细胞)设置 FSC(前向散射)、SSC(侧向散射)、BV421/CasB(活力)、CE-594(mCherry)和 APC(CD45.2)通道的电压。
注意:需要对单独染色的样品进行建立补偿设置,以消除不同染色剂之间的荧光染料重叠。 - 使用未注射的胚胎样本建立适合移植细胞和斑马鱼细胞的设置。
- 将流速提高到每秒 8000 个事件,并为每个样本记录 100 万个事件。
- 使用适当的分析软件分析结果数据,首先通过绘制 FSC-H 与 FSC-A(高度与 s 面积)来选择单峰,然后绘制用于选择活细胞的图。FlowJo 软件被广泛用于此类分析。
- 使用肿瘤细胞对照,通过FSC-A vs / s SSC-A在移植细胞周围绘制一个门,然后使用指示剂染色剂,在本例中为CD45和mCherry(图5B)。
注意:为肿瘤选择的大小门也将包含斑马鱼细胞,这为标准化和确定疾病负荷提供了基础。 - 使用与上述相同的门设置分析胚胎样品。肿瘤染色和荧光蛋白指示剂的最终图将提供疾病负担的量度(图5C)。
注:在这里,绘制了接受良好注射细胞团的胚胎与接受较差团肥的胚胎的疾病负担差异。 - 如果需要,通过流式细胞术对胚胎中的肿瘤细胞进行分选,以进行下游分子分析。
结果
异种移植
图1描绘了整个实验和分析的全面视图,从胚胎生产到通过流式细胞术分析生存和疾病负担分析来评估疾病进展。这种方法带来了一些改进,提高了异种移植的可重复性和可扩展性,并增加了一种评估疾病负担的新方法。这些实验的成功在很大程度上取决于移植细胞的健康状况,因为不健康且处于对数期的细胞在移植时无法繁殖。注射会话的持续时间也是一个关键参数。制备肿瘤细胞后,在3-4小时内完成注射到斑马鱼中至关重要。本研究中使用的方法可以通过简单的修改,直接将它们侧放在琼脂糖平板上并将它们注射到蛋黄中,从而可以在此时间范围内注射更多的胚胎(图2C,D)。此外,必须选择最佳的针孔,以便注射足够的细胞(400-600个细胞),但孔口不会太大以至于胚胎受伤。另一个考虑因素是注射压力。我们发现,大于 12-13 psi 的压力会破坏胚胎的蛋黄,导致死亡。最后,该过程固有的另一个可变性是注射的一致性。待注射的细胞沉降到注射针的末端,这使得注射推注的精确控制变得具有挑战性。当细胞被异种移植时,所有胚胎都有可能接受相同的注射推注,但在实践中,它们不会(图3)。转移的细胞数量可能因肿瘤细胞的行为(例如,聚集)和操作者的技能水平而有很大差异。我们已经通过CM-Dil染色/mCherry标记解决了这种不确定性,该标记可以对接受适当和一致的细胞团的动物以及接受劣质团注的动物进行注射后分类。CM-Dil染色,但更有效地使用荧光蛋白进行标记,具有额外的好处,即通过显微镜或流式细胞术监测疾病进展(图4和图5)。
肿瘤行为分析
使用聚焦RFP的简单荧光显微镜可以很容易地监测肿瘤进展(图4A)。同样,传统的生存监测可以通过Kaplan-Meier分析(Log-rank和Wilcoxon检验)进行(图4B)。令人印象深刻的是,与基于小鼠的异种移植研究相比,每个研究组通常有8-10只动物,使用此处描述的斑马鱼方法,不难实现每个研究臂超过60只动物(图4B)。这显着增强了体内研究的分辨能力。最后,我们实施了另一种使用流式细胞术进行疾病负荷分析的方法。这需要破坏等量的胚胎,并通过流式细胞术分析所得单细胞悬浮液的肿瘤细胞含量。通过将肿瘤特异性细胞表面标记物与荧光蛋白指示剂相结合,可以通过流式细胞术自信地识别异种移植的小鼠/人类细胞,作为评估疾病负担的一种方法(图5)。为此,红色荧光蛋白更胜一筹,因为绿色荧光蛋白未能在宿主斑马鱼细胞的自发荧光上提供信号。在这里,mCherry 用于在异种移植过程中进行细胞标记和监测,以便与 CD45 一起进行 FACS 分析。双重标记使我们能够测量良好接种与劣质推注接种之间肿瘤负荷的差异(图5B,C)。
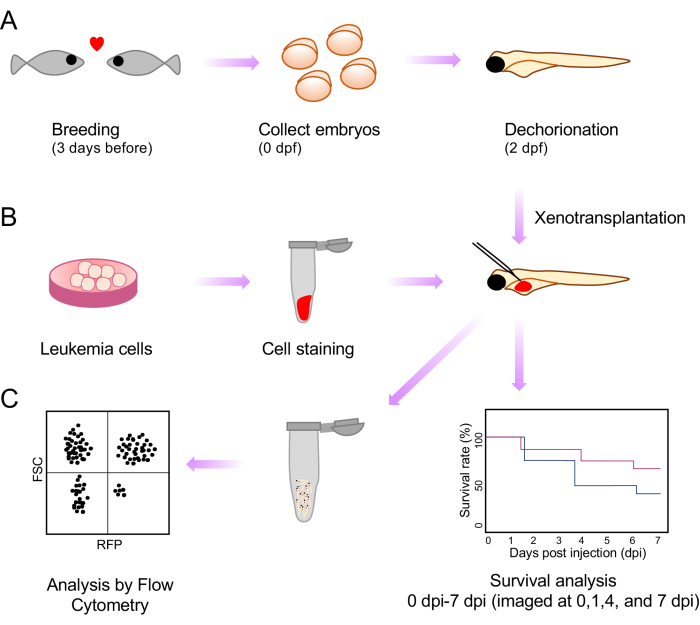
图 1:整个异种移植和注射后分析程序的示意图。 (A) 育种设置、胚胎收集和受精后 2 天 (dpf) 形态示意图。(B)斑马鱼胚胎卵黄中用于异种移植的白血病细胞的制备、染色和注射。(C) 异种移植后分析,包括存活率和流式细胞术。 请点击这里查看此图的较大版本.
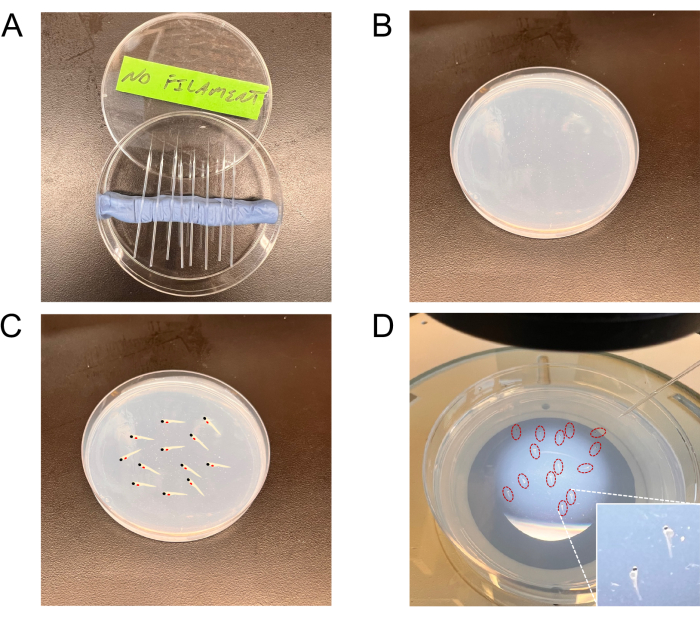
图 2:用于注射的工具的代表性图像。 (A) 在培养皿中拉针。(B) 用于胚胎分期的琼脂糖平板。(C,D)一块板,显示了在胚胎装载板上注射的胚胎(图C中的代表图和图D中的真实胚胎(用红色圈起来))。面板 D 右下角的插图显示了分期胚胎的更高放大视图。 请点击这里查看此图的较大版本.
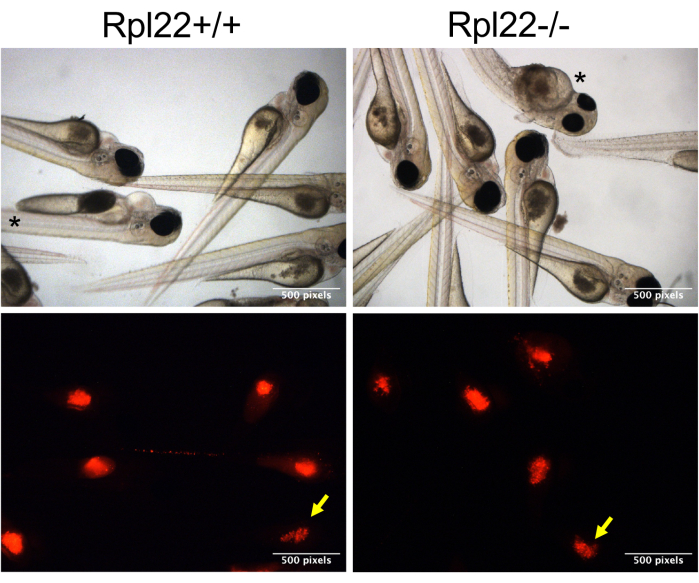
图3:异种移植胚胎的代表性图像。 明场和免疫荧光图像显示了 casper 胚胎蛋黄中 CM-Dil 染色(红色)阳性细胞,分辨率为 1 dpi(离合器图像)。具有下块状物的胚胎用黄色箭头表示,而具有紊乱形态的胚胎用星号表示。 请点击这里查看此图的较大版本.
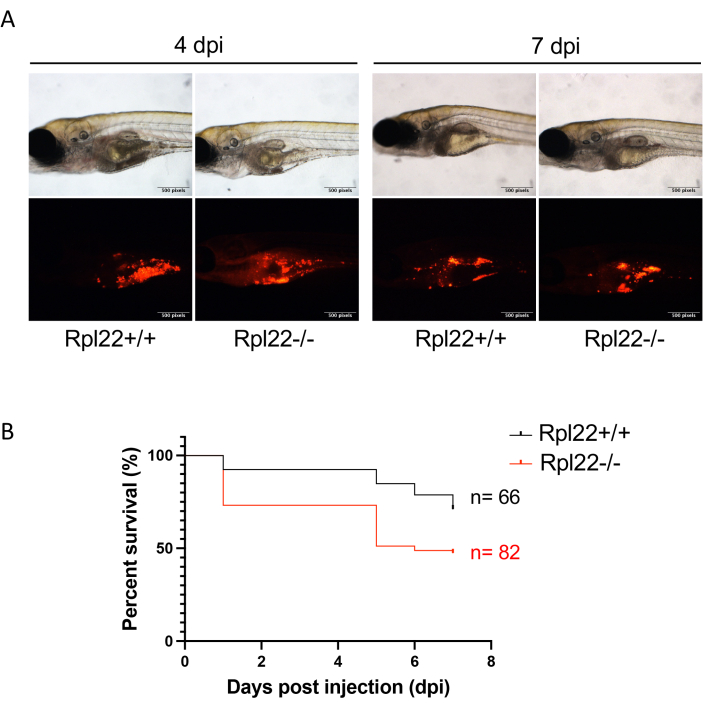
图 4:通过荧光成像和生存分析评估疾病进展。 (A) 4 dpi 和 7 dpi 时异种移植胚胎的代表性图像。(B) Kaplan Meier 图显示了具有两个遗传上不同的白血病系的胚胎的存活分析。 请点击这里查看此图的较大版本.
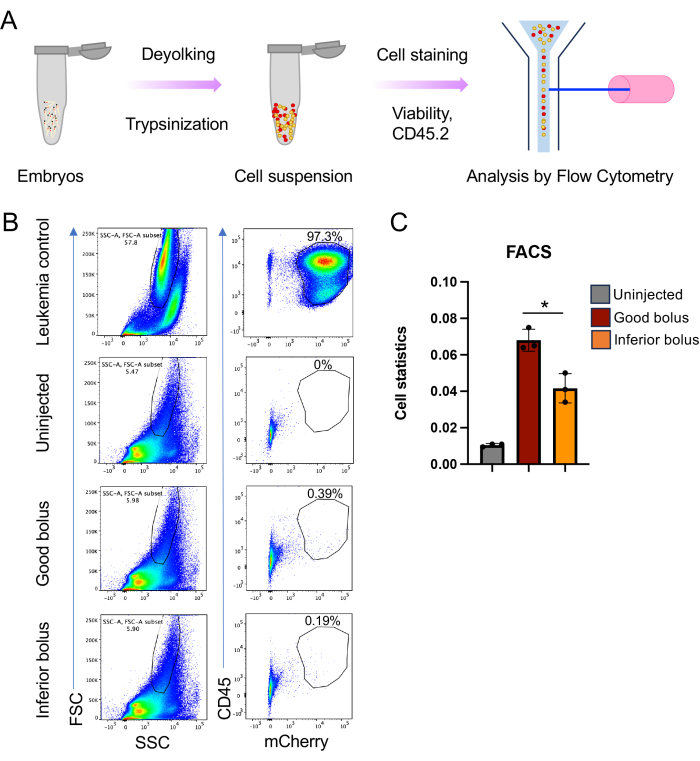
图5:异种移植斑马鱼疾病负荷的流式细胞术分析。 (A)细胞悬液制备和流式细胞术分析的示意图。简而言之,使用胰蛋白酶和胶原酶将4dpi的胚胎分解成单细胞悬浮液,然后进行流式细胞术。(B) 流式细胞术分析的代表性图,其中每个面板中的左侧图像是 FSC-A v/s SSC-A 图,右侧图像是 CD45 v/s mCherry 信号。(C) 条形图显示了从 CD45 v/s mCherry 图获得的异种移植细胞的细胞统计数据,适用于未注射、良好和劣质胚胎(每次重复 n = 45、40 和 40 (n = 3); p 值 * ≤ 0.05,使用未配对 t 检验和 GraphPad Prism 9 中的 Welch 校正计算)。 请点击这里查看此图的较大版本.
讨论
斑马鱼异种移植已成为小鼠研究的一种快速、稳健且具有成本效益的替代方案12.尽管已经报道了几种斑马鱼异种移植方法,但我们的适应已经带来了显着的改进。除了标准化程序的参数外,这些改进还特别侧重于加快肿瘤注射的速度,从而增加每个研究组的动物数量,并使用肿瘤标记来监测注射质量和注射后行为。
虽然这里描述的对这种方法的改进具有很大的潜力,但这种策略的成功执行将需要熟练的实践者和针对特定应用的优化。我们使用了白血病细胞。因此,使用实体癌可能会带来额外的挑战。这种肿瘤可能容易聚集,这将在细胞团的递送中产生可变性;然而,即使在这种情况下,RFP标签也应该能够对推注进行充分的注射后质量控制。这优于 GFP 标记或绿色染料,后者被自发荧光遮挡。最后,这里描述的大多数影响成功的参数(胚胎健康、水产养殖温度、针孔、注射压力等)的标准化最大限度地减少了这一过程的可变性。
斑马鱼异种移植实验的一个主要考虑因素是注射部位。在这里,我们已经表明,相对于其他技术上更具挑战性的部位,如卵黄碱间隙34、Cuvier 导管35 和心内注射(心室)36,卵黄中的注射非常容易。卵黄注射的缺点是它是胚胎生长的重要器官,因此必须注意确保针头直径和压力得到仔细控制,以免胚胎因注射创伤而死亡。这里描述的方法通过最大限度地减少伤害和丢弃任何明显的伤害或死亡 1 dpi 来减轻这种担忧,因为这些问题与肿瘤生长无关。关于注射部位的最后一个考虑因素是,不同的微环境可能或多或少地支持异种移植肿瘤的繁殖。因此,也许可以先进行蛋黄注射,然后再进行更具挑战性的原位注射。卵黄注射的主要优点是它不需要精确的胚胎分期,因此可以更快速地注射更多的胚胎,从而更好地保持它们的健康,并提高统计能力,以解决移植肿瘤细胞行为的差异。
疾病进展的注射后监测通常通过使用 Kaplan-Meier 分析对生存率的影响来评估37;然而,疾病负担检测也可以提供相当多的信息。对于留在注射部位的移植细胞,可以使用各种显微镜方法量化肿瘤负荷,前提是肿瘤细胞的标记方法不被自发荧光遮挡29。CM-Dil 染料易于分离且不受自发荧光的影响,因此非常适合定量定位细胞的肿瘤负荷。当肿瘤细胞没有留在注射部位并扩散时,就会发生挑战。在这种情况式细胞术与使用红色荧光蛋白的不可磨灭的基因标记相结合,是监测标准化胚胎群体中疾病负担的一种非常有效的方法,因为可以使用不同于斑马鱼细胞的物种特异性染色剂来分析标记的肿瘤。CM-Dil 的一个缺点是它被细胞分裂38 稀释。因此,使用RFP或mCherry对肿瘤进行基因标记的适应具有显着的好处。mCherry 表达与肿瘤特异性抗体相结合,能够在宿主斑马鱼细胞提供的复杂背景信号模式中可靠地识别移植细胞。
综上所述,本研究采用的优化斑马鱼异种移植方法和分析方法为本已强大的实验平台提供了实质性的改进。
披露声明
提交人声明没有竞争利益。
致谢
这项工作得到了美国国立卫生研究院 R37AI110985 和 P30CA006927 拨款的支持,这是宾夕法尼亚联邦、白血病和淋巴瘤协会以及主教基金的拨款。这项研究还得到了 Fox Chase 核心设施的支持,包括细胞培养、流式细胞术和实验动物设施。我们感谢 Jennifer Rhodes 博士维护 FCCC 的斑马鱼和显微注射设施。
材料
| Name | Company | Catalog Number | Comments |
| 1-phenyl 2-thiourea (PTU) | Sigma | P7629 | |
| 70 micron cell strainer | Corning | CLS431751-50EA | |
| 90 mm Petri dish | Thermo Fisher Scientific | S43565 | |
| Agarose | Apex bioresearch | 20-102GP | |
| APC APC anti-mouse CD45.2 Antibody | Biolegend | 109814 | |
| BD FACSymphony A5 Cell Analyzer | BD Biosciences | BD FACSymphony A5 | |
| calibration capillaries | Sigma | P1424-1PAK | |
| Cell tracker CM-dil dye | Invitrogen | C7001 | |
| Collageanse IV | Gibco | 17104019 | |
| Dumont forceps number 55 | Fine science tools | 11255-20 | |
| FBS | Corning | 35-015-CV | |
| Fluorescence microscope | Nikon | model SMZ1500 | |
| Glass capillaries (Borosilicate) | World precision instruments | 1B100-4 | |
| HBSS | Corning | 21-023-CV | |
| Helix NP Blue | Biolegend | 425305 | |
| Instant Ocean Sea Salt | Instant ocean | SS15-10 | |
| Light microscope | Nikon | model SMZ1000 | |
| Methylene blue | Sigma | M9140-100G | |
| Microloader (long tips for laoding cells) | eppendorf | 930001007 | |
| P1000 micropipette puller | Sutter instruments | model P-97 | |
| PM 1000 cell microinjector | MicroData Instruments, Inc. (MDI) | PM1000 | |
| Tricaine methanesulphate (Ethyl 3- aminobenzoate methanesulphate) | Sigma | E10521-10G | |
| Trypsin-EDTA (0.5%), no phenol red | Gibco | 15400054 | |
| Zebrafish adult irradiated diet (dry feed) | Zeigler | 388763 |
参考文献
- Sharma, G., Goyal, Y., Bhatia, S. Handbook of Animal Models and its Uses in Cancer Research. Preclinical Animal Models of Cancer: Applications and Limitations. , (2022).
- Singhal, S. S., et al. Recent advancement in breast cancer research: Insights from model organisms-Mouse models to zebrafish. Cancers. 15 (11), 2961 (2023).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduction and Targeted Therapy. 8 (1), 160 (2023).
- Fuochi, S., Galligioni, V. Disease Animal Models for Cancer Research. Cancer Cell Culture: Methods and Protocols. , (2023).
- Shaw, T. J., Senterman, M. K., Dawson, K., Crane, C. A., Vanderhyden, B. C. Characterization of intraperitoneal, orthotopic, and metastatic xenograft models of human ovarian cancer. Mol Ther. 10 (6), 1032-1042 (2004).
- Deroose, C. M., et al. Multimodality imaging of tumor xenografts and metastases in mice with combined small-animal PET, small-animal CT, and bioluminescence imaging. J Nucl Med. 48 (2), 295-303 (2007).
- Zeng, M., et al. Generation, evolution, interfering factors, applications, and challenges of patient-derived xenograft models in immunodeficient mice. Cancer Cell Int. 23 (1), 120 (2023).
- Adhish, M., Manjubala, I. Effectiveness of zebrafish models in understanding human diseases-A review of models. Heliyon. 9 (3), e14557 (2023).
- MacRae, C. A., Peterson, R. T. Zebrafish as a mainstream model for in vivo systems pharmacology and toxicology. Ann Rev Pharmacol Toxicol. 63, 43-64 (2023).
- Choe, S. -. K., Kim, C. -. H. Zebrafish: A powerful model for genetics and genomics. Int J Mol Sci. 24 (9), 8169 (2023).
- White, R., Rose, K., Zon, L. Zebrafish cancer: the state of the art and the path forward. Nat Rev Cancer. 13 (9), 624-636 (2013).
- Al-Hamaly, M. A., Turner, L. T., Rivera-Martinez, A., Rodriguez, A., Blackburn, J. S. Zebrafish cancer avatars: A translational platform for analyzing tumor heterogeneity and predicting patient outcomes. Int J Mol Sci. 24 (3), 2288 (2023).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Hill, D., Chen, L., Snaar-Jagalska, E., Chaudhry, B. Embryonic zebrafish xenograft assay of human cancer metastasis. F1000Res. 7, 1682 (2018).
- Corkery, D. P., Dellaire, G., Berman, J. N. Leukaemia xenotransplantation in zebrafish--chemotherapy response assay in vivo. Br J Haematol. 153 (6), 786-789 (2011).
- Lin, J., et al. A clinically relevant in vivo zebrafish model of human multiple myeloma to study preclinical therapeutic efficacy. Blood. 128 (2), 249-252 (2016).
- Grissenberger, S., et al. High-content drug screening in zebrafish xenografts reveals high efficacy of dual MCL-1/BCL-XL inhibition against Ewing sarcoma. Cancer Lett. 554, 216028 (2023).
- Baxi, D. Zebrafish: A Versatile Animal Model to Study Tumorigenesis Process and Effective Preclinical Drug Screening for Human Cancer Research. Handbook of Animal Models and its Uses in Cancer Research. , (2022).
- Li, X., Li, M. The application of zebrafish patient-derived xenograft tumor models in the development of antitumor agents. Med Res Rev. 43 (1), 212-236 (2023).
- Yin, J., et al. Zebrafish patient-derived xenograft model as a preclinical platform for uveal melanoma drug discovery. Pharmaceuticals. 16 (4), 598 (2023).
- Nakayama, J., Makinoshima, H., Gong, Z. In vivo drug screening to identify anti-metastatic drugs in Twist1a-ER(T2) transgenic zebrafish. Bio Protoc. 13 (10), e4673-e4673 (2023).
- Lam, S., Chua, H., Gong, Z., Lam, T., Sin, Y. Development and maturation of the immune system in zebrafish, Danio rerio: a gene expression profiling, in situ hybridization and immunological study. Dev Comp Immunol. 28 (1), 9-28 (2004).
- Nicoli, S., Presta, M. The zebrafish/tumor xenograft angiogenesis assay. Nat Protoc. 2 (11), 2918-2923 (2007).
- Casey, M. J., et al. Transplantation of zebrafish pediatric brain tumors into immune-competent hosts for long-term study of tumor cell behavior and drug response. J Vis Exp. (123), e55712 (2017).
- Soh, G. H., Kögler, A. C., Müller, P. A simple and effective transplantation device for zebrafish embryos. J Vis Exp. (174), e62767 (2021).
- Martinez-Lopez, M., Póvoa, V., Fior, R. Generation of zebrafish larval xenografts and tumor behavior analysis. J Vis Exp. (172), e62373 (2021).
- Ren, J., Liu, S., Cui, C., Ten Dijke, P. Invasive behavior of human breast cancer cells in embryonic zebrafish. J Vis Exp. (122), e55459 (2017).
- Zhao, C., et al. A novel xenograft model in zebrafish for high-resolution investigating dynamics of neovascularization in tumors. PloS One. 6 (7), e21768 (2011).
- Cabezas-Sáinz, P., Pensado-López, A., Sáinz Jr, B., Sánchez, L. Modeling cancer using zebrafish xenografts: drawbacks for mimicking the human microenvironment. Cells. 9 (9), 1978 (2020).
- Haraoka, Y., Akieda, Y., Ishitani, T. Live-imaging analyses using small fish models reveal new mechanisms that regulate primary tumorigenesis. Yakugaku Zasshi. 139 (5), 733-741 (2019).
- Westerfield, M. . The Zebrafish Book. A Guide for the Laboratory Use of Zebrafish (Danio rerio). , (2000).
- Rao, S., et al. Inactivation of ribosomal protein L22 promotes transformation by induction of the stemness factor, Lin28B. Blood. 120 (18), 3764-3773 (2012).
- Goel, M. K., Khanna, P., Kishore, J. Understanding survival analysis: Kaplan-Meier estimate. Int J Ayurveda Res. 1 (4), 274-278 (2010).
- Usai, A., Di Franco, G., Gabellini, C., Morelli, L., Raffa, V. Establishment of zebrafish patient-derived xenografts from pancreatic cancer for chemosensitivity testing. J Vis Exp. (195), e63744 (2023).
- Murali Shankar, N., et al. Preclinical assessment of CAR-NK cell-mediated killing efficacy and pharmacokinetics in a rapid zebrafish xenograft model of metastatic breast cancer. Front Immunol. 14, 1254821 (2023).
- Takahi, M., et al. Xenograft of human pluripotent stem cell-derived cardiac lineage cells on zebrafish embryo heart. Biochem Biophys Res Commun. 674, 190-198 (2023).
- Rudner, L. A., et al. Shared acquired genomic changes in zebrafish and human T-ALL. Oncogene. 30 (41), 4289-4296 (2011).
- Regan, J. L., et al. RNA sequencing of long-term label-retaining colon cancer stem cells identifies novel regulators of quiescence. iScience. 24 (6), 102618 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。