Method Article
Um método simples, rápido e eficaz para análise de xenotransplante tumoral em embriões transparentes de peixe-zebra
Neste Artigo
Resumo
Descrevemos um protocolo de xenotransplante na gema de embriões transparentes de peixe-zebra que é otimizado por um método de estadiamento simples e rápido. As análises pós-injeção incluem sobrevida e avaliação da carga da doença de células xenotransplantadas por citometria de fluxo.
Resumo
Estudos in vivo do comportamento do tumor são um elemento básico da pesquisa do câncer; no entanto, o uso de camundongos apresenta desafios significativos em custo e tempo. Aqui, apresentamos o peixe-zebra larval como um modelo de transplante que apresenta inúmeras vantagens sobre os modelos murinos, incluindo facilidade de manuseio, baixo custo e curta duração experimental. Além disso, a ausência de um sistema imunológico adaptativo durante os estágios larvais evita a necessidade de gerar e usar cepas imunodeficientes. Embora existam protocolos estabelecidos para xenotransplante em embriões de peixe-zebra, apresentamos aqui um método aprimorado envolvendo o estadiamento embrionário para transferência mais rápida, análise de sobrevivência e o uso de citometria de fluxo para avaliar a carga da doença. Os embriões são preparados para facilitar a injeção rápida de células na gema das larvas e a marcação celular para monitorar a consistência do bolo celular injetado. Após a injeção, a análise de sobrevivência do embrião é avaliada até 7 dias após a injeção (dpi). Finalmente, a carga da doença também é avaliada marcando as células transferidas com uma proteína fluorescente e análise por citometria de fluxo. A citometria de fluxo é possibilitada por um método padronizado de preparação de suspensões celulares de embriões de peixe-zebra, que também pode ser usado no estabelecimento da cultura primária de células de peixe-zebra. Em resumo, o procedimento descrito aqui permite uma avaliação mais rápida do comportamento das células tumorais in vivo com maior número de animais por braço de estudo e de maneira mais econômica.
Introdução
A análise do comportamento dos tumores em resposta à alteração genética ou ao tratamento medicamentoso in vivo é um elemento essencial da pesquisa do câncer 1,2,3,4. Tais estudos geralmente envolvem o uso de modelos de camundongos imunocomprometidos (Mus musculus)5; No entanto, os estudos de xenotransplante em camundongos são limitados em muitos aspectos, incluindo capacidade limitada, duração prolongada, despesas significativas e a necessidade de equipamentos de imagem sofisticados para monitorar a progressão de tumores internos 6,7. Por outro lado, o modelo zebrafish (Danio rerio) permite maior capacidade, menor duração, menor gasto e, devido à sua transparência, monitoramento simples da progressão da doença 8,9.
O peixe-zebra é um sistema modelo de vertebrado bem desenvolvido com desenvolvimento ex-útero e alta fecundidade, com fêmeas individuais produzindo mais de 100 embriões10. Além disso, os embriões de peixe-zebra são transparentes, permitindo fácil visualização dos processos de desenvolvimento usando técnicas relacionadas à fluorescência, como repórteres. Finalmente, a conservação de processos críticos de desenvolvimento os torna um modelo ideal para muitos tipos de estudos, incluindo o comportamento de células malignas transplantadas 11,12. Os embriões de peixe-zebra do tipo selvagem desenvolvem melanócitos, que os tornam opticamente opacos às 2 semanas de idade, mas isso foi superado pela geração de embriões de casper (roya9; mitfaw2), que permanecem transparentes ao longo da vida13. Devido às suas propriedades ópticas, o peixe-zebra casper é um receptor ideal de células tumorais transplantadas 14,15,16. O xenotransplante de células tumorais em peixe-zebra ganhou importância nas últimas 2 décadas 17,18,19,20,21. Os embriões de peixe-zebra têm imunidade inata; no entanto, eles carecem de imunidade adaptativa durante o estágio larval, tornando-os funcionalmente imunocomprometidos, o que lhes permite servir como hospedeiros eficazes para xenoenxertos tumorais transplantados22.
Protocolos foram desenvolvidos para enxerto tumoral em embriões de peixe-zebra, bem como em adultos, que consideraram uma série de variáveis diferentes 23,24,25,26,27. Estes exploraram vários locais de deposição tumoral em peixe-zebra, incluindo injeções na gema, espaço perivitelino e coração e em diferentes estágios de desenvolvimento 16,28. A temperatura ambiente da aquicultura para xenoenxertos de peixe-zebra também é importante, pois a criação de peixe-zebra normalmente ocorre a 28 ° C, enquanto as células de mamíferos crescem a 37 ° C. Consequentemente, uma temperatura de compromisso deve ser empregada que seja tolerada pelos peixes, mas que suporte o crescimento do tumor, e 34 ° C parece atingir ambos os objetivos29. A análise do comportamento e progressão dos tumores após o xenotransplante é outra área importante de foco, e isso envolve o uso de uma variedade de modalidades de imagem, bem como a análise de sobrevida30. Uma das principais vantagens do modelo de peixe-zebra é a disponibilidade de um grande número de animais de estudo para fornecer imenso poder estatístico aos estudos in vivo do comportamento do tumor; no entanto, as abordagens anteriores limitaram severamente esse potencial devido à necessidade de procedimentos de montagem tediosos para injeções.
Aqui, abordamos essa limitação por meio do desenvolvimento de um método simples e rápido para estadiar embriões que permite alto rendimento e monitoramento da qualidade da injeção usando a linha transparente de peixe-zebra. Isso envolve a injeção de xenoenxertos no saco vitelino dos embriões de peixe-zebra casper 2 dias após a fertilização (dpf). Observamos a sobrevivência de embriões após xenotransplante como parte da análise do comportamento tumoral. Mostramos ainda a avaliação da carga da doença após o xenotransplante por meio de suspensões de células únicas e análise por citometria de fluxo (Figura 1).
Protocolo
A manutenção, alimentação e criação do peixe-zebra ocorreram em condições padrão de aquicultura a 28,5 ° C, conforme descrito31. Todos os experimentos relacionados ao peixe-zebra foram feitos nessa temperatura; no entanto, após o xenotransplante, os animais foram cultivados a 34 °C durante o experimento, de acordo com os procedimentos aprovados pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC).
1. Reprodução (3 dias antes da injeção)
- Forneça ração seca (ração extra; 5-6 grânulos por peixe) aos pares de peixes uma semana antes da reprodução para maximizar a saúde animal e aumentar o número de embriões produzidos pelos casais reprodutores.
- Na noite anterior à colheita do embrião, coloque os animais reprodutores em tanques de reprodução com uma divisória separando os peixes machos e fêmeas, usando acasalamentos de harém de 2 fêmeas para cada macho.
NOTA: Para experimentos com 4 braços de 100 animais por braço, empregue 20 casais reprodutores por experimento. Para determinar o número de casais reprodutores necessários, uma boa estimativa é de 50 embriões por casal reprodutor de casper . Outra opção é empregar uma cepa de peixe-zebra mais robusta e pigmentada e tratar com 1-fenil 2-tioureia (PTU) para prevenir a pigmentação31. Na prática, o experimento deve ser dimensionado de forma que se tenha embriões suficientes para injetar o dobro do número desejado 1 dia após a injeção (dpi).
2. Coleta de embriões (2 dias antes da injeção)
- Na manhã seguinte, remova as divisórias, permitindo que os peixes se reproduzam.
- Visualize os embriões nos tanques 20 minutos (min) após a remoção dos divisores.
- Colete os embriões usando uma peneira em uma placa de Petri de 90 mm contendo água de embriões feita conforme descrito no The Zebrafish Book31.
- Para fazer água embrionária, adicione 1,5 mL de sais de estoque a 1 L de água destilada e azul de metileno a 0,1% final. Faça a solução salina de estoque dissolvendo 40 g de sais marinhos (Tabela de Materiais) em 1 L de água destilada. A composição iônica da água embrionária é K+ (0,68 mg/L), Cl− (31,86 mg/L), Na+ (17,77 mg/L), SO4− (4,47 mg/L), Mg2+ (2,14 mg/L) e Ca2+ (0,68 mg/L).
- Deixe o peixe-zebra se reproduzir por mais uma hora e colete os embriões resultantes.
- Agrupe os embriões para o experimento.
- À noite, remova todos os embriões não fertilizados ou mortos, que são reconhecíveis por sua morfologia anormal, e forneça água fresca para os embriões.
3. Manutenção do embrião e preparação da ferramenta para injeções (1 dia antes da injeção)
- Na manhã seguinte, remova quaisquer embriões mortos adicionais e forneça água fresca para o embrião.
- Prepare uma placa de agarose aquecendo 1,5% de agarose em água de embrião e despeje a mistura aquecida em uma placa de Petri de 90 mm. Um prato de 90 mm requer 30-35 mL da mistura.
- Puxe agulhas sem filamento de capilares de vidro (borossilicato) usando o extrator de agulhas. As agulhas são puxadas (sob pressão de calor) produzindo uma extremidade fechada; Prenda-os com uma pinça para gerar um orifício ideal. Avalie a adequação do orifício da agulha determinando o volume de fluido deslocado por unidade de tempo (ver abaixo, secção 6.3).
NOTA: Os capilares de vidro podem ser adquiridos com ou sem filamentos centrais. Os capilares sem filamentos centrais são preferidos para injeções de células. - Colocar as agulhas em uma placa de Petri de 90 mm coberta nas ranhuras feitas com argila (argila de modelar kids) até o uso (Figura 2A).
4. Preparação e marcação de células de leucemia com CM-Dil (dia da injeção)
- Manter as células a serem transplantadas em condições ideais para seu crescimento. As células de leucemia murina empregadas aqui foram suficientes (M82; Rpl22+/+) ou deficiente (M109; Rpl22-/-) para a proteína ribossômica Rpl22, que funciona como um supressor tumoral32.
- Células de pellets em um tubo cônico de 50 mL. Contar e centrifugar a 300 x g à temperatura ambiente (RT) durante 5 min. Descarte o sobrenadante.
NOTA: O número de células necessárias será ditado pelo escopo e condições experimentais, mas 1 x 106 células é um bom ponto de partida. - Realize a coloração CM-Dil
NOTA: A coloração CM-Dil permite o monitoramento do bolus de injeção.- Faça uma solução estoque de CM-Dil ressuspendendo um frasco de 50 μg de CM-Dil em 50 μL de dimetilsulfóxido (DMSO; 1 mg / mL ou ~ 1 mM final).
- Produza uma solução de trabalho diluindo o estoque (4,8 μL de corante/mL) em soro fetal bovino a 1% (FBS)/solução salina balanceada de Hank (HBSS) contendo quaisquer suplementos de suporte necessários para as células a serem usadas.
- Ressuspenda as células a 1 x 106/100 μL na solução de trabalho da mancha.
- Incubar a 37 °C durante 10 min.
NOTA: As condições de coloração devem ser otimizadas para as células empregadas (tempo, etc). As células usadas aqui exigiram duas incubações distintas de 10 minutos em diferentes temperaturas para obter a coloração ideal. - Lavar com 10 mL de 1x HBSS à temperatura ambiente (RT).
- Células de pellets (centrifugação a 300 x g por 5 min em RT), decantar o sobrenadante, depois ressuspender com 10 mL de HBSS e repetir o mesmo para uma segunda lavagem.
- Ressuspenda as células tumorais coradas a 40.000 células/μL em 1% de FBS/PBS e quaisquer suplementos de suporte necessários e mantenha a suspensão celular a 34 °C até a injeção.
NOTA: Suplementos de suporte foram necessários para a manutenção das linhagens celulares usadas neste estudo (por exemplo, 1% de FBS e citocinas). Os suplementos e o xenotransplante podem precisar ser adaptados às linhagens celulares específicas em estudo. O PBS foi selecionado aqui em vez de meio para evitar qualquer toxicidade potencial na gema.
5. Descorionação
- Descorionate os embriões de peixe-zebra casper manualmente a 2 dpf usando seringas de injeção de insulina com ampliação de 2x em um microscópio de luz. Perfure o córion com uma agulha enquanto usa a outra agulha para imobilizar o córion.
NOTA: O uso de pronase para descorionação não é recomendado porque às vezes resulta em redução da saúde do embrião. A descorionização dos embriões a 2 dpf é preferível porque é mais fácil e os embriões são menos frágeis do que em épocas anteriores (1 dpf). - Durante a descorionização, tome cuidado para não tocar nos embriões com as agulhas. Tocar ou danificar a gema dos embriões por contato inadvertido com as agulhas pode causar a morte.
- Remova os córions descascados trocando a água do embrião.
6. Configurando o microinjetor e a agulha
- Ligue o microinjetor e a bomba e configure as condições adequadas para microinjeções de células. Uma pressão de injeção de 9-11 psi e um tempo de injeção de 0,5 segundos (s) são um bom ponto de partida para cortar a agulha e ajustar o orifício.
- Carregue a suspensão da linha de células tumorais (~ 5 μL) na microagulha cuidadosamente em uma única passagem, evitando a formação de bolhas de ar, que interromperão o fluxo celular dentro da agulha.
- Corte a ponta da agulha com uma pinça (Dumont número 5) para produzir um orifício que suportará a ejeção de 10-15 nanolitros (nL) de suspensão celular por 0,2-0,3 s.
NOTA: O cálculo acima do volume de nL é feito usando capilares de calibração, onde 1 mm = 30 nL. Em resumo, defina o tempo para 0,5 s e, após cada clipe da agulha, pressione injetar e colete o volume no capilar de calibração. Em seguida, o comprimento do volume coletado é medido usando a escala ao microscópio e o corte da agulha é interrompido quando 30 nL são injetados em 0,5 s. Em seguida, defina o tempo de injeções como 0,2-0,3 s. (injetando ~ 10-15 nL de células)
7. Preparação de embriões para injeção
- Selecione embriões saudáveis ao microscópio, eliminando qualquer um com anomalias de desenvolvimento, como edema cardíaco ou tronco curto ou curvo.
- Anestesiar os embriões com metanossulfonato de tricaína (MS-222; 0,16 g/L de água embrionária) por 1 min em uma placa de Petri de 90 mm.
- Use uma pipeta de vidro Pasteur para pegar os embriões. Organize 10-15 embriões em posição lateral na placa de agarose a 1,5% (Figura 2B-D).
- Remova o excesso de água usando a pipeta Pasteur, deixando a quantidade mínima de água embrionária necessária para manter os embriões vivos.
8. Procedimento de injeção
- Verifique sob o microscópio óptico para garantir que as células se acumularam na ponta da agulha.
- Injete os embriões usando a agulha calibrada por 0,2-0,3 s (com 10-15 nL correspondendo a 400-600 células) na gema dos embriões.
- Repita a injeção para todos os embriões e colete-os em água fresca para embriões.
NOTA: Como as células tendem a se acumular na ponta da agulha, a ponta precisará ser recortada ligeiramente a cada 15-20 injeções. Isso também exigirá a redefinição da pressão e do tempo a cada recorte para garantir que um volume semelhante seja injetado. - Para garantir que a comparação do comportamento de dois conjuntos distintos de células transferidas seja válida, monitore o bolo de células transferidas. Faça isso classificando os embriões com base na coloração CM-Dil (no canal RFP) 1 hora após a injeção (hpi), separando aqueles com coloração ideal ("bolo bom") daqueles com coloração inferior ("bolo inferior"; Figura 3, seta amarela).
- Descarte os embriões com um bolo inferior ou use-os para avaliar o impacto de uma dose celular diferente na progressão da doença.
- Remova todos os embriões mortos até o final do dia, pois sua morte está relacionada ao trauma da injeção, e não ao crescimento do tumor. Remova da análise embriões que não retêm células, pois as células provavelmente vazaram do local da injeção.
- Manter os embriões injectados a 34 °C durante a experiência numa placa de 90 mm com ~60 embriões por placa.
NOTA: Após 5 dpf, a gema terá sido consumida pelos embriões em crescimento, portanto, os embriões devem receber alimento paramécio durante o experimento. Para garantir uma nutrição adequada, a paramécia deve ser administrada aos embriões diariamente de 6 dpf (4 dpi) a 9 dpf (7 dpi). Os paramécios são propagados por cultura em frascos em condições ideais de nutrição e temperatura, conforme descrito31.
9. Análise de sobrevivência
- Monitore os embriões pelos próximos 7 dpi, trocando a água do embrião diariamente. As trocas de água podem ser reduzidas para dias alternados por conveniência se o estudo envolver tratamento medicamentoso.
- Verifique a saúde do embrião e marque a morte durante a análise.
NOTA: A duração experimental foi de 7 dias para este experimento, mas pode ser menor ou mais longa, dependendo da agressividade do tumor xenotransplantado. - Use a fluorescência CM-Dil para avaliar a carga da doença (Figura 4A) e determinar o impacto de alterações genéticas ou tratamentos medicamentosos na sobrevida usando a análise de Kaplan Meier e represente graficamente (por exemplo, com GraphPad Prism; Figura 4B) 33.
10. Suspensão unicelular de embriões para análise por citometria de fluxo
NOTA: A carga da doença pode ser avaliada por análise de citometria de fluxo após xenotransplante; no entanto, isso requer uma marcação indelével das células tumorais. A proteína fluorescente vermelha (RFP) ou mCherry fornecida retroviral ou lentiviralmente é eficaz, pois fornece um bom sinal sobre a autofluorescência das células do peixe-zebra, o que obscurece o sinal da proteína fluorescente verde.
- Isole os embriões no estágio dpi de escolha. 5 dpi são exibidos aqui (Figura 5).
- Reúna de 30 a 40 embriões por condição como ponto de partida, mas o número de embriões pode diferir dependendo do estágio e da agressividade das células transplantadas. Anestesiar os embriões conforme descrito acima.
NOTA: Os embriões podem ser subdivididos em réplicas para fornecer significância estatística, conforme mostrado aqui (Figura 5B). - Transfira os embriões para tubos de centrífuga de 1,5 mL.
- Use 100 μL de solução de Ringer sem cálcio (receita31) por amostra para dissolver a gema, pois o baixo teor de cálcio amolece os tecidos embrionários, permitindo uma dissociação mais eficaz dos tecidos.
- Pipete para cima e para baixo intermitentemente por 5 min para remover a gema usando uma ponta de pipeta de 200 μL.
- Pré-aqueça 0,05% de tripsina / PBS (sem indicador de vermelho de fenol) a 29 ° C e complemente-o com 27 μL de colagenase IV (100 mg / mL) por mL de solução de tripsina. Será necessário um volume de 1 mL de solução para cada amostra de embriões.
- Adicionar 1 ml da solução de tripsina/colagenase a cada amostra de embriões vitelinos e incubar a 29 °C durante 30-35 min.
- Pipete os embriões para cima e para baixo nesta solução usando uma ponta de pipeta de 1 mL a cada 5 minutos até que a estrutura dos embriões (espinha dorsal) não seja mais visível.
- Pare a reação usando 200 μL de FBS.
- Misturar bem e incubar a 29 °C durante mais 5 minutos para garantir a inativação completa da tripsina.
NOTA: Uma temperatura de 29 ° C é empregada para o protocolo de dissociação tecidual para evitar a morte induzida por choque térmico de células de peixe-zebra, que ocorre a 37 ° C; no entanto, se a preservação das células do peixe-zebra não for necessária, a digestão pode ser realizada a 37 °C. - Pulverizar a suspensão celular a 300 x g durante 5 min a 4 °C e rejeitar o sobrenadante.
- Ressuspenda o pellet da célula em PBS a 4 °C e o pellet como acima.
- Repita a lavagem e, em seguida, coe as células através de um filtro de células de 70 μm.
- Pastilha e prossiga com a coloração para análise de citometria de fluxo.
NOTA: Se for necessária a cultura de células primárias de peixe-zebra, lave mais duas vezes com PBS a 4 °C e ressuspenda em meio L15 (com antibióticos e FBS a 10%).
11. Classificação de células ativadas por fluorescência (FACS): Coloração e classificação de células xenotransplantadas
- Ressuspenda a suspensão celular em um meio de coloração (HBSS com 1% de FBS) e pellet a 300 x g por 5 min.
- Ressuspenda o pellet celular no meio de coloração com um anticorpo reativo com as células transplantadas para fornecer um segundo marcador (além de RFP ou mCherry) com o qual distinguir células transplantadas de células de peixe-zebra. Aqui, 50 μL de CD45 anti-camundongo (APC-CD45) por amostra foram empregados em uma diluição de 1:50 (Figura 5).
- Incubar durante 20 min a 4 °C antes de lavar como acima com 1 ml do meio de coloração para remover o anticorpo não ligado.
- Depois de descartar o sobrenadante, ressuspenda o pellet celular em 200 μL de meio de coloração contendo o corante vital Helix NP Blue (1 μM), o que permitirá a discriminação de vivos / mortos.
- Transfira a mistura de células para tubos de policarbonato de fundo redondo de 5 mL para análise de citometria de fluxo.
NOTA: A coloração de um controle de célula tumoral em paralelo fornece clareza para desenhar portas durante a análise de citometria de fluxo.
12. Citometria de fluxo
- Ligue o citômetro de fluxo disponível usando uma taxa de fluxo baixa (500 eventos por segundo ou menos) para definir os parâmetros.
- Use o controle de células tumorais (as mesmas células usadas para xenotransplante) para definir a voltagem para os canais FSC (dispersão direta), SSC (dispersão lateral), BV421 / CasB (viabilidade), CE-594 (mCherry) e APC (CD45.2).
NOTA: Amostras coradas individualmente serão necessárias para estabelecer as configurações de compensação que eliminam a sobreposição de fluorocromo entre manchas distintas. - Use a amostra de embrião não injetado para estabelecer configurações que acomodem células transplantadas e de peixe-zebra.
- Aumente a taxa de fluxo para 8000 eventos por segundo e registre 1 milhão de eventos para cada amostra.
- Analise os dados resultantes usando o software de análise apropriado, primeiro selecionando singlets plotando FSC-H v/s FSC-A (altura v/s área), seguido por um gráfico para selecionar células viáveis. O software FlowJo é amplamente utilizado para essa análise.
- Usando o controle de células tumorais, desenhe uma porta ao redor das células transplantadas por FSC-A v / s SSC-A e, em seguida, use as colorações indicadoras, neste caso, CD45 e mCherry (Figura 5B).
NOTA: O portão de tamanho selecionado para o tumor também conterá células de peixe-zebra, o que fornece a base para a normalização e determinação da carga da doença. - Analise as amostras de embriões usando as mesmas configurações de porta acima. O gráfico final da coloração tumoral e do indicador de proteína fluorescente fornecerá uma medida da carga da doença (Figura 5C).
NOTA: Aqui, a diferença na carga da doença foi plotada para embriões que receberam um bom bolo de células injetadas versus aqueles que receberam um bolo inferior. - Se necessário, classifique as células tumorais nos embriões por citometria de fluxo para análise molecular a jusante.
Resultados
Xenotransplante
Uma visão abrangente de todo o experimento e análise é representada na Figura 1, abrangendo desde a produção de embriões até a avaliação da progressão da doença por análise de sobrevivência e carga de doença por citometria de fluxo. Essa abordagem traz várias melhorias que aumentam a reprodutibilidade e escalabilidade do xenotransplante, além de adicionar uma nova maneira de avaliar a carga da doença. O sucesso desses experimentos é altamente dependente da saúde das células transplantadas, pois as células que não são saudáveis e estão em fase logarítmica não se propagam após o transplante. A duração da sessão de injeção também é um parâmetro crítico. Depois que as células tumorais são preparadas, é fundamental completar a injeção no peixe-zebra dentro de 3-4 h. A abordagem usada neste estudo permite que um número maior de embriões seja injetado durante esse período de tempo por meio da simples modificação de colocá-los diretamente de lado em uma placa de agarose e injetá-los na gema (Figura 2C, D). Além disso, é imperativo que o orifício ideal da agulha seja selecionado para que células suficientes sejam injetadas (400-600 células), mas que o orifício não seja tão grande que os embriões sejam feridos. Outra consideração é a pressão de injeção. Descobrimos que pressões superiores a 12-13 psi rompem a gema dos embriões, causando a morte. Por fim, outra variabilidade inerente a esse procedimento é a consistência da injeção. As células a serem injetadas se depositam na extremidade da agulha de injeção, dificultando o controle preciso do bolus de injeção. Quando as células são xenotransplantadas, todos os embriões têm o potencial de receber o mesmo bolus de injeção, mas, na prática, não (Figura 3). O número de células transferidas pode diferir amplamente, dependendo do comportamento das células tumorais (por exemplo, aglomeração) e do nível de habilidade do operador. Abordamos essa incerteza por meio da coloração CM-Dil / marcação mCherry, que permite a categorização pós-injeção de animais que receberam um bolo celular apropriado e consistente, bem como aqueles que receberam um bolo inferior. A coloração CM-Dil, mas a marcação mais eficaz com uma proteína fluorescente, tem o benefício adicional de facilitar o monitoramento da progressão da doença, seja por microscopia ou por citometria de fluxo (Figura 4 e Figura 5).
Análise do comportamento tumoral
A progressão do tumor pode ser facilmente monitorada usando microscopia de fluorescência simples focada em RFP (Figura 4A). Da mesma forma, o monitoramento tradicional da sobrevida pode ser realizado pela análise de Kaplan-Meier (Log-rank e teste de Wilcoxon) (Figura 4B). Impressionantemente, em contraste com os estudos de xenotransplante baseados em camundongos, onde normalmente há 8 a 10 animais por braço de estudo, usando o método do peixe-zebra descrito aqui, não é difícil obter braços de estudo com mais de 60 animais cada (Figura 4B). Isso aumenta acentuadamente o poder de resolução dos estudos in vivo . Finalmente, implementamos outra abordagem para análise de carga de doenças usando citometria de fluxo. Isso implica a interrupção de números equivalentes de embriões e a análise do conteúdo de células tumorais da suspensão unicelular resultante por citometria de fluxo. Ao combinar um marcador de superfície celular específico do tumor com o indicador de proteína fluorescente, os camundongos / células humanas xenotransplantados podem ser identificados com segurança por citometria de fluxo como uma abordagem para avaliar a carga da doença (Figura 5). Para este propósito, as proteínas fluorescentes vermelhas são superiores, uma vez que as proteínas fluorescentes verdes não conseguiram fornecer um sinal sobre a autofluorescência das células hospedeiras do peixe-zebra. Aqui, o mCherry foi empregado para marcação e monitoramento celular durante o curso de xenotransplante para análise de FACS junto com CD45. A dupla marcação nos permitiu medir as diferenças na carga tumoral entre a inoculação em bolus bom e inferior (Figura 5B, C).
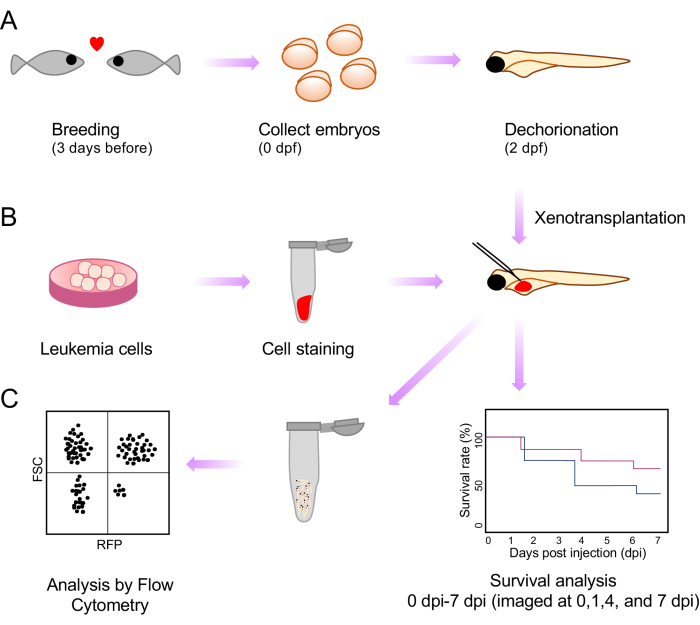
Figura 1: Esquema de todos os procedimentos de análise de xenotransplante e pós-injeção. (A) A configuração de reprodução, coleta de embriões e morfologia de 2 dias pós-fertilização (dpf) é esquematizada. (B) Preparação, coloração e injeções de células de leucemia para xenotransplante na gema de embriões de peixe-zebra. (C) Análises pós-xenotransplante, incluindo sobrevida e citometria de fluxo. Clique aqui para ver uma versão maior desta figura.
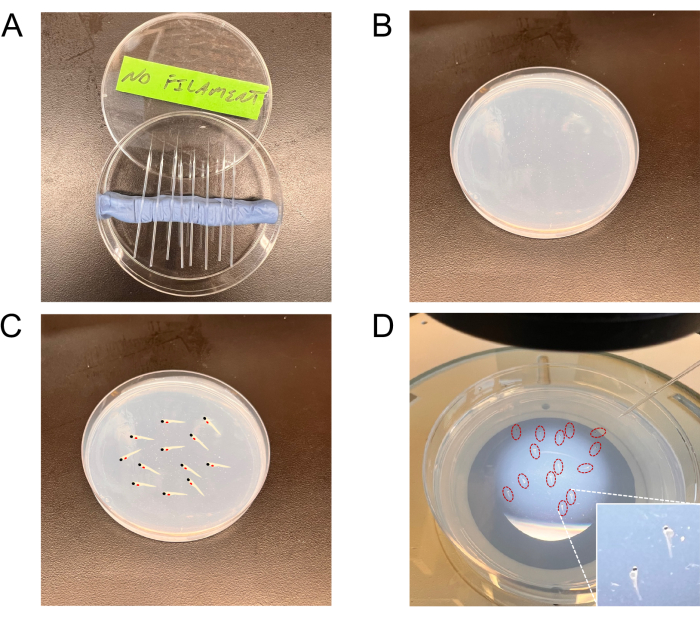
Figura 2: Imagens representativas das ferramentas usadas para as injeções. (A) Agulhas puxadas em uma placa de Petri. (B) A placa de agarose para estadiamento de embriões. (C, D) Uma placa mostrando embriões estagiados (diagrama representativo no painel C e embriões reais (circundados em vermelho) no painel D) para injeções na placa de carregamento de embriões. A inserção no canto inferior direito do painel D mostra uma visão de maior ampliação dos embriões estadiados. Clique aqui para ver uma versão maior desta figura.
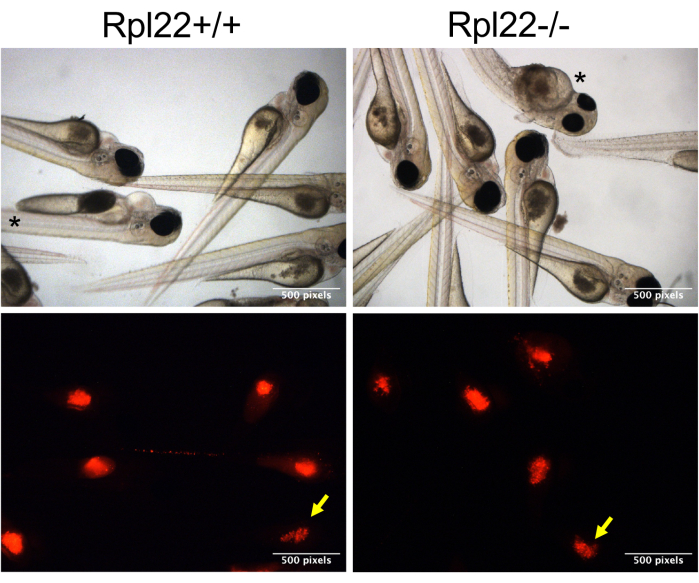
Figura 3: Imagens representativas de embriões xenotransplantados. Imagens de campo claro e imunofluorescentes são mostradas de células positivas para coloração CM-Dil (vermelho) na gema dos embriões de casper a 1 dpi (imagem de embreagem). Embriões com bolo inferior são indicados com seta amarela, enquanto aqueles com morfologia perturbada são indicados com asterisco. Clique aqui para ver uma versão maior desta figura.
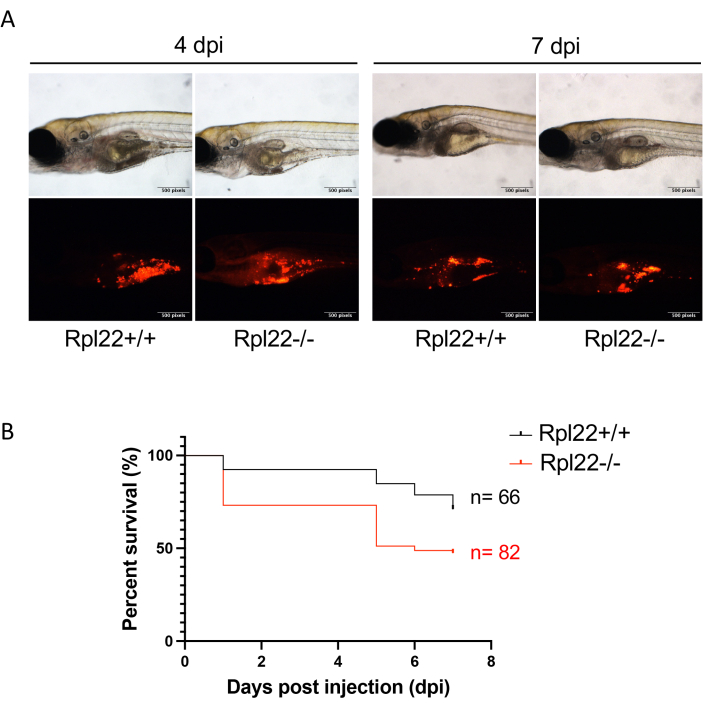
Figura 4: Avaliação da progressão da doença por imagem de fluorescência e análise de sobrevida. (A) Imagem representativa de embriões xenotransplantados a 4 dpi e 7 dpi. (B) O gráfico de Kaplan Meier mostrando a análise de sobrevivência de embriões com duas linhas de leucemia geneticamente distintas. Clique aqui para ver uma versão maior desta figura.
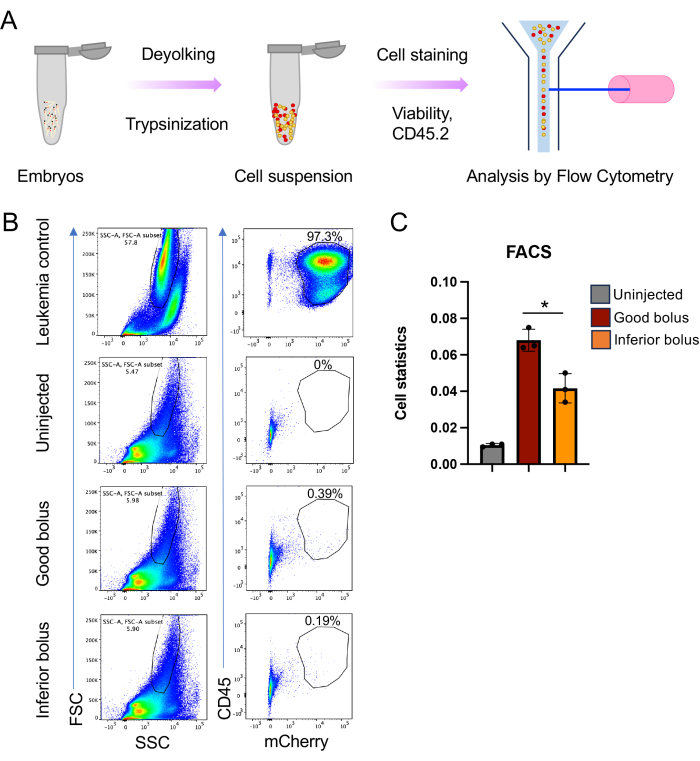
Figura 5: Análise por citometria de fluxo da carga de doença em peixe-zebra xenotransplantado. (A) Representação esquemática da preparação da suspensão celular e análise por citometria de fluxo. Resumidamente, os embriões a 4 dpi são desagregados em suspensões unicelulares usando tripsina e colagenase, seguidas de citometria de fluxo. (B) Gráficos representativos para a análise de citometria de fluxo, onde a imagem da esquerda em cada painel é FSC-A v / s SSC-A e a imagem da direita é CD45 v / s sinais mCherry. (C) Gráfico de barras mostrando as estatísticas celulares para células xenotransplantadas obtidas do gráfico de mCherry CD45 v/s para embriões não injetados, bons e inferiores (n = 45, 40 e 40 para cada repetição (n = 3); valor de p * ≤ 0,05, calculado usando o teste t não pareado com correção de Welch no GraphPad Prism 9). Clique aqui para ver uma versão maior desta figura.
Discussão
O xenotransplante de peixe-zebra surgiu como uma alternativa rápida, robusta e econômica aos estudos com camundongos12. Embora várias abordagens para o xenotransplante de peixe-zebra tenham sido relatadas, nossa adaptação resultou em melhorias significativas. Além de padronizar os parâmetros em torno do procedimento, essas melhorias se concentram especificamente em acelerar a taxa na qual as injeções de tumor podem ser realizadas, permitindo assim um aumento no número de animais por braço de estudo e usando a rotulagem do tumor para monitorar a qualidade da injeção e o comportamento pós-injeção.
Embora as melhorias neste método descritas aqui tenham um grande potencial, a execução bem-sucedida dessa estratégia exigirá um profissional qualificado e otimização para a aplicação específica. Empregamos células de leucemia. Consequentemente, o uso de cânceres sólidos pode trazer desafios adicionais. Esses tumores podem ser propensos à agregação, o que criaria variabilidade na entrega do bolo celular; no entanto, mesmo em tais circunstâncias, a rotulagem RFP deve permitir o controle de qualidade pós-injeção adequado do bolus. Isso é superior à rotulagem GFP ou corantes verdes, que são obscurecidos por autofluorescência. Finalmente, a padronização descrita aqui da maioria dos parâmetros que afetam o sucesso (saúde do embrião, temperatura da aquicultura, orifício da agulha, pressão de injeção, etc.) minimiza a variabilidade desse processo.
Uma consideração importante para experimentos de xenotransplante em peixe-zebra é o local da injeção. Aqui, mostramos que as injeções na gema são bastante fáceis em relação a outros locais mais desafiadores tecnicamente, como o espaço perivitelino34, o ducto de Cuvier35 e a injeção intracárdica (ventrículo cardíaco) 36 . A desvantagem da injeção de gema é que ela é um órgão vital para os embriões em crescimento, portanto, deve-se tomar cuidado para garantir que o diâmetro e a pressão da agulha sejam cuidadosamente controlados para que o embrião não morra devido ao trauma da injeção. A abordagem descrita aqui mitiga essa preocupação, minimizando lesões e descartando quaisquer lesões óbvias ou morte em 1 dpi, uma vez que esses problemas não estão relacionados ao crescimento do tumor. A consideração final em relação ao local da injeção é que microambientes distintos podem ter maior ou menor capacidade de suportar a propagação de tumores xenotransplantados. Consequentemente, talvez as injeções de gema possam ser realizadas primeiro antes de prosseguir para injeções ortotópicas mais desafiadoras. A principal vantagem da injeção de gema é que ela não requer estadiamento preciso do embrião e, portanto, permite uma injeção mais rápida de um número maior de embriões, preservando melhor sua saúde e aumentando o poder estatístico para resolver diferenças no comportamento das células tumorais transplantadas.
O monitoramento pós-injeção da progressão da doença é tipicamente avaliado por meio de efeitos na sobrevida usando a análise de Kaplan-Meier37; no entanto, o teste de carga de doenças também pode ser bastante informativo. Para células transplantadas que permanecem no local da injeção, a carga tumoral pode ser quantificada usando vários métodos de microscopia, desde que o método de marcação das células tumorais não seja obscurecido pela autofluorescência29. A coloração CM-Dil é facilmente resolvida e não é afetada pela autofluorescência, por isso funciona bem para quantificar a carga tumoral de células localizadas. O desafio ocorre quando as células tumorais não permanecem no local da injeção e se disseminam. Nesses casos, a citometria de fluxo, juntamente com a marcação genética indelével usando proteínas fluorescentes vermelhas, é uma maneira muito eficaz de monitorar a carga da doença em ninhadas padronizadas de embriões, uma vez que o tumor marcado pode ser analisado usando colorações específicas da espécie diferentes das células do peixe-zebra. Uma deficiência do CM-Dil é que ele é diluído pela divisão celular38. Assim, a adaptação usando marcação genética dos tumores usando RFP ou mCherry traz benefícios significativos. A expressão de mCherry, juntamente com um anticorpo específico do tumor, permite a identificação confiável de células transplantadas entre o que pode ser um padrão complexo de sinais de fundo fornecidos pelas células hospedeiras de peixe-zebra.
Em conjunto, a abordagem otimizada de xenotransplante de peixe-zebra e o método de análise usado neste estudo fornecem melhorias substanciais para uma plataforma experimental já poderosa.
Divulgações
Os autores declaram não haver interesses conflitantes.
Agradecimentos
Este trabalho foi apoiado por doações do NIH R37AI110985 e P30CA006927, uma dotação da Comunidade da Pensilvânia, da Sociedade de Leucemia e Linfoma e do Fundo Bishop. Este estudo também foi apoiado pelas principais instalações da Fox Chase, incluindo Cultura de Células, Citometria de Fluxo e Instalações de Animais de Laboratório. Agradecemos à Dra. Jennifer Rhodes por manter a instalação de peixe-zebra e microinjeção na FCCC.
Materiais
| Name | Company | Catalog Number | Comments |
| 1-phenyl 2-thiourea (PTU) | Sigma | P7629 | |
| 70 micron cell strainer | Corning | CLS431751-50EA | |
| 90 mm Petri dish | Thermo Fisher Scientific | S43565 | |
| Agarose | Apex bioresearch | 20-102GP | |
| APC APC anti-mouse CD45.2 Antibody | Biolegend | 109814 | |
| BD FACSymphony A5 Cell Analyzer | BD Biosciences | BD FACSymphony A5 | |
| calibration capillaries | Sigma | P1424-1PAK | |
| Cell tracker CM-dil dye | Invitrogen | C7001 | |
| Collageanse IV | Gibco | 17104019 | |
| Dumont forceps number 55 | Fine science tools | 11255-20 | |
| FBS | Corning | 35-015-CV | |
| Fluorescence microscope | Nikon | model SMZ1500 | |
| Glass capillaries (Borosilicate) | World precision instruments | 1B100-4 | |
| HBSS | Corning | 21-023-CV | |
| Helix NP Blue | Biolegend | 425305 | |
| Instant Ocean Sea Salt | Instant ocean | SS15-10 | |
| Light microscope | Nikon | model SMZ1000 | |
| Methylene blue | Sigma | M9140-100G | |
| Microloader (long tips for laoding cells) | eppendorf | 930001007 | |
| P1000 micropipette puller | Sutter instruments | model P-97 | |
| PM 1000 cell microinjector | MicroData Instruments, Inc. (MDI) | PM1000 | |
| Tricaine methanesulphate (Ethyl 3- aminobenzoate methanesulphate) | Sigma | E10521-10G | |
| Trypsin-EDTA (0.5%), no phenol red | Gibco | 15400054 | |
| Zebrafish adult irradiated diet (dry feed) | Zeigler | 388763 |
Referências
- Sharma, G., Goyal, Y., Bhatia, S. Handbook of Animal Models and its Uses in Cancer Research. Preclinical Animal Models of Cancer: Applications and Limitations. , (2022).
- Singhal, S. S., et al. Recent advancement in breast cancer research: Insights from model organisms-Mouse models to zebrafish. Cancers. 15 (11), 2961 (2023).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduction and Targeted Therapy. 8 (1), 160 (2023).
- Fuochi, S., Galligioni, V. Disease Animal Models for Cancer Research. Cancer Cell Culture: Methods and Protocols. , (2023).
- Shaw, T. J., Senterman, M. K., Dawson, K., Crane, C. A., Vanderhyden, B. C. Characterization of intraperitoneal, orthotopic, and metastatic xenograft models of human ovarian cancer. Mol Ther. 10 (6), 1032-1042 (2004).
- Deroose, C. M., et al. Multimodality imaging of tumor xenografts and metastases in mice with combined small-animal PET, small-animal CT, and bioluminescence imaging. J Nucl Med. 48 (2), 295-303 (2007).
- Zeng, M., et al. Generation, evolution, interfering factors, applications, and challenges of patient-derived xenograft models in immunodeficient mice. Cancer Cell Int. 23 (1), 120 (2023).
- Adhish, M., Manjubala, I. Effectiveness of zebrafish models in understanding human diseases-A review of models. Heliyon. 9 (3), e14557 (2023).
- MacRae, C. A., Peterson, R. T. Zebrafish as a mainstream model for in vivo systems pharmacology and toxicology. Ann Rev Pharmacol Toxicol. 63, 43-64 (2023).
- Choe, S. -. K., Kim, C. -. H. Zebrafish: A powerful model for genetics and genomics. Int J Mol Sci. 24 (9), 8169 (2023).
- White, R., Rose, K., Zon, L. Zebrafish cancer: the state of the art and the path forward. Nat Rev Cancer. 13 (9), 624-636 (2013).
- Al-Hamaly, M. A., Turner, L. T., Rivera-Martinez, A., Rodriguez, A., Blackburn, J. S. Zebrafish cancer avatars: A translational platform for analyzing tumor heterogeneity and predicting patient outcomes. Int J Mol Sci. 24 (3), 2288 (2023).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Hill, D., Chen, L., Snaar-Jagalska, E., Chaudhry, B. Embryonic zebrafish xenograft assay of human cancer metastasis. F1000Res. 7, 1682 (2018).
- Corkery, D. P., Dellaire, G., Berman, J. N. Leukaemia xenotransplantation in zebrafish--chemotherapy response assay in vivo. Br J Haematol. 153 (6), 786-789 (2011).
- Lin, J., et al. A clinically relevant in vivo zebrafish model of human multiple myeloma to study preclinical therapeutic efficacy. Blood. 128 (2), 249-252 (2016).
- Grissenberger, S., et al. High-content drug screening in zebrafish xenografts reveals high efficacy of dual MCL-1/BCL-XL inhibition against Ewing sarcoma. Cancer Lett. 554, 216028 (2023).
- Baxi, D. Zebrafish: A Versatile Animal Model to Study Tumorigenesis Process and Effective Preclinical Drug Screening for Human Cancer Research. Handbook of Animal Models and its Uses in Cancer Research. , (2022).
- Li, X., Li, M. The application of zebrafish patient-derived xenograft tumor models in the development of antitumor agents. Med Res Rev. 43 (1), 212-236 (2023).
- Yin, J., et al. Zebrafish patient-derived xenograft model as a preclinical platform for uveal melanoma drug discovery. Pharmaceuticals. 16 (4), 598 (2023).
- Nakayama, J., Makinoshima, H., Gong, Z. In vivo drug screening to identify anti-metastatic drugs in Twist1a-ER(T2) transgenic zebrafish. Bio Protoc. 13 (10), e4673-e4673 (2023).
- Lam, S., Chua, H., Gong, Z., Lam, T., Sin, Y. Development and maturation of the immune system in zebrafish, Danio rerio: a gene expression profiling, in situ hybridization and immunological study. Dev Comp Immunol. 28 (1), 9-28 (2004).
- Nicoli, S., Presta, M. The zebrafish/tumor xenograft angiogenesis assay. Nat Protoc. 2 (11), 2918-2923 (2007).
- Casey, M. J., et al. Transplantation of zebrafish pediatric brain tumors into immune-competent hosts for long-term study of tumor cell behavior and drug response. J Vis Exp. (123), e55712 (2017).
- Soh, G. H., Kögler, A. C., Müller, P. A simple and effective transplantation device for zebrafish embryos. J Vis Exp. (174), e62767 (2021).
- Martinez-Lopez, M., Póvoa, V., Fior, R. Generation of zebrafish larval xenografts and tumor behavior analysis. J Vis Exp. (172), e62373 (2021).
- Ren, J., Liu, S., Cui, C., Ten Dijke, P. Invasive behavior of human breast cancer cells in embryonic zebrafish. J Vis Exp. (122), e55459 (2017).
- Zhao, C., et al. A novel xenograft model in zebrafish for high-resolution investigating dynamics of neovascularization in tumors. PloS One. 6 (7), e21768 (2011).
- Cabezas-Sáinz, P., Pensado-López, A., Sáinz Jr, B., Sánchez, L. Modeling cancer using zebrafish xenografts: drawbacks for mimicking the human microenvironment. Cells. 9 (9), 1978 (2020).
- Haraoka, Y., Akieda, Y., Ishitani, T. Live-imaging analyses using small fish models reveal new mechanisms that regulate primary tumorigenesis. Yakugaku Zasshi. 139 (5), 733-741 (2019).
- Westerfield, M. . The Zebrafish Book. A Guide for the Laboratory Use of Zebrafish (Danio rerio). , (2000).
- Rao, S., et al. Inactivation of ribosomal protein L22 promotes transformation by induction of the stemness factor, Lin28B. Blood. 120 (18), 3764-3773 (2012).
- Goel, M. K., Khanna, P., Kishore, J. Understanding survival analysis: Kaplan-Meier estimate. Int J Ayurveda Res. 1 (4), 274-278 (2010).
- Usai, A., Di Franco, G., Gabellini, C., Morelli, L., Raffa, V. Establishment of zebrafish patient-derived xenografts from pancreatic cancer for chemosensitivity testing. J Vis Exp. (195), e63744 (2023).
- Murali Shankar, N., et al. Preclinical assessment of CAR-NK cell-mediated killing efficacy and pharmacokinetics in a rapid zebrafish xenograft model of metastatic breast cancer. Front Immunol. 14, 1254821 (2023).
- Takahi, M., et al. Xenograft of human pluripotent stem cell-derived cardiac lineage cells on zebrafish embryo heart. Biochem Biophys Res Commun. 674, 190-198 (2023).
- Rudner, L. A., et al. Shared acquired genomic changes in zebrafish and human T-ALL. Oncogene. 30 (41), 4289-4296 (2011).
- Regan, J. L., et al. RNA sequencing of long-term label-retaining colon cancer stem cells identifies novel regulators of quiescence. iScience. 24 (6), 102618 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados