Method Article
طريقة بسيطة وسريعة وفعالة لتحليل زراعة الأعضاء في الأورام في أجنة الزرد الشفافة
In This Article
Summary
وصفنا بروتوكولا لزرع الأجانب في صفار أجنة الزرد الشفافة التي يتم تحسينها بطريقة مرحلية بسيطة وسريعة. تشمل تحليلات ما بعد الحقن البقاء على قيد الحياة وتقييم عبء المرض للخلايا المزروعة بالأجانب عن طريق قياس التدفق الخلوي.
Abstract
في الجسم الحي دراسات سلوك الورم هي عنصر أساسي في أبحاث السرطان. ومع ذلك ، فإن استخدام الفئران يمثل تحديات كبيرة في التكلفة والوقت. هنا ، نقدم يرقات الزرد كنموذج زرع له مزايا عديدة على نماذج الفئران ، بما في ذلك سهولة التعامل ، والتكلفة المنخفضة ، والمدة التجريبية القصيرة. علاوة على ذلك ، فإن عدم وجود نظام مناعي تكيفي خلال مراحل اليرقات يغني عن الحاجة إلى توليد واستخدام سلالات نقص المناعة. في حين توجد بروتوكولات راسخة لزراعة الأعضاء في أجنة الزرد ، فإننا نقدم هنا طريقة محسنة تتضمن تحديد مراحل الجنين من أجل النقل الأسرع وتحليل البقاء على قيد الحياة واستخدام قياس التدفق الخلوي لتقييم عبء المرض. يتم تنظيم الأجنة لتسهيل الحقن السريع للخلايا في صفار اليرقات وعلامات الخلايا لمراقبة اتساق بلعة الخلايا المحقونة. بعد الحقن ، يتم تقييم تحليل بقاء الجنين لمدة تصل إلى 7 أيام بعد الحقن (نقطة في البوصة). أخيرا ، يتم تقييم عبء المرض أيضا عن طريق وضع علامة على الخلايا المنقولة ببروتين فلوري وتحليلها عن طريق قياس التدفق الخلوي. يتم تمكين قياس التدفق الخلوي من خلال طريقة موحدة لإعداد معلقات الخلايا من أجنة الزرد ، والتي يمكن استخدامها أيضا في إنشاء الثقافة الأولية لخلايا الزرد. باختصار ، يسمح الإجراء الموصوف هنا بإجراء تقييم أسرع لسلوك الخلايا السرطانية في الجسم الحي مع أعداد أكبر من لكل ذراع دراسة وبطريقة أكثر فعالية من حيث التكلفة.
Introduction
يعد تحليل سلوك الأورام استجابة للتغيير الجيني أو العلاج الدوائي في الجسم الحي عنصرا أساسيا في أبحاث السرطان1،2،3،4. غالبا ما تتضمن هذه الدراسات استخدام نماذج الفئران التي تعاني من نقص المناعة (Mus musculus)5 ؛ ومع ذلك ، فإن دراسات زراعة الأعضاء الخارجية في الفئران محدودة في كثير من النواحي ، بما في ذلك السعة المحدودة ، والمدة الممتدة ، والنفقات الكبيرة ، والحاجة إلى معدات تصوير متطورة لمراقبة تطور الأورام الداخلية 6,7. على النقيض من ذلك ، يتيح نموذج الزرد (Danio rerio) سعة أكبر ، ومدة أقصر ، ونفقات أقل ، وبسبب شفافيتها ، مراقبة بسيطة لتطور المرض 8,9.
الزرد هو نظام نموذجي متطور للفقاريات مع تطور خارج الرحم وخصوبة عالية ، حيث تنتج الإناث الفردية أكثر من 100 جنين10. علاوة على ذلك ، فإن أجنة الزرد شفافة ، مما يتيح تصورا سهلا للعمليات التنموية باستخدام التقنيات المتعلقة بالتألق مثل المراسلين. أخيرا ، فإن الحفاظ على العمليات التنموية الحرجة يجعلها نموذجا مثاليا للعديد من أنواع الدراسات ، بما في ذلك سلوك الخلايا الخبيثة المزروعة11,12. تطور أجنة الزرد من النوع البري الخلايا الصباغية ، مما يجعلها معتمة بصريا بحلول 2 أسابيع من العمر ، ولكن تم التغلب على ذلك من خلال توليد أجنة كاسبر (roya9; MitfaW2) ، والتي تظل شفافة طوال الحياة13. بسبب خصائصها البصرية ، فإن الزرد كاسبر هي المتلقين المثاليين للخلايا السرطانية المزروعة14،15،16. اكتسبت زراعة الخلايا السرطانية في الزرد أهمية في العقدين الماضيين17،18،19،20،21. أجنة الزرد لها مناعة فطرية. ومع ذلك ، فإنها تفتقر إلى المناعة التكيفية خلال مرحلة اليرقات ، مما يجعلها منقوصة المناعة وظيفيا ، مما يمكنها من العمل كمضيفين فعالين للطعوم الخارجية للورمالمزروع 22.
تم تطوير بروتوكولات لتطعيم الورم في أجنة الزرد وكذلك البالغين الذين أخذوا في الاعتبار عددا من المتغيرات المختلفة23،24،25،26،27. وقد استكشفت هذه العديد من مواقع ترسب الورم في الزرد ، بما في ذلك الحقن في صفار البيض ، والفضاء شبه vitelline ، والقلب وفي مراحل النمو المختلفة16،28. كما أن درجة الحرارة المحيطة للاستزراع المائي للطعوم الخارجية لأسماك الزرد مهمة أيضا حيث أن تربية أسماك الزرد تحدث عادة عند 28 درجة مئوية، بينما تنمو خلايا الثدييات عند 37 درجة مئوية. وبالتالي ، يجب استخدام درجة حرارة توفيقية تتحملها الأسماك ولكنها تدعم نمو الورم ، ويبدو أن 34 درجة مئوية تحقق كلا الهدفين29. يعد تحليل سلوك الأورام وتطورها بعد زراعة الأعضاء الخارجية مجالا رئيسيا آخر للتركيز ، وهذا ينطوي على استخدام مجموعة متنوعة من طرق التصوير بالإضافة إلى تحليل البقاء على قيد الحياة30. واحدة من المزايا الرئيسية لنموذج الزرد هو توافر أعداد كبيرة من الدراسة لتوفير قوة إحصائية هائلة للدراسات في الجسم الحي لسلوك الورم. ومع ذلك ، فقد حدت الأساليب السابقة بشدة من هذه الإمكانات بسبب متطلبات إجراءات التركيب المملة للحقن.
هنا ، نعالج هذا القيد من خلال تطوير طريقة بسيطة وسريعة يمكن من خلالها تحديد مرحلة الأجنة التي تتيح إنتاجية عالية ومراقبة جودة الحقن باستخدام خط الزرد كاسبر الشفاف. وهذا يستلزم حقن الطعوم الخارجية في كيس صفار أجنة الزرد كاسبر في 2 أيام بعد الإخصاب (dpf). نلاحظ بقاء الأجنة بعد زراعة الأعضاء كجزء من تحليل سلوك الورم. نعرض كذلك تقييم عبء المرض بعد زراعة الأعضاء عن طريق إجراء معلقات أحادية الخلية وتحليلها عن طريق قياس التدفق الخلوي (الشكل 1).
Protocol
وقد تمت صيانة أسماك الزرد وتغذيتها وتربيتها في ظروف الاستزراع المائي القياسية عند 28.5 درجة مئوية، كما هو موضح31. تم إجراء جميع التجارب المتعلقة بالزرد عند درجة الحرارة هذه. ومع ذلك ، بعد زراعة الأجانب ، تم استزراع عند 34 درجة مئوية طوال مدة التجربة ، وفقا للإجراءات المعتمدة من قبل اللجنة المؤسسية لرعاية واستخدام (IACUC).
1. تربية (3 أيام قبل الحقن)
- توفير العلف الجاف (علف إضافي ؛ 5-6 حبيبات لكل سمكة) لأزواج الأسماك قبل أسبوع من التكاثر لزيادة صحة إلى أقصى حد وزيادة عدد الأجنة التي تنتجها أزواج التكاثر.
- في المساء السابق لحصاد الأجنة ، قم بإعداد تربية في أحواض تربية مع فاصل يفصل بين الأسماك الذكور والإناث ، باستخدام تزاوج الحريم من 2 أنثى لكل ذكر.
ملاحظة: للتجارب مع 4 أذرع من 100 لكل ذراع ، استخدم 20 زوجا من التربية لكل تجربة. لتحديد عدد أزواج التكاثر المطلوبة ، فإن التقدير الجيد هو 50 جنينا لكل زوج تربية كاسبر . خيار آخر هو استخدام سلالة أكثر قوة وتصبغا من الزرد ومعالجتها باستخدام 1-فينيل 2-ثيوريا (PTU) لمنع التصبغ31. في الممارسة العملية ، يجب تحجيم التجربة بحيث يكون لدى المرء ما يكفي من الأجنة لحقن ضعف العدد المطلوب في 1 يوم بعد الحقن (dpi).
2. جمع الأجنة (يومين قبل الحقن)
- في صباح اليوم التالي ، قم بإزالة الفواصل ، مما يسمح للأسماك بالتكاثر.
- تصور الأجنة في الخزانات بعد 20 دقيقة (دقيقة) من إزالة الفواصل.
- اجمع الأجنة باستخدام غربال في طبق بتري 90 مم يحتوي على ماء جنين مصنوع كما هو موضح في كتاب الزرد31.
- لصنع ماء الجنين ، أضف 1.5 مل من أملاح المرق إلى 1 لتر من الماء المقطر وأزرق الميثيلين إلى 0.1٪ نهائي. اصنع محلول ملح المخزون عن طريق إذابة 40 جم من أملاح البحر (جدول المواد) في 1 لتر من الماء المقطر. التركيب الأيوني لماء الجنين هو K + (0.68 مجم / لتر) ، Cl− (31.86 مجم / لتر) ، Na + (17.77 مجم / لتر) ، SO4− (4.47 مجم / لتر) ، Mg2+ (2.14 مجم / لتر) ، و Ca2+ (0.68 مجم / لتر).
- اسمح لسمك الزرد بالتكاثر لمدة ساعة إضافية وجمع الأجنة الناتجة.
- تجميع الأجنة للتجربة.
- في المساء ، قم بإزالة جميع الأجنة غير المخصبة أو الميتة ، والتي يمكن التعرف عليها من خلال مورفولوجيتها غير الطبيعية ، وتوفير مياه الجنين العذبة.
3. صيانة الجنين وإعداد أداة للحقن (1 يوم قبل الحقن)
- في صباح اليوم التالي ، قم بإزالة أي أجنة ميتة إضافية وقدم ماء الجنين النقي.
- تحضير لوحة الأغاروز عن طريق تسخين 1.5 ٪ من الأغاروز في ماء الجنين وصب الخليط الساخن في لوحة بتري 90 ملم. طبق واحد 90 مم يتطلب 30-35 مل من الخليط.
- اسحب الإبر غير الخيطية من الشعيرات الدموية الزجاجية (البورسليكات) باستخدام مجتذب الإبرة. يتم سحب الإبر (تحت ضغط الحرارة) لإنتاج نهاية مغلقة ؛ قم بقصها بالملقط لتوليد فتحة مثالية. تقييم مدى ملاءمة فتحة الإبرة عن طريق تحديد حجم السائل النازح لكل وحدة زمنية (انظر أدناه ، القسم 6.3).
ملاحظة: يمكن شراء الشعيرات الدموية الزجاجية مع أو بدون خيوط مركزية. الشعيرات الدموية التي تفتقر إلى خيوط مركزية مفضلة لحقن الخلايا. - ضع الإبر في صفيحة بتري مغطاة مقاس 90 مم في الأخاديد المصنوعة باستخدام الطين (طين نمذجة الأطفال) حتى الاستخدام (الشكل 2 أ).
4. إعداد ووضع العلامات على خلايا سرطان الدم مع CM-Dil (يوم الحقن)
- الحفاظ على الخلايا المراد زرعها في ظل الظروف المثلى لنموها. كانت خلايا ابيضاض الدم الفئران المستخدمة هنا إما كافية (M82; Rpl22+/+) أو ناقص (M109; Rpl22-/-) للبروتين الريبوسومي Rpl22 ، الذي يعمل كمثبط للورم32.
- خلايا الحبيبات في أنبوب مخروطي سعة 50 مل. عد ، ثم أجهزة الطرد المركزي عند 300 × جم في درجة حرارة الغرفة (RT) لمدة 5 دقائق. تخلص من المادة الطافية.
ملاحظة: سيتم تحديد عدد الخلايا المطلوبة من خلال النطاق التجريبي والظروف ، ولكن 1 × 106 خلايا هي نقطة انطلاق جيدة. - أداء تلطيخ CM-Dil
ملاحظة: يتيح تلطيخ CM-Dil مراقبة بلعة الحقن.- اصنع محلول مخزون من CM-Dil عن طريق تعليق قارورة 50 ميكروغرام من CM-Dil في 50 ميكرولتر من ثنائي ميثيل سلفوكسيد (DMSO ؛ 1 مجم / مل أو ~ 1 مللي متر نهائي).
- أنتج محلولا عمليا عن طريق تخفيف المخزون (4.8 ميكرولتر من البقع / مل) في مصل بقري جنيني 1٪ (FBS) / محلول ملح هانك المتوازن (HBSS) يحتوي على أي مكملات داعمة تحتاجها الخلايا المراد استخدامها.
- أعد تعليق الخلايا عند 1 × 106/100 ميكرولتر في محلول عمل البقعة.
- احتضان على حرارة 37 درجة مئوية لمدة 10 دقائق.
ملاحظة: يجب تحسين ظروف التلوين للخلايا المستخدمة (الوقت ، إلخ). تطلبت الخلايا المستخدمة هنا حضانتين متميزتين لمدة 10 دقائق في درجات حرارة مختلفة لتحقيق التلوين الأمثل. - يغسل مع 10 مل من 1x HBSS في درجة حرارة الغرفة (RT).
- خلايا الحبيبات (الطرد المركزي عند 300 × جم لمدة 5 دقائق في RT) ، صب المادة الطافية ، ثم إعادة تعليقها ب 10 مل من HBSS وتكرار نفس الشيء لغسل ثان.
- إعادة تعليق الخلايا السرطانية الملطخة عند 40000 خلية / ميكرولتر في 1٪ FBS / PBS وأي مكملات داعمة مطلوبة والحفاظ على تعليق الخلية عند 34 درجة مئوية حتى الحقن.
ملاحظة: كانت هناك حاجة إلى مكملات داعمة للحفاظ على خطوط الخلايا المستخدمة في هذه الدراسة (على سبيل المثال ، 1٪ FBS والسيتوكينات). قد تحتاج المكملات الغذائية وزرع الأجانب إلى تكييفها مع خطوط الخلايا المعينة قيد الدراسة. تم اختيار PBS هنا بدلا من الوسائط لتجنب أي سمية محتملة في صفار البيض.
5. التجريد
- قم بإزالة أجنة الزرد كاسبر يدويا عند 2 dpf باستخدام محاقن حقن الأنسولين تحت تكبير 2x في مجهر ضوئي. اثقب المشيم بإبرة واحدة أثناء استخدام الإبرة الأخرى لشل حركة المشيمية.
ملاحظة: لا ينصح باستخدام البروناز لإزالة الشوائب لأنه يؤدي أحيانا إلى انخفاض صحة الجنين. يفضل إزالة الأجنة عند 2 dpf لأنه أسهل ، والأجنة أقل هشاشة مما كانت عليه في الأوقات السابقة (1 dpf). - أثناء إزالة الأجنة ، احرص على عدم لمس الأجنة بالإبر. قد يؤدي لمس صفار الأجنة أو إتلافه عن طريق ملامسة الإبر عن غير قصد إلى الوفاة.
- قم بإزالة الحبال المجردة عن طريق تغيير ماء الجنين.
6. إعداد الحاقن الدقيق والإبرة
- قم بتشغيل الحاقن الدقيق والمضخة وقم بإعداد الظروف المناسبة للحقن المجهري للخلايا. يعد ضغط الحقن من 9-11 رطل لكل بوصة مربعة ووقت الحقن البالغ 0.5 ثانية (ثوان) نقطة انطلاق جيدة لقص الإبرة ووضع الفتحة.
- قم بتحميل تعليق خط الخلية السرطانية (~ 5 ميكرولتر) في الإبرة الدقيقة بعناية في مسار واحد ، وتجنب تكوين فقاعات الهواء ، والتي ستعطل تيار الخلية داخل الإبرة.
- قطع نهاية الإبرة بالملقط (دومون رقم 5) لإنتاج فتحة تدعم طرد 10-15 نانولتر (nL) من تعليق الخلية لكل 0.2-0.3 ثانية.
ملاحظة: يتم الحساب أعلاه لحجم nL باستخدام الشعيرات الدموية المعايرة ، حيث 1 مم = 30 nL. باختصار ، اضبط الوقت على 0.5 ثانية ، وبعد كل مقطع من الإبرة ، اضغط على حقن وجمع الحجم في الشعيرات الدموية المعايرة. بعد ذلك ، يتم قياس طول الحجم الذي تم جمعه باستخدام المقياس تحت المجهر ، ويتم إيقاف قص الإبرة عند حقن 30 nL في 0.5 ثانية. ثم ، اضبط وقت الحقن على 0.2-0.3 ثانية (حقن ~ 10-15 nL من الخلايا)
7. تحضير الجنين للحقن
- حدد الأجنة السليمة تحت المجهر ، واستبعد أي تشوهات في النمو مثل وذمة القلب أو جذع قصير أو منحني.
- تخدير الأجنة باستخدام تريكايين ميثان سلفونات (MS-222 ؛ 0.16 جم / لتر من ماء الجنين) لمدة 1 دقيقة في لوحة بتري 90 مم.
- استخدم ماصة باستور الزجاجية لالتقاط الأجنة. رتب 10-15 جنينا في وضع جانبي على صفيحة الأغاروز 1.5٪ (الشكل 2B-D).
- قم بإزالة الماء الزائد باستخدام ماصة باستور ، مع ترك الحد الأدنى من ماء الجنين اللازم للحفاظ على الأجنة على قيد الحياة.
8. إجراء الحقن
- تحقق تحت المجهر الضوئي للتأكد من أن الخلايا قد تراكمت في طرف الإبرة.
- حقن الأجنة باستخدام إبرة معايرة لمدة 0.2-0.3 ثانية (مع 10-15 نانولتر المقابلة ل 400-600 خلية) في صفار الأجنة.
- كرر الحقن لجميع الأجنة ، ثم اجمعها في ماء الجنين النقي.
ملاحظة: نظرا لأن الخلايا تميل إلى التراكم على طرف الإبرة ، فستحتاج الأطراف إلى القص قليلا كل 15-20 حقنة. سيتطلب ذلك أيضا إعادة ضبط الضغط والوقت مع كل عملية إعادة قص لضمان حقن حجم مماثل. - للتأكد من صحة مقارنة سلوك مجموعتين متميزتين من الخلايا المنقولة ، راقب بلعة الخلايا المنقولة. القيام بذلك عن طريق فرز الأجنة على أساس تلطيخ CM-Dil (في قناة RFP) في 1 ساعة بعد الحقن (hpi) ، وفصل تلك مع تلطيخ الأمثل ("بلعة جيدة") من أولئك الذين لديهم تلطيخ أدنى ("بلعة أدنى" ؛ الشكل 3 ، السهم الأصفر).
- تخلص من الأجنة التي تحتوي على بلعة رديئة أو استخدمها لتقييم تأثير جرعة خلية مختلفة على تطور المرض.
- قم بإزالة أي أجنة ميتة بحلول نهاية اليوم لأن موتها مرتبط بصدمة الحقن بدلا من نمو الورم. إزالة من التحليل الأجنة التي لا تحتفظ بالخلايا لأن الخلايا من المحتمل أن تكون قد تسربت من موقع الحقن.
- الحفاظ على الأجنة المحقونة عند 34 درجة مئوية طوال مدة التجربة في طبق 90 مم مع ~ 60 جنينا لكل طبق.
ملاحظة: بعد 5 dpf ، سيتم استهلاك صفار البيض من قبل الأجنة النامية ، لذلك يجب تزويد الأجنة بطعام البراميسيوم طوال مدة التجربة. لضمان التغذية السليمة ، يجب إعطاء paramecia للأجنة يوميا من 6 dpf (4 نقطة في البوصة) إلى 9 dpf (7 نقطة في البوصة). يتم نشر البراميسيا عن طريق الاستزراع في قوارير في ظل ظروف التغذية ودرجة الحرارة المثلى ، كما هو موضح31.
9. تحليل البقاء على قيد الحياة
- راقب الأجنة لمدة 7 نقطة في البوصة التالية ، وقم بتغيير ماء الجنين يوميا. يمكن تقليل تغييرات المياه إلى أيام بديلة للراحة إذا كانت الدراسة تنطوي على علاج دوائي.
- تحقق من صحة الجنين وسجل الموت طوال مدة التحليل.
ملاحظة: كانت المدة التجريبية 7 أيام لهذه التجربة ولكنها قد تكون أقصر أو أطول اعتمادا على عدوانية الورم المزروع بالأجانب. - استخدم مضان CM-Dil لتقييم عبء المرض (الشكل 4A) وتحديد تأثير التغيرات الجينية أو العلاجات الدوائية على البقاء على قيد الحياة باستخدام تحليل كابلان ماير وتصويره بيانيا (على سبيل المثال ، مع GraphPad Prism ؛ الشكل 4 ب) 33.
10. تعليق خلية واحدة من الأجنة لتحليل التدفق الخلوي
ملاحظة: يمكن تقييم عبء المرض عن طريق تحليل التدفق الخلوي بعد زرع الأعضاء. ومع ذلك ، فإن القيام بذلك يتطلب وضع علامات لا تمحى على الخلايا السرطانية. يعتبر البروتين الفلوري الأحمر (RFP) أو mCherry فعالا لأنه يوفر إشارة جيدة على التألق الذاتي لخلايا الزرد ، مما يحجب الإشارة من البروتين الفلوري الأخضر.
- عزل الأجنة في مرحلة نقطة في البوصة من اختيار. يتم عرض 5 نقطة في البوصة هنا (الشكل 5).
- اجمع 30-40 جنينا لكل حالة كنقطة انطلاق ، ولكن قد يختلف عدد الجنين اعتمادا على مرحلة وعدوانية الخلايا المزروعة. تخدير الأجنة كما هو موضح أعلاه.
ملاحظة: يمكن تقسيم الأجنة على شكل تكرارات لتوفير دلالة إحصائية ، كما هو موضح هنا (الشكل 5B). - نقل الأجنة إلى أنابيب الطرد المركزي 1.5 مل.
- استخدم 100 ميكرولتر من محلول رينغر الخالي من الكالسيوم (الوصفة31) لكل عينة لإذابة صفار البيض لأن الكالسيوم المنخفض يلين الأنسجة الجنينية ، مما يتيح تفكك الأنسجة بشكل أكثر فعالية.
- ماصة صعودا وهبوطا بشكل متقطع لمدة 5 دقائق لإزالة صفار البيض باستخدام طرف ماصة 200 ميكرولتر.
- يسخن 0.05٪ من التربسين/برنامج تلفزيوني (بدون مؤشر الفينول الأحمر) إلى 29 درجة مئوية ويكمله ب 27 ميكرولتر كولاجيناز وريدي (100 ملغ/مل) لكل مل من محلول التربسين. ستكون هناك حاجة إلى حجم 1 مل من المحلول لكل عينة من الأجنة.
- أضف 1 مل من محلول التربسين / الكولاجيناز إلى كل عينة من الأجنة منزوعة الصفار واحتضانها على حرارة 29 درجة مئوية لمدة 30-35 دقيقة.
- ماصة الأجنة صعودا وهبوطا في هذا الحل باستخدام طرف ماصة 1 مل كل 5 دقائق حتى بنية الأجنة (العمود الفقري) لم تعد مرئية.
- أوقف التفاعل باستخدام 200 ميكرولتر من FBS.
- تخلط جيدا وتحتضن على حرارة 29 درجة مئوية لمدة 5 دقائق إضافية لضمان التعطيل الكامل للتربسين.
ملاحظة: يتم استخدام درجة حرارة 29 درجة مئوية لبروتوكول تفكك الأنسجة لمنع الموت الناجم عن الصدمة الحرارية لخلايا الزرد ، والذي يحدث عند 37 درجة مئوية. ومع ذلك ، إذا لم يكن الحفاظ على خلايا الزرد مطلوبا ، فيمكن إجراء الهضم عند 37 درجة مئوية. - قم بتعليق الخلية عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية وتخلص من المادة الطافية.
- أعد تعليق حبيبات الخلية في 4 درجات مئوية PBS والحبيبات على النحو الوارد أعلاه.
- كرر الغسيل ، ثم صفي الخلايا من خلال مصفاة خلية 70 ميكرومتر.
- بيليه والمضي قدما في تلطيخ لتحليل التدفق الخلوي.
ملاحظة: إذا كانت زراعة خلايا الزرد الأولية مطلوبة، اغسلها مرتين أخريين باستخدام 4 درجات مئوية PBS وأعد تعليقها في وسائط L15 (مع المضادات الحيوية و 10٪ FBS).
11. فرز الخلايا المنشطة بالتألق (FACS): تلطيخ وفرز الخلايا المزروعة بالأجانب
- أعد تعليق تعليق الخلية في وسط تلطيخ (HBSS مع 1٪ FBS) والحبيبات عند 300 × جم لمدة 5 دقائق.
- أعد تعليق حبيبات الخلية في وسط التلوين بجسم مضاد يتفاعل مع الخلايا المزروعة لتوفير علامة ثانية (بالإضافة إلى RFP أو mCherry) لتمييز الخلايا المزروعة عن خلايا الزرد. هنا ، تم استخدام 50 ميكرولتر من CD45 المضاد للفأر (APC-CD45) لكل عينة بتخفيف 1:50 (الشكل 5).
- احتضان لمدة 20 دقيقة عند 4 درجات مئوية قبل غسلها على النحو الوارد أعلاه مع 1 مل من وسط التلوين لإزالة الجسم المضاد غير المقيد.
- بعد التخلص من المادة الطافية ، أعد تعليق حبيبات الخلية في 200 ميكرولتر من وسط التلوين الذي يحتوي على الصبغة الحيوية Helix NP Blue (1 ميكرومتر) ، والتي ستمكن من التمييز الحي / الميت.
- انقل مزيج الخلايا إلى أنابيب البولي كربونات ذات القاع المستدير سعة 5 مل لتحليل قياس التدفق الخلوي.
ملاحظة: يوفر تلطيخ التحكم في الخلايا السرطانية بالتوازي وضوحا لبوابات الرسم أثناء تحليل قياس التدفق الخلوي.
12. قياس التدفق الخلوي
- قم بتشغيل مقياس التدفق الخلوي المتوفر باستخدام معدل تدفق منخفض (500 حدث في الثانية أو أقل) لتعيين المعلمات.
- استخدم التحكم في الخلايا السرطانية (نفس الخلايا المستخدمة في زراعة الأعضاء) لضبط الجهد لقنوات FSC (التشتت الأمامي) و SSC (التشتت الجانبي) و BV421 / CasB (الجدوى) و CE-594 (mCherry) و APC (CD45.2).
ملاحظة: ستكون هناك حاجة إلى عينات ملطخة منفردة لتحديد إعدادات التعويض التي تقضي على تداخل الفلوروكروم بين البقع المميزة. - استخدم عينة الجنين غير المحقونة لإنشاء إعدادات تستوعب كلا من الخلايا المزروعة وخلايا الزرد.
- زيادة معدل التدفق إلى 8000 حدث في الثانية وتسجيل 1 مليون حدث لكل عينة.
- قم بتحليل البيانات الناتجة باستخدام برنامج التحليل المناسب ، واختر أولا المفردات عن طريق رسم FSC-H v / s FSC-A (مساحة الارتفاع مقابل / ثانية) ، متبوعا بمخطط لاختيار الخلايا القابلة للحياة. يستخدم برنامج FlowJo على نطاق واسع لمثل هذا التحليل.
- باستخدام التحكم في الخلايا السرطانية ، ارسم بوابة حول الخلايا المزروعة بواسطة FSC-A v / s SSC-A ، ثم استخدم بقع المؤشر ، في هذه الحالة ، CD45 و mCherry (الشكل 5B).
ملاحظة: ستحتوي بوابة الحجم المختارة للورم أيضا على خلايا الزرد ، والتي توفر الأساس لتطبيع وتحديد عبء المرض. - تحليل عينات الأجنة باستخدام نفس إعدادات البوابة المذكورة أعلاه. سيوفر المخطط النهائي لمؤشر صبغة الورم والبروتين الفلوري مقياسا لعبء المرض (الشكل 5 ج).
ملاحظة: هنا ، تم رسم الفرق في عبء المرض للأجنة التي تتلقى بلعة جيدة من الخلايا المحقونة مقابل تلك التي تتلقى بلعة أدنى. - إذا لزم الأمر ، قم بفرز الخلايا السرطانية في الأجنة عن طريق قياس التدفق الخلوي للتحليل الجزيئي النهائي.
النتائج
زرع الأعضاء
يوضح الشكل 1 عرضا شاملا للتجربة والتحليل بأكملهما ، بدءا من إنتاج الجنين إلى تقييم تطور المرض من خلال كل من تحليل البقاء على قيد الحياة وعبء المرض عن طريق قياس التدفق الخلوي. يجلب هذا النهج العديد من التحسينات التي تعزز قابلية استنساخ وقابلية التوسع في زراعة الأعضاء ، بالإضافة إلى إضافة طريقة جديدة لتقييم عبء المرض. يعتمد نجاح هذه التجارب بشكل كبير على صحة الخلايا المزروعة ، حيث تفشل الخلايا غير السليمة وفي مرحلة السجل في التكاثر عند الزرع. مدة جلسة الحقن هي أيضا معلمة حرجة. بعد تحضير الخلايا السرطانية ، من الأهمية بمكان إكمال الحقن في الزرد في غضون 3-4 ساعات. يتيح النهج المستخدم في هذه الدراسة حقن أعداد أكبر من الأجنة خلال هذا الإطار الزمني من خلال التعديل البسيط لتنظيمها مباشرة على جانبها على صفيحة أغاروز وحقنها في صفار البيض (الشكل 2 ج ، د). علاوة على ذلك ، من الضروري اختيار فتحة الإبرة المثلى بحيث يتم حقن خلايا كافية (400-600 خلية) ولكن الفتحة ليست كبيرة جدا بحيث تصاب الأجنة. اعتبار آخر هو ضغط الحقن. نجد أن الضغوط الأكبر من 12-13 رطل لكل بوصة مربعة تعطل صفار الأجنة ، مما يسبب الموت. أخيرا ، هناك تباين آخر متأصل في هذا الإجراء وهو اتساق الحقن. تستقر الخلايا المراد حقنها في نهاية إبرة الحقن ، مما يجعل التحكم الدقيق في بلعة الحقن أمرا صعبا. عندما يتم زرع الخلايا بالحقن ، يكون لدى جميع الأجنة القدرة على تلقي نفس بلعة الحقن ، ولكن في الممارسة العملية ، لا تفعل ذلك (الشكل 3). يمكن أن يختلف عدد الخلايا المنقولة بشكل كبير اعتمادا على سلوك الخلايا السرطانية (على سبيل المثال ، التكتل) ومستوى مهارة المشغل. لقد عالجنا عدم اليقين هذا من خلال وضع العلامات على تلطيخ CM-Dil / mCherry ، والذي يتيح تصنيف ما بعد الحقن للحيوانات التي تلقت بلعة خلوية مناسبة ومتسقة ، وكذلك تلك التي تتلقى بلعة أدنى. إن تلطيخ CM-Dil ، ولكن بشكل أكثر فعالية باستخدام بروتين الفلورسنت ، له فائدة إضافية تتمثل في تسهيل مراقبة تطور المرض ، إما عن طريق الفحص المجهري أو عن طريق قياس التدفق الخلوي (الشكل 4 والشكل 5).
تحليل سلوك الورم
يمكن بسهولة مراقبة تطور الورم باستخدام الفحص المجهري الفلوري البسيط الذي يركز على RFP (الشكل 4 أ). وبالمثل ، يمكن إجراء مراقبة البقاء التقليدية عن طريق تحليل كابلان ماير (رتبة السجل واختبار ويلكوكسون) (الشكل 4 ب). بشكل مثير للإعجاب ، على عكس دراسات زراعة الأعضاء القائمة على الفئران حيث يوجد عادة 8-10 لكل ذراع دراسة ، باستخدام طريقة الزرد الموصوفة هنا ، ليس من الصعب تحقيق أذرع دراسة مع أكثر من 60 لكل منها (الشكل 4 ب). هذا يعزز بشكل ملحوظ قوة حل الدراسات في الجسم الحي . أخيرا ، قمنا بتنفيذ نهج آخر لتحليل عبء المرض باستخدام قياس التدفق الخلوي. وهذا يستلزم تعطيل أعداد مكافئة من الأجنة وتحليل محتوى الخلايا السرطانية لتعليق الخلية الواحدة الناتج عن طريق قياس التدفق الخلوي. من خلال الجمع بين علامة سطح الخلية الخاصة بالورم ومؤشر البروتين الفلوري ، يمكن تحديد الفئران / الخلايا البشرية المزروعة بثقة من خلال قياس التدفق الخلوي كنهج لتقييم عبء المرض (الشكل 5). لهذا الغرض ، تتفوق البروتينات الفلورية الحمراء لأن البروتينات الفلورية الخضراء فشلت في توفير إشارة على التألق الذاتي لخلايا الزرد المضيفة. هنا ، تم استخدام mCherry لوضع العلامات على الخلايا ومراقبتها خلال مسار زرع الأجانب لتحليل FACS جنبا إلى جنب مع CD45. سمح لنا وضع العلامات المزدوجة بقياس الاختلافات في عبء الورم بين التلقيح الجيد مقابل التلقيح بالبلعة السفلية (الشكل 5B ، C).
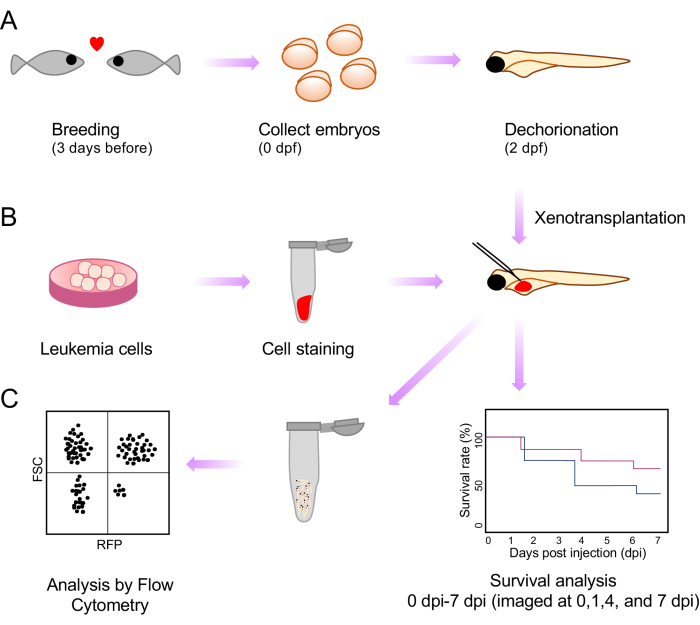
الشكل 1: رسم تخطيطي لكامل إجراءات زرع الأعضاء وتحليل ما بعد الحقن. (أ) يتم تخطيط إعداد التكاثر وجمع الأجنة ومورفولوجيا ما بعد الإخصاب (dpf) لمدة 2 أيام. ب: تحضير خلايا ابيضاض الدم وتلطيخها وحقنها من أجل زراعة الأجانب في صفار أجنة الزرد. (ج) تحليلات ما بعد زرع الأعضاء، بما في ذلك قياس البقاء على قيد الحياة والتدفق الخلوي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
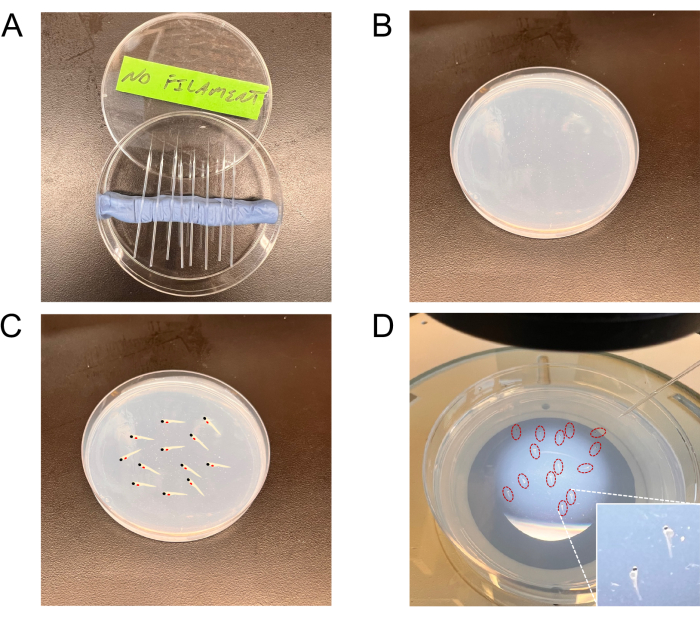
الشكل 2: صور تمثيلية للأدوات المستخدمة في الحقن. أ: الإبر المسحوبة في صفيحة بتري. ب: صفيحة الأغاروز لتحديد مراحل الجنين. (ج، د) لوحة تظهر الأجنة على مراحل (مخطط تمثيلي في اللوحة C وأجنة حقيقية (محاطة باللون الأحمر) في اللوحة D) للحقن على لوحة تحميل الجنين. يظهر الجزء الداخلي في الزاوية اليمنى السفلية من اللوحة D عرضا أعلى للتكبير للأجنة المرحلية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
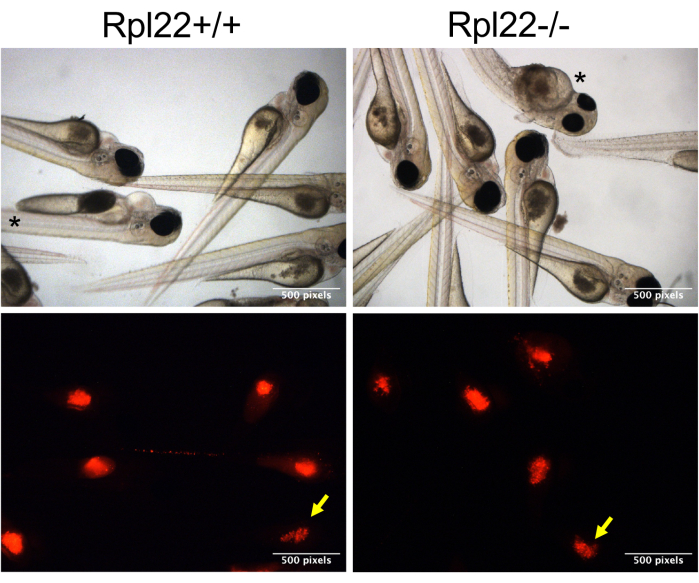
الشكل 3: صور تمثيلية للأجنة المزروعة بزراعة الزينة. يتم عرض صور المجال الساطع والفلورسنت المناعي للخلايا الإيجابية لصبغة CM-Dil (الحمراء) في صفار أجنة كاسبر عند 1 نقطة في البوصة (صورة القابض). يشار إلى الأجنة ذات البلعة السفلية بسهم أصفر ، بينما يشار إلى الأجنة ذات التشكل المضطرب بعلامة النجمة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
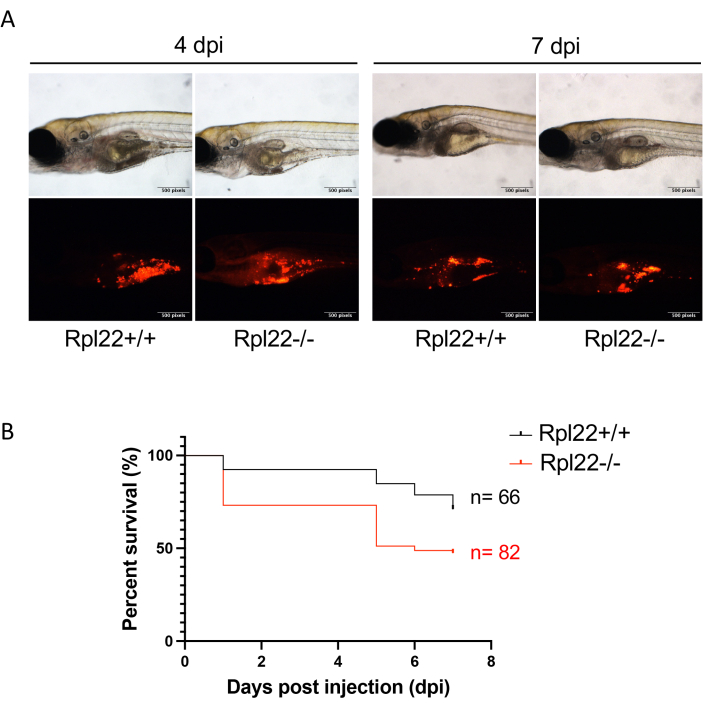
الشكل 4: تقييم تطور المرض عن طريق التصوير الفلوري وتحليل البقاء على قيد الحياة. (أ) صورة تمثيلية للأجنة المزروعة بالأجانب بدقة 4 نقطة في البوصة و7 نقطة في البوصة. (ب) مخطط كابلان ماير الذي يوضح تحليل بقاء الأجنة التي تحتوي على خطين مختلفين وراثيا من ابيضاض الدم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
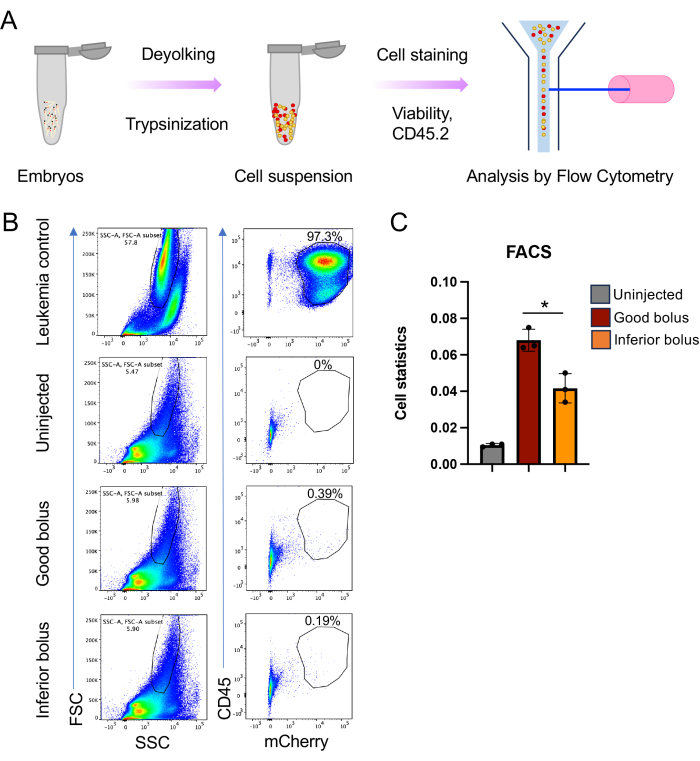
الشكل 5: تحليل التدفق الخلوي لعبء المرض في الزرد المزروع بالزينة. (أ) التمثيل التخطيطي لإعداد معلق الخلية وتحليل قياس التدفق الخلوي. باختصار ، يتم تصنيف الأجنة عند 4 نقطة في البوصة إلى معلقات أحادية الخلية باستخدام التربسين والكولاجيناز ، يليها قياس التدفق الخلوي. (B) مخططات تمثيلية لتحليل قياس التدفق الخلوي حيث تكون الصورة اليسرى في كل لوحة هي مخطط FSC-A v / s SSC-A والصورة اليمنى هي إشارات CD45 v / s mCherry . (C) رسم بياني شريطي يوضح إحصائيات الخلية للخلايا المزروعة بالأجانب كما تم الحصول عليها من مخطط CD45 v / s mCherry للأجنة غير المحقونة والجيدة والسفلية (n = 45 و 40 و 40 لكل نسخة مكررة (n = 3) ؛ قيمة p * ≤ 0.05 ، محسوبة باستخدام اختبار t غير المزاوج مع تصحيح ويلش في GraphPad Prism 9). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
برزت زراعة الأجانب لسمك الزرد كبديل سريع وقوي وفعال من حيث التكلفة لدراسات الفئران12. على الرغم من الإبلاغ عن عدة طرق لزراعة الزرد ، فقد أدى تكيفنا إلى تحسينات كبيرة. بالإضافة إلى توحيد المعلمات حول الإجراء ، تركز هذه التحسينات بشكل خاص على تسريع معدل إجراء حقن الورم ، وبالتالي تمكين زيادة عدد لكل ذراع دراسة واستخدام علامات الورم لمراقبة جودة الحقن وسلوك ما بعد الحقن.
في حين أن التحسينات على هذه الطريقة الموصوفة هنا لها إمكانات كبيرة ، فإن التنفيذ الناجح لهذه الاستراتيجية سيتطلب ممارسا ماهرا وتحسينا للتطبيق المحدد. استخدمنا خلايا سرطان الدم. وبالتالي ، فإن استخدام السرطانات الصلبة قد يجلب تحديات إضافية. قد تكون هذه الأورام عرضة للتجميع ، مما يخلق تباينا في توصيل بلعة الخلية ؛ ومع ذلك ، حتى في مثل هذه الظروف ، يجب أن يتيح وضع العلامات على طلب تقديم العروض مراقبة جودة كافية بعد الحقن للبلعة. هذا يتفوق على وضع العلامات GFP أو الأصباغ الخضراء ، والتي يتم حجبها بواسطة التألق الذاتي. وأخيرا، فإن التوحيد الموصوف هنا لمعظم المعلمات التي تؤثر على النجاح (صحة الجنين، ودرجة حرارة تربية الأحياء المائية، وفتحة الإبرة، وضغط الحقن، وما إلى ذلك) يقلل من تباين هذه العملية.
أحد الاعتبارات الرئيسية لتجارب زراعة الأعضاء في الزرد هو موقع الحقن. هنا ، أظهرنا أن الحقن في صفار البيض سهلة للغاية مقارنة بالمواقع الأخرى الأكثر تحديا من الناحية الفنية ، مثل مساحة periviteline34 ، وقناة Cuvier35 ، والحقن داخل القلب (بطين القلب)36. عيب حقن صفار البيض هو أنه عضو حيوي للأجنة النامية ، لذلك يجب توخي الحذر لضمان التحكم بعناية في قطر الإبرة والضغط حتى لا يموت الجنين بسبب صدمة الحقن. النهج الموصوف هنا يخفف من هذا القلق عن طريق تقليل الإصابة والتخلص من أي إصابات واضحة أو وفاة بمقدار 1 نقطة في البوصة لأن هذه المشكلات لا علاقة لها بنمو الورم. الاعتبار الأخير فيما يتعلق بموقع الحقن هو أن البيئات الدقيقة المتميزة قد يكون لها قدرة أكبر أو أقل على دعم انتشار الأورام المزروعة بالأجانب. وبالتالي ، ربما يمكن إجراء حقن صفار البيض أولا قبل الشروع في حقن تقويم العظام الأكثر تحديا. الميزة الرئيسية لحقن صفار البيض هي أنه لا يتطلب تدريجا دقيقا للجنين ، وبالتالي يتيح حقنا أسرع لعدد أكبر من الأجنة ، وبالتالي الحفاظ على صحتهم بشكل أفضل وزيادة القوة الإحصائية لحل الاختلافات في سلوك الخلايا السرطانية المزروعة.
عادة ما يتم تقييم مراقبة تطور المرض بعد الحقن من خلال التأثيرات على البقاء على قيد الحياة باستخدام تحليل كابلان ماير37 ؛ ومع ذلك ، يمكن أن يكون اختبار عبء المرض مفيدا أيضا. بالنسبة للخلايا المزروعة التي تبقى في موقع الحقن ، يمكن قياس عبء الورم باستخدام طرق الفحص المجهري المختلفة ، بشرط ألا يتم حجب طريقة وضع العلامات على الخلايا السرطانية بواسطة التألق الذاتي29. يتم حل صبغة CM-Dil بسهولة ولا تتأثر بالتألق الذاتي ، لذلك فهي تعمل بشكل جيد لتحديد عبء الورم للخلايا الموضعية. يحدث التحدي عندما لا تبقى الخلايا السرطانية في موقع الحقن وتنتشر. في مثل هذه الحالات ، يعد قياس التدفق الخلوي ، إلى جانب العلامات الجينية التي لا تمحى باستخدام بروتينات الفلورسنت الحمراء ، طريقة فعالة للغاية لرصد عبء المرض في براثن الأجنة الموحدة حيث يمكن تحليل الورم المسمى باستخدام بقع خاصة بالأنواع تختلف عن خلايا الزرد. أحد عيوب CM-Dil هو أنه مخفف عن طريق انقسام الخلايا38. وفقا لذلك ، فإن التكيف باستخدام العلامات الجينية للأورام باستخدام RFP أو mCherry يحمل فوائد كبيرة. يتيح تعبير mCherry ، إلى جانب الجسم المضاد الخاص بالورم ، التعرف الواثق على الخلايا المزروعة بين ما يمكن أن يكون نمطا معقدا من إشارات الخلفية التي توفرها خلايا الزرد المضيفة.
مجتمعة ، يوفر نهج زراعة الأجانب وطريقة التحليل المحسنة لسمك الزرد المستخدم في هذه الدراسة تحسنا كبيرا لمنصة تجريبية قوية بالفعل.
Disclosures
يعلن المؤلفون عدم وجود مصالح متنافسة.
Acknowledgements
تم دعم هذا العمل من خلال منح المعاهد الوطنية للصحة R37AI110985 و P30CA006927 ، وهو اعتماد من كومنولث بنسلفانيا ، وجمعية اللوكيميا والأورام اللمفاوية ، وصندوق الأسقف. تم دعم هذه الدراسة أيضا من قبل المرافق الأساسية في Fox Chase ، بما في ذلك زراعة الخلايا ، وقياس التدفق الخلوي ، ومنشأة المختبر. نشكر الدكتورة جينيفر رودس على صيانة مرفق الزرد والحقن المجهري في FCCC.
Materials
| Name | Company | Catalog Number | Comments |
| 1-phenyl 2-thiourea (PTU) | Sigma | P7629 | |
| 70 micron cell strainer | Corning | CLS431751-50EA | |
| 90 mm Petri dish | Thermo Fisher Scientific | S43565 | |
| Agarose | Apex bioresearch | 20-102GP | |
| APC APC anti-mouse CD45.2 Antibody | Biolegend | 109814 | |
| BD FACSymphony A5 Cell Analyzer | BD Biosciences | BD FACSymphony A5 | |
| calibration capillaries | Sigma | P1424-1PAK | |
| Cell tracker CM-dil dye | Invitrogen | C7001 | |
| Collageanse IV | Gibco | 17104019 | |
| Dumont forceps number 55 | Fine science tools | 11255-20 | |
| FBS | Corning | 35-015-CV | |
| Fluorescence microscope | Nikon | model SMZ1500 | |
| Glass capillaries (Borosilicate) | World precision instruments | 1B100-4 | |
| HBSS | Corning | 21-023-CV | |
| Helix NP Blue | Biolegend | 425305 | |
| Instant Ocean Sea Salt | Instant ocean | SS15-10 | |
| Light microscope | Nikon | model SMZ1000 | |
| Methylene blue | Sigma | M9140-100G | |
| Microloader (long tips for laoding cells) | eppendorf | 930001007 | |
| P1000 micropipette puller | Sutter instruments | model P-97 | |
| PM 1000 cell microinjector | MicroData Instruments, Inc. (MDI) | PM1000 | |
| Tricaine methanesulphate (Ethyl 3- aminobenzoate methanesulphate) | Sigma | E10521-10G | |
| Trypsin-EDTA (0.5%), no phenol red | Gibco | 15400054 | |
| Zebrafish adult irradiated diet (dry feed) | Zeigler | 388763 |
References
- Sharma, G., Goyal, Y., Bhatia, S. Handbook of Animal Models and its Uses in Cancer Research. Preclinical Animal Models of Cancer: Applications and Limitations. , (2022).
- Singhal, S. S., et al. Recent advancement in breast cancer research: Insights from model organisms-Mouse models to zebrafish. Cancers. 15 (11), 2961 (2023).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduction and Targeted Therapy. 8 (1), 160 (2023).
- Fuochi, S., Galligioni, V. Disease Animal Models for Cancer Research. Cancer Cell Culture: Methods and Protocols. , (2023).
- Shaw, T. J., Senterman, M. K., Dawson, K., Crane, C. A., Vanderhyden, B. C. Characterization of intraperitoneal, orthotopic, and metastatic xenograft models of human ovarian cancer. Mol Ther. 10 (6), 1032-1042 (2004).
- Deroose, C. M., et al. Multimodality imaging of tumor xenografts and metastases in mice with combined small-animal PET, small-animal CT, and bioluminescence imaging. J Nucl Med. 48 (2), 295-303 (2007).
- Zeng, M., et al. Generation, evolution, interfering factors, applications, and challenges of patient-derived xenograft models in immunodeficient mice. Cancer Cell Int. 23 (1), 120 (2023).
- Adhish, M., Manjubala, I. Effectiveness of zebrafish models in understanding human diseases-A review of models. Heliyon. 9 (3), e14557 (2023).
- MacRae, C. A., Peterson, R. T. Zebrafish as a mainstream model for in vivo systems pharmacology and toxicology. Ann Rev Pharmacol Toxicol. 63, 43-64 (2023).
- Choe, S. -. K., Kim, C. -. H. Zebrafish: A powerful model for genetics and genomics. Int J Mol Sci. 24 (9), 8169 (2023).
- White, R., Rose, K., Zon, L. Zebrafish cancer: the state of the art and the path forward. Nat Rev Cancer. 13 (9), 624-636 (2013).
- Al-Hamaly, M. A., Turner, L. T., Rivera-Martinez, A., Rodriguez, A., Blackburn, J. S. Zebrafish cancer avatars: A translational platform for analyzing tumor heterogeneity and predicting patient outcomes. Int J Mol Sci. 24 (3), 2288 (2023).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Hill, D., Chen, L., Snaar-Jagalska, E., Chaudhry, B. Embryonic zebrafish xenograft assay of human cancer metastasis. F1000Res. 7, 1682 (2018).
- Corkery, D. P., Dellaire, G., Berman, J. N. Leukaemia xenotransplantation in zebrafish--chemotherapy response assay in vivo. Br J Haematol. 153 (6), 786-789 (2011).
- Lin, J., et al. A clinically relevant in vivo zebrafish model of human multiple myeloma to study preclinical therapeutic efficacy. Blood. 128 (2), 249-252 (2016).
- Grissenberger, S., et al. High-content drug screening in zebrafish xenografts reveals high efficacy of dual MCL-1/BCL-XL inhibition against Ewing sarcoma. Cancer Lett. 554, 216028 (2023).
- Baxi, D. Zebrafish: A Versatile Animal Model to Study Tumorigenesis Process and Effective Preclinical Drug Screening for Human Cancer Research. Handbook of Animal Models and its Uses in Cancer Research. , (2022).
- Li, X., Li, M. The application of zebrafish patient-derived xenograft tumor models in the development of antitumor agents. Med Res Rev. 43 (1), 212-236 (2023).
- Yin, J., et al. Zebrafish patient-derived xenograft model as a preclinical platform for uveal melanoma drug discovery. Pharmaceuticals. 16 (4), 598 (2023).
- Nakayama, J., Makinoshima, H., Gong, Z. In vivo drug screening to identify anti-metastatic drugs in Twist1a-ER(T2) transgenic zebrafish. Bio Protoc. 13 (10), e4673-e4673 (2023).
- Lam, S., Chua, H., Gong, Z., Lam, T., Sin, Y. Development and maturation of the immune system in zebrafish, Danio rerio: a gene expression profiling, in situ hybridization and immunological study. Dev Comp Immunol. 28 (1), 9-28 (2004).
- Nicoli, S., Presta, M. The zebrafish/tumor xenograft angiogenesis assay. Nat Protoc. 2 (11), 2918-2923 (2007).
- Casey, M. J., et al. Transplantation of zebrafish pediatric brain tumors into immune-competent hosts for long-term study of tumor cell behavior and drug response. J Vis Exp. (123), e55712 (2017).
- Soh, G. H., Kögler, A. C., Müller, P. A simple and effective transplantation device for zebrafish embryos. J Vis Exp. (174), e62767 (2021).
- Martinez-Lopez, M., Póvoa, V., Fior, R. Generation of zebrafish larval xenografts and tumor behavior analysis. J Vis Exp. (172), e62373 (2021).
- Ren, J., Liu, S., Cui, C., Ten Dijke, P. Invasive behavior of human breast cancer cells in embryonic zebrafish. J Vis Exp. (122), e55459 (2017).
- Zhao, C., et al. A novel xenograft model in zebrafish for high-resolution investigating dynamics of neovascularization in tumors. PloS One. 6 (7), e21768 (2011).
- Cabezas-Sáinz, P., Pensado-López, A., Sáinz Jr, B., Sánchez, L. Modeling cancer using zebrafish xenografts: drawbacks for mimicking the human microenvironment. Cells. 9 (9), 1978 (2020).
- Haraoka, Y., Akieda, Y., Ishitani, T. Live-imaging analyses using small fish models reveal new mechanisms that regulate primary tumorigenesis. Yakugaku Zasshi. 139 (5), 733-741 (2019).
- Westerfield, M. . The Zebrafish Book. A Guide for the Laboratory Use of Zebrafish (Danio rerio). , (2000).
- Rao, S., et al. Inactivation of ribosomal protein L22 promotes transformation by induction of the stemness factor, Lin28B. Blood. 120 (18), 3764-3773 (2012).
- Goel, M. K., Khanna, P., Kishore, J. Understanding survival analysis: Kaplan-Meier estimate. Int J Ayurveda Res. 1 (4), 274-278 (2010).
- Usai, A., Di Franco, G., Gabellini, C., Morelli, L., Raffa, V. Establishment of zebrafish patient-derived xenografts from pancreatic cancer for chemosensitivity testing. J Vis Exp. (195), e63744 (2023).
- Murali Shankar, N., et al. Preclinical assessment of CAR-NK cell-mediated killing efficacy and pharmacokinetics in a rapid zebrafish xenograft model of metastatic breast cancer. Front Immunol. 14, 1254821 (2023).
- Takahi, M., et al. Xenograft of human pluripotent stem cell-derived cardiac lineage cells on zebrafish embryo heart. Biochem Biophys Res Commun. 674, 190-198 (2023).
- Rudner, L. A., et al. Shared acquired genomic changes in zebrafish and human T-ALL. Oncogene. 30 (41), 4289-4296 (2011).
- Regan, J. L., et al. RNA sequencing of long-term label-retaining colon cancer stem cells identifies novel regulators of quiescence. iScience. 24 (6), 102618 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved