Method Article
Внутрисердечная инъекция клеток рака предстательной железы человека для создания мышиной модели ксенотрансплантата с метастазами в кости
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы представляем протокол внутрисердечной инъекции клеток рака предстательной железы человека для создания мышиной модели с поражениями метастазов в кости.
Аннотация
Как наиболее распространенное мужское злокачественное новообразование, рак предстательной железы (РПЖ) занимает второе место по смертности, в первую очередь из-за частоты метастазирования в кости 65-75%. Поэтому важно понимать процесс и связанные с ним механизмы метастазирования рака предстательной железы в кости для разработки новых терапевтических средств. Для этого животная модель метастазирования в кости является важным инструментом. Здесь мы сообщаем о подробных процедурах создания модели мышей с метастазами в кости с помощью внутрисердечной инъекции клеток рака предстательной железы. Система биолюминесцентной визуализации может определить, были ли клетки рака предстательной железы точно введены в сердце, и контролировать метастазирование раковых клеток, поскольку она имеет большие преимущества в мониторинге развития метастатического поражения. Эта модель воспроизводит естественное развитие диссеминированных раковых клеток с образованием микрометастазов в кости и имитирует патологический процесс метастазирования рака предстательной железы в кости. Он предоставляет эффективный инструмент для дальнейшего изучения молекулярных механизмов и терапевтических эффектов этого заболевания in vivo .
Введение
Рак предстательной железы является наиболее частым онкологическим заболеванием у мужчин в 112 странах и занимает второе место по смертности в странах с более высоким индексом человеческого развития 1,2. Большинство смертей у пациентов с раком предстательной железы вызваны метастазированием, и примерно в 65-75% случаев развиваются метастазы в кости 3,4. Поэтому профилактика и лечение метастазов рака предстательной железы в кости крайне необходимы для улучшения клинического исхода пациентов с раком предстательной железы. Животная модель метастазирования в кости является незаменимым инструментом для изучения многоступенчатого процесса и молекулярных механизмов, участвующих в каждой стадии метастазирования в кости рака предстательной железы, что позволяет определить терапевтические цели и разработать новые терапевтические средства5.
Наиболее распространенные методы создания экспериментальных животных моделей метастазов рака предстательной железы в кости включают ортотопические, внутридиафизионные (например, внутрибольшеберцовые) и внутрисердечные инъекции клеток рака предстательной железы. Модель метастазирования в кости с ортотопической инъекцией генерируется путем прямой инъекции клеток рака предстательной железы в предстательную железу мыши 6,7. Эта экспериментальная модель на животных имеет очень похожие клинические характеристики на метастазы в кости рака предстательной железы. Однако метастазирование в основном происходит в подмышечных лимфатических узлах и легких, а не в кости 8,9. Модель внутрибольшеберцовой инъекции при раке предстательной железы непосредственно вводит клетки рака предстательной железы в большеберцовую кость с высокой скоростью образования опухоли в кости (большеберцовой кости)10,11; Однако кора костей и полость костного мозга легко повреждаются. Кроме того, метод инъекции большеберцовой кости не может стимулировать патологический процесс метастазирования рака предстательной железы в кости, при котором раковые клетки колонизируют кость через кровообращение. Для исследования кровообращения, сосудистой экстравазации и отдаленных метастазов с более высокой скоростью метастазирования раковых клеток в кости была разработана техника внутрисердечной инъекции путем прямого введения клеток рака предстательной железы в левый желудочек мыши 8,12,13. Это делает его ценной моделью на животных для исследования метастазовв кости 8. Метод внутрисердечной инъекции показывает частоту метастазирования в кости около 75%9,14, что намного выше, чем метод ортотопической инъекции. Таким образом, внутрисердечная инъекция является идеальным методом создания животной модели с метастазами рака предстательной железы в кости.
Эта работа направлена на описание процесса создания мышиной модели метастазов рака предстательной железы в кости, позволяя читателям визуализировать создание модели. Текущая работа содержит подробные процессы, меры предосторожности и иллюстративные изображения для создания модели ксенотрансплантата метастазов в кости с помощью внутрисердечной инъекции клеток рака предстательной железы человека у мышей с атимией. Этот метод является эффективным инструментом для дальнейшего изучения молекулярных механизмов и терапевтических эффектов метастазов рака предстательной железы в кости in vivo .
протокол
Шести-восьминедельные самцы атимических мышей BALB/c (n = 10) были размещены в индивидуально вентилируемых клетках для мышей (5 мышей/клетка) в помещении для животных без специфических патогенов (SPF) в условиях 12-часового цикла свет/темнота, со свободным доступом к корму SPF и стерильной воде. Мышей адаптивно кормили в течение недели перед экспериментами. Все эксперименты на животных были одобрены комитетом по благополучию животных Шанхайского университета традиционной китайской медицины.
1. Подготовка клеток
- В день инъекции клеток рака предстательной железы дважды вымойте 80%-90% сливающиеся клетки PC-3, меченные люциферазой (PC-3-люциферазой), культивируемые в 10-сантиметровой чашке для культивирования клеток с предварительно холодным стерильным PBS (pH 7,4). Трипсинизировать в течение 3 мин с 1,5 мл 0,25% трипсина и собрать клетки в центрифужную пробирку объемом 15 мл после гашения трипсина 6 мл среды F-12, содержащей 10% сыворотки.
ПРИМЕЧАНИЕ: Клеточная линия PC-3-люциферазы получена из клеточной линии PC-3 после трансфицирования вектором pLV-люциферазы15. - Используйте автоматический счетчик ячеек и рассчитайте концентрацию клеток, перенеся 20 мкл клеточной суспензии на планшет для подсчета клеток (см. Таблицу материалов).
- Центрифугируйте клетки при 800 x g при комнатной температуре (RT) в течение 5 мин.
- С помощью пипетки откажитесь от надосадочной жидкости и ресуспендируйте клеточную гранулу в среде F-12 (см. Таблицу материалов) до конечной плотности клеток 1 x 10,7 клеток/мл.
- Держите клетки на льду все время до инъекции.
- Принесите клетки в операционную и завершите инъекцию клеток в течение 2 часов.
ПРИМЕЧАНИЕ: Подготовьте дополнительные клеточные суспензии (обычно удвоенные объемы по мере необходимости), чтобы обеспечить точные дозы инъекций (например, чтобы избежать мертвых зон внутри шприцев).
2. Операция по внутрисердечной инъекции клеток рака предстательной железы человека
ПРИМЕЧАНИЕ: Хирургический аппарат, используемый для внутрисердечной инъекции, представляет собой шприц объемом 1 мл (рис. 1). Обеспечьте тепловую поддержку на протяжении всей процедуры до тех пор, пока животное не оправится от анестезии.
- Держите мышь в комнате для животных с SPF. Выполняйте все процедуры с помощью стерилизованных аппаратов в асептическом шкафу.
- Анестезируйте мышей, используя 2% изофлурана с 98% кислородом при скорости потока кислорода 2 л / мин.
ПРИМЕЧАНИЕ: Нанесите небольшое количество офтальмологической мази на глаза мыши, чтобы избежать сухости во время анестезии. Выполняйте всю операцию в хорошо проветриваемом помещении. Убедитесь, что мышь находится под глубоким наркозом, ущипнув пальцы мыши перед инъекцией клеток. Если реакция (например, рывок или подергивание) остается, подождите дополнительное время, пока анестезия подействует. - Поместите мышь в положение супона и обездвижите обе верхние конечности, перпендикулярно вытянутые от средней линии (рис. 2А).
- Иммобилизуйте мышь от живота вниз хирургическим скотчем. Избегайте сильного надавливания и смещения внутренних органов (рис. 2B).
ПРИМЕЧАНИЕ: Поддержание топографической анатомии (т.е. фиксация клейкой лентой) имеет важное значение, поскольку внутрисердечная инъекция слепа (т.е. точное место инъекции на сердце невидимо невооруженным глазом). - Продезинфицируйте кожу грудной клетки с помощью тампона с 70% этанолом.
- Определите мечевидный отросток мыши в углублении на самом нижнем конце средней грудины, пальпируя середину передней грудной стенки. Определите яремную выемку мыши в центральном углублении на верхней границе манубриума, пальпируя вверх от середины передней грудной стенки.
- Отметьте маркером самую нижнюю точку мечевидного отростка и яремную выемку (рис. 2А). Сделайте третью отметку посередине этих двух ориентиров и немного правее (слева от животного) прямо над сердцем в третьем межреберье.
ПРИМЕЧАНИЕ: Место инъекции находится в 1-2 мм слева от средней линии, а точка инъекции находится между третьим и четвертым ребрами мыши (рис. 2A). - Загрузите 200 мкл клеточной суспензии в шприц объемом 1 мл.
ПРИМЕЧАНИЕ: Держите пузырь воздуха в шприце, как показано на рисунке 2C, чтобы убедиться, что кровь пульсирует. Клеточную суспензию перед загрузкой необходимо тщательно перемешать. - Вертикально введите иглу 26 G через место инъекции (рис. 2D).
- Держите руку, держащую шприц, устойчиво на столе, или используйте другую руку, чтобы удерживать его устойчиво. Убедитесь, что длинная ось шприца перпендикулярна месту инъекции, и вставьте шприц примерно на 2 мм подкожно.
- Ярко-красная пульсация крови видна в игольчатой втулке и/или клеточной суспензии, когда кончик иглы правильно введен в левый желудочек. Если пульсация крови незаметна, кончик иглы находится не в сердце. Втяните и замените иглу (в случае, если свертывание крови внутри иглы останавливает пульсацию крови). Вставьте иглу еще раз.
- Вводите клетки. Вводите клеточную суспензию (100 мкл) очень медленно в течение 40-60 с и все время держите руку, держащую шприц, устойчивой.
ПРИМЕЧАНИЕ: Внимательно следите за клеточной суспензией в шприце и не вводите пузырь воздуха внутри шприца в сердце. - Надавите на место инъекции сухим ватным тампоном в течение 15 с, чтобы обеспечить гемостаз при втягивании иглы.
- Верните мышь в чистую клетку и следите за животным до тех пор, пока оно полностью не оправится от наркоза.
- Сфотографируйте мышь с помощью биолюминесцентной системы in vivo в течение 24 часов после инъекции, чтобы убедиться, что раковые клетки попали в системный кровоток.
ПРИМЕЧАНИЕ: Правильно введенные раковые клетки попадают в артериальное кровообращение через левый желудочек сердца, что видно по биолюминесцентной сигнализации, видимой по всему телу (например, см. рис. 3A). - Выполняйте биолюминесцентную визуализацию in vivo .
- Включите прибор и компьютер. Откройте программное обеспечение, когда индикатор питания на приборе и компьютере загорится, а затем откройте окно «Получение изображения ».
- Определите систему визуализации in vivo , подключенную к компьютеру, на панели устройства. Поместите мышь для получения изображения в камеру визуализации в положении лежа на спине. Затем закройте дверцу камеры визуализации.
- Задайте параметры на панели « Настройка » в окне «Получение изображения ».
- Установите параметры с помощью объектива > Zoom > 1x, Lens > Focus > 108 и Lens > Iris > F 2.8 , чтобы сделать изображения четкими.
- Установите канал съемки в поле «Фильтр и свет»: «Фильтр и свет» > «Фильтр > люминесценции», «Фильтр и свет > свет» > «Выкл.» и «Фильтр и свет» > интенсивности света > середине.
- Установите тип изображения, которое будет сделано: Image > Type > Single-Frame, Imaging > Exposure Time > 500 ms, Imaging > HDR Mode > Low GainMode. Нажмите кнопку «Получить », чтобы получить изображение.
- Визуализируйте рост метастатического рака с помощью биолюминесценции in vivo .
ПРИМЕЧАНИЕ: В каждый момент времени визуализации внутрибрюшинно вводите 200 мкл субстрата люциферина мышке весом 20 г (150 мг / кг) и подождите 15 минут перед анестезией (2% изофлуран, смешанный с 98% кислородом в индукционной камере). Поместите мышь на платформу системы биолюминесцентной визуализации. Поддерживают анестезию через назальную маску с 2% изофлураном.
3. Патологоанатомическое исследование
- Через четыре недели после инъекции клеток пожертвуйте мышь ингаляцией CO2 , а затем вывихом шейки матки.
- Обездвижите мышь в положении лежа на спине. Сделайте вертикальный разрез (около 6 см) от живота до грудной клетки хирургическими ножницами, чтобы обнажить и грубо исследовать все органы брюшной полости и грудной клетки на наличие раковых поражений и/или патологических изменений.
ПРИМЕЧАНИЕ: Для внутрисердечного исследования инъекции раковых клеток раковые поражения в средостении, прилегающем к сердцу, предполагают неправильно введенные раковые клетки (клетки, не введенные в левый желудочек сердца); Поэтому эти мыши не включаются в окончательный сбор данных. - Иссекают метастатические опухоли ножницами. Измерьте длинные диаметры (a) и короткие диаметры (b) опухоли с помощью штангенциркуля, чтобы рассчитать объем опухоли (V) по формуле V = 1/2 × a × b2, и взвесьте опухоль с помощью электронных весов.
- Фиксируют опухолевые ткани в 10% растворе формалина с последующим заделыванием в парафин. В качестве альтернативы можно заморозить опухоли в жидком азоте.
- Иссекают кости (задние конечности, позвонки и/или ребра) с метастатическими поражениями. Зафиксируйте образец каждой мыши в пробирке объемом 50 мл, содержащей 20 мл 10% раствора формалина, в течение 24 ч после удаления кожи и мышц с последующей декальцификацией в течение 14 дней в 10% растворе ЭДТА с частой сменой буфера (каждые 3 дня).
- Поместите образец в парафин и разделите образцы для рутинного гистологического исследования16.
Результаты
Биолюминесцентная визуализация дает огромные преимущества в мониторинге развития метастатического поражения для внутрисердечной инъекционной модели. Вскоре после инъекции раковых клеток (в течение 24 часов) биолюминесцентная визуализация использовалась для визуализации раковых клеток, поступающих в общий кровоток (рис. 3А). Очевидная биолюминесцентная сигнализация по всему телу будет видна, когда раковые клетки будут введены в артериальное кровообращение должным образом. Данные мышей, демонстрирующие сигналы биолюминесценции только в месте инъекции (сердце), должны быть исключены из окончательного сбора данных. Метастатические поражения задних конечностей наблюдались (рис. 3B-D) через 2 недели после инъекции клеток. Со временем метастатические поражения стали больше и появились в других местах, включая грудину, ребра и нижнюю челюсть.
Рентгеновские снимки показали разрушение кости, представляющее метастатические поражения в кости (рис. 4А). Разрушение кости также было обнаружено с помощью микро-КТ. Сканирование микро-КТ проводилось в 3D-режиме с использованием микро-КТ (μCT80), связанного с 3Dcalc, реконусной реконструкцией и программным обеспечением для визуализации модели. Для построения 3D-модели была получена реконструкция растровых данных. Репрезентативное микро-КТ-изображение разрушения кости в проксимальном отделе большеберцовой кости показано на рисунке 4B. Метастатические поражения были дополнительно подтверждены в парафиновых тканях окрашиванием H&E (рис. 4C).

Рисунок 1: Хирургический аппарат. Шприц объемом 1 мл. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Внутрисердечная инъекция клеток рака предстательной железы . (A) На панели показаны яремная выемка, мечевидный отросток, грудная клетка (нижний край) и средняя линия. Место инъекции равноудалено от мечевидного отростка и яремной выемки. (B) Хирургическая лента используется горизонтально через брюшную полость, чтобы предотвратить движение мыши во время инъекции. (C) Шприц, загруженный клеточной суспензией и наличием пузырька воздуха. Пузырь воздуха помогает визуализировать пульсацию крови. (D) Игла вводится вертикально через место инъекции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
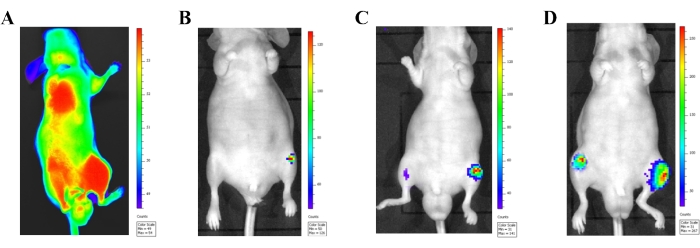
Рисунок 3: Подтверждение модели внутрисердечной инъекции с помощью системы биолюминесцентной визуализации in vivo. (A) Биолюминесцентная визуализация in vivo самца атимической мыши через 24 ч после инъекции меченных люциферазой клеток PC-3 (1 × 106 клеток) в левый желудочек сердца. Правильно введенные раковые клетки в системный кровоток видны по сигналу биолюминесценции, высвобождаемому из всего организма. (Б-Д) Биолюминесцентные изображения репрезентативной мыши, демонстрирующей прогрессирующее развитие метастазов. (B) Изображение, показывающее клетки рака предстательной железы через 2 недели после инъекции. (C) Изображение, показывающее клетки рака предстательной железы через 3 недели после инъекции. (D) Изображение, показывающее клетки рака предстательной железы через 4 недели после инъекции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
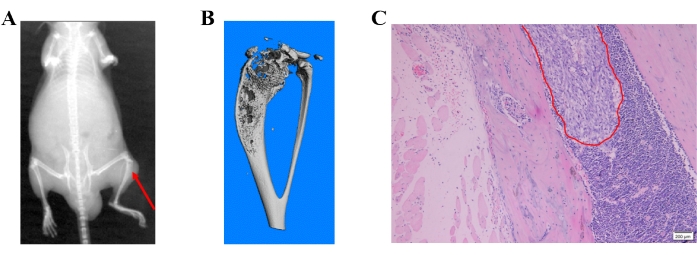
Рисунок 4: Различные методы обнаружения метастазов в кости, вызванных клетками рака предстательной железы. а) репрезентативное рентгеновское изображение; Красная стрелка показывает разрушение кости в проксимальном отделе большеберцовой кости. (B) Репрезентативное микро-КТ-изображение большеберцовой кости. (C) Изображение H&E, показывающее метастазы клеток рака предстательной железы в кости. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Внутрисердечная инъекция клеток рака предстательной железы человека для получения метастазов в кости является идеальной моделью мыши для изучения функций и механизмов метастазирования рака предстательной железы в кости и оценки терапевтической эффективности. Исследования показали, что повреждение костей, скорее всего, происходит в проксимальном отделе большеберцовой кости идистальном отделе бедренной кости 17, что может быть связано с их высокой васкуляризацией и метаболической активностью.
Поскольку метастазирование в кости является часто наблюдаемым метастатическим поражением у пациентов с раком молочной железы, модель метастазирования в кости, полученная путем внутрисердечной инъекции клеток рака молочной железы, также широко используется в исследованиях рака молочной железы18,19. Таким образом, текущая работа может помочь разработать модель метастазирования в кости с помощью внутрисердечной инъекции с клетками рака молочной железы и предстательной железы.
Для последовательного формирования опухоли есть несколько ключевых соображений. Клетки следует вводить как можно скорее после отделения от культуры. Мыши должны быть рандомизированы в экспериментальные группы после инъекции раковых клеток. Объем инъекции должен быть постоянным, и один и тот же человек должен вводить раковые клетки всем мышам, используя одну и ту же технику.
Вся процедура состоит из нескольких важных этапов. Если место инъекции расположено правильно, во время инъекции следует наблюдать пульсирующую кровь. Потенциальными проблемами являются потеря устойчивости руки, держащей шприц, и изменение положения иглы при продвижении поршня шприца. Шприц с цветным концентратором внутри позволяет легко увидеть пульсацию крови. Если при введении иглы в ступице иглы появляются пузырьки воздуха (что указывает на неправильное введение в легкие), иглу необходимо извлечь и снова вставить после перемещения. Если в игольчатой втулке нет пульса красной крови, но человек, делающий инъекцию, уверен, что место инъекции правильное, слегка потяните поршень шприца, чтобы убедиться в том, что инъекция находится в сердечном желудочке. Отсутствие метастазов после 2-3 недель инъекции раковых клеток свидетельствует о неправильном введении. Подтвердите циркуляцию раковых клеток во всем организме с помощью биолюминесцентной визуализации в течение 24 ч после инъекции20. Биолюминесцентную передачу сигналов можно было бы увидеть по всему телу, если бы раковые клетки были точно введены в желудочек сердца. Кроме того, частота метастазов, локализация и количество метастатических опухолей могут различаться в разных клеточных линиях 8,21.
После операции мышей необходимо регулярно проверять. Из-за хирургического вмешательства и воздействия анестетика мыши могут испытывать значительные страдания или даже умереть. Поэтому первая неделя после операции является критической, и за мышами необходимо тщательно наблюдать. На протяжении всего эксперимента по метастазированию в кости мышей следует ежедневно контролировать на предмет изменений уровня активности, подвижности и возникновения кахексии (паранеопластический синдром у мышей, характеризующийся потерей веса, атрофией и слабостью мышц, дугообразным внешним видом и вялостью22,23). Мышей следует усыплять, когда теряется 10-20% массы тела; прогрессирование опухоли ухудшает подвижность (например, перелом длинной кости, наклон головы, параплегия); или мыши, по-видимому, находятся в респираторном дистрессе24.
Преимущество этой модели заключается в том, что раковые клетки, обнаруженные в кости, «засеяли почву» 25, тем самым воспроизводя более естественное прогрессирование образования микрометастазов диссеминированных раковых клеток. Эта модель также имеет несколько ограничений. Это модель рака ксенотрансплантата с использованием иммунодефицитных мышей. Эта модель не полезна для изучения взаимодействия между раковыми клетками и иммунными клетками в микроокружении метастазов в кости. Подсчитано, что около 30% мышей погибнут во время моделирования; Таким образом, практика значительно повысит вероятность успеха разработки модели. Кроме того, метастазирование также может возникать в головном мозге, легких и почках; Образованию множественных метастазов мешает изучение механизмов метастазирования в кости 9,26,27,28. Хотя частота метастазирования в кости намного выше при внутрисердечной инъекции, чем при ортотопической инъекции, техника внутрисердечной инъекции показывает частоту метастазирования в кости около 75%, а не 100%9,14. Более низкая эффективность может быть связана с тем, что введенные раковые клетки не смогли проникнуть в кровоток или смерть мыши-реципиента во время сердечной инъекции из-за того, что игла пронзила сердце или легкое.
Несмотря на эти ограничения, эта устоявшаяся мышиная модель метастазов рака предстательной железы в кости оказалась отличным инструментом для изучения перекрестных помех костей и рака и оценки потенциальных терапевтических средств для предотвращения прогрессирования рака и нарушения цикла разрушения кости, вызванного метастазированием.
Раскрытие информации
Все авторы заявляют об отсутствии конкурирующих финансовых интересов.
Благодарности
Эта работа поддерживается грантами Национальной программы ключевых исследований и разработок Китая (2018YFC1704300 и 2020YFE0201600), Национального фонда естественных наук (81973877 и 82174408), исследовательских проектов в рамках бюджета Шанхайского университета традиционной китайской медицины (2021LK047) и Шанхайского совместного инновационного центра промышленной трансформации подготовки больниц к ТКМ.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mL syringes and needles | Shandong Weigao Group Medical Polymer Co., Ltd | 20200411 | The cells were injected into the ventricles of mice |
| Anesthesia machine | Shenzhen RWD Life Technology Co., Ltd | R500IP | Equipment for anesthetizing mice |
| Automatic cell counter | Shanghai Simo Biological Technology Co., Ltd | IC1000 | For counting cells |
| BALB/c athymic mice | Shanghai SLAC Laboratory Animal Co, Ltd. | Male | 6-8 week old, male mice |
| Bioluminescence imaging system | Shanghai Baitai Technology Co., Ltd | Vieworks | For tracking the tumor growth and pulmonary metastasis if the injected cells are labeled by luciferase |
| Centrifuge tube (15 mL, 50 mL) | Shanghai YueNian Biotechnology Co., Ltd | 430790, Corning | |
| EDTA solution | Wuhan Xavier Biotechnology Co., Ltd | G1105 | For decalcification of bone tissure |
| F-12 medium | Shanghai YueNian Biotechnology Co., Ltd | 21700075, GIBCO | Cell culture medium |
| Formalin solution | Shanghai YueNian Biotechnology Co., Ltd | BL539A | For fixing the specimen of each mouse |
| Isoflurane | Shenzhen RWD Life Technology Co., Ltd | VETEASY | For anesthesia |
| Lipofectamine 2000 | Shanghai YueNian Biotechnology Co., Ltd | 11668027, Thermo fisher | Plasmid transfection reagent |
| PC-3 cell line | Cell Bank of Chinese Academy of Sciences | TCHu 158 | Prostate cancer cell line |
| Phosphate-buffered saline | Beyotime Biotechnology | ST447 | Wash the human osteosarcoma cells |
| Trypsin (0.25%) | Shanghai YueNian Biotechnology Co., Ltd | 25200056, Gibco | For detaching the cells |
| Vector (pLV-luciferase) | Shanghai YueNian Biotechnology Co., Ltd | VL3613 | Plasmid for transfection |
| X-ray imaging system | Brook (Beijing) Technology Co., Ltd | FX PRO | For obtaining x-ray images to detect tumor growth |
| μCT80 | Shenzhen Fraun Technology Service Co., Ltd | Scanco Medical AG,Switzerland | For detection of bone destruction. The mico-CT is equipped with 3DCalc, cone reconstruction, and μCT Ray V3.4A model visualization software. |
Ссылки
- Siegel, R. L., Miller, K. D., Fuchs, H. E., Jemal, A. Cancer Cancerstatistics, 2021. CA: A Cancer Journal for Clinicians. 71 (1), 7-33 (2021).
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 71 (3), 209-249 (2021).
- Coleman, R. E. Skeletal complications of malignancy. Cancer. 80, 1588-1594 (1997).
- Macedo, F., et al. Bone metastases: An overview. Oncology Reviews. 11 (1), 321 (2017).
- Rea, D., et al. Mouse models in prostate cancer translational research: From xenograft to PDX. BioMed Research International. 2016, 9750795 (2016).
- Zhang, Y., et al. Real-time GFP intravital imaging of the differences in cellular and angiogenic behavior of subcutaneous and orthotopic nude-mouse models of human PC-3 prostate cancer. Journal of Cellular Biochemistry. 117 (11), 2546-2551 (2016).
- Stephenson, R. A., et al. Metastatic model for human prostate cancer using orthotopic implantation in nude mice. Journal of the National Cancer Institute. 84 (12), 951-957 (1992).
- Simmons, J. K., et al. Animal models of bone metastasis. Veterinary Pathology. 52 (5), 827-841 (2015).
- Jenkins, D. E., Hornig, Y. S., Oei, Y., Dusich, J., Purchio, T. Bioluminescent human breast cancer cell lines that permit rapid and sensitive in vivo detection of mammary tumors and multiple metastases in immune deficient mice. Breast Cancer Research: BCR. 7 (4), 444-454 (2005).
- Corey, E., et al. Establishment and characterization of osseous prostate cancer models: intra-tibial injection of human prostate cancer cells. The Prostate. 52 (1), 20-33 (2002).
- Andersen, C., Bagi, C. M., Adams, S. W. Intra-tibial injection of human prostate cancer cell line CWR22 elicits osteoblastic response in immunodeficient rats. Journal of Musculoskeletal & Neuronal Interactions. 3 (2), 148-155 (2003).
- Sudhan, D. R., Pampo, C., Rice, L., Siemann, D. W. Cathepsin L inactivation leads to multimodal inhibition of prostate cancer cell dissemination in a preclinical bone metastasis model. International Journal of Cancer. 138 (11), 2665-2677 (2016).
- Jinnah, A. H., Zacks, B. C., Gwam, C. U., Kerr, B. A. Emerging and established models of bone metastasis. Cancers. 10 (6), 176 (2018).
- Simmons, J. K., et al. Canine prostate cancer cell line (Probasco) produces osteoblastic metastases in vivo. The Prostate. 74 (13), 1251-1265 (2014).
- Lamar, J. M., et al. SRC tyrosine kinase activates the YAP/TAZ axis and thereby drives tumor growth and metastasis. The Journal of Biological Chemistry. 294 (7), 2302-2317 (2019).
- Chang, J., et al. Matrine inhibits prostate cancer via activation of the unfolded protein response/endoplasmic reticulum stress signaling and reversal of epithelial to mesenchymal transition. Molecular Medicine Reports. 18 (1), 945-957 (2018).
- Arguello, F., Baggs, R. B., Frantz, C. N. A murine model of experimental metastasis to bone and bone marrow. Cancer Research. 48 (23), 6876-6881 (1988).
- Brylka, L., et al. Spine Metastases in immunocompromised mice after intracardiac injection of MDA-MB-231-SCP2 breast cancer cells. Cancers. 14 (3), 556 (2022).
- Rahman, M. M., Veigas, J. M., Williams, P. J., Fernandes, G. DHA is a more potent inhibitor of breast cancer metastasis to bone and related osteolysis than EPA. Breast Cancer Research and Treatment. 141 (3), 341-352 (2013).
- Park, S. I., Kim, S. J., McCauley, L. K., Gallick, G. E. Pre-clinical mouse models of human prostate cancer and their utility in drug discovery. Current Protocols in Pharmacology. , (2010).
- Wright, L. E., et al. Murine models of breast cancer bone metastasis. BoneKEy Reports. 5, 804 (2016).
- Fearon, K. C., Glass, D. J., Guttridge, D. C. Cancer cachexia: mediators, signaling, and metabolic pathways. Cell Metabolism. 16 (2), 153-166 (2012).
- Waning, D. L., et al. Excess TGF-β mediates muscle weakness associated with bone metastases in mice. Nature Medicine. 21 (11), 1262-1271 (2015).
- Talbot, S. R., et al. Defining body-weight reduction as a humane endpoint: a critical appraisal. Laboratory Animals. 54 (1), 99-110 (2020).
- Paget, S. The distribution of secondary growths in cancer of the breast. Cancer Metastasis Reviews. 8 (2), 98-101 (1989).
- Yin, J. J., et al. TGF-beta signaling blockade inhibits PTHrP secretion by breast cancer cells and bone metastases development. The Journal of Clinical Investigation. 103 (2), 197-206 (1999).
- Schneider, A., et al. turnover mediates preferential localization of prostate cancer in the skeleton. Endocrinology. 146 (4), 1727-1736 (2005).
- Padalecki, S. S., et al. Chromosome 18 suppresses prostate cancer metastases. Urologic Oncology. 21 (5), 366-373 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены