Method Article
הזרקה תוך לבבית של תאי סרטן ערמונית אנושיים ליצירת גרורות עצם מודל עכבר Xenograft
* These authors contributed equally
In This Article
Summary
כאן, אנו מציגים פרוטוקול להזרקה תוך לבבית של תאי סרטן ערמונית אנושיים כדי ליצור מודל עכבר עם נגעים גרורות בעצמות.
Abstract
כממאירות הגברית הנפוצה ביותר, סרטן הערמונית (PC) מדורג במקום השני בתמותה, בעיקר בשל שיעור גרורות בעצמות של 65%-75%. לכן, חיוני להבין את התהליך ואת המנגנונים הקשורים של גרורות עצם סרטן הערמונית לפיתוח טיפולים חדשים. לשם כך, מודל בעלי חיים של גרורות עצם הוא כלי חיוני. כאן, אנו מדווחים על הליכים מפורטים ליצירת מודל עכבר גרורות עצם באמצעות הזרקה תוך לבבית של תאי סרטן הערמונית. מערכת הדמיה ביולומינסנטית יכולה לקבוע אם תאי סרטן הערמונית הוזרקו במדויק ללב ולנטר גרורות של תאים סרטניים, שכן יש לה יתרונות גדולים במעקב אחר התפתחות נגעים גרורתיים. מודל זה משכפל את ההתפתחות הטבעית של תאי סרטן מופצים ליצירת מיקרו-גרורות בעצם ומחקה את התהליך הפתולוגי של גרורות בעצמות סרטן הערמונית. הוא מספק כלי יעיל לחקירה נוספת של המנגנונים המולקולריים ואת ההשפעות הטיפוליות in vivo של מחלה זו.
Introduction
סרטן הערמונית הוא הסרטן השכיח ביותר בקרב גברים ב -112 מדינות ומדורג במקום השני בתמותה במדינות מדד התפתחות אנושי גבוה יותר 1,2. רוב מקרי המוות בחולי סרטן הערמונית נגרמים מגרורות, וכ-65%-75% מהמקרים יפתחו גרורות בעצמות 3,4. לכן, יש צורך דחוף במניעה וטיפול בגרורות עצם של סרטן הערמונית כדי לשפר את התוצאה הקלינית של חולי סרטן הערמונית. המודל החייתי של גרורות עצם הוא כלי חיוני לחקר התהליך הרב-שלבי והמנגנונים המולקולריים המעורבים בכל שלב של גרורות עצם של סרטן הערמונית, ובכך לזהות מטרות טיפוליות ולפתח טיפולים חדשניים5.
השיטות הנפוצות ביותר ליצירת מודלים ניסיוניים של בעלי חיים של גרורות בעצמות סרטן הערמונית כוללות את האורתוטופיה, תוך דיאפיזה (כגון תוך טיביאלית) והזרקה תוך לבבית של תאי סרטן הערמונית. מודל גרורות העצם עם הזרקה אורתוטופית נוצר על ידי הזרקה ישירה של תאי סרטן הערמונית לתוך הערמונית של עכבר 6,7. למודל ניסיוני זה של בעלי חיים יש מאפיינים קליניים דומים מאוד לגרורות בעצמות סרטן הערמונית. עם זאת, הגרורות מתרחשות בעיקר בבלוטת הלימפה בבית השחי ובריאה ולא בעצם 8,9. מודל ההזרקה התוך טיביאלית לסרטן הערמונית מזריק ישירות תאי סרטן ערמונית לעצם השוקה עם שיעור היווצרות גידול גבוה בעצם (טיביה)10,11; עם זאת, קליפת העצם וחלל מח העצם ניזוקים בקלות. בנוסף, שיטת ההזרקה הטיביאלית אינה יכולה לעורר את התהליך הפתולוגי של גרורות עצם סרטן הערמונית שבו התאים הסרטניים מאכלסים את העצם דרך מחזור הדם. כדי לחקור את מחזור הדם, אקסטרווסציה וסקולרית וגרורות מרוחקות עם שיעור גרורות עצם גבוה יותר של תאים סרטניים, פותחה טכניקת הזרקה תוך לבבית על ידי הזרקה ישירה של תאי סרטן הערמונית לחדר השמאלי של העכבר 8,12,13. זה הופך אותו למודל בעל ערך בבעלי חיים לחקר גרורות בעצמות8. בשיטת ההזרקה התוך-לבבית שיעור גרורות בעצמות עומד על כ-75%9,14, גבוה בהרבה משיטת ההזרקה האורתוטופית. לכן, הזרקה תוך לבבית היא שיטה אידיאלית ליצור מודל בעלי חיים עם גרורות עצם סרטן הערמונית.
עבודה זו נועדה לתאר את תהליך הקמת מודל העכבר של גרורות עצם סרטן הערמונית, המאפשר לקוראים לדמיין את הקמת המודל. העבודה הנוכחית מספקת תהליכים מפורטים, אמצעי זהירות ותמונות להמחשה ליצירת מודל xenograft גרורות עצם באמצעות הזרקה תוך לבבית של תאי סרטן ערמונית אנושיים בעכברים אתימיים. שיטה זו מספקת כלי יעיל לחקירה נוספת של המנגנונים המולקולריים וההשפעות הטיפוליות in vivo של גרורות בעצמות סרטן הערמונית.
Protocol
עכברי BALB/c אתימיים זכרים בני שישה עד שמונה שבועות (n = 10) שוכנו בכלובי עכברים מאווררים בנפרד (5 עכברים / כלוב) בחדר בעלי חיים ספציפי ללא פתוגן (SPF) בתנאים של מחזור אור / חושך של 12 שעות, עם גישה חופשית להזנת SPF ומים סטריליים. עכברים הוזנו באופן אדפטיבי במשך שבוע לפני הניסויים. כל הניסויים בבעלי חיים אושרו על ידי הוועדה לרווחת בעלי חיים של אוניברסיטת שנגחאי לרפואה סינית מסורתית.
1. הכנת תאים
- ביום הזרקת תאי סרטן הערמונית, יש לשטוף 80%-90% לוציפראז קונפלואנטי המסומן בתאי PC-3 (PC-3-luciferase) בתרבית תאים בקוטר 10 ס"מ עם PBS סטרילי טרום קר (pH 7.4) פעמיים. טריפסין במשך 3 דקות עם 1.5 מ"ל של 0.25% טריפסין, ולאסוף את התאים לתוך צינור צנטריפוגה 15 מ"ל לאחר הרוות את טריפסין עם 6 מ"ל של מדיום F-12 המכיל 10% סרום.
הערה: קו התאים PC-3-luciferase נגזר מקו התאים PC-3 לאחר שהודבק בווקטור pLV-luciferase15. - השתמש במונה תאים אוטומטי וחשב את ריכוז התא על-ידי העברת 20 μL מתרחיף התא ללוח ספירת התאים (ראה טבלת חומרים).
- צנטריפוגה את התאים ב 800 x גרם בטמפרטורת החדר (RT) במשך 5 דקות.
- השתמש פיפטה כדי להשליך את supernatant ולהשהות מחדש את גלולת התא בתווך F-12 (ראה טבלת חומרים) לצפיפות תא סופית של 1 x 107 תאים/מ"ל.
- שמור את התאים על קרח בכל עת עד ההזרקה.
- הביאו את התאים לחדר הניתוח וסיימו את הזרקת התאים תוך שעתיים.
הערה: הכינו מתלי תאים נוספים (בדרך כלל נפחים כפולים לפי הצורך) כדי להבטיח מנות הזרקה מדויקות (לדוגמה, כדי למנוע את החללים המתים בתוך המזרקים).
2. ניתוח להזרקה תוך לבבית של תאי סרטן הערמונית האנושית
הערה: המנגנון הכירורגי המשמש להזרקה תוך לבבית הוא מזרק 1 מ"ל (איור 1). לספק תמיכה תרמית לאורך כל ההליך עד להחלמה של בעל החיים מההרדמה.
- שמור את העכבר בחדר בעלי החיים SPF. בצע את כל ההליכים עם מנגנונים מעוקרים בתוך ארון אספטי.
- מרדימים את העכבר באמצעות איזופלורן 2% עם 98% חמצן תחת קצב זרימת חמצן של 2 ליטר/דקה.
הערה: יש למרוח כמות קטנה של משחת עיניים על עיני העכבר כדי למנוע יובש במהלך ההרדמה. בצע את כל הניתוח באזור מאוורר היטב. ודא שהעכבר מורדם עמוקות על ידי צביטת אצבעות רגלי העכבר לפני הזרקת התא. אם התגובות (למשל, אידיוט או עווית) נשארות, המתן זמן נוסף עד שההרדמה תיכנס לתוקף. - הניחו את העכבר בתנוחת שכיבה ושתקו את שתי הגפיים העליונות בניצב הרחק מקו האמצע (איור 2A).
- לשתק את העכבר מהבטן ומטה עם סרט הדבקה כירורגי. הימנעו מללחוץ חזק ולהזיז את האיברים הפנימיים (איור 2B).
הערה: שמירה על האנטומיה הטופוגרפית (כלומר, קיבוע עם סרט הדבקה) היא חיונית מכיוון שההזרקה תוך לבבית היא עיוורת (כלומר, אתר ההזרקה המדויק בלב אינו נראה לעין בלתי). - לחטא את עור בית החזה עם מקלון אתנול 70%.
- זהה את תהליך הקסיפואיד של העכבר בשקע בקצה התחתון של אמצע עצם החזה על ידי מישוש באמצע דופן החזה הקדמית. זהה את החריץ הצווארי של העכבר בשקע המרכזי בגבול העליון של המנובריום על ידי מישוש מאמצע דופן החזה הקדמית.
- תייגו את הנקודה הנחותה ביותר בתהליך הקסיפואיד ואת החריץ הג'וגולרי בעזרת עט סמן (איור 2A). סמנו סימן שלישי באמצע שני ציוני הדרך הללו ומעט ימינה (משמאל החיה) קצת מעל הלב בחלל הבין-קוסטלי השלישי.
הערה: מקום ההזרקה נמצא 1-2 מ"מ משמאל לקו האמצע, ונקודת ההזרקה נמצאת בין הצלע השלישית והרביעית של העכבר (איור 2A). - טען 200 μL של תרחיף התא לתוך מזרק 1 מ"ל.
הערה: שמרו על בועת אוויר במזרק, כפי שמוצג באיור 2C, כדי לוודא שהדם פועם. יש לערבב היטב את מתלה התא לפני הטעינה. - הכניסו אנכית מחט 26G דרך אתר ההזרקה (איור 2D).
- שמור על היד המחזיקה את המזרק יציב על השולחן, או השתמש ביד השנייה כדי להחזיק אותו יציב. יש לוודא שהציר הארוך של המזרק ניצב לאתר ההזרקה, ולהכניס את המזרק כ-2 מ"מ תת עורית.
- פעימת דם אדומה בהירה נראית במרכז המחט ו / או תרחיף התא כאשר קצה המחט מוכנס כראוי לחדר השמאלי. אם פעימת הדם אינה נראית, קצה המחט אינו בלב. יש לשלוף ולהחליף את המחט (במקרה שקרישת הדם בתוך המחט עוצרת את פעימות הדם). הכנס שוב את המחט.
- להזריק את התאים. הזריקו את מתלה התא (100 מיקרוליטר) לאט מאוד מעל 40-60 שניות ושמרו על היד האוחזת במזרק יציבה כל הזמן.
הערה: יש להשגיח מקרוב על תרחיף התאים במזרק, ואין להזריק את בועת האוויר בתוך המזרק לתוך הלב. - הפעל לחץ על אתר ההזרקה עם צמר גפן יבש במשך 15 שניות כדי להבטיח המוסטאזיס כאשר המחט נשלפת.
- החזירו את העכבר לכלוב הנקי ועקבו אחר בעל החיים עד שיתאושש לחלוטין מההרדמה.
- דמיינו את העכבר עם מערכת ביולומינסנציה in vivo תוך 24 שעות לאחר ההזרקה כדי להבטיח שהתאים הסרטניים נכנסו למחזור הדם.
הערה: תאי סרטן המוזרקים כראוי נכנסים למחזור הדם העורקי דרך חדר הלב השמאלי, אשר נראה על-ידי איתות ביולומינסנציה הנראה בכל הגוף (לדוגמה, ראו איור 3A). - בצע הדמיה ביולומינסנציה in vivo .
- הפעל את המכשיר ואת המחשב. פתח את התוכנה כאשר מחוון ההפעלה במכשיר ובמחשב מתבהר, ולאחר מכן פתח את החלון Image Acquisition .
- זהה את מערכת ההדמיה in vivo המחוברת למחשב בחלונית ההתקן. מקם את העכבר לצילום בתא ההדמיה במצב שכיבה. לאחר מכן סגור את דלת תא ההדמיה.
- הגדר את הפרמטרים בחלונית ההגדרה המסופקת בחלון רכישת תמונה .
- הגדר את הפרמטרים עם Lens > Zoom > 1x, Lens > Focus > 108 ו - Lens > Iris > F 2.8 כדי להבהיר את התמונות.
- הגדר את ערוץ הצילום ב- Filter&Light: Filter&Light > Filter > Luminescence, Filter&Light > Light > OFF ו - Filter&Light > עוצמת אור > באמצע.
- הגדר את סוג התמונה שיש לצלם: סוג > הדמיה > מסגרת יחידה, זמן חשיפה > הדמיה > 500 אלפיות השנייה, מצב הדמיה > HDR > מצב רווח נמוך. לחץ על כפתור לרכוש כדי לרכוש את התמונה.
- דמיינו את צמיחת הסרטן הגרורתי עם ביולומינסנציה in vivo .
הערה: בכל נקודת זמן של ההדמיה, תוך צפקית להזריק 200 μL של מצע luciferin לתוך עכבר 20 גרם (150 מ"ג / ק"ג) ולחכות 15 דקות לפני ההרדמה (2% isoflurane מעורבב עם 98% חמצן בתא אינדוקציה). הנח את העכבר על פלטפורמת מערכת ההדמיה של ביולומינסנציה. יש לשמור על הרדמה באמצעות מסכת אף עם 2% איזופלורן.
3. חקירה פתולוגית
- ארבעה שבועות לאחר הזרקת התא, להקריב את העכבר על ידי שאיפת CO2 ולאחר מכן נקע צוואר הרחם.
- לשתק את העכבר במצב שכיבה. ביצוע חתך אנכי (כ-6 ס"מ) מהבטן לבית החזה בעזרת מספריים כירורגיים כדי לחשוף ולבדוק באופן גס את כל איברי הבטן ובית החזה לאיתור נגעים סרטניים ו/או שינויים פתולוגיים.
הערה: במחקר הזרקת תאי סרטן תוך לבביים, נגעים סרטניים במדיאסטינום הסמוך ללב מצביעים על תאים סרטניים שהוזרקו שלא כהלכה (תאים שלא הוזרקו לחדר הלב השמאלי); לכן, עכברים אלה אינם נכללים באיסוף הנתונים הסופי. - הבלו את הגידולים גרורתיים עם מספריים. למדוד את הקטרים הארוכים (a) והקצרים (b) של הגידול באמצעות קליפרים כדי לחשב את נפח הגידול (V) באמצעות הנוסחה V = 1/2 × a × b2, ולשקול את הגידול באמצעות סולם אלקטרוני.
- תקן את רקמות הגידול בתמיסת פורמלין 10% ואחריה הטבעה בפרפין. לחלופין, הקפיאו את הגידולים בחנקן נוזלי.
- הבלו על העצמות (גפיים אחוריות, חוליות ו/או צלעות) עם נגעים גרורתיים. תקן את הדגימה של כל עכבר בצינור 50 מ"ל המכיל 20 מ"ל של תמיסת פורמלין 10% למשך 24 שעות לאחר הסרת העור והשרירים, ולאחר מכן הסתיידות למשך 14 יום בתמיסת EDTA 10% עם שינוי חיץ תכוף (כל 3 ימים).
- הטמע את הדגימה בפרפין וחתך את הדגימות לבדיקה היסטולוגית שגרתית16.
תוצאות
להדמיית ביולומינסנציה יתרונות עצומים במעקב אחר התפתחות הנגע הגרורתי במודל הזרקה תוך לבבי. זמן קצר לאחר הזרקת התאים הסרטניים (תוך 24 שעות), נעשה שימוש בדימות ביולומינסנציה כדי לדמיין את התאים הסרטניים נכנסים למחזור הדם הכללי (איור 3A). איתות ביולומינסנציה ברור בכל הגוף ייראה כאשר התאים הסרטניים מוזרקים למחזור הדם העורקי כראוי. נתונים מעכברים המראים אותות ביולומינסנציה רק באתר ההזרקה (לב) צריכים להיכלל באיסוף הנתונים הסופי. נגעים גרורתיים בגפיים האחוריות נצפו (איור 3B-D) שבועיים לאחר הזרקת התא. ככל שהתקדם הזמן, הנגעים הגרורתיים גדלו והופיעו באתרים אחרים, כולל עצם החזה, הצלעות והלסת התחתונה.
תמונות הרנטגן הראו הרס עצם המייצג נגעים גרורתיים בעצם (איור 4A). הרס עצם זוהה גם על ידי סריקת מיקרו-CT. סריקת מיקרו-CT בוצעה במצב תלת-ממדי באמצעות מיקרו-CT (μCT80) המשויך ל-3Dcalc, שחזור חרוט ויישום תוכנה להדמיית מודלים. שחזור של נתוני מפת הסיביות התקבל כדי לבנות את המודל התלת-ממדי. תמונת מיקרו-CT מייצגת של הרס העצם בשוקה הפרוקסימלית מוצגת באיור 4B. הנגעים הגרורתיים אושרו עוד יותר ברקמות משובצות פרפין על ידי צביעת H&E (איור 4C).

איור 1: מנגנון כירורגי. מזרק 1 מ"ל. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: הזרקה תוך-לבבית של תאי סרטן הערמונית . (A) הלוח מדגים את החריץ הצווארי, תהליך הקסיפואיד, כלוב הצלעות (השוליים התחתונים) וקו האמצע. אתר ההזרקה נמצא במרחק שווה מתהליך הקסיפואיד ומהחריץ הג'וגולרי. (B) סרט כירורגי משמש אופקית לאורך הבטן כדי למנוע תנועת עכבר במהלך ההזרקה. (C) מזרק טעון בתרחיף התא ובנוכחות בועת אוויר. בועת האוויר מסייעת לדמיין את פעימת הדם. (D) המחט מוחדרת אנכית דרך אתר ההזרקה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
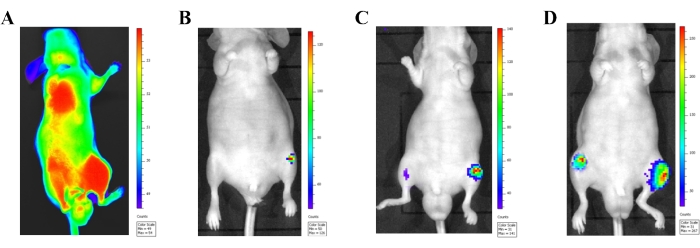
איור 3: אישור מודל ההזרקה התוך-לבבית באמצעות מערכת הדמיה ביולומינסנציה in vivo. (A) הדמיית ביולומינסנציה In vivo של עכבר אתימי זכר 24 שעות לאחר הזרקת לוציפראז המסומן בתאי PC-3 (1 × 10,6 תאים) לחדר הלב השמאלי. תאים סרטניים מוזרקים כראוי במחזור הדם המערכתי נראים על ידי אות bioluminescence שוחרר מכל הגוף. (ב-ד) תמונות ביולומינסנציה של עכבר מייצג המציג התפתחות גרורות מתקדמת. (B) תמונה המציגה תאים סרטניים של הערמונית שבועיים לאחר ההזרקה. (C) תמונה המציגה תאים סרטניים של הערמונית 3 שבועות לאחר ההזרקה. (D) תמונה המציגה תאים סרטניים של הערמונית 4 שבועות לאחר ההזרקה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
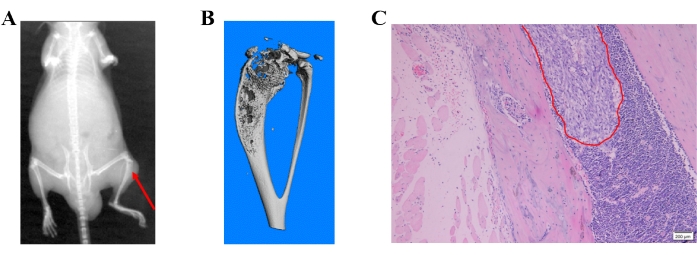
איור 4: שיטות זיהוי שונות של גרורות עצם המושרות על-ידי תאי סרטן הערמונית. (א) תמונת רנטגן מייצגת; החץ האדום מראה הרס עצם בשוקה הפרוקסימלית. (B) תמונת מיקרו-CT מייצגת של השוקה. (C) תמונת H&E המראה גרורות בעצמות של תאי סרטן הערמונית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
הזרקה תוך לבבית של תאי סרטן ערמונית אנושיים ליצירת גרורות בעצמות היא מודל עכבר אידיאלי לחקר הפונקציות והמנגנונים של גרורות עצם של סרטן הערמונית והערכת היעילות הטיפולית. מחקרים הראו כי נזק לעצם מתרחש ככל הנראה בשוקה הפרוקסימלית ובעצם הירך הדיסטלית17, אשר עשויה לנבוע מכלי הדם הגבוהים והפעילות המטבולית שלהם.
מכיוון שגרורות בעצמות הן נגע גרורתי שכיח בחולות סרטן השד, מודל גרורות העצם המיוצר על ידי הזרקה תוך לבבית של תאי סרטן השד נפוץ גם במחקרים על סרטן השד18,19. לכן, העבודה הנוכחית יכולה לסייע בפיתוח מודל גרורות עצם המיוצרות בהזרקת לב עם תאי סרטן השד והערמונית.
עבור היווצרות גידול עקבית, ישנם כמה שיקולים מרכזיים. יש להזריק תאים בהקדם האפשרי לאחר ניתוק מהתרבית. עכברים צריכים להיות מחולקים באופן אקראי לקבוצות ניסוי לאחר הזרקת תאים סרטניים. נפח ההזרקה צריך להיות עקבי ואותו אדם צריך להזריק תאים סרטניים לכל העכברים באותה טכניקה.
ההליך כולו מכיל מספר שלבים קריטיים. אם אתר ההזרקה ממוקם כראוי, דם פועם יש לראות במהלך ההזרקה. אובדן יציבות היד האוחזת במזרק ושינוי במיקום המחט תוך כדי קידום בוכנת המזרק הן בעיות פוטנציאליות. מזרק עם רכזת צבעונית בתוכו גורם לפעימת הדם להיראות בקלות. אם מופיעות בועות אוויר ברכזת המחט בעת החדרת המחט (דבר המעיד על החדרה שגויה לריאות), יש להסיר את המחט ולהחדיר אותה שוב לאחר ההעברה. אם אין דופק דם אדום במרכז המחט, אך האדם המזריק בטוח שאתר ההזרקה נכון, משוך מעט את בוכנת המזרק כדי לאמת את ההזרקה בחדר הלב. היעדר גרורות לאחר 2-3 שבועות של הזרקת תאים סרטניים מצביע על הזרקה שגויה. אשר את זרימת התאים הסרטניים בכל הגוף על ידי הדמיה bioluminescence בתוך 24 שעות לאחר הזרקה20. איתות ביולומינסנציה ניתן היה לראות בכל הגוף אם תאים סרטניים הוזרקו במדויק לחדר הלב. יתר על כן, קצב גרורתי, מיקום ומספר גידולים גרורתיים עשויים להיות שונים בקווי תאים שונים 8,21.
לאחר הניתוח יש לבדוק עכברים באופן קבוע. בשל הניתוח והחשיפה להרדמה, עכברים עלולים לחוות מצוקה משמעותית או אפילו למות. לכן, השבוע הראשון לאחר הניתוח הוא קריטי, ויש לעקוב בקפידה אחר העכברים. במהלך ניסוי גרורות בעצמות, יש לעקוב אחר עכברים מדי יום לשינויים ברמות הפעילות, בניידות ובהופעת קצ'קסיה (תסמונת פרנאופלסטית בעכברים המאופיינת בירידה במשקל, ניוון שרירים וחולשה, מראה מקושת ועייפות22,23). יש להרדים עכברים כאשר 10%-20% ממשקל גופם הולך לאיבוד; התקדמות הגידול פוגעת בניידות (לדוגמה, שבר עצם ארוך, הטיית ראש, שיתוק); או שנראה שהעכברים נמצאים במצוקה נשימתית24.
היתרון של מודל זה הוא שתאים סרטניים שזוהו בעצם "זרעו את הקרקע" 25, ובכך משכפלים את ההתקדמות הטבעית יותר של היווצרות מיקרו-גרורות של תאי הסרטן המופצים. למודל זה יש גם מספר מגבלות. זהו מודל סרטן xenograft באמצעות עכברים immunodeficient. מודל זה אינו מועיל לחקר האינטראקציה בין תאים סרטניים ותאי מערכת החיסון במיקרו-סביבה של גרורות בעצמות. ההערכה היא כי כ -30% מהעכברים ימותו במהלך הדוגמנות; לכן, תרגול ישפר מאוד את שיעור ההצלחה של פיתוח מודל. יתר על כן, נגע גרורות יכול להתרחש גם במוח, ריאות, וכליות; היווצרות גרורות מרובות מפריעה לחקר מנגנוני גרורות בעצמות 9,26,27,28. למרות ששיעור גרורות העצם גבוה בהרבה בהזרקה תוך לבבית מאשר בהזרקה אורתוטופית, טכניקת ההזרקה התוך-לבבית מראה שיעור גרורות בעצם של כ-75% ולא 100%9,14. היעילות הנמוכה יותר עשויה לנבוע מכך שתאי הסרטן המוזרקים לא הצליחו להיכנס למחזור הדם או מותו של העכבר המקבל במהלך זריקת לב עקב המחט המנקבת את הלב או הריאה.
למרות מגבלות אלה, מודל עכברי מבוסס זה של גרורות עצם של סרטן הערמונית הוכח ככלי מצוין לחקר הצלבת עצמות וסרטן והערכת טיפולים פוטנציאליים למניעת התקדמות הסרטן ולשיבוש מעגל הרס העצם הנגרם על ידי גרורות.
Disclosures
כל המחברים מצהירים כי אין אינטרסים כלכליים מתחרים.
Acknowledgements
עבודה זו נתמכת על ידי מענקים מתוכנית המו"פ הלאומית של סין (2018YFC1704300 ו- 2020YFE0201600), הקרן הלאומית למדעי הטבע (81973877 ו- 82174408), פרויקטי המחקר במסגרת התקציב של אוניברסיטת שנגחאי לרפואה סינית מסורתית (2021LK047), ומרכז החדשנות השיתופית בשנחאי של טרנספורמציה תעשייתית של הכנת TCM בבית החולים.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringes and needles | Shandong Weigao Group Medical Polymer Co., Ltd | 20200411 | The cells were injected into the ventricles of mice |
| Anesthesia machine | Shenzhen RWD Life Technology Co., Ltd | R500IP | Equipment for anesthetizing mice |
| Automatic cell counter | Shanghai Simo Biological Technology Co., Ltd | IC1000 | For counting cells |
| BALB/c athymic mice | Shanghai SLAC Laboratory Animal Co, Ltd. | Male | 6-8 week old, male mice |
| Bioluminescence imaging system | Shanghai Baitai Technology Co., Ltd | Vieworks | For tracking the tumor growth and pulmonary metastasis if the injected cells are labeled by luciferase |
| Centrifuge tube (15 mL, 50 mL) | Shanghai YueNian Biotechnology Co., Ltd | 430790, Corning | |
| EDTA solution | Wuhan Xavier Biotechnology Co., Ltd | G1105 | For decalcification of bone tissure |
| F-12 medium | Shanghai YueNian Biotechnology Co., Ltd | 21700075, GIBCO | Cell culture medium |
| Formalin solution | Shanghai YueNian Biotechnology Co., Ltd | BL539A | For fixing the specimen of each mouse |
| Isoflurane | Shenzhen RWD Life Technology Co., Ltd | VETEASY | For anesthesia |
| Lipofectamine 2000 | Shanghai YueNian Biotechnology Co., Ltd | 11668027, Thermo fisher | Plasmid transfection reagent |
| PC-3 cell line | Cell Bank of Chinese Academy of Sciences | TCHu 158 | Prostate cancer cell line |
| Phosphate-buffered saline | Beyotime Biotechnology | ST447 | Wash the human osteosarcoma cells |
| Trypsin (0.25%) | Shanghai YueNian Biotechnology Co., Ltd | 25200056, Gibco | For detaching the cells |
| Vector (pLV-luciferase) | Shanghai YueNian Biotechnology Co., Ltd | VL3613 | Plasmid for transfection |
| X-ray imaging system | Brook (Beijing) Technology Co., Ltd | FX PRO | For obtaining x-ray images to detect tumor growth |
| μCT80 | Shenzhen Fraun Technology Service Co., Ltd | Scanco Medical AG,Switzerland | For detection of bone destruction. The mico-CT is equipped with 3DCalc, cone reconstruction, and μCT Ray V3.4A model visualization software. |
References
- Siegel, R. L., Miller, K. D., Fuchs, H. E., Jemal, A. Cancer Cancerstatistics, 2021. CA: A Cancer Journal for Clinicians. 71 (1), 7-33 (2021).
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 71 (3), 209-249 (2021).
- Coleman, R. E. Skeletal complications of malignancy. Cancer. 80, 1588-1594 (1997).
- Macedo, F., et al. Bone metastases: An overview. Oncology Reviews. 11 (1), 321 (2017).
- Rea, D., et al. Mouse models in prostate cancer translational research: From xenograft to PDX. BioMed Research International. 2016, 9750795 (2016).
- Zhang, Y., et al. Real-time GFP intravital imaging of the differences in cellular and angiogenic behavior of subcutaneous and orthotopic nude-mouse models of human PC-3 prostate cancer. Journal of Cellular Biochemistry. 117 (11), 2546-2551 (2016).
- Stephenson, R. A., et al. Metastatic model for human prostate cancer using orthotopic implantation in nude mice. Journal of the National Cancer Institute. 84 (12), 951-957 (1992).
- Simmons, J. K., et al. Animal models of bone metastasis. Veterinary Pathology. 52 (5), 827-841 (2015).
- Jenkins, D. E., Hornig, Y. S., Oei, Y., Dusich, J., Purchio, T. Bioluminescent human breast cancer cell lines that permit rapid and sensitive in vivo detection of mammary tumors and multiple metastases in immune deficient mice. Breast Cancer Research: BCR. 7 (4), 444-454 (2005).
- Corey, E., et al. Establishment and characterization of osseous prostate cancer models: intra-tibial injection of human prostate cancer cells. The Prostate. 52 (1), 20-33 (2002).
- Andersen, C., Bagi, C. M., Adams, S. W. Intra-tibial injection of human prostate cancer cell line CWR22 elicits osteoblastic response in immunodeficient rats. Journal of Musculoskeletal & Neuronal Interactions. 3 (2), 148-155 (2003).
- Sudhan, D. R., Pampo, C., Rice, L., Siemann, D. W. Cathepsin L inactivation leads to multimodal inhibition of prostate cancer cell dissemination in a preclinical bone metastasis model. International Journal of Cancer. 138 (11), 2665-2677 (2016).
- Jinnah, A. H., Zacks, B. C., Gwam, C. U., Kerr, B. A. Emerging and established models of bone metastasis. Cancers. 10 (6), 176 (2018).
- Simmons, J. K., et al. Canine prostate cancer cell line (Probasco) produces osteoblastic metastases in vivo. The Prostate. 74 (13), 1251-1265 (2014).
- Lamar, J. M., et al. SRC tyrosine kinase activates the YAP/TAZ axis and thereby drives tumor growth and metastasis. The Journal of Biological Chemistry. 294 (7), 2302-2317 (2019).
- Chang, J., et al. Matrine inhibits prostate cancer via activation of the unfolded protein response/endoplasmic reticulum stress signaling and reversal of epithelial to mesenchymal transition. Molecular Medicine Reports. 18 (1), 945-957 (2018).
- Arguello, F., Baggs, R. B., Frantz, C. N. A murine model of experimental metastasis to bone and bone marrow. Cancer Research. 48 (23), 6876-6881 (1988).
- Brylka, L., et al. Spine Metastases in immunocompromised mice after intracardiac injection of MDA-MB-231-SCP2 breast cancer cells. Cancers. 14 (3), 556 (2022).
- Rahman, M. M., Veigas, J. M., Williams, P. J., Fernandes, G. DHA is a more potent inhibitor of breast cancer metastasis to bone and related osteolysis than EPA. Breast Cancer Research and Treatment. 141 (3), 341-352 (2013).
- Park, S. I., Kim, S. J., McCauley, L. K., Gallick, G. E. Pre-clinical mouse models of human prostate cancer and their utility in drug discovery. Current Protocols in Pharmacology. , (2010).
- Wright, L. E., et al. Murine models of breast cancer bone metastasis. BoneKEy Reports. 5, 804 (2016).
- Fearon, K. C., Glass, D. J., Guttridge, D. C. Cancer cachexia: mediators, signaling, and metabolic pathways. Cell Metabolism. 16 (2), 153-166 (2012).
- Waning, D. L., et al. Excess TGF-β mediates muscle weakness associated with bone metastases in mice. Nature Medicine. 21 (11), 1262-1271 (2015).
- Talbot, S. R., et al. Defining body-weight reduction as a humane endpoint: a critical appraisal. Laboratory Animals. 54 (1), 99-110 (2020).
- Paget, S. The distribution of secondary growths in cancer of the breast. Cancer Metastasis Reviews. 8 (2), 98-101 (1989).
- Yin, J. J., et al. TGF-beta signaling blockade inhibits PTHrP secretion by breast cancer cells and bone metastases development. The Journal of Clinical Investigation. 103 (2), 197-206 (1999).
- Schneider, A., et al. turnover mediates preferential localization of prostate cancer in the skeleton. Endocrinology. 146 (4), 1727-1736 (2005).
- Padalecki, S. S., et al. Chromosome 18 suppresses prostate cancer metastases. Urologic Oncology. 21 (5), 366-373 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved