Method Article
心内注射人前列腺癌细胞以创建骨转移异种移植小鼠模型
* 这些作者具有相同的贡献
摘要
在这里,我们提出了一种用于心内注射人前列腺癌细胞的方案,以生成具有骨转移病变的小鼠模型。
摘要
作为最常见的男性恶性肿瘤,前列腺癌(PC)的死亡率排名第二,主要是由于65%-75%的骨转移率。因此,了解前列腺癌骨转移的过程和相关机制对于开发新的治疗方法至关重要。为此,骨转移的动物模型是必不可少的工具。在这里,我们报告了通过心内注射前列腺癌细胞 来 生成骨转移小鼠模型的详细程序。生物发光成像系统可以确定前列腺癌细胞是否已准确注射到心脏中并监测癌细胞转移,因为它在监测转移性病变发展方面具有很大的优势。该模型复制播散癌细胞的自然发育,在骨骼中形成微转移,并模仿前列腺癌骨转移的病理过程。为进一步探索本病的分子机制和 体内 治疗效果提供了有效的工具。
引言
前列腺癌是112个国家中男性最常见的癌症,在人类发展指数较高的国家中排名第二1,2。前列腺癌患者的死亡大多是由转移引起的,约65%-75%的病例会发生骨转移3,4。因此,迫切需要预防和治疗前列腺癌骨转移,以改善前列腺癌患者的临床结果。骨转移动物模型是探索前列腺癌骨转移各阶段涉及的多阶段过程和分子机制,从而确定治疗靶点和开发新疗法不可或缺的工具5。
生成前列腺癌骨转移实验动物模型的最常见方法包括原位、骨干内(如胫骨内)和心内注射前列腺癌细胞。原位注射的骨转移模型是通过将前列腺癌细胞直接注射到小鼠的前列腺中而生成的6,7。该实验动物模型与前列腺癌骨转移具有非常相似的临床特征。然而,转移主要发生在腋窝淋巴结和肺,而不是骨8,9。前列腺癌的胫内注射模型直接将前列腺癌细胞注射到胫骨中,骨(胫骨)肿瘤形成率高10,11;但是,骨皮层和骨髓腔很容易受损。此外,胫骨注射方法不能刺激前列腺癌骨转移的病理过程,其中癌细胞通过循环定植骨骼。为了研究癌细胞骨转移率较高的循环、血管外渗和远处转移,已经开发出一种通过将前列腺癌细胞直接注射到小鼠左心室的心内注射技术8,12,13。这使其成为骨转移研究的有价值的动物模型8。心内注射法显示骨转移率约为75%9,14,远高于原位注射法。因此,心内注射是生成前列腺癌骨转移动物模型的理想方法。
这项工作旨在描述建立前列腺癌骨转移小鼠模型的过程,让读者可视化模型的建立。目前的工作提供了详细的过程,预防措施和说明性图片,以通过在无胸腺小鼠中心内注射人前列腺癌细胞 来 生成骨转移异种移植模型。该方法为进一步探索前列腺癌骨转移的分子机制和 体内 治疗效果提供了有效的工具。
研究方案
6至8周龄雄性BALB / c无胸腺小鼠(n = 10)在12小时光照/黑暗循环条件下,在无特异性(SPF)动物室中单独通风的小鼠笼子(5只小鼠/笼)中,自由获得SPF饲料和无菌水。小鼠在实验前适应性喂养一周。所有动物实验均经上海中医药大学动物福利委员会批准。
1. 细胞制备
- 在前列腺癌细胞注射当天,用预冷无菌PBS(pH 7.4)洗涤在10cm细胞培养皿中培养的80%-90%汇合荧光素酶标记的PC-3细胞(PC-3-荧光素酶)。用 1.5 mL 的 0.25% 胰蛋白酶胰蛋白酶消化 3 分钟,并在用含有 10% 血清的 6 mL F-12 培养基淬灭胰蛋白酶后将细胞收集到 15 mL 离心管中。
注意:PC-3-荧光素酶细胞系在转染pLV-荧光素酶载体15后来源于PC-3细胞系。 - 使用自动细胞计数仪,通过将20μL细胞悬液转移到细胞计数板上来计算细胞浓度(参见 材料表)。
- 在室温(RT)下以800× g 离心细胞5分钟。
- 使用移液管弃去上清液并将细胞沉淀重悬于F-12培养基中(参见 材料表),最终细胞密度为1 x 107 个细胞/ mL。
- 始终将细胞保持在冰上,直到注射。
- 将细胞带到手术室并在2小时内完成细胞注射。
注意:准备额外的细胞悬液(通常根据需要加倍体积)以确保准确的注射剂量(例如,避免注射器内的死区)。
2. 人前列腺癌细胞心内注射手术
注意:用于心脏内注射的手术设备是1 mL注射器(图1)。在整个过程中提供热支持,直到动物从麻醉中恢复。
- 将鼠标放在SPF动物室中。使用无菌柜内的灭菌设备执行所有程序。
- 在2 L / min氧气流速下使用2%异氟醚和98%氧气麻醉小鼠。
注意:在小鼠的眼睛上涂抹少量眼科软膏,以避免麻醉期间干燥。在通风良好的区域进行整个手术。确保在细胞注射前通过捏住鼠标的脚趾来深度麻醉鼠标。如果反应(例如抽搐或抽搐)仍然存在,请等待更多时间让麻醉生效。 - 将鼠标置于超位,并固定垂直伸展远离中线的两条上肢(图2A)。
- 用手术胶带将鼠标从腹部向下固定。避免用力按压和移位内脏(图2B)。
注意:保持地形解剖结构(即用胶带固定)至关重要,因为心内注射是盲目的(即,心脏上的准确注射部位是肉眼看不见的)。 - 用70%乙醇棉签消毒胸部皮肤。
- 通过触诊前胸壁中部,识别胸骨中最低端凹陷处的小鼠剑突。通过从前胸壁中间向上触诊,识别手掌上缘中央凹陷处的小鼠颈静脉切迹。
- 用记号笔标记剑突和颈静脉切口的最下点(图2A)。在这两个地标的中间做第三个标记,在第三个肋间隙的心脏上方稍微向右(动物的左边)做第三个标记。
注意:注射部位位于中线左侧1-2毫米,注射点在小鼠的第三和第四肋骨之间(图2A)。 - 将 200 μL 细胞悬液加载到 1 mL 注射器中。
注意:如图 2C所示,在注射器中保留气泡,以确保血液脉动。上样前必须彻底混合细胞悬液。 - 垂直插入26 G针头穿过注射部位(图2D)。
- 将握住注射器的手稳定放在桌子上,或用另一只手保持稳定。确保注射器的长轴垂直于注射部位,并将注射器皮下插入约2mm。
- 当针尖正确插入左心室时,针毂和/或细胞悬液中可见鲜红色血脉动。如果血液脉动不可见,则针尖不在心脏中。缩回并更换针头(以防针头内的血液凝固停止血液搏动)。再次插入针头。
- 注射细胞。在40-60秒内非常缓慢地注入细胞悬液(100μL),并保持握住注射器的手始终稳定。
注意:密切关注注射器中的细胞悬液,不要将注射器内的气泡注入心脏。 - 用干棉签对注射部位施加压力15秒,以确保针头缩回时止血。
- 将鼠标放回干净的笼子并监测动物,直到它从麻醉中完全恢复。
- 在注射后24小时内用 体内 生物发光系统对小鼠进行成像,以确保癌细胞已进入体循环。
注意:正确注射的癌细胞通过左心室 进入 动脉循环,这可以通过全身可见的生物发光信号看到(例如,见 图3A)。 - 进行 体内 生物发光成像。
- 打开仪器和计算机。当仪器和计算机上的电源指示灯变亮时,打开软件,然后打开 图像采集 窗口。
- 在设备窗格中识别连接到计算机的 活体 成像系统。将要成像的鼠标以仰卧位放入成像室中。然后关闭成像室的门。
- 在"图像采集"窗口中提供的"设置"窗格中设置参数。
- 使用 镜头>变焦> 1 倍、镜头>对焦> 108 和 镜头>光圈> F 2.8 设置参数以使图像清晰。
- 在"滤镜与光线"中设置拍摄通道 :滤镜与光线> 滤镜>发光、滤镜与灯光>>关闭和 滤镜与光线>光强度>中间。
- 设置要拍摄的图像类型: 成像>类型>单帧、成像>曝光时间> 500 ms、成像> HDR 模式>低增益模式。单击" 获取 "按钮以获取图像。
- 通过 体内 生物发光可视化转移性癌症生长。
注意:在可视化的每个时间点,腹膜内将200μL荧光素底物注入20g小鼠(150mg / kg)中,并在麻醉前等待15分钟(2%异氟醚与98%氧气在诱导室中混合)。将鼠标放在生物发光成像系统平台上。通过含有2%异氟醚的鼻罩维持麻醉。
3.病理检查
- 细胞注射四周后,通过吸入CO2 然后颈椎脱位处死小鼠。
- 将鼠标固定在仰卧位。用手术剪刀从腹部到胸部做一个垂直切口(约6厘米),暴露并粗略检查腹部和胸部的所有器官是否有癌变和/或病理变化。
注意:对于心脏内癌细胞注射研究,心脏附近纵隔的癌症病变表明癌细胞注射错误(未注射到左心室的细胞);因此,这些小鼠不包括在最终的数据收集中。 - 用剪刀切除转移性肿瘤。使用卡尺测量肿瘤的长直径(a)和短直径(b),使用公式V = 1/2××b2计算肿瘤体积(V),并使用电子秤称量肿瘤。
- 将肿瘤组织固定在10%福尔马林溶液中,然后包埋在石蜡中。或者,在液氮中快速冷冻肿瘤。
- 切除有转移性病变的骨骼(后肢、椎骨和/或肋骨)。去除皮肤和肌肉后,将每只小鼠的标本固定在含有20mL 10%福尔马林溶液的50mL管中24小时,然后在10%EDTA溶液中脱钙14天,频繁更换缓冲液(每3天)。
- 将标本嵌入石蜡中,并对样本进行常规组织学检查16.
结果
生物发光成像在监测心内注射模型的转移性病变发展方面具有巨大的优势。癌细胞注射后不久(24小时内),使用生物发光成像来可视化进入一般循环的癌细胞(图3A)。当癌细胞被正确注射到动脉循环中时,全身都会看到明显的生物发光信号。来自仅在注射部位(心脏)显示生物发光信号的小鼠数据应从最终数据收集中排除。细胞注射后2周观察到后肢的转移性病变(图3B-D)。随着时间的推移,转移性病变变大并出现在其他部位,包括胸骨、肋骨和下颌骨。
X射线图像显示骨破坏,代表骨中的转移性病变(图4A)。显微CT扫描也检测到骨破坏。显微CT扫描在3D模式下使用与3Dcalc相关的显微CT(μCT80)进行,锥体重建和模型可视化软件应用程序。获得了位图数据的重建以构建3D模型。 图4B显示了胫骨近端骨破坏的代表性显微CT图像。通过H&E染色在石蜡包埋组织中进一步确认转移性病变(图4C)。

图1:手术器械。1 mL注射器。请点击此处查看此图的大图。

图2:前列腺癌细胞的心内注射 。 (A)该图显示了颈静脉切口,剑突,肋骨(下缘)和中线。注射部位与剑突和颈静脉切口等距。(B)手术胶带水平穿过腹部,以防止注射过程中小鼠移动。(C)装有细胞悬液和气泡存在的注射器。气泡有助于可视化血液脉动。(D)针头垂直插入注射部位。 请点击此处查看此图的大图。
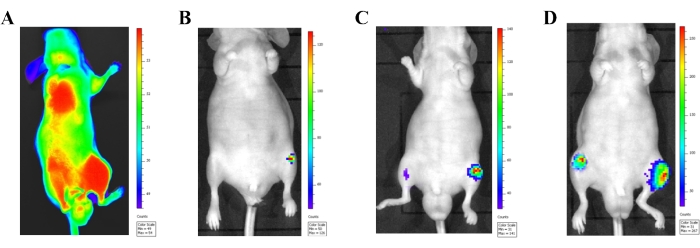
图 3:使用体内生物发光成像系统确认心内注射模型。 (A)将荧光素酶标记的PC-3细胞(1×106细胞)注射到左心室后24小时雄性无胸腺小鼠的体内生物发光成像。通过全身释放的生物发光信号可以看到体循环中正确注射的癌细胞。(乙-四)显示进行性转移发展的代表性小鼠的生物发光图像。(B)注射后2周显示前列腺癌细胞的图像。(C)注射后3周显示前列腺癌细胞的图像。(D)注射后4周显示前列腺癌细胞的图像。请点击此处查看此图的大图。
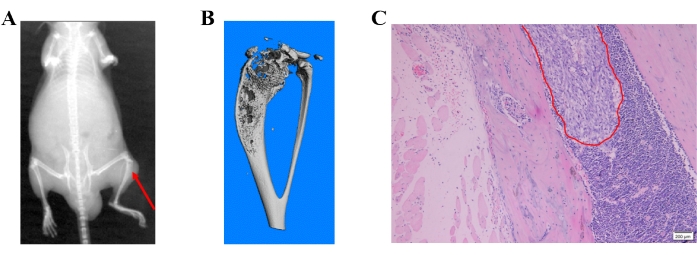
图4:前列腺癌细胞诱导的骨转移的不同检测方法。 (A)具有代表性的X射线图像;红色箭头显示胫骨近端的骨破坏。(B)具有代表性的胫骨显微CT图像。(C)H&E图像显示前列腺癌细胞的骨转移。 请点击此处查看此图的大图。
讨论
心内注射人前列腺癌细胞产生骨转移是探索前列腺癌骨转移的功能和机制以及评价治疗效果的理想小鼠模型。研究表明,骨损伤最有可能发生在胫骨近端和股骨远端17,这可能是由于它们的高血管化和代谢活性。
由于骨转移是乳腺癌患者中经常观察到的转移性病变,因此通过心内注射乳腺癌细胞产生的骨转移模型也常用于乳腺癌研究18,19。因此,目前的工作可以帮助开发一种心内注射产生的乳腺癌和前列腺癌细胞骨转移模型。
对于一致的肿瘤形成,有一些关键的考虑因素。从培养物中分离后应尽快注射细胞。癌细胞注射后应将小鼠随机分成实验组。注射量应一致,同一个人应使用相同的技术向所有小鼠注射癌细胞。
整个过程包含几个关键步骤。如果注射部位位置正确,注射过程中应观察脉动血液。握住注射器的手失去稳定性以及在推进注射器柱塞时针头位置的变化是潜在的问题。内部带有彩色集线器的注射器使血液脉动很容易看到。如果在插入针头时针毂中出现气泡(表明误插入肺部),则必须在重新定位后取出针头并再次插入。如果针头轮毂中没有红血球,但注射者确信注射部位正确,请稍微拉动注射器柱塞以验证心室中的注射。癌细胞注射2-3周后没有转移表明注射错误。注射后24小时内通过生物发光成像确认全身癌细胞循环20。如果将癌细胞准确地注射到心室中,则可以在整个身体中看到生物发光信号。此外,转移肿瘤的转移率、位置和数量在不同的细胞系中可能不同8,21。
手术后,必须定期检查小鼠。由于手术和麻醉剂暴露,小鼠可能会经历显着的痛苦甚至死亡。因此,手术后的第一周至关重要,必须仔细监测小鼠。在整个骨转移实验中,应每天监测小鼠的活动水平、活动性和恶病质(一种以体重减轻、肌肉萎缩和虚弱、弓形外观和嗜睡为特征的小鼠副肿瘤综合征)的变化22,23)。当小鼠体重减轻10%-20%时,应对其进行安乐死;肿瘤进展损害活动能力(例如,长骨骨折、头部倾斜、截瘫);或小鼠似乎处于呼吸窘迫状态24.
该模型的优点是在骨中检测到的癌细胞已经"播种土壤"25,从而复制了播散癌细胞的微转移形成的更自然的进展。此模型也有几个限制。这是一种使用免疫缺陷小鼠的异种移植癌症模型。该模型无益于研究骨转移微环境中癌细胞与免疫细胞之间的相互作用。据估计,大约30%的小鼠在建模过程中会死亡;因此,实践将大大提高模型开发的成功率。此外,转移病变也可发生在脑、肺和肾脏;多发性转移瘤的形成干扰了骨转移机制的研究9,26,27,28。虽然心内注射的骨转移率远高于原位注射,但心内注射技术的骨转移率约为75%,而不是100%9,14。较低的效率可能是因为注射的癌细胞未能进入血液循环,或者在心脏注射过程中由于针刺穿心脏或肺部而导致受体小鼠死亡。
尽管存在这些局限性,但这种已建立的前列腺癌骨转移小鼠模型已被证明是研究骨和癌症串扰以及评估潜在疗法以防止癌症进展和破坏转移诱导的骨破坏循环的绝佳工具。
披露声明
所有作者都声明没有相互竞争的经济利益。
致谢
这项工作得到了国家重点研发计划(2018YFC1704300和2020YFE0201600)、国家自然科学基金(81973877和82174408)、上海中医药大学预算内的研究项目(2021LK047)和上海市医院中药制剂产业转化协同创新中心的资助。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL syringes and needles | Shandong Weigao Group Medical Polymer Co., Ltd | 20200411 | The cells were injected into the ventricles of mice |
| Anesthesia machine | Shenzhen RWD Life Technology Co., Ltd | R500IP | Equipment for anesthetizing mice |
| Automatic cell counter | Shanghai Simo Biological Technology Co., Ltd | IC1000 | For counting cells |
| BALB/c athymic mice | Shanghai SLAC Laboratory Animal Co, Ltd. | Male | 6-8 week old, male mice |
| Bioluminescence imaging system | Shanghai Baitai Technology Co., Ltd | Vieworks | For tracking the tumor growth and pulmonary metastasis if the injected cells are labeled by luciferase |
| Centrifuge tube (15 mL, 50 mL) | Shanghai YueNian Biotechnology Co., Ltd | 430790, Corning | |
| EDTA solution | Wuhan Xavier Biotechnology Co., Ltd | G1105 | For decalcification of bone tissure |
| F-12 medium | Shanghai YueNian Biotechnology Co., Ltd | 21700075, GIBCO | Cell culture medium |
| Formalin solution | Shanghai YueNian Biotechnology Co., Ltd | BL539A | For fixing the specimen of each mouse |
| Isoflurane | Shenzhen RWD Life Technology Co., Ltd | VETEASY | For anesthesia |
| Lipofectamine 2000 | Shanghai YueNian Biotechnology Co., Ltd | 11668027, Thermo fisher | Plasmid transfection reagent |
| PC-3 cell line | Cell Bank of Chinese Academy of Sciences | TCHu 158 | Prostate cancer cell line |
| Phosphate-buffered saline | Beyotime Biotechnology | ST447 | Wash the human osteosarcoma cells |
| Trypsin (0.25%) | Shanghai YueNian Biotechnology Co., Ltd | 25200056, Gibco | For detaching the cells |
| Vector (pLV-luciferase) | Shanghai YueNian Biotechnology Co., Ltd | VL3613 | Plasmid for transfection |
| X-ray imaging system | Brook (Beijing) Technology Co., Ltd | FX PRO | For obtaining x-ray images to detect tumor growth |
| μCT80 | Shenzhen Fraun Technology Service Co., Ltd | Scanco Medical AG,Switzerland | For detection of bone destruction. The mico-CT is equipped with 3DCalc, cone reconstruction, and μCT Ray V3.4A model visualization software. |
参考文献
- Siegel, R. L., Miller, K. D., Fuchs, H. E., Jemal, A. Cancer Cancerstatistics, 2021. CA: A Cancer Journal for Clinicians. 71 (1), 7-33 (2021).
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 71 (3), 209-249 (2021).
- Coleman, R. E. Skeletal complications of malignancy. Cancer. 80, 1588-1594 (1997).
- Macedo, F., et al. Bone metastases: An overview. Oncology Reviews. 11 (1), 321 (2017).
- Rea, D., et al. Mouse models in prostate cancer translational research: From xenograft to PDX. BioMed Research International. 2016, 9750795 (2016).
- Zhang, Y., et al. Real-time GFP intravital imaging of the differences in cellular and angiogenic behavior of subcutaneous and orthotopic nude-mouse models of human PC-3 prostate cancer. Journal of Cellular Biochemistry. 117 (11), 2546-2551 (2016).
- Stephenson, R. A., et al. Metastatic model for human prostate cancer using orthotopic implantation in nude mice. Journal of the National Cancer Institute. 84 (12), 951-957 (1992).
- Simmons, J. K., et al. Animal models of bone metastasis. Veterinary Pathology. 52 (5), 827-841 (2015).
- Jenkins, D. E., Hornig, Y. S., Oei, Y., Dusich, J., Purchio, T. Bioluminescent human breast cancer cell lines that permit rapid and sensitive in vivo detection of mammary tumors and multiple metastases in immune deficient mice. Breast Cancer Research: BCR. 7 (4), 444-454 (2005).
- Corey, E., et al. Establishment and characterization of osseous prostate cancer models: intra-tibial injection of human prostate cancer cells. The Prostate. 52 (1), 20-33 (2002).
- Andersen, C., Bagi, C. M., Adams, S. W. Intra-tibial injection of human prostate cancer cell line CWR22 elicits osteoblastic response in immunodeficient rats. Journal of Musculoskeletal & Neuronal Interactions. 3 (2), 148-155 (2003).
- Sudhan, D. R., Pampo, C., Rice, L., Siemann, D. W. Cathepsin L inactivation leads to multimodal inhibition of prostate cancer cell dissemination in a preclinical bone metastasis model. International Journal of Cancer. 138 (11), 2665-2677 (2016).
- Jinnah, A. H., Zacks, B. C., Gwam, C. U., Kerr, B. A. Emerging and established models of bone metastasis. Cancers. 10 (6), 176 (2018).
- Simmons, J. K., et al. Canine prostate cancer cell line (Probasco) produces osteoblastic metastases in vivo. The Prostate. 74 (13), 1251-1265 (2014).
- Lamar, J. M., et al. SRC tyrosine kinase activates the YAP/TAZ axis and thereby drives tumor growth and metastasis. The Journal of Biological Chemistry. 294 (7), 2302-2317 (2019).
- Chang, J., et al. Matrine inhibits prostate cancer via activation of the unfolded protein response/endoplasmic reticulum stress signaling and reversal of epithelial to mesenchymal transition. Molecular Medicine Reports. 18 (1), 945-957 (2018).
- Arguello, F., Baggs, R. B., Frantz, C. N. A murine model of experimental metastasis to bone and bone marrow. Cancer Research. 48 (23), 6876-6881 (1988).
- Brylka, L., et al. Spine Metastases in immunocompromised mice after intracardiac injection of MDA-MB-231-SCP2 breast cancer cells. Cancers. 14 (3), 556 (2022).
- Rahman, M. M., Veigas, J. M., Williams, P. J., Fernandes, G. DHA is a more potent inhibitor of breast cancer metastasis to bone and related osteolysis than EPA. Breast Cancer Research and Treatment. 141 (3), 341-352 (2013).
- Park, S. I., Kim, S. J., McCauley, L. K., Gallick, G. E. Pre-clinical mouse models of human prostate cancer and their utility in drug discovery. Current Protocols in Pharmacology. , (2010).
- Wright, L. E., et al. Murine models of breast cancer bone metastasis. BoneKEy Reports. 5, 804 (2016).
- Fearon, K. C., Glass, D. J., Guttridge, D. C. Cancer cachexia: mediators, signaling, and metabolic pathways. Cell Metabolism. 16 (2), 153-166 (2012).
- Waning, D. L., et al. Excess TGF-β mediates muscle weakness associated with bone metastases in mice. Nature Medicine. 21 (11), 1262-1271 (2015).
- Talbot, S. R., et al. Defining body-weight reduction as a humane endpoint: a critical appraisal. Laboratory Animals. 54 (1), 99-110 (2020).
- Paget, S. The distribution of secondary growths in cancer of the breast. Cancer Metastasis Reviews. 8 (2), 98-101 (1989).
- Yin, J. J., et al. TGF-beta signaling blockade inhibits PTHrP secretion by breast cancer cells and bone metastases development. The Journal of Clinical Investigation. 103 (2), 197-206 (1999).
- Schneider, A., et al. turnover mediates preferential localization of prostate cancer in the skeleton. Endocrinology. 146 (4), 1727-1736 (2005).
- Padalecki, S. S., et al. Chromosome 18 suppresses prostate cancer metastases. Urologic Oncology. 21 (5), 366-373 (2003).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。