Method Article
Inyección intracardíaca de células de cáncer de próstata humano para crear un modelo de ratón xenoinjerto de metástasis ósea
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, presentamos un protocolo para la inyección intracardíaca de células de cáncer de próstata humano para generar un modelo de ratón con lesiones de metástasis óseas.
Resumen
Como la neoplasia maligna masculina más común, el cáncer de próstata (CP) ocupa el segundo lugar en mortalidad, principalmente debido a una tasa de metástasis ósea del 65% al 75%. Por lo tanto, es esencial comprender el proceso y los mecanismos relacionados con la metástasis ósea del cáncer de próstata para desarrollar nuevas terapias. Para ello, un modelo animal de metástasis ósea es una herramienta esencial. Aquí, informamos procedimientos detallados para generar un modelo de ratón con metástasis ósea a través de la inyección intracardíaca de células de cáncer de próstata. Un sistema de imágenes de bioluminiscencia puede determinar si las células de cáncer de próstata se han inyectado con precisión en el corazón y controlar la metástasis de las células cancerosas, ya que tiene grandes ventajas en el seguimiento del desarrollo de lesiones metastásicas. Este modelo replica el desarrollo natural de las células cancerosas diseminadas para formar micrometástasis en el hueso e imita el proceso patológico de la metástasis ósea del cáncer de próstata. Proporciona una herramienta eficaz para una mayor exploración de los mecanismos moleculares y los efectos terapéuticos in vivo de esta enfermedad.
Introducción
El cáncer de próstata es el cáncer más frecuente en hombres en 112 países y ocupa el segundo lugar en mortalidad en los países con mayor índice de desarrollo humano 1,2. La mayoría de las muertes en pacientes con cáncer de próstata son causadas por metástasis, y alrededor del 65%-75% de los casos desarrollarán metástasis óseas 3,4. Por lo tanto, se necesitan urgentemente la prevención y el tratamiento de las metástasis óseas del cáncer de próstata para mejorar el resultado clínico de los pacientes con cáncer de próstata. El modelo animal de metástasis ósea es una herramienta indispensable para explorar el proceso multietapa y los mecanismos moleculares implicados en cada estadio de la metástasis ósea del cáncer de próstata, identificando así dianas terapéuticas y desarrollando nuevas terapias5.
Los métodos más comunes para generar modelos animales experimentales de metástasis óseas de cáncer de próstata incluyen la inyección ortotópica, intradiáfisis (como intratibial) e intracardíaca de células de cáncer de próstata. El modelo de metástasis ósea con inyección ortotópica se genera inyectando directamente células de cáncer de próstata en la próstata de un ratón 6,7. Este modelo animal experimental tiene características clínicas muy similares a la metástasis ósea del cáncer de próstata. Sin embargo, la metástasis ocurre principalmente en el ganglio linfático axilar y el pulmón más que en el hueso 8,9. El modelo de inyección intratibial para el cáncer de próstata inyecta directamente células de cáncer de próstata en la tibia con una alta tasa de formación de tumores en el hueso (tibia)10,11; Sin embargo, la corteza ósea y la cavidad de la médula ósea se dañan fácilmente. Además, el método de inyección tibial no puede estimular el proceso patológico de la metástasis ósea del cáncer de próstata en el que las células cancerosas colonizan el hueso a través de la circulación. Para investigar la circulación, la extravasación vascular y la metástasis a distancia con una mayor tasa de metástasis ósea de las células cancerosas, se ha desarrollado una técnica de inyección intracardíaca mediante la inyección directa de células de cáncer de próstata en el ventrículo izquierdo del ratón 8,12,13. Esto lo convierte en un modelo animal valioso para la investigación de metástasis óseas8. El método de inyección intracardíaca muestra una tasa de metástasis ósea de alrededor del 75%9,14, mucho más alta que el método de inyección ortotópica. Por lo tanto, la inyección intracardíaca es un método ideal para generar un modelo animal con metástasis óseas de cáncer de próstata.
Este trabajo tiene como objetivo describir el proceso de establecimiento de un modelo de ratón de metástasis óseas de cáncer de próstata, permitiendo a los lectores visualizar el establecimiento del modelo. El trabajo actual proporciona procesos detallados, precauciones e imágenes ilustrativas para generar un modelo de xenoinjerto de metástasis ósea a través de la inyección intracardíaca de células de cáncer de próstata humano en ratones atímicos. Este método proporciona una herramienta eficaz para explorar más a fondo los mecanismos moleculares y los efectos terapéuticos in vivo de la metástasis ósea del cáncer de próstata.
Protocolo
Los ratones atímicos machos BALB/c machos de seis a ocho semanas de edad (n = 10) fueron alojados en jaulas de ratones ventilados individualmente (5 ratones/jaula) en una sala de animales libre de patógenos específicos (SPF) bajo las condiciones de ciclo de luz/oscuridad de 12 h, con libre acceso a alimento SPF y agua estéril. Los ratones fueron alimentados adaptativamente durante una semana antes de los experimentos. Todos los experimentos con animales fueron aprobados por el comité de bienestar animal de la Universidad de Medicina Tradicional China de Shanghai.
1. Preparación celular
- El día de la inyección de células de cáncer de próstata, lavar dos veces las células PC-3 marcadas con luciferasa confluente (PC-3-luciferasa) marcadas con luciferasa confluente cultivadas en una placa de cultivo celular de 10 cm con PBS estéril prefría (pH 7.4). Tripsinizar durante 3 min con 1,5 ml de tripsina al 0,25% y recoger las células en un tubo de centrífuga de 15 ml después de enfriar la tripsina con 6 ml de medio F-12 que contiene 10% de suero.
NOTA: La línea celular PC-3-luciferasa se deriva de la línea celular PC-3 después de ser transfectada con el vector pLV-luciferasa15. - Utilice un contador automático de celdas y calcule la concentración de celdas transfiriendo 20 μL de la suspensión celular a la placa de conteo de celdas (consulte la Tabla de materiales).
- Centrifugar las células a 800 x g a temperatura ambiente (RT) durante 5 min.
- Utilice una pipeta para desechar el sobrenadante y resuspender el pellet celular en medio F-12 (ver Tabla de materiales) hasta una densidad celular final de 1 x 107 células/ml.
- Mantenga las células en hielo en todo momento hasta la inyección.
- Lleve las células a la sala de cirugía y termine la inyección de células dentro de 2 h.
NOTA: Prepare suspensiones celulares adicionales (generalmente volúmenes duplicados según sea necesario) para garantizar dosis de inyección precisas (por ejemplo, para evitar los espacios muertos dentro de las jeringas).
2. Cirugía para la inyección intracardíaca de las células de cáncer de próstata humano
NOTA: El aparato quirúrgico utilizado para la inyección intracardíaca es una jeringa de 1 ml (Figura 1). Proporcionar soporte térmico durante todo el procedimiento hasta la recuperación del animal de la anestesia.
- Mantenga el ratón en la sala de animales SPF. Realice todos los procedimientos con aparatos esterilizados dentro de un gabinete aséptico.
- Anestesiar al ratón utilizando isoflurano al 2% con oxígeno al 98% bajo un caudal de oxígeno de 2 L/min.
NOTA: Frote una pequeña cantidad de ungüento oftálmico en los ojos del ratón para evitar la sequedad durante la anestesia. Realice toda la cirugía en un área bien ventilada. Asegúrese de que el ratón esté profundamente anestesiado pellizcando los dedos de los pies del ratón antes de la inyección celular. Si las respuestas (p. ej., una sacudida o contracción) persisten, espere un tiempo adicional para que la anestesia surta efecto. - Coloque el ratón en una posición de supone e inmovilice ambas extremidades superiores estiradas perpendicularmente lejos de la línea media (Figura 2A).
- Inmovilice al ratón desde el abdomen hacia abajo con cinta adhesiva quirúrgica. Evite presionar con fuerza y desplazar los órganos internos (Figura 2B).
NOTA: El mantenimiento de la anatomía topográfica (es decir, la fijación con cinta adhesiva) es esencial ya que la inyección intracardíaca es ciega (es decir, el sitio preciso de inyección en el corazón es invisible a simple vista). - Desinfecte la piel del tórax con un hisopo de etanol al 70%.
- Identifique el proceso xifoide del ratón en la depresión en el extremo más bajo del esternón medio palpando por el centro de la pared torácica anterior. Identifique la muesca yugular del ratón en la depresión central en el borde superior del manubrio palpando hacia arriba desde el centro de la pared torácica anterior.
- Etiquete el punto más inferior del proceso xifoide y la muesca yugular con un rotulador (Figura 2A). Haga una tercera marca en el medio de estos dos puntos de referencia y ligeramente a la derecha (izquierda del animal) justo sobre el corazón en el tercer espacio intercostal.
NOTA: El sitio de inyección está a 1-2 mm a la izquierda de la línea media, y el punto de inyección está entre la tercera y cuarta costillas del ratón (Figura 2A). - Cargue 200 μL de la suspensión celular en una jeringa de 1 ml.
NOTA: Mantenga una burbuja de aire en la jeringa, como se muestra en la Figura 2C, para asegurarse de que la sangre esté pulsando. La suspensión celular debe mezclarse bien antes de cargarla. - Inserte verticalmente una aguja de 26 G a través del lugar de inyección (Figura 2D).
- Mantenga la mano que sostiene la jeringa estable sobre la mesa, o use la otra mano para mantenerla estable. Asegúrese de que el eje largo de la jeringa sea perpendicular al lugar de la inyección e inserte la jeringa aproximadamente 2 mm por vía subcutánea.
- La pulsación sanguínea de color rojo brillante es visible en el cubo de la aguja y/o la suspensión celular cuando la punta de la aguja se inserta correctamente en el ventrículo izquierdo. Si la pulsación de la sangre es invisible, la punta de la aguja no está en el corazón. Retraiga y reemplace la aguja (en caso de que la coagulación de la sangre dentro de la aguja detenga la pulsación de sangre). Inserte la aguja una vez más.
- Inyecte las células. Inyecte la suspensión celular (100 μL) muy lentamente durante 40-60 s y mantenga la mano que sostiene la jeringa estable todo el tiempo.
NOTA: Vigile de cerca la suspensión celular en la jeringa y no inyecte la burbuja de aire dentro de la jeringa en el corazón. - Aplique presión en el lugar de la inyección con un hisopo de algodón seco durante 15 s para asegurar la hemostasia cuando se retrae la aguja.
- Devuelva el ratón a la jaula limpia y controle al animal hasta que se recupere completamente de la anestesia.
- Imagen del ratón con un sistema de bioluminiscencia in vivo dentro de las 24 horas posteriores a la inyección para garantizar que las células cancerosas hayan entrado en la circulación sistémica.
NOTA: Las células cancerosas inyectadas correctamente ingresan a la circulación arterial a través del ventrículo cardíaco izquierdo, que se ve por la señalización de bioluminiscencia visible en todo el cuerpo (por ejemplo, vea la Figura 3A). - Realizar imágenes de bioluminiscencia in vivo .
- Encienda el instrumento y la computadora. Abra el software cuando el indicador de encendido del instrumento y la computadora se ilumine y, a continuación, abra la ventana Adquisición de imágenes .
- Identifique el sistema de imágenes in vivo conectado al equipo en el panel del dispositivo. Coloque el ratón para obtener imágenes en la cámara de imágenes en posición supina. Luego cierre la puerta de la cámara de imágenes.
- Establezca los parámetros en el panel Configuración proporcionado en la ventana Adquisición de imágenes .
- Establezca los parámetros con Lens > Zoom > 1x, Lens > Focus > 108 y Lens > Iris > F 2.8 para que las imágenes sean claras.
- Ajuste el canal de disparo en Filtro y luz: filtro y luz > filtro > luminiscencia, filtro y luz > luz > apagado y filtro y luz > intensidad de luz > medio.
- Establezca el tipo de imagen que se va a tomar: Imaging > Type > Single-Frame, Imaging > Exposure Time > 500 ms, Imaging > HDR Mode > Low GainMode. Haga clic en el botón Adquirir para adquirir la imagen.
- Visualice el crecimiento del cáncer metastásico con bioluminiscencia in vivo .
NOTA: En cada punto de tiempo de la visualización, inyectar intraperitonealmente 200 μL del sustrato de luciferina en un ratón de 20 g (150 mg/kg) y esperar 15 min antes de la anestesia (isoflurano al 2% mezclado con oxígeno al 98% en una cámara de inducción). Coloque el ratón en la plataforma del sistema de imágenes de bioluminiscencia. Mantener la anestesia a través de una máscara nasal con isoflurano al 2%.
3. Investigación patológica
- Cuatro semanas después de la inyección celular, sacrifique al ratón por inhalación deCO2 y luego dislocación cervical.
- Inmovilizar el ratón en posición supina. Haga una incisión vertical (aproximadamente 6 cm) desde el abdomen hasta el tórax con tijeras quirúrgicas para exponer y examinar groseramente todos los órganos en el abdomen y el tórax en busca de lesiones cancerosas y / o cambios patológicos.
NOTA: Para un estudio de inyección intracardíaca de células cancerosas, las lesiones cancerosas en el mediastino adyacente al corazón sugieren células cancerosas mal inyectadas (células no inyectadas en el ventrículo cardíaco izquierdo); Por lo tanto, estos ratones no se incluyen en la recopilación final de datos. - Extirpar los tumores metastásicos con tijeras. Mida los diámetros largos (a) y cortos (b) del tumor usando calibradores para calcular el volumen del tumor (V) usando la fórmula V = 1/2 × a × b2, y pese el tumor usando una balanza electrónica.
- Fijar los tejidos tumorales en una solución de formalina al 10% seguida de incrustación en parafina. Alternativamente, congele rápidamente los tumores en nitrógeno líquido.
- Extirpar los huesos (extremidades posteriores, vértebras y/o costillas) con lesiones metastásicas. Fijar la muestra de cada ratón en un tubo de 50 ml que contenga 20 ml de solución de formalina al 10% durante 24 h después de retirar la piel y los músculos, seguido de descalcificación durante 14 días en solución de EDTA al 10% con cambio tampón frecuente (cada 3 días).
- Incrustar la muestra en parafina y seccionar las muestras para el examen histológico de rutina16.
Resultados
Las imágenes de bioluminiscencia ofrecen enormes ventajas en el monitoreo del desarrollo de lesiones metastásicas para un modelo de inyección intracardíaca. Poco después de la inyección de células cancerosas (dentro de las 24 h), se utilizaron imágenes de bioluminiscencia para visualizar las células cancerosas que ingresan a la circulación general (Figura 3A). La señalización obvia de bioluminiscencia en todo el cuerpo se verá cuando las células cancerosas se inyecten correctamente en la circulación arterial. Los datos de ratones que muestran señales de bioluminiscencia solo en el lugar de la inyección (corazón) deben excluirse de la recopilación final de datos. Se observaron lesiones metastásicas en las extremidades posteriores (Figura 3B-D) 2 semanas después de la inyección celular. A medida que pasaba el tiempo, las lesiones metastásicas se hicieron más grandes y aparecieron en otros sitios, incluyendo el esternón, las costillas y la mandíbula.
Las imágenes de rayos X mostraron destrucción ósea que representa las lesiones metastásicas en el hueso (Figura 4A). La destrucción ósea también se detectó mediante micro-tomografía computarizada. La micro-tomografía computarizada se realizó en modo 3D utilizando una micro-TC (μCT80) asociada con 3Dcalc, reconstrucción de conos y una aplicación de software de visualización de modelos. Se obtuvo una reconstrucción de los datos del mapa de bits para construir el modelo 3D. Una imagen representativa de micro-TC de la destrucción ósea en la tibia proximal se muestra en la Figura 4B. Las lesiones metastásicas se confirmaron aún más en tejidos embebidos en parafina mediante tinción de H&E (Figura 4C).

Figura 1: Aparato quirúrgico. Una jeringa de 1 ml. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Inyección intracardíaca de células de cáncer de próstata . (A) El panel ilustra la muesca yugular, el proceso xifoides, la caja torácica (margen inferior) y la línea media. El sitio de inyección es equidistante del proceso xifoide y la muesca yugular. (B) La cinta quirúrgica se utiliza horizontalmente a través del abdomen para evitar el movimiento del ratón durante la inyección. (C) Una jeringa cargada con la suspensión celular y la presencia de una burbuja de aire. La burbuja de aire ayuda a visualizar la pulsación de la sangre. (D) La aguja se inserta verticalmente a través del lugar de inyección. Haga clic aquí para ver una versión más grande de esta figura.
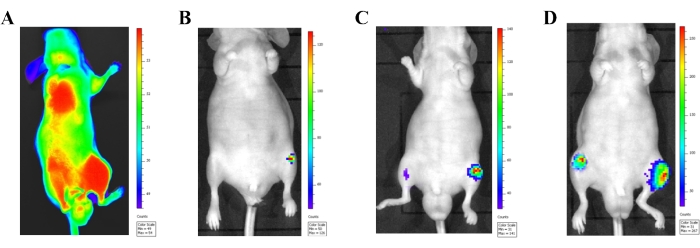
Figura 3: Confirmación del modelo de inyección intracardíaca con un sistema de imagen de bioluminiscencia in vivo. (A) Imágenes de bioluminiscencia in vivo de un ratón atímico macho 24 h después de inyectar células PC-3 marcadas con luciferasa (1 × 106 células) en el ventrículo cardíaco izquierdo. Las células cancerosas inyectadas correctamente en la circulación sistémica son vistas por la señal de bioluminiscencia liberada de todo el cuerpo. (B-D) Imágenes de bioluminiscencia de un ratón representativo que muestra el desarrollo progresivo de metástasis. (B) Una imagen que muestra las células de cáncer de próstata 2 semanas después de la inyección. (C) Una imagen que muestra las células de cáncer de próstata 3 semanas después de la inyección. (D) Una imagen que muestra las células de cáncer de próstata 4 semanas después de la inyección. Haga clic aquí para ver una versión más grande de esta figura.
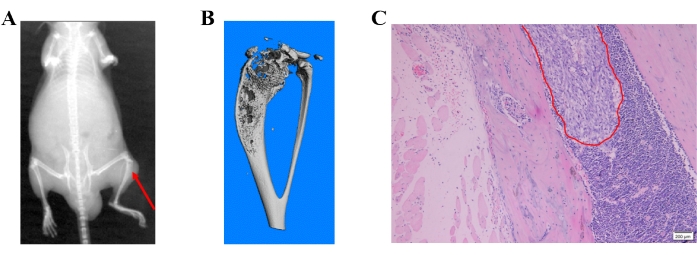
Figura 4: Diferentes métodos de detección de metástasis óseas inducidas por células de cáncer de próstata. (A) Una imagen representativa de rayos X; La flecha roja muestra la destrucción ósea en la tibia proximal. (B) Una imagen representativa de micro-TC de la tibia. (C) Imagen de H&E que muestra metástasis óseas de células de cáncer de próstata. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La inyección intracardíaca de células de cáncer de próstata humano para generar metástasis óseas es un modelo de ratón ideal para explorar las funciones y mecanismos de la metástasis ósea del cáncer de próstata y evaluar la eficacia terapéutica. Los estudios han demostrado que el daño óseo probablemente ocurre en la tibia proximal y el fémur distal17, lo que puede deberse a su alta vascularización y actividad metabólica.
Dado que la metástasis ósea es una lesión metastásica frecuentemente observada en pacientes con cáncer de mama, el modelo de metástasis ósea producido por inyección intracardíaca de células de cáncer de mama también se utiliza comúnmente en estudios sobre cáncer de mama18,19. Por lo tanto, el trabajo actual podría ayudar a desarrollar un modelo de metástasis ósea producida por inyección intracardíaca con células de cáncer de mama y próstata.
Para la formación consistente de tumores, hay algunas consideraciones clave. Las células deben inyectarse tan pronto como sea posible después del desprendimiento del cultivo. Los ratones deben ser aleatorizados en grupos experimentales después de la inyección de células cancerosas. El volumen de inyección debe ser constante y la misma persona debe inyectar células cancerosas a todos los ratones utilizando la misma técnica.
Todo el procedimiento contiene varios pasos críticos. Si el lugar de la inyección está colocado correctamente, se debe observar sangre pulsada durante la inyección. La pérdida de estabilidad de la mano que sostiene la jeringa y el cambio en la posición de la aguja mientras avanza el émbolo de la jeringa son problemas potenciales. Una jeringa con un cubo de color en el interior hace que la pulsación de la sangre se vea fácilmente. Si aparecen burbujas de aire en el cubo de la aguja al insertar la aguja (lo que indica una mala inserción en los pulmones), la aguja debe retirarse y volver a insertarse después de la reubicación. Si no hay pulso rojo de sangre en el cubo de la aguja, pero la persona que inyecta está segura de que el sitio de inyección es correcto, tire ligeramente del émbolo de la jeringa para verificar la inyección en el ventrículo cardíaco. La falta de metástasis después de 2-3 semanas de inyección de células cancerosas indica una inyección errónea. Confirmar la circulación de las células cancerosas en todo el cuerpo mediante imágenes de bioluminiscencia dentro de las 24 h posteriores a la inyección20. La señalización de bioluminiscencia podría verse en todo el cuerpo si las células cancerosas se inyectaran con precisión en el ventrículo cardíaco. Además, la tasa metastásica, la localización y el número de tumores metastásicos pueden diferir en diferentes líneas celulares 8,21.
Después de la cirugía, los ratones deben ser revisados regularmente. Debido a la cirugía y la exposición a la anestesia, los ratones pueden experimentar una angustia significativa o incluso morir. Por lo tanto, la primera semana después de la cirugía es crítica, y los ratones deben ser monitoreados cuidadosamente. A lo largo de un experimento de metástasis ósea, los ratones deben ser monitoreados diariamente para detectar cambios en los niveles de actividad, movilidad y la aparición de caquexia (un síndrome paraneoplásico en ratones caracterizado por pérdida de peso, atrofia y debilidad muscular, apariencia arqueada y letargo22,23). Los ratones deben ser sacrificados cuando se pierde el 10% -20% de su peso corporal; la progresión del tumor afecta la movilidad (por ejemplo, fractura de huesos largos, inclinación de la cabeza, paraplejia); o los ratones parecen estar en dificultad respiratoria24.
La ventaja de este modelo es que las células cancerosas detectadas en el hueso han "sembrado el suelo" 25, replicando así la progresión más natural de la formación de micrometástasis de las células cancerosas diseminadas. Este modelo también tiene varias limitaciones. Este es un modelo de cáncer de xenoinjerto utilizando ratones inmunodeficientes. Este modelo no es beneficioso para estudiar la interacción entre las células cancerosas y las células inmunes en el microambiente de metástasis ósea. Se estima que alrededor del 30% de los ratones morirán durante el modelado; Por lo tanto, la práctica mejorará en gran medida la tasa de éxito del desarrollo del modelo. Además, la lesión por metástasis también puede ocurrir en el cerebro, los pulmones y los riñones; La formación de metástasis múltiples interfiere con el estudio de los mecanismos de metástasis ósea 9,26,27,28. Aunque la tasa de metástasis óseas es mucho mayor por inyección intracardíaca que por inyección ortotópica, la técnica de inyección intracardíaca muestra una tasa de metástasis ósea de alrededor del 75% en lugar del 100%9,14. La menor eficiencia puede deberse a que las células cancerosas inyectadas no pudieron ingresar a la circulación sanguínea o a la muerte del ratón receptor durante una inyección cardíaca debido a que la aguja perforó el corazón o el pulmón.
A pesar de estas limitaciones, este modelo de ratón establecido de metástasis óseas de cáncer de próstata ha demostrado ser una excelente herramienta para estudiar la diafonía ósea y del cáncer y evaluar posibles terapias para prevenir la progresión del cáncer e interrumpir el ciclo de destrucción ósea inducida por metástasis.
Divulgaciones
Todos los autores declaran que no hay intereses financieros en conflicto.
Agradecimientos
Este trabajo está respaldado por subvenciones del Programa Nacional de Investigación y Desarrollo Clave de China (2018YFC1704300 y 2020YFE0201600), la Fundación Nacional de Ciencias de la Naturaleza (81973877 y 82174408), los proyectos de investigación dentro del presupuesto de la Universidad de Medicina Tradicional China de Shanghai (2021LK047) y el Centro de Innovación Colaborativa de Shanghai de Transformación Industrial de Preparación de MTC Hospitalaria.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 mL syringes and needles | Shandong Weigao Group Medical Polymer Co., Ltd | 20200411 | The cells were injected into the ventricles of mice |
| Anesthesia machine | Shenzhen RWD Life Technology Co., Ltd | R500IP | Equipment for anesthetizing mice |
| Automatic cell counter | Shanghai Simo Biological Technology Co., Ltd | IC1000 | For counting cells |
| BALB/c athymic mice | Shanghai SLAC Laboratory Animal Co, Ltd. | Male | 6-8 week old, male mice |
| Bioluminescence imaging system | Shanghai Baitai Technology Co., Ltd | Vieworks | For tracking the tumor growth and pulmonary metastasis if the injected cells are labeled by luciferase |
| Centrifuge tube (15 mL, 50 mL) | Shanghai YueNian Biotechnology Co., Ltd | 430790, Corning | |
| EDTA solution | Wuhan Xavier Biotechnology Co., Ltd | G1105 | For decalcification of bone tissure |
| F-12 medium | Shanghai YueNian Biotechnology Co., Ltd | 21700075, GIBCO | Cell culture medium |
| Formalin solution | Shanghai YueNian Biotechnology Co., Ltd | BL539A | For fixing the specimen of each mouse |
| Isoflurane | Shenzhen RWD Life Technology Co., Ltd | VETEASY | For anesthesia |
| Lipofectamine 2000 | Shanghai YueNian Biotechnology Co., Ltd | 11668027, Thermo fisher | Plasmid transfection reagent |
| PC-3 cell line | Cell Bank of Chinese Academy of Sciences | TCHu 158 | Prostate cancer cell line |
| Phosphate-buffered saline | Beyotime Biotechnology | ST447 | Wash the human osteosarcoma cells |
| Trypsin (0.25%) | Shanghai YueNian Biotechnology Co., Ltd | 25200056, Gibco | For detaching the cells |
| Vector (pLV-luciferase) | Shanghai YueNian Biotechnology Co., Ltd | VL3613 | Plasmid for transfection |
| X-ray imaging system | Brook (Beijing) Technology Co., Ltd | FX PRO | For obtaining x-ray images to detect tumor growth |
| μCT80 | Shenzhen Fraun Technology Service Co., Ltd | Scanco Medical AG,Switzerland | For detection of bone destruction. The mico-CT is equipped with 3DCalc, cone reconstruction, and μCT Ray V3.4A model visualization software. |
Referencias
- Siegel, R. L., Miller, K. D., Fuchs, H. E., Jemal, A. Cancer Cancerstatistics, 2021. CA: A Cancer Journal for Clinicians. 71 (1), 7-33 (2021).
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 71 (3), 209-249 (2021).
- Coleman, R. E. Skeletal complications of malignancy. Cancer. 80, 1588-1594 (1997).
- Macedo, F., et al. Bone metastases: An overview. Oncology Reviews. 11 (1), 321 (2017).
- Rea, D., et al. Mouse models in prostate cancer translational research: From xenograft to PDX. BioMed Research International. 2016, 9750795 (2016).
- Zhang, Y., et al. Real-time GFP intravital imaging of the differences in cellular and angiogenic behavior of subcutaneous and orthotopic nude-mouse models of human PC-3 prostate cancer. Journal of Cellular Biochemistry. 117 (11), 2546-2551 (2016).
- Stephenson, R. A., et al. Metastatic model for human prostate cancer using orthotopic implantation in nude mice. Journal of the National Cancer Institute. 84 (12), 951-957 (1992).
- Simmons, J. K., et al. Animal models of bone metastasis. Veterinary Pathology. 52 (5), 827-841 (2015).
- Jenkins, D. E., Hornig, Y. S., Oei, Y., Dusich, J., Purchio, T. Bioluminescent human breast cancer cell lines that permit rapid and sensitive in vivo detection of mammary tumors and multiple metastases in immune deficient mice. Breast Cancer Research: BCR. 7 (4), 444-454 (2005).
- Corey, E., et al. Establishment and characterization of osseous prostate cancer models: intra-tibial injection of human prostate cancer cells. The Prostate. 52 (1), 20-33 (2002).
- Andersen, C., Bagi, C. M., Adams, S. W. Intra-tibial injection of human prostate cancer cell line CWR22 elicits osteoblastic response in immunodeficient rats. Journal of Musculoskeletal & Neuronal Interactions. 3 (2), 148-155 (2003).
- Sudhan, D. R., Pampo, C., Rice, L., Siemann, D. W. Cathepsin L inactivation leads to multimodal inhibition of prostate cancer cell dissemination in a preclinical bone metastasis model. International Journal of Cancer. 138 (11), 2665-2677 (2016).
- Jinnah, A. H., Zacks, B. C., Gwam, C. U., Kerr, B. A. Emerging and established models of bone metastasis. Cancers. 10 (6), 176 (2018).
- Simmons, J. K., et al. Canine prostate cancer cell line (Probasco) produces osteoblastic metastases in vivo. The Prostate. 74 (13), 1251-1265 (2014).
- Lamar, J. M., et al. SRC tyrosine kinase activates the YAP/TAZ axis and thereby drives tumor growth and metastasis. The Journal of Biological Chemistry. 294 (7), 2302-2317 (2019).
- Chang, J., et al. Matrine inhibits prostate cancer via activation of the unfolded protein response/endoplasmic reticulum stress signaling and reversal of epithelial to mesenchymal transition. Molecular Medicine Reports. 18 (1), 945-957 (2018).
- Arguello, F., Baggs, R. B., Frantz, C. N. A murine model of experimental metastasis to bone and bone marrow. Cancer Research. 48 (23), 6876-6881 (1988).
- Brylka, L., et al. Spine Metastases in immunocompromised mice after intracardiac injection of MDA-MB-231-SCP2 breast cancer cells. Cancers. 14 (3), 556 (2022).
- Rahman, M. M., Veigas, J. M., Williams, P. J., Fernandes, G. DHA is a more potent inhibitor of breast cancer metastasis to bone and related osteolysis than EPA. Breast Cancer Research and Treatment. 141 (3), 341-352 (2013).
- Park, S. I., Kim, S. J., McCauley, L. K., Gallick, G. E. Pre-clinical mouse models of human prostate cancer and their utility in drug discovery. Current Protocols in Pharmacology. , (2010).
- Wright, L. E., et al. Murine models of breast cancer bone metastasis. BoneKEy Reports. 5, 804 (2016).
- Fearon, K. C., Glass, D. J., Guttridge, D. C. Cancer cachexia: mediators, signaling, and metabolic pathways. Cell Metabolism. 16 (2), 153-166 (2012).
- Waning, D. L., et al. Excess TGF-β mediates muscle weakness associated with bone metastases in mice. Nature Medicine. 21 (11), 1262-1271 (2015).
- Talbot, S. R., et al. Defining body-weight reduction as a humane endpoint: a critical appraisal. Laboratory Animals. 54 (1), 99-110 (2020).
- Paget, S. The distribution of secondary growths in cancer of the breast. Cancer Metastasis Reviews. 8 (2), 98-101 (1989).
- Yin, J. J., et al. TGF-beta signaling blockade inhibits PTHrP secretion by breast cancer cells and bone metastases development. The Journal of Clinical Investigation. 103 (2), 197-206 (1999).
- Schneider, A., et al. turnover mediates preferential localization of prostate cancer in the skeleton. Endocrinology. 146 (4), 1727-1736 (2005).
- Padalecki, S. S., et al. Chromosome 18 suppresses prostate cancer metastases. Urologic Oncology. 21 (5), 366-373 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados