Method Article
骨転移異種移植マウスモデルを作成するためのヒト前立腺癌細胞の心臓内注射
* これらの著者は同等に貢献しました
要約
ここでは、骨転移病変を有するマウスモデルを生成するためのヒト前立腺癌細胞の心臓内注射のためのプロトコルを提示する。
要約
最も一般的な男性悪性腫瘍として、前立腺がん(PC)は、主に65%〜75%の骨転移率のために、死亡率で2番目にランクされています。したがって、新しい治療法を開発するためには、前立腺癌骨転移のプロセスと関連するメカニズムを理解することが不可欠です。このためには、骨転移の動物モデルが不可欠なツールです。今回,前立腺癌細胞の心臓内注射 による 骨転移マウスモデル作製の詳細な手順について報告する.生物発光イメージングシステムは、転移性病変の発生を監視する上で大きな利点があるため、前立腺癌細胞が心臓に正確に注入されているかどうかを判断し、癌細胞の転移を監視できます。このモデルは、播種性癌細胞の自然な発達を再現して骨に微小転移を形成し、前立腺癌の骨転移の病理学的プロセスを模倣します。これは、この疾患の分子メカニズムと in vivo 治療効果をさらに調査するための効果的なツールを提供します。
概要
前立腺がんは、112か国の男性で最も頻度の高いがんで、人間開発指数の高い国で死亡率で2番目にランクされています1,2。前立腺がん患者の死亡のほとんどは転移によって引き起こされ、症例の約65%〜75%が骨転移を発症します3,4。したがって、前立腺癌患者の臨床転帰を改善するために、前立腺癌骨転移の予防と治療が緊急に必要とされています。骨転移の動物モデルは、前立腺がんの骨転移の各段階に関与する多段階のプロセスと分子メカニズムを探索し、治療標的を特定し、新しい治療法を開発するために不可欠なツールです5。
前立腺癌骨転移の実験動物モデルを生成する最も一般的な方法には、前立腺癌細胞の同所性、骨幹内(脛骨内など)、および心臓内注射が含まれます。同所性注射による骨転移モデルは、マウスの前立腺に前立腺癌細胞を直接注入することによって生成される6、7。この実験動物モデルは、前立腺癌の骨転移と非常によく似た臨床的特徴を持っています。ただし、転移は主に骨ではなく腋窩リンパ節と肺で発生します8,9。前立腺がんの脛骨内注射モデルは、前立腺がん細胞を骨(脛骨)の腫瘍形成率が高い状態で脛骨に直接注入します10,11;しかしながら、骨皮質および骨髄腔は容易に損傷を受ける。さらに、脛骨注射法は、癌細胞が循環を介して骨にコロニーを形成する前立腺癌骨転移の病理学的プロセスを刺激することはできません。癌細胞の骨転移率が高い循環、血管溢出、遠隔転移を調べるために、マウスの左心室に前立腺癌細胞を直接注入する心臓内注射技術が開発されています8、12、13。これは、骨転移研究のための貴重な動物モデルになります8。心臓内注射法は、同所性注射法よりもはるかに高い約75%9,14の骨転移率を示しています。したがって、心臓内注射は、前立腺癌骨転移を有する動物モデルを生成するための理想的な方法である。
この研究は、前立腺癌の骨転移のマウスモデルを確立するプロセスを記述し、読者がモデル確立を視覚化できるようにすることを目的としています。現在の研究は、無胸腺マウスにおけるヒト前立腺癌細胞の心臓内注射 を介して 骨転移異種移植片モデルを生成するための詳細なプロセス、予防措置、および例示的な写真を提供します。この方法は、前立腺癌骨転移の分子メカニズムおよび in vivo 治療効果をさらに探索するための有効なツールを提供する。
プロトコル
6〜8週齢の雄性BALB/c無胸腺マウス(n = 10)を、SPF飼料および滅菌水に自由にアクセスできる状態で、12時間の明暗サイクルの条件下で、特定の病原体のない(SPF)動物室に個別に換気されたマウスケージ(5匹/ケージ)に収容した。マウスは、実験の前に1週間適応的に給餌された。すべての動物実験は、上海中医薬大学の動物福祉委員会によって承認されました。
1.細胞調製
- 前立腺癌細胞注入当日に、10cm細胞培養皿で培養した80%〜90%コンフルエントなルシフェラーゼ標識PC-3細胞(PC-3-ルシフェラーゼ)を予め低温滅菌PBS(pH7.4)で2回洗浄する。1.5 mLの0.25%トリプシンで3分間トリプシン処理し、10%血清を含む6 mLのF-12培地でトリプシンをクエンチした後、細胞を15 mLの遠沈管に回収します。
注:PC-3-ルシフェラーゼ細胞株は、pLV-ルシフェラーゼベクター15でトランスフェクトされた後のPC-3細胞株に由来します。 - 自動セルカウンターを使用し、20 μLの細胞懸濁液をセルカウントプレートに移して細胞濃度を計算します( 材料表を参照)。
- 細胞を室温(RT)で800 x g で5分間遠心分離します。
- ピペットを使用して上清を廃棄し、細胞ペレットをF-12培地( 材料表を参照)に再懸濁して、最終細胞密度が1 x 107 細胞/mLになるようにします。
- 注射までは常に細胞を氷上に保管してください。
- 細胞を手術室に持ち込み、2時間以内に細胞注入を終了します。
注意: 正確な注入量を確保するために(たとえば、シリンジ内のデッドスペースを避けるために)、追加の細胞懸濁液(通常は必要に応じて2倍の容量)を準備します。
2.ヒト前立腺癌細胞の心臓内注射手術
注:心臓内注射に使用される手術器具は1mLシリンジです(図1)。動物が麻酔から回復するまで、手順全体を通して熱サポートを提供します。
- マウスをSPF動物室に保管してください。無菌キャビネット内の滅菌装置ですべての手順を実行します。
- 2 L / minの酸素流量で98%の酸素を含む2%イソフルランを使用してマウスに麻酔をかけます。
注意: 麻酔中の乾燥を避けるために、マウスの目に少量の眼科用軟膏を塗ります。換気の良い場所で手術全体を行います。細胞注入の前にマウスのつま先をつまんで、マウスが深く麻酔されていることを確認してください。反応(けいれんやけいれんなど)が残っている場合は、麻酔が有効になるまでさらに待ちます。. - マウスを肇位に置き、正中線から垂直に伸ばした両上肢を固定します(図2A)。
- マウスを腹部から下に外科用粘着テープで固定します。強く押して内臓を移動させないでください(図2B)。
注:心臓内注射は盲目であるため(すなわち、心臓の正確な注射部位は肉眼では見えないため)、地形の解剖学的構造を維持すること(すなわち、粘着テープで固定すること)が不可欠である。 - 70%エタノール綿棒で胸部の皮膚を消毒します。
- 前胸壁の中央を触診することにより、胸骨中央部の下端にあるくぼみのマウス剣状突起を特定します。前胸壁の中央から触診することにより、マニュブリウムの上部境界にある中央のくぼみにあるマウス頸静脈ノッチを特定します。
- 剣状突起の最も劣った点と頸静脈のノッチにマーカーペンでラベルを付けます(図2A)。これら2つのランドマークの中央に、3番目の肋間腔の心臓のすぐ上にわずかに右(動物の左)に3番目のマークを付けます。
注:注射部位は正中線の左1〜2 mmで、注射点はマウスの3番目と4番目の肋骨の間です(図2A)。 - 200 μLの細胞懸濁液を1 mLシリンジに入れます。
注意: 図2Cに示すように、シリンジ内に気泡を保ち、血液が脈動していることを確認します。細胞懸濁液は、装填前に十分に混合しなければならない。 - 26 Gの針を注射部位に垂直に挿入します(図2D)。
- シリンジを持っている手をテーブルの上に安定させておくか、もう一方の手でシリンジを安定させます。シリンジの長軸が注射部位に対して垂直であることを確認し、シリンジを約2 mm皮下に挿入します。
- 針先が左心室に正しく挿入されると、針ハブおよび/または細胞懸濁液に真っ赤な血液脈動が見られます。血液の脈動が見えない場合、針先は心臓にありません。針を引っ込めて交換します(針内の血液凝固が血液の脈動を止める場合)。もう一度針を挿入します。
- 細胞を注入します。細胞懸濁液(100 μL)を40〜60秒にわたって非常にゆっくりと注入し、シリンジを持っている手を常に安定させてください。
注意: シリンジ内の細胞懸濁液を注意深く監視し、シリンジ内の気泡を心臓に注入しないでください。 - 針を引っ込めたときの止血を確実にするために、乾いた綿棒で注射部位に15秒間圧力をかけます。
- マウスを清潔なケージに戻し、麻酔から完全に回復するまで動物を監視します。
- 注射後24時間以内に in vivo 生物発光システムでマウスを画像化し、がん細胞が体循環に入ったことを確認します。
注:正しく注入された癌細胞は、全身に見える生物発光シグナル伝達によって見られる左心室 を介して 動脈循環に入ります(たとえば、 図3Aを参照)。 - 生体内生物発光イメージングを行う。
- 機器とコンピュータの電源を入れます。機器とコンピュータの電源インジケータが明るくなったらソフトウェアを開き、 画像取得 ウィンドウを開きます。
- デバイスペインで、コンピューターに接続されている in vivo イメージングシステムを特定します。画像化するマウスを仰臥位でイメージングチャンバーに入れる。次に、イメージングチャンバーのドアを閉じます。
- 画像取得ウィンドウにある設定ペインでパラメータを設定します。
- レンズ>ズーム>1倍、レンズ>フォーカス>108、レンズ>アイリス>F 2.8でパラメータを設定して、画像を鮮明にします。
- フィルター&ライト :フィルター&ライト>フィルター>発光、フィルター&ライト>ライト>OFF、 フィルター&ライト>光の強度>真ん中で撮影チャンネルを設定します。
- 撮影する画像の種類を設定します: イメージング>タイプ>シングルフレーム、イメージング>露光時間>500ミリ秒、イメージング>HDRモード>低ゲインモード。[ 取得 ]ボタンをクリックして画像を取得します。
- in vivo生物発光による転移性がんの増殖を可視化します。
注:視覚化の各時点で、200 μLのルシフェリン基質を20 gマウス(150 mg / kg)に腹腔内注射し、麻酔(誘導チャンバー内で2%イソフルランと98%酸素を混合)の前に15分間待ちます。生物発光イメージングシステムのプラットフォームにマウスを置きます。2%イソフルランを含む鼻マスクを通して麻酔を維持する。
3.病理学的調査
- 細胞注射の4週間後、CO2 吸入およびその後頸部脱臼によりマウスを屠殺する。
- マウスを仰臥位で固定します。外科用ハサミで腹部から胸部まで垂直に切開(約6cm)し、腹部と胸部のすべての臓器を露出させ、癌性病変や病理学的変化がないか大胆に検査します。
注:心臓内がん細胞注入研究では、心臓に隣接する縦隔のがん病変は、誤注入されたがん細胞(左心室に注入されていない細胞)を示唆しています。したがって、これらのマウスは最終的なデータ収集には含まれていません。 - ハサミで転移性腫瘍を切除します。ノギスを用いて腫瘍の長径(a)と短径(b)を測定し、式V = 1/2 × a × b2を用いて腫瘍体積(V)を計算し、電子スケールを用いて腫瘍の重量を量る。
- 腫瘍組織を10%ホルマリン溶液に固定し、続いてパラフィンに包埋する。あるいは、腫瘍を液体窒素で急速凍結します。
- 転移性病変のある骨(後肢、椎骨、および/または肋骨)を切除します。皮膚と筋肉を取り除いた後、20 mLの10%ホルマリン溶液を含む50 mLチューブに各マウスの検体を24時間固定し、その後、頻繁にバッファーを交換しながら10%EDTA溶液で14日間脱灰します(3日ごと)。
- 検体をパラフィンに埋め込み、ルーチン組織学的検査のために検体を切片化する16。
結果
生物発光イメージングは、心臓内注射モデルの転移病変の発生を監視する上で大きな利点を提供します。がん細胞注入直後(24時間以内)に、生物発光イメージングを使用して、全身循環に入るがん細胞を視覚化しました(図3A)。がん細胞が動脈循環に適切に注入されると、全身に明らかな生物発光シグナル伝達が見られます。注射部位(心臓)でのみ生物発光シグナルを示すマウスからのデータは、最終的なデータ収集から除外する必要があります。細胞注入後2週間で後肢に転移病変が認められた(図3B-D)。時間が経つにつれて、転移性病変は大きくなり、胸骨、肋骨、下顎などの他の部位に現れました。
X線画像は、骨の転移性病変を表す骨破壊を示した(図4A)。骨破壊はマイクロCTスキャンによっても検出されました。マイクロCTスキャンは、3Dcalc、円錐再構成、およびモデル視覚化ソフトウェアアプリケーションに関連付けられたマイクロCT(μCT80)を使用して3Dモードで実行されました。ビットマップデータの再構成を取得して、3Dモデルを構築しました。近位脛骨における骨破壊の代表的なマイクロCT画像を 図4Bに示す。転移性病変は、H&E染色によってパラフィン包埋組織でさらに確認されました(図4C)。

図1:手術器具。1 mLシリンジ。この図の拡大版を表示するには、ここをクリックしてください。

図2:前立腺癌細胞の心臓内注射 。 (A)パネルは、頸静脈ノッチ、剣状突起、胸郭(下縁)、および正中線を示しています。注射部位は剣状突起および頸静脈ノッチから等距離にある。(B)サージカルテープは、注射中のマウスの動きを防ぐために腹部を横切って水平に使用されます。(c)細胞懸濁液および気泡の存在を装填したシリンジ。気泡は血液の脈動を視覚化するのに役立ちます。(D)注射部位を通して針を垂直に挿入する。 この図の拡大版を表示するには、ここをクリックしてください。
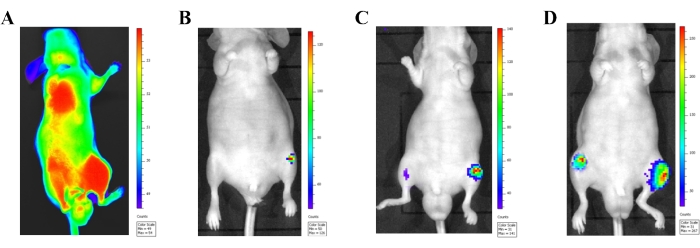
図3:in vivo生物発光イメージングシステムによる心臓内注入モデルの確認。 (A)ルシフェラーゼ標識PC-3細胞(1×10、6細胞)を左心室に注入してから24時間後の雄性無胸腺マウスのin vivo生物発光イメージング。体循環に正しく注入されたがん細胞は、全身から放出される生物発光シグナルによって見られます。(B-D)進行性転移発生を示す代表的なマウスの生物発光画像。(B)注射後2週間の前立腺癌細胞を示す画像。(c)注射後3週目の前立腺癌細胞を示す画像。(D)注射後4週間の前立腺癌細胞を示す画像。この図の拡大版を表示するには、ここをクリックしてください。
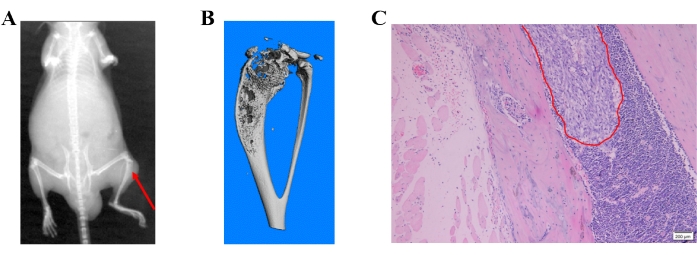
図4:前立腺癌細胞誘発性骨転移の異なる検出方法。 (a)代表的なX線画像;赤い矢印は近位脛骨の骨破壊を示しています。(B)脛骨の代表的なマイクロCT画像。(C)前立腺癌細胞の骨転移を示すH&E画像。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
骨転移を生じさせるためのヒト前立腺癌細胞の心臓内注射は、前立腺癌骨転移の機能とメカニズムを探索し、治療効果を評価するための理想的なマウスモデルである。研究によると、骨の損傷は近位脛骨と遠位大腿骨17で発生する可能性が最も高く、これはそれらの高い血管新生と代謝活動が原因である可能性があります。
骨転移は乳がん患者で頻繁に観察される転移性病変であるため、乳がん細胞の心臓内注射によって作製された骨転移モデルも乳がんの研究で一般的に使用されています18,19。したがって、現在の研究は、乳がん細胞と前立腺がん細胞を用いた心臓内注射による骨転移モデルの開発に役立つ可能性があります。
一貫した腫瘍形成のためには、いくつかの重要な考慮事項があります。細胞は、培養物から剥離した後できるだけ早く注入する必要があります。マウスは、癌細胞注入後に実験群に無作為化されるべきである。注入量は一定である必要があり、同じ人が同じ技術を使用してすべてのマウスに癌細胞を注射する必要があります。
手順全体には、いくつかの重要なステップが含まれています。注射部位が正しく配置されている場合は、注射中に脈動した血液を観察する必要があります。シリンジを保持する手の安定性の喪失と、シリンジプランジャーを進めている間の針の位置の変化は、潜在的な問題です。内部に色付きのハブを備えた注射器は、血液の脈動を簡単に見ることができます。針を挿入したときに針ハブに気泡が現れた場合(肺への誤挿入を示している)、針を取り外して、再配置後に再度挿入する必要があります。針ハブに赤血球パルスがないが、注射する人が注射部位が正しいと確信している場合は、シリンジプランジャーを少し引いて心室への注射を確認します。癌細胞注射の2〜3週間後の転移の欠如は、誤注射を示します。注射後24時間以内に生物発光イメージングにより全身のがん細胞循環を確認20.生物発光シグナル伝達は、癌細胞が心室に正確に注入された場合、全身に見られる可能性があります。さらに、転移率、位置、および転移性腫瘍の数は、異なる細胞株8、21において異なり得る。
手術後、マウスは定期的にチェックする必要があります。手術と麻酔薬の曝露により、マウスは重大な苦痛を経験したり、死亡することさえあります。したがって、手術後の最初の週は重要であり、マウスを注意深く監視する必要があります。骨転移実験を通して、マウスの活動レベル、可動性、および悪液質の発症(体重減少、筋萎縮と脱力感、アーチ型の外観、および無気力を特徴とするマウスの腫瘍随伴症候群)の変化について毎日監視する必要があります22,23)。マウスは、体重の10%〜20%が失われたときに安楽死させる必要があります。腫瘍の進行は可動性を損ないます(例えば、長い骨折、頭の傾き、対麻痺)。またはマウスは呼吸困難にあるように見える24。
このモデルの利点は、骨内で検出された癌細胞が「土壌に播種」25し、したがって、播種性癌細胞の微小転移形成のより自然な進行を再現することである。このモデルにはいくつかの制限もあります。免疫不全マウスを用いた異種移植癌モデルです。このモデルは、骨転移微小環境における癌細胞と免疫細胞との相互作用を研究するのに有益ではありません。マウスの約30%がモデリング中に死亡すると推定されています。したがって、実践はモデル開発の成功率を大幅に向上させます。さらに、転移病変は脳、肺、腎臓にも発生する可能性があります。多発性転移の形成は、骨転移メカニズムの研究を妨げる9,26,27,28。骨転移率は同所性注射よりも心臓内注射の方がはるかに高いが、心臓内注入法では100%ではなく約75%の骨転移率を示す9,14。効率が低いのは、注射された癌細胞が血液循環に入ることができなかったか、針が心臓または肺を突き刺したために心臓注射中にレシピエントマウスが死亡したためである可能性があります。
これらの制限にもかかわらず、前立腺癌骨転移のこの確立されたマウスモデルは、骨と癌のクロストークを研究し、癌の進行を防ぎ、転移誘発性骨破壊のサイクルを混乱させるための潜在的な治療法を評価するための優れたツールであることが証明されています。
開示事項
すべての著者は、競合する経済的利益を宣言していません。
謝辞
この研究は、中国の国家重点研究開発プログラム(2018YFC1704300および2020YFE0201600)、国家自然科学財団(81973877および82174408)、上海中医薬大学の予算内の研究プロジェクト(2021LK047)、および病院TCM準備の産業変革の上海共同イノベーションセンターからの助成金によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL syringes and needles | Shandong Weigao Group Medical Polymer Co., Ltd | 20200411 | The cells were injected into the ventricles of mice |
| Anesthesia machine | Shenzhen RWD Life Technology Co., Ltd | R500IP | Equipment for anesthetizing mice |
| Automatic cell counter | Shanghai Simo Biological Technology Co., Ltd | IC1000 | For counting cells |
| BALB/c athymic mice | Shanghai SLAC Laboratory Animal Co, Ltd. | Male | 6-8 week old, male mice |
| Bioluminescence imaging system | Shanghai Baitai Technology Co., Ltd | Vieworks | For tracking the tumor growth and pulmonary metastasis if the injected cells are labeled by luciferase |
| Centrifuge tube (15 mL, 50 mL) | Shanghai YueNian Biotechnology Co., Ltd | 430790, Corning | |
| EDTA solution | Wuhan Xavier Biotechnology Co., Ltd | G1105 | For decalcification of bone tissure |
| F-12 medium | Shanghai YueNian Biotechnology Co., Ltd | 21700075, GIBCO | Cell culture medium |
| Formalin solution | Shanghai YueNian Biotechnology Co., Ltd | BL539A | For fixing the specimen of each mouse |
| Isoflurane | Shenzhen RWD Life Technology Co., Ltd | VETEASY | For anesthesia |
| Lipofectamine 2000 | Shanghai YueNian Biotechnology Co., Ltd | 11668027, Thermo fisher | Plasmid transfection reagent |
| PC-3 cell line | Cell Bank of Chinese Academy of Sciences | TCHu 158 | Prostate cancer cell line |
| Phosphate-buffered saline | Beyotime Biotechnology | ST447 | Wash the human osteosarcoma cells |
| Trypsin (0.25%) | Shanghai YueNian Biotechnology Co., Ltd | 25200056, Gibco | For detaching the cells |
| Vector (pLV-luciferase) | Shanghai YueNian Biotechnology Co., Ltd | VL3613 | Plasmid for transfection |
| X-ray imaging system | Brook (Beijing) Technology Co., Ltd | FX PRO | For obtaining x-ray images to detect tumor growth |
| μCT80 | Shenzhen Fraun Technology Service Co., Ltd | Scanco Medical AG,Switzerland | For detection of bone destruction. The mico-CT is equipped with 3DCalc, cone reconstruction, and μCT Ray V3.4A model visualization software. |
参考文献
- Siegel, R. L., Miller, K. D., Fuchs, H. E., Jemal, A. Cancer Cancerstatistics, 2021. CA: A Cancer Journal for Clinicians. 71 (1), 7-33 (2021).
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 71 (3), 209-249 (2021).
- Coleman, R. E. Skeletal complications of malignancy. Cancer. 80, 1588-1594 (1997).
- Macedo, F., et al. Bone metastases: An overview. Oncology Reviews. 11 (1), 321 (2017).
- Rea, D., et al. Mouse models in prostate cancer translational research: From xenograft to PDX. BioMed Research International. 2016, 9750795 (2016).
- Zhang, Y., et al. Real-time GFP intravital imaging of the differences in cellular and angiogenic behavior of subcutaneous and orthotopic nude-mouse models of human PC-3 prostate cancer. Journal of Cellular Biochemistry. 117 (11), 2546-2551 (2016).
- Stephenson, R. A., et al. Metastatic model for human prostate cancer using orthotopic implantation in nude mice. Journal of the National Cancer Institute. 84 (12), 951-957 (1992).
- Simmons, J. K., et al. Animal models of bone metastasis. Veterinary Pathology. 52 (5), 827-841 (2015).
- Jenkins, D. E., Hornig, Y. S., Oei, Y., Dusich, J., Purchio, T. Bioluminescent human breast cancer cell lines that permit rapid and sensitive in vivo detection of mammary tumors and multiple metastases in immune deficient mice. Breast Cancer Research: BCR. 7 (4), 444-454 (2005).
- Corey, E., et al. Establishment and characterization of osseous prostate cancer models: intra-tibial injection of human prostate cancer cells. The Prostate. 52 (1), 20-33 (2002).
- Andersen, C., Bagi, C. M., Adams, S. W. Intra-tibial injection of human prostate cancer cell line CWR22 elicits osteoblastic response in immunodeficient rats. Journal of Musculoskeletal & Neuronal Interactions. 3 (2), 148-155 (2003).
- Sudhan, D. R., Pampo, C., Rice, L., Siemann, D. W. Cathepsin L inactivation leads to multimodal inhibition of prostate cancer cell dissemination in a preclinical bone metastasis model. International Journal of Cancer. 138 (11), 2665-2677 (2016).
- Jinnah, A. H., Zacks, B. C., Gwam, C. U., Kerr, B. A. Emerging and established models of bone metastasis. Cancers. 10 (6), 176 (2018).
- Simmons, J. K., et al. Canine prostate cancer cell line (Probasco) produces osteoblastic metastases in vivo. The Prostate. 74 (13), 1251-1265 (2014).
- Lamar, J. M., et al. SRC tyrosine kinase activates the YAP/TAZ axis and thereby drives tumor growth and metastasis. The Journal of Biological Chemistry. 294 (7), 2302-2317 (2019).
- Chang, J., et al. Matrine inhibits prostate cancer via activation of the unfolded protein response/endoplasmic reticulum stress signaling and reversal of epithelial to mesenchymal transition. Molecular Medicine Reports. 18 (1), 945-957 (2018).
- Arguello, F., Baggs, R. B., Frantz, C. N. A murine model of experimental metastasis to bone and bone marrow. Cancer Research. 48 (23), 6876-6881 (1988).
- Brylka, L., et al. Spine Metastases in immunocompromised mice after intracardiac injection of MDA-MB-231-SCP2 breast cancer cells. Cancers. 14 (3), 556 (2022).
- Rahman, M. M., Veigas, J. M., Williams, P. J., Fernandes, G. DHA is a more potent inhibitor of breast cancer metastasis to bone and related osteolysis than EPA. Breast Cancer Research and Treatment. 141 (3), 341-352 (2013).
- Park, S. I., Kim, S. J., McCauley, L. K., Gallick, G. E. Pre-clinical mouse models of human prostate cancer and their utility in drug discovery. Current Protocols in Pharmacology. , (2010).
- Wright, L. E., et al. Murine models of breast cancer bone metastasis. BoneKEy Reports. 5, 804 (2016).
- Fearon, K. C., Glass, D. J., Guttridge, D. C. Cancer cachexia: mediators, signaling, and metabolic pathways. Cell Metabolism. 16 (2), 153-166 (2012).
- Waning, D. L., et al. Excess TGF-β mediates muscle weakness associated with bone metastases in mice. Nature Medicine. 21 (11), 1262-1271 (2015).
- Talbot, S. R., et al. Defining body-weight reduction as a humane endpoint: a critical appraisal. Laboratory Animals. 54 (1), 99-110 (2020).
- Paget, S. The distribution of secondary growths in cancer of the breast. Cancer Metastasis Reviews. 8 (2), 98-101 (1989).
- Yin, J. J., et al. TGF-beta signaling blockade inhibits PTHrP secretion by breast cancer cells and bone metastases development. The Journal of Clinical Investigation. 103 (2), 197-206 (1999).
- Schneider, A., et al. turnover mediates preferential localization of prostate cancer in the skeleton. Endocrinology. 146 (4), 1727-1736 (2005).
- Padalecki, S. S., et al. Chromosome 18 suppresses prostate cancer metastases. Urologic Oncology. 21 (5), 366-373 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved