Method Article
Стерилизация низкими дозами гамма-излучения для децеллюляризированных трансплантатов трахеи
В этой статье
Резюме
Получение стерилизации имеет важное значение для трансплантации тканей трахеи. Здесь мы представляем протокол стерилизации с использованием низких доз гамма-облучения, которые полностью переносятся органами.
Аннотация
Одним из основных ключевых аспектов обеспечения правильного развития трансплантата является стерильность среды. Децеллюлярная трансплантация трахеи включает имплантацию органа, который изначально находился в контакте с окружающей средой, поэтому не был стерильным с самого начала. Несмотря на то, что протокол децеллюляризации (через экспозицию моющего средства [2% додецилсульфата натрия], непрерывное перемешивание и осмотические шоки) проводится в соответствии с асептическими мерами, он не обеспечивает стерилизацию. Поэтому одной из основных задач является обеспечение стерильности перед имплантацией in vivo . Несмотря на то, что существуют установленные протоколы стерилизации гамма-излучением для неорганических материалов, для органических материалов таких мер не существует. Кроме того, протоколы, действующие для неорганических материалов, не могут быть применены к органическим материалам, так как установленная доза облучения (25 кГр) полностью разрушит имплантат. В данной работе изучается влияние повышенной дозы облучения на децеллюляризированную трахею кролика. Мы поддерживали диапазон доз (кГр) и тестировали повышенные дозы, пока не нашли минимальную дозу, при которой достигается стерилизация. После определения дозы мы изучили его влияние на орган как гистологически, так и биомеханически. Мы определили, что, хотя 0,5 кГр не достигали стерильности, дозы как 1 кГр, так и 2 кГр достигали бесплодия, при этом 1 кГр, следовательно, является минимальной дозой, необходимой для достижения стерилизации. Микроскопические исследования не показали существенных изменений по сравнению с нестерилизованными органами. Осевые биомеханические характеристики вообще не изменялись, и наблюдалось лишь незначительное снижение силы на единицу длины, которую орган может радиально переносить. Таким образом, мы можем сделать вывод, что 1 кГр обеспечивает полную стерилизацию децеллюляризованной трахеи кролика с минимальным, если таковые имеются, воздействием на орган.
Введение
Стерилизация имплантата является основным условием его жизнеспособности; Фактически, протезы, которые доказали свою эффективность, - это те, которые имплантированы в стерильные области (кровеносные сосуды, сердце, кости и т. Д.) 1. Трахея имеет две поверхности: поверхность, контактирующую с внешней средой, которая поэтому не стерильна, и поверхность средостения, которая стерильна. Поэтому с момента извлечения трахеи она не является стерильным органом. Несмотря на то, что последующий процесс децеллюляризации проводится в максимально стерильных условиях, он не является этапомстерилизации 2. Имплантация инородного материала сама по себе влечет за собой риск инфицирования из-за пробактериального микроокружения,которое он производит3, и риск передачи заболевания от донора к реципиенту до 0,014%, даже если материал был стерилизован4. Чтобы обеспечить правильную васкуляризацию трахеи, практически во всех экспериментальных протоколах трансплантации, она сначала подвергается гетеротопическому имплантату 5,6,7 в стерильную область (мышцы, фасции, сальники, подкожные и т.д.); Это связано с тем, что имплантация нестерильного элемента в эту среду приведет к инфицированию области3.
Существует ряд возможных стратегий получения стерильного имплантата. С помощью сверхкритическогоСО2достигнута терминальная стерилизация 8,9. Другие методы, такие как ультрафиолетовое излучение или обработка такими веществами, как надуксусная кислота, этанол, перекись кислорода и электролизованная вода, получили различные показатели успеха в стерилизации, почти всегда в зависимости от их дозировок, но было показано, что они влияют на биомеханические характеристики имплантатов. Действительно, некоторые вещества, такие как окись этилена, могут существенно изменять структуру имплантированного матрикса и даже могут вызывать нежелательные иммуногенные эффекты. По этой причине многие из этих стратегий не могут быть применены к биологическим моделям 2,10,11,12,13.
Наиболее широко изученной и принятой стратегией стерилизации является стратегия, установленная стандартом ISO 11737-1:2006 для стерилизации медицинских изделий, имплантированных человеку, с дозой гамма-излучения 25 кГр. Однако это правило фокусируется только на стерилизации инертных, небиологических элементов14,15. Кроме того, дозы лучевой терапии при радикальном лечении карциномы на три порядка ниже, чем те, которые используются для стерилизации медицинских изделий1. Имея это в виду, мы можем сделать вывод, что указанная доза не только убьет микробиоту, но также разрушит и радикально изменит биологическую структуру имплантата. Существует также вероятность того, что при деградации будут образовываться остаточные липиды, которые потенциально могут быть цитотоксичными и ускорять ферментативную деградацию каркаса 13,14,15,16,17 даже при использовании доз всего 1,9 кГр и с повреждением, прямо пропорциональным полученной дозе облучения 17.
Таким образом, цель данной работы состоит в том, чтобы попытаться определить дозу облучения, позволяющую получить стерильный имплантат с минимальными вредными эффектами, вызванными облучением 2,18,19. Стратегия, которой мы следовали, включала облучение децеллюляризированных и облученных трахей в различных повышенных дозах в диапазоне килогрей (0,5, 1, 2, 3 кГр и т. д.) до достижения отрицательного результата. Дополнительные тесты были проведены для тех доз, которые достигли отрицательных культур, чтобы подтвердить стерилизацию. После определения минимальной дозы для получения стерилизации проверяли структурное и биомеханическое воздействие облучения на трахею. Все показатели сравнивались с контрольной нативной трахеей кролика. Затем стерилизация конструкции была протестирована in vivo путем имплантации трахеи новозеландским белым кроликам.
протокол
Европейская директива 20170/63/ЕС по уходу за лабораторными животными и их использованию была соблюдена, и протокол исследования был одобрен Комитетом по этике Университета Валенсии (Закон 86/609/EEC и 214/1997 и Кодекс 2018/VSC/PEA/0122 Тип 2 правительства Валенсии, Испания).
1. Децеллюляризация трахеи
ПРИМЕЧАНИЕ: О методе децеллюляризации сообщалось в другом месте20.
- Усыпляют донорского самца взрослого новозеландского белого кролика (Oryctolagus cuniculus) весом 3,5-4,1 кг с 133 мг / кг пентобарбитала натрия, используя инъекцию 200 мг / мл через вену краевого уха.
- Обеспечивая асептические условия, выполните центральную продольную цервикотомию, рассеките шейные мышцы и подойдите к трахее. Рассекают орган по окружности и продольно. Наконец, сделайте разрез под первым кольцом и чуть выше киля.
- Скальпелем разрезайте трахеи на кусочки по 2 см. С помощью ножниц удалите окружающую соединительную ткань и внутренний слойслизистой оболочки 6.
- Погрузите образцы в 12 мл фосфатного солевого буфера (PBS), содержащего 2% додецилсульфата натрия (SDS), 5% пенициллина-стрептомицина и 5% амфотерицина B.
- Подвергайте трахеи постоянному перемешиванию магнитной мешалкой при 400 об/мин в течение 5 недель при комнатной температуре. Замените раствор децеллюляризации еженедельно после 2-часового осмотического шока, путем погружения трахеи в дистиллированную воду.
- Криогенизируют образцы, используя 12 мл смеси 80% фетальной бычьей сыворотки (FBS) и 20% диметилсульфоксида (ДМСО) в морозильном контейнере при -80 °C.
- Когда трахеи будут использоваться (через 13-15 дней), разморозьте их на водяной бане при 37 ° C и промойте, погрузив в PBS после завершения оттаивания.
2. Стерилизация
- Облучение
- Поместите партии по четыре кусочка трахеи размером 2 см каждый в 20 мл метакрилата в колбу для культуры T25, заполненную PBS, до тех пор, пока не будет достигнут общий объем 30 мл. Следите за тем, чтобы не образовывались пузырьки, которые могут вызвать диффузию энергии на границе раздела воздух-жидкость.
- Проводят облучение с помощью линейного ускорителя, фотонами номинальной энергии 10 МВ сплющивая бесфильтрующие пучки. Мощность дозы составляет 2 400 единиц монитора в минуту в изоцентре, размещая трахеи на расстоянии 100 см от поверхности источника, подлежащего облучению, с глубиной резкости 2,5 см для поля излучения 10 см х 10 см, чтобы покрыть весь контейнер, что соответствует дозе 24 Гр/мин.
- Увеличивайте дозы с каждой партией из четырех частей; четыре штуки будут подвергаться воздействию 0,5 кГр, четыре - 1 кГр, четыре - 2 кГ и т. д. до тех пор, пока не будет достигнута стерилизация.
- Культура
- Введите кусочки в 30 мл модифицированной среды орла (DMEM) Дульбекко с инактивированным 10% FBS без антибиотиков или противогрибковых препаратов.
- Культивируйте их в стандартном тканевом инкубаторе при 37 ° C и 5% CO 2 в течение2 недель и осматривайте каждые 24 часа.
ПРИМЕЧАНИЕ: Параметрами загрязнения являются изменения рН питательной среды и, соответственно, изменения цвета и мутности среды. Трахеи были собраны у зайцеобразных без микробов, которые не болели и, таким образом, ожидали, что в их трахях не будет анаэробных бактерий.
3. Гистологический анализ
ПРИМЕЧАНИЕ: Окрашивайте кусочки гематоксилином и эозином21, трихромом Массона и орцеином22.
- Окрашивание DAPI
- Определяют жизнеспособность тканей с помощью DAPI (4',6-диамидино-2-фенилиндол). Это сине-флуоресцентное окрашивание прочно связывается с богатыми аденином и тимином областями в последовательностях ДНК и, следовательно, позволяет просматривать ДНК с помощью флуоресцентной микроскопии.
- Поместите образцы тканей в смесь с оптимальной температурой резки (OCT).
- Вырежьте образцы с помощью криостата.
- Трижды промойте окрашиваемый образец в дистиллированной воде, чтобы удалить OCT. Поместите в монтажную среду, содержащую раствор DAPI с массой 30 нМ.
- Визуализируйте флуоресценцию с помощью флуоресцентной микроскопии.
- Анализ содержимого ДНК
- Разрезают сегменты трахеи длиной примерно 3 мм с помощью скальпеля.
- Инкубировать в течение 2 ч в протеиназе К (таблица материалов).
- Извлеките ДНК с помощью набора для экстракции ДНК, следуя инструкциям производителя.
- С помощью спектрофотометрии определяют концентрацию ДНК, измеряя поглощение на уровне 260/280 с помощью спектрофотометра.
- Измерьте размер извлеченных образцов ДНК с помощью капиллярной хроматографии с биоанализатором.
4. Биомеханическое исследование
ПРИМЕЧАНИЕ: Сопротивление трахеи продольным и поперечным усилиям измеряется с помощью испытаний на осевое растяжение и радиальное сжатие23.
- Измерение трахеи
- Измерьте длину трахеи, толщину стенки и внешний диаметр с помощью штангенциркуля.
- Рассчитайте средние значения из трех случайных измерений каждой из переменных.
- В испытаниях на радиальное сжатие вычисляют переднезадний диаметр, определяя точку, в которой пластина вступает в контакт с образцом.
- Выполняйте все тесты при комнатной температуре.
- Испытания на растяжение
- Проводите испытания на растяжение на тяговой настольной универсальной испытательной машине (UTM) контроля перемещения, оснащенной нагрузкой 100 Н (разрешение по усилию 0,1 Н, положение 0,001 мм и 0,1 с). Испытательная машина оснащена датчиками силы и положения и подключена к компьютеру с программным обеспечением, специально разработанным производителем23.
- Записывайте данные каждые 0,4 с и экспортируйте их в электронную таблицу.
- Сконструируйте растягивающие челюсти, адаптированные к среднему калибру трахеи кролика, из чистых монослойных нетоксичных кристаллических поливинилхлоридных (ПВХ) полых трубок с внешним диаметром 1 см и толщиной стенки 1,5 мм.
- Разделите провод на сегменты длиной 3 см.
- Просверлите 12 предварительно сформированных отверстий для терминотерминального шва, на расстоянии 2 мм от края челюстей и разделенных расстоянием 2,5 мм, чтобы предотвратить смещение из-за швов.
- Прикрепите стеклянные трубки из ПВХ к трахее кролика с помощью терминально-терминального анастомоза с непрерывным швом через чередующиеся предварительно сформированные отверстия (через каждые 5 мм), на расстоянии 2 мм от края трахеи и с помощью нейлонового монофиламентного шва 6-0.
- Растяните все детали со скоростью смещения 5,0 мм/мин.
- Запишите переменные максимальное напряжение (σ max, в Н/мм2) и деформацию (εmax, без единиц), а также энергию, запасенную на единицу объема трахеи (Вт/об, в мДж/мм), и модуль Юнга (E, в МПа).
- Испытания на радиальное сжатие
- Проведите испытания на радиальное сжатие на настольном компрессионном UTM, оснащенном тензодатчиком мощностью 15 Н (разрешение по усилию 0,001 Н, положение 0,001 мм и время 0,1 с), чтобы получить данные о силе (Н), положении (мм) и времени (с). Записывайте данные и экспортируйте их в электронную таблицу с интервалом 0,5 с.
- Поместите трахеи так, чтобы перепончатая область опиралась на нижнюю пластину. Пластина постепенно поднимается вверх к верхней пластине с постоянной скоростью 5 мм/мин.
- Рассчитайте каждую единицу на единицу длины образца (f в Н/мм), жесткость (R в МПа·мм) и энергию на единицу площади поверхности (Вт / С в мДж/мм2), необходимые для полной закупорки трахеи.
5. Хирургическая техника
ПРИМЕЧАНИЕ: О хирургической технике широко сообщалось в других местах20.
- Установите стерильный внутрипросветный стент из ПВХ размером 14 Fr (что позволяет ему свободно скользить, не сдавливая стенки), с запасом 3-4 мм на каждом конце.
- Зафиксируйте стент одним нейлоновым монофиламентным швом 6-0 через межхрящевое пространство первого хряща.
- Приступают к обезболиванию кроликов.
- Предварительно обработайте испытуемых (3,65-4,05 кг самцов новозеландских белых кроликов) внутримышечными анальгетиками (35 мг/кг кетамина) с седативным, миорелаксантным и обезболивающим (2,5 мг/кг ксилазина).
- Вырежьте зону разреза из операционной зоны и очистите операционную область, чтобы удалить волосы.
- Вводите анальгетики плюс антибиотикопрофилактику: 0,05 мг/кг внутримышечного бупренорфина и 10 мг/кг энрофлоксацина.
- Поместите венозный катетер в краевую ушную вену каждого кролика.
- Индукционная анестезия внутривенным болюсом пропофола 10 мг/кг.
- Контролируйте жизненные показатели животного с помощью электрокардиограммы в трех отведениях, пульсоксиметрии и неинвазивного измерения давления. Каждые 30 минут наносите физиологическую сыворотку на глаза, чтобы предотвратить сухость под наркозом.
- Проверьте плоскость анестезии, используя метод защемления пальцев ног.
- Поддерживайте анестезию ингаляционным изофлураном на уровне 1,5%-2% от минимальной альвеолярной концентрации без потери самопроизвольной вентиляции и обеспечьте тепловую поддержку кролику грелкой.
- Продезинфицируйте зону разреза несколько раз круговыми движениями скрабом на основе йода. В асептических условиях всегда и со стерильным материалом сделайте продольный разрез центральной грудной клетки длиной 3 см и соберите двусторонние лоскуты на ножках, состоящие из грудной фасции и мышечного компонента.
- Оберните трахеи лоскутом у четырех кроликов, по одному на каждую гемиторакс (таким образом, всего трахеи восемь).
- Когда операция будет завершена, отмените анестезию, прервав введение изофлурана.
- Послеоперационный период
- Держите животных в операционной до тех пор, пока они полностью не оправятся от наркоза. Когда они полностью выздоровеют, верните их в среду обитания вместе с другими кроликами.
- Лечить кроликов антибиотиками (0,5 мл/кг 2,5% энрофлоксацина) и анальгетиками (5 мг/мл мелоксикама; 0,05 мл/кг метакама) каждые 24 ч в течение 5 дней.
- Оставьте имплантаты на месте на желаемое время.
- Перед эвтаназией предварительно обработайте кроликов внутримышечными анальгетиками (35 мг / кг кетамина) и седативным, миорелаксантным и обезболивающим (2,5 мг / кг ксилазина). Затем усыпьте кроликов 133 мг / кг пентобарбитала натрия с помощью инъекции 200 мг / мл через маргинальную ушную вену и собирайте трахеи.
- Проведите биомеханические и гистологические исследования трахеи.
6. Статистический анализ
- Настройте все модели байесовским методом на программном обеспечении R, версия 3.5.3 R Core (R Foundation for Statistical Computing. 2019).
- Проанализируйте исследуемые переменные, кроме f и R, используя несколько моделей линейной регрессии.
- Для переменных f и R примените смешанные модели линейной регрессии. В этих моделях, в дополнение к интересующим переменным, связанным с лечением и состоянием каждой трахеи, вводят процент окклюзии как монотонный эффект и независимый член на трахею в качестве случайного фактора.
Результаты
Децеллюляризация
Окрашивание DAPI показывает отсутствие ДНК, и ни в одной из трахей не было обнаружено значений ДНК выше 50 нг с помощью электрофореза, при этом все фрагменты были меньше 200.н.20.
Микробная культура
Две из восьми частей, подвергнутых воздействию 0,5 кГр, показали изменение цвета менее чем за 1 неделю. Ни один из фрагментов, облученных при 1 кГр и 2 кГр, не показал каких-либо изменений цвета (рис. 1).
Гистологический анализ
Никаких изменений в структуре распределения коллагена или эластичных волокон не было обнаружено ни в одном из проанализированных образцов (рис. 2).
Определение дозы облучения
Учитывая описанные выше результаты, которые показали, что облучение при 0,5 кГр не обеспечивало стерилизацию образца, в то время как дозы 1 кГр и 2 кГр обеспечивали, мы установили минимально возможную дозу облучения для достижения стерилизации ткани как 1 кГр. Поэтому мы проверили биомеханическое воздействие этой дозы на трахеи 2,17,23.
Биомеханическое исследование
Испытания на осевое растяжение
Данные, полученные при испытании на растяжение облученных трахей, приведены в таблице 1. На рисунке 3 показаны соответствующие кривые напряжения-деформации и точки разрыва.
Таким образом, подвергание кусочков трахеи гамма-облучению в целях стерилизации, несмотря на незначительное увеличение обнаруженных значений, не оказывает существенного влияния на осевые биомеханические характеристики органов. Следовательно, оба σмаксимума, который могут переносить трахеи (0,05 МПа; ДИ [-0,046, 0,144] МПа), а также ε max (0,096 ДИ [-0,096, 0,281]), (0,022 МПа); ДИ [-0,23, 0,274] МПа) и Вт/об. (от 0,044 мДж/мм3; ДИ [-0,018, 0,106] мДж/мм3), очень незначительно увеличены в этой выборке, но ни в коем случае не применимы к популяционной оценке.
Испытания на радиальное сжатие
Компрессионные тесты, выполненные как на нативных трахеях (контроль), так и на децеллюляризированных, криоконсервированных и облученных трахеях, показаны в таблице 2. Соответствующие графики можно увидеть на рисунке 4.
Гамма-облучение вызывает лишь минимальное, но значительное снижение радиальных биомеханических характеристик при переменной силе на единицу длины, которая изменяется на -0,017 Н/мм; ДИ [-0,042, -0,004] Н/ мм, в то время как минимальные вариации обнаружены в Вт/об . (0,044 мДж/мм3; CI [-0,018, 0,106] мДж/мм3), R (-0,018 МПа · мм; CI [-0,145, 0,083] МПа · мм) и W/ S (-0,081 мДж/мм2; ДИ [-0,95, 0,74] мДж/мм2), ни в коем случае не применимы к оценке численности населения (рис. 5).
Имплантировать
Макроскопическое исследование
Ни у одного из животных не было воспалительных или инфекционных симптомов в послеоперационном периоде; Их диета была восстановлена, как и планировалось, а прием антибиотиков и анальгетиков был приостановлен на пятый день. При эвтаназии интеграция трахеи и лоскута наблюдалась макроскопически, без видимых признаков воспаления.
Гистологическое исследование
Гистологическое исследование показало, что лоскут образует высокоорганизованную соединительную ткань - тесно связанную с кольцами трахеи, демонстрирующую преемственность между ними и тканью - в виде надхрящницы нативной трахеи. Хрящ был цел и не имел признаков некроза. Кроме того, наблюдалось присутствие макрофагов и некоторых изолированных гигантских клеток, образующих листы. Помимо редкого присутствия эозинофилов, наблюдалась обычная послеоперационная легкая острая воспалительная клеточная клетка (рис. 6). Начинающаяся неоваскуляризация также наблюдалась вокруг трахеи.
Биомеханическая оценка
После имплантации зайцеобразному характеристики трахеи остались неизменными, за исключением силы на единицу длины, которая восстановила характеристики нативной трахеи только через 2 недели после трансплантации (0,006 Н/мм, ДИ [-0,026, 0,04] Н/мм) (рис. 7).

Рисунок 1: Облученные трахеи при ДМЭМ без антибиотиков или противогрибковых препаратов. Цвет двух образцов слева (0,5 кГр) изменился, что указывает на изменение рН, и является косвенным признаком роста бактерий. Также наблюдается повышенная мутность у первого экземпляра слева. Два образца справа (1 кГр) не показывают изменения цвета. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
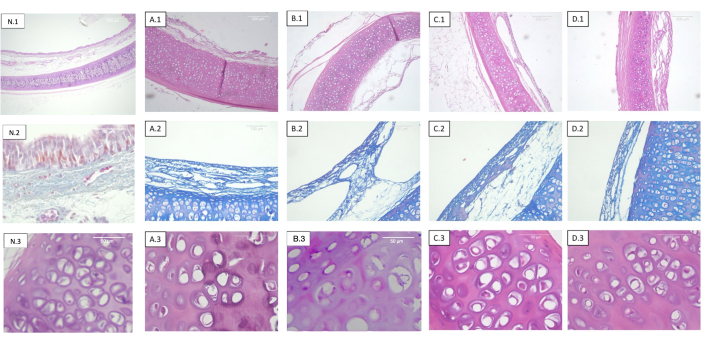
Рисунок 2: Трахеи децеллюляризируют и облучают в разных дозах. Каждая строка соответствует разному окрашиванию, а каждый столбец - разной дозировке стерилизации. 1) Гематоксилин-эозин. Панорамный вид на хрящ, слизистую оболочку, подслизистую оболочку и серозу. 2) Трихромное пятно Массона. Подслизистая оболочка трахеи. 3) Гематоксилин-эозин. Детальный вид хряща трахеи. (А) Необлученные трахеи (контроль). (B) Трахеи, облученные при 0,5 кГр. (C) Трахеи, облученные при 1 кГр. (D) Трахеи, облученные при 2 кГр. Наблюдается отсутствие объективных гистологических изменений относительно дозы облучения. Аббревиатура: N = нативная трахея. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Кривые напряжения-деформации для децеллюляризированных и облученных трахей. Предельная точка отмечена оранжевым цветом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
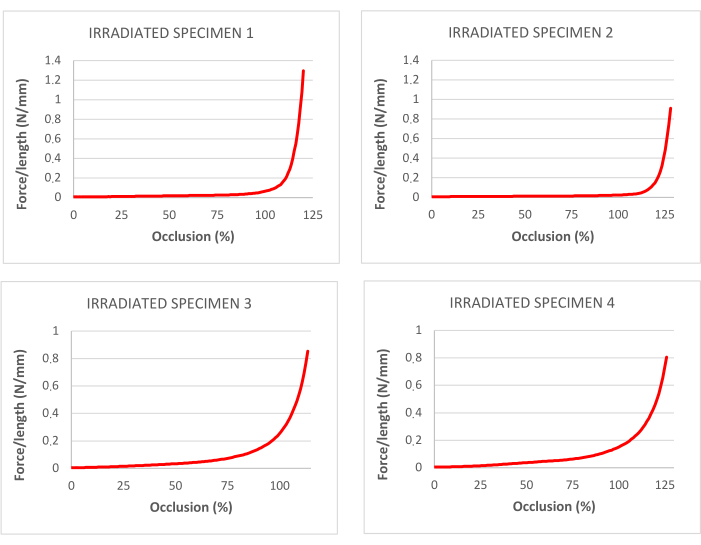
Рисунок 4: кривые процента окклюзии, соответствующие тракционным тестам в децеллюляризированных и облученных трахеях. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
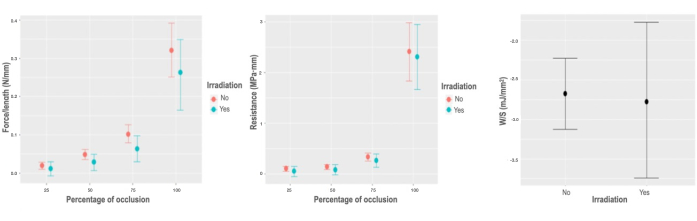
Рисунок 5: Биомеханическая реакция на облучение. (A) График предельных эффектов переменной силы на единицу длины в соответствии с процентом окклюзии радиационного взаимодействия. (B) График предельных эффектов переменной силы на единицу длины в зависимости от процента окклюзии радиационного взаимодействия. (C) График частичной зависимости модели накопленной энергии на единицу площади для переменной облучения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Вид имплантированной трахеи через 2 недели . (А) Трихромное окрашивание Массона. Наблюдается новоформенная соединительная ткань наружной поверхности трахеи, организованная в концентрические слои волокон и клеток. (Б) Гематоксилин-эозин. Панорамный вид на прекрасно сохранившийся хрящ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
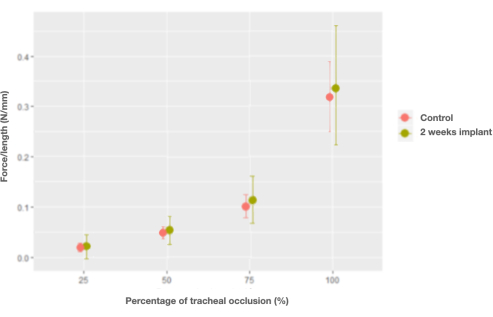
Рисунок 7: График предельных эффектов взаимодействия между силой на единицу длины и процентом окклюзии и контрольных (нативных) трахей по сравнению с имплантатами трахеи через 2 недели. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Испытания на растяжение облученных трахей. Контрольная часть - нативные трахеи кроликов. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 2: Компрессионные испытания облученных, децеллюляризированных трахей. Контрольная часть - нативные трахеи кроликов. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Существует несколько стратегий стерилизации. СверхкритическийСО2полностью проникает в ткани, подкисляя среду и деконструируя клеточный фосфолипидный бислой с простым удалением посредством разгерметизации имплантата 8,14,25. Ультрафиолетовое излучение также использовалось, и его эффективность в трахее грызунов была опубликована, хотя в литературе имеется всего несколько сообщений10. Другие используемые методы включают применение таких веществ, как надуксусная кислота, этанол, перекись кислорода или электролизованная вода, которые дали нерегулярные результаты и, как было показано, сильно влияют на ткани11,12. В отличие от вышеупомянутых стратегий, гамма-облучение не только показало свою полную эффективность с точки зрения стерилизации, но также было тщательно и обильно изучено как в отношении его дозы, так и в отношении стерилизующего эффекта. На самом деле, это было изучено настолько, что существует стандарт ISO для использования гамма-излучения при стерилизации, в котором доза для стерилизации инертного материала, имплантируемого человеку, установлена в 25 кГр13,14,15.
С другой стороны, в дополнение к стерилизации материала, было также показано, что облучение вызывает побочные эффекты в качестве ограничения метода. К ним относятся разрушение и изменение матриц путем денатурации белковых молекул, включая коллаген, и образования остаточных молекул, которые могут даже стать токсичными. Эта деградация структуры органа, следовательно, влияет как на его биологические, так и на биомеханические характеристики, при этом вредные эффекты облучения прямо пропорциональны его дозе и наблюдаются при относительно низких дозах 13,14,15,16,17. Таким образом, в данном случае цель была двоякой: с одной стороны, получить стерильную конструкцию для обеспечения жизнеспособности имплантата, а с другой стороны, сохранить биологические и биомеханические характеристики матрицы, поскольку имплантат был бы бесполезен, если бы оба не поддерживались26. Таким образом, задача состояла в том, чтобы выбрать стратегию, которая позволила бы найти баланс между успешной стерилизацией и сохранением структуры ткани.
При этом 1 кГр была установлена в качестве минимальной дозы для стерилизации. Гистологическое исследование показало, что эта доза облучения не оказывает никакого воздействия на ткани. Кроме того, биомеханическая характеристика облученных трахей определила, что использование облучения абсолютно не влияет на параметры тяги. Наблюдалось небольшое, но статистически значимое снижение силы на единицу длины, которое трахея смогла выдержать в испытаниях на радиальное сжатие, однако это не влияет на другие ее радиальные характеристики.
Хотя есть несколько работ, в которых обсуждается невозможность стерилизации и деструктурации, вызванной дозами всего 1,5 кГр 19, подавляющее большинство из них соответствует представленным данным 2,18,19. Таким образом, авторы отмечают, что стерилизация кости в дозах 10, 15, 20 и 25 кГр обеспечивает полную стерилизацию, хотя и в обмен на снижение инкубационной способности клеток и увеличение продуктов распада коллагена в дозах выше 15 кГр18. Доза 1,5 кГр не приводила к стерилизации в децеллюляризированных клапанах сердца, но вызывала повреждение механических качеств образцов как in vivo, так и in vitro; между тем, доза 3 кГр действительно достигала стерилизации, но вызывала деструктуризацию и фиброз19. Что касается трахеи, Johnson et al. сравнили эффекты стерилизации в дозе ISO 25 кГр с дозой 5 кГр. Обе дозы получили терминальную стерилизацию, при этом доза 5 кГр незначительно изменила структуру образца, а доза 25 кГр полностью разрушила трахею2.
Кроме того, эффективная стерилизация подтверждается благодаря отсутствию инфекционных явлений в отношении имплантата через 2 недели, при этом стерилизация полностью переносится органами. Кроме того, структура была полностью сохранена, без некроза или денатурации органа. Кроме того, в качестве дополнительного вывода было отмечено, что незначительное изменение биомеханических характеристик - до силы, которую трахея способна переносить на единицу длины, - вернулось к значениям нативной трахеи только через 2 недели после имплантации; Следовательно, этот эффект можно игнорировать в соответствии с окончательным управлением конструкцией.
Таким образом, в данной работе представлена возможность получения полностью стерильных органов в гораздо меньших дозах, чем рекомендуемая доза 25 кГр; предложение устраняет неполадки при стерилизации трахеи новозеландских кроликов дозой 1 кГр. Эта доза обеспечивает сохранение гистологических, ультраструктурных и биомеханических характеристик этих органов и демонстрирует идеальную переносимость имплантации. Ограничением исследования является то, что оно проводится только на стерилизованных трахеях кроликов, которые обычно требуют более низкой дозировки из-за меньшего размера; однако можно сделать вывод, что чрезмерно высокие показатели, установленные в стандарте ISO для инертных имплантатов, не являются необходимыми для стерилизации децеллюляризированных трахей, что является огромным достижением из-за значительного снижения вреда для ткани. Кроме того, в будущих исследованиях, в зависимости от животного и, следовательно, от размера его трахеи, эти дозы могут быть скорректированы до гораздо более низких доз, которые, следовательно, более уважительно относятся к структуре и функции органа.
Раскрытие информации
Ни у кого из авторов нет конфликта интересов.
Благодарности
Эта статья была поддержана грантом Испанского общества торакальной хирургии 2018 года для Национального многоцентрового исследования [номер 180101 присужден Нестору Х. Мартинесу-Эрнандесу] и PI16-01315 [присужден Мануэлю Мата-Роигу] Институтом спасения Карлоса III. CIBERER финансируется VI Национальным планом исследований и разработок на 2018-2011 гг., Iniciativa Ingenio 2010, Консолидированной программой, CIBER Actions и Instituto de Salud Carlos III при содействии Европейского фонда регионального развития.
Материалы
| Name | Company | Catalog Number | Comments |
| 6-0 nylon monofilament suture | Monosoft. Covidien; Mansfield, MA, USA | SN-5698G | |
| Amphotericin B 5% | Gibco Thermo Fisher Scientific; Waltham, MA USA | 15290018 | |
| Bioanalyzer | Agilent, Santa Clara, CA, USA | G2939BA | |
| Buprenorphine | Buprex. Reckitt Benckiser Healthcare; Hull, Reino Unido | N02AE01 | |
| Compression desktop UTM | Microtest, Madrid, Spain | EM1/10/FR | |
| Cryostate | Leyca CM3059, Leyca Biosystems, Wetzlar, Alemania | CM3059 | |
| DAPI (4',6-diamino-2-phenylindole) | DAPI. Sigma-Aldrich, Missouri, USA | D9542 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich; MO, USA | D2650 | |
| DMEM | Thermo Fisher Scientific; Waltham, MA, USA | 11965084 | |
| DNA extraction kit | DNeasy extraction kit Quiagen, Hilden, Germany | 4368814 | |
| Enrofloxacin, 2.5% | Boehringer Ingelheim, Ingelheim am Rhein, Germany | 0035-0002 | |
| Fetal bovine serum (FBS) | GE Healthcare Hyclone; Madrid, Spain | SH20898.03IR | |
| Fluorescence microscope | Leyca DM2500 (Leica, Wetzlar, Germany) | DM2500?? | |
| Freezing Container | Mr Frosty. Thermo Fisher; Madrid, Spain | 5100-0001 | |
| Isofluorane | Isoflo; Proyma Ganadera; Ciudad Real, Spain | 8.43603E+12 | |
| Ketamin | Imalgene. Merial; Toulouse, Francia | BOE127823 | |
| Linear accelerator | "True Beam". Varian, Palo Alto, California, USA | H191001 | |
| Magnetic stirrer | Orbital Shaker PSU-10i. Biosan; Riga, Letonia | BS-010144-AAN | |
| Meloxicam 5 mg/ml | Boehringer Ingelheim, Ingelheim am Rhein, Germany | 6283-MV | |
| OCT (Optimal Cutting Temperature Compound) | Fischer Scientific, Madrid, Spain | 12678646 | |
| Penicillin-streptomycin 5% | Gibco Thermo Fisher Scientific; Waltham, MA USA | 15140122 | |
| Pentobarbital sodium | Dolethal. Vetoquinol; Madrid, España | 3.60587E+12 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich; MO, USA | P2272 | |
| Propofol | Propofol Lipuro. B. Braun Melsungen AG; Melsungen, Alemania | G 151030 | |
| Proteinase K | Gibco Thermo Fisher Scientific; Waltham, Massachussetts, USA | S3020 | |
| PVC hollow tubes | Cristallo Extra; FITT, Sandrigo, Italy | hhdddyyZ | |
| PVC stent | ArgyleTM Medtronic; Istanbul, Turkey | 019 5305 1 | |
| R software, Version 3.5.3 R Core | R Foundation for Statistical Computing | R 3.5.3 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich; MO, USA | 8,17,034 | |
| Spectrophotometer | Nanodrop, Life Technologies; Isogen Life Science. Utrech, Netherlands | ND-ONEC-W | |
| Spreadsheet | Microsoft Excel for Mac, Version 16.23, Redmond, WA, USA | 2864993241 | |
| Traction Universal Testing Machine | Testing Machines, Veenendaal, Netherlands | 84-01 | |
| UTM Software | TestWorks 4, MTS Systems Corporation, Eden Prairie, MN, USA | 100-093-627 F | |
| VECTASHIELD Mounting Medium | Vector Labs, Burlingame; CA; USA | H-1000-10 | |
| Xylacine | Xilagesic. Calier; Barcelona, España | 20102-003 |
Ссылки
- Ch'ng, S., et al. Reconstruction of the (Crico)trachea for malignancy in the virgin and irradiated neck. Journal of Plastic, Reconstructive & Aesthetic Surgery. 65 (12), 1645-1653 (2012).
- Johnson, C. M., Guo, D. H., Ryals, S., Postma, G. N., Weinberger, P. M. The feasibility of gamma radiation sterilization for decellularized tracheal grafts. Laryngoscope. 127 (8), 258-264 (2017).
- de Donato, G., et al. Prosthesis infection: prevention and treatment. The Journal of Cardiovascular Surgery. 55 (6), 779-792 (2014).
- Vangsness, C. T., Dellamaggiora, R. D. Current safety sterilization and tissue banking issues for soft tissue allografts. Clinics in Sports Medicine. 28 (2), 183-189 (2009).
- Den Hondt, M., Vanaudenaerde, B. M., Delaere, P., Vranckx, J. J. Twenty years of experience with the rabbit model, a versatile model for tracheal transplantation research. Plastic and Aesthetic Research. 3 (7), 223-230 (2016).
- Hysi, I., et al. Successful orthotopic transplantation of short tracheal segments without immunosuppressive therapy. European Journal of Cardiothoracic Surgery. 47 (2), 54-61 (2015).
- Wurtz, A., et al. Tracheal reconstruction with a composite graft: Fascial flap-wrapped allogenic aorta with external cartilage-ring support. Interactive Cardiovascular and Thoracic Surgery. 16 (1), 37-43 (2013).
- White, A., Burns, D., Christensen, T. W. Effective terminal sterilization using supercritical carbon dioxide. Journal of Biotechnology. 123 (4), 504-515 (2006).
- Qiu, Q. Q., et al. Inactivation of bacterial spores and viruses in biological material using supercritical carbon dioxide with sterilant. Journal of Biomedical Materials Research. Part B, Applied Biomaterials. 91 (2), 572-578 (2009).
- Lange, P., et al. Pilot study of a novel vacuum-assisted method for decellularization of tracheae for clinical tissue engineering applications. Journal of Tissue Engineering and Regenerative Medicine. 11 (3), 800-811 (2017).
- Wedum, A. G., Hanel, E., Phillips, G. B. Ultraviolet sterilization in microbiological laboratories. Public Health Reports. 71 (4), 331-336 (1956).
- Hennessy, R. S., et al. Supercritical carbon dioxide-based sterilization of decellularized heart valves. JACC. Basic to Translational Science. 2 (1), 71-84 (2017).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Balestrini, J. L., et al. Sterilization of lung matrices by supercritical carbon dioxide. Tissue Engineering. Part C, Methods. 22 (3), 260-269 (2016).
- AENOR. UNE-EN. ISO 11737-1:2006. Esterilización de productos sanitarios. Métodos biológicos. Parte 1: Determinación de la población de microorganismos en los productos. AENOR. UNE-EN. , (2006).
- Uriarte, J. J., et al. Mechanical properties of acellular mouse lungs after sterilization by gamma irradiation. Journal of the Mechanical Behavior of Biomedical Materials. 40, 168-177 (2014).
- Sun, W. Q., Leung, P. Calorimetric study of extracellular tissue matrix degradation and instability after gamma irradiation. Acta Biomaterialia. 4 (4), 817-826 (2008).
- Nguyen, H., et al. Reducing the radiation sterilization dose improves mechanical and biological quality while retaining sterility assurance levels of bone allografts. Bone. 57 (1), 194-200 (2013).
- Helder, M. R. K., et al. Low-dose gamma irradiation of decellularized heart valves results in tissue injury in vitro and in vivo. The Annals of Thoracic Surgery. 101 (2), 667-674 (2016).
- Martínez-Hernández, N. J., et al. Decellularized tracheal prelamination implant: A proposed bilateral double organ technique. Artificial Organs. 45 (12), 1491-1500 (2021).
- Feldman, A. T., Wolfe, D. Tissue processing and hematoxylin and eosin staining. Methods in Molecular Biology. 1180, 31-43 (2014).
- López Caballero, J., Peña, M., De Federico, M. Coloraciones para fibras colágenas y elásticas del tejido conjuntivo. Coloraciones para sustancia amiloidea. Laboratorio de Anatomía Patologica. , 175-195 (1993).
- Martínez-Hernández, N. J., et al. A standardised approach to the biomechanical evaluation of tracheal grafts. Biomolecules. 11 (10), 1461 (2021).
- Kajbafzadeh, A. M., Javan-Farazmand, N., Monajemzadeh, M., Baghayee, A. Determining the optimal decellularization and sterilization protocol for preparing a tissue scaffold of a human-sized liver tissue. Tissue Engineering. Part C, Methods. 19 (8), 642-651 (2013).
- Wehmeyer, J. L., Natesan, S., Christy, R. J. Development of a sterile amniotic membrane tissue graft using supercritical carbon dioxide. Tissue Engineering. Part C, Methods. 21 (7), 649-659 (2015).
- Ross, E. A., et al. Mouse stem cells seeded into decellularized rat kidney scaffolds endothelialize and remodel basement membranes. Organogenesis. 8 (2), 49-55 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены