Method Article
Esterilización por radiación gamma de baja dosis para injertos traqueales descelularizados
En este artículo
Resumen
La esterilización es esencial para el trasplante de tejido traqueal. En este documento, presentamos un protocolo de esterilización utilizando irradiación gamma de baja dosis que es totalmente tolerada por los órganos.
Resumen
Uno de los principales aspectos clave para asegurar que un trasplante evoluciona correctamente es la esterilidad del medio. El trasplante traqueal descelularizado implica implantar un órgano que originalmente estaba en contacto con el medio ambiente, por lo que no es estéril desde el principio. Si bien el protocolo de descelularización (a través de la exposición con detergente [dodecil sulfato de sodio al 2%, agitación continua y choques osmóticos) se lleva a cabo de acuerdo con las medidas asépticas, no proporciona esterilización. Por lo tanto, uno de los principales desafíos es garantizar la esterilidad previa a la implantación in vivo . Aunque existen protocolos establecidos de esterilización por radiación gamma para materiales inorgánicos, no existen tales medidas para materiales orgánicos. Además, los protocolos establecidos para materiales inorgánicos no se pueden aplicar a materiales orgánicos, ya que la dosis de radiación establecida (25 kGy) destruiría completamente el implante. Este artículo estudia el efecto de una dosis de radiación escalada en una tráquea de conejo descelularizada. Mantuvimos el rango de dosis (kGy) y probamos las dosis escalonadas hasta encontrar la dosis mínima a la que se logra la esterilización. Después de determinar la dosis, estudiamos los efectos de la misma en el órgano, tanto histológica como biomecánicamente. Determinamos que mientras 0,5 kGy no alcanzaban la esterilidad, las dosis de 1 kGy y 2 kGy sí lo hacían, siendo 1 kGy, por lo tanto, la dosis mínima necesaria para lograr la esterilización. Los estudios microscópicos no mostraron cambios relevantes en comparación con los órganos no esterilizados. Las características biomecánicas axiales no se alteraron en absoluto, y solo se observó una ligera reducción en la fuerza por unidad de longitud que el órgano puede tolerar radialmente. Por lo tanto, podemos concluir que 1 kGy logra la esterilización completa de la tráquea de conejo descelularizada con un efecto mínimo, si es que tiene alguno, en el órgano.
Introducción
La esterilización de un implante es un requisito básico para su viabilidad; De hecho, las prótesis que han demostrado ser exitosas son aquellas implantadas en áreas estériles (vasos sanguíneos, corazón, hueso, etc.) 1. La tráquea tiene dos superficies: una superficie en contacto con el ambiente externo, que por lo tanto no es estéril, y una superficie hacia el mediastino, que es estéril. Por lo tanto, desde el momento en que se extrae la tráquea, no es un órgano estéril. A pesar de que el proceso de descelularización posterior se lleva a cabo en condiciones máximas estériles, no es una etapa de esterilización2. La implantación de material extraño en sí misma conlleva un riesgo de infección debido al microambiente probacteriano que produce3y un riesgo de transmisión de enfermedades del donante al receptor, incluso si el material ha sido esterilizado4. Para asegurar la correcta vascularización de la tráquea, en casi todos los protocolos experimentales de trasplante, primero se somete al implante heterotópico 5,6,7 en un área estéril (músculo, fascia, epiplón, subcutáneo, etc.); Esto se debe a que la implantación de un elemento no estéril en este medio conduciría a la infección del área3.
Hay una gama de estrategias posibles para obtener un implante estéril. El uso deCO2supercrítico ha logrado la esterilización terminal 8,9. Otros métodos, como la radiación ultravioleta o el tratamiento con sustancias como el ácido peracético, el etanol, el peróxido de oxígeno y el agua electrolizada, han obtenido diferentes tasas de éxito en la esterilización, casi siempre dependiendo de sus dosis, pero se ha demostrado que afectan a las características biomecánicas de los implantes. De hecho, algunas sustancias, como el óxido de etileno, pueden cambiar sustancialmente la estructura de la matriz implantada e incluso pueden causar efectos inmunogénicos indeseables. Por esta razón, muchas de estas estrategias no pueden ser aplicadas a modelos biológicos 2,10,11,12,13.
La estrategia de esterilización más estudiada y aceptada es la establecida por la norma ISO 11737-1:2006 para la esterilización de productos sanitarios implantados en humanos, con una dosis de radiación gamma de 25 kGy. Sin embargo, esta regulación se centra únicamente en la esterilización de elementos inertes no biológicos14,15. Además, las dosis de radioterapia en el tratamiento radical del carcinoma son tres órdenes de magnitud inferiores a las utilizadas para esterilizar dispositivos médicos1. Con esto en mente, podemos concluir que dicha dosis no solo mataría la microbiota, sino que también destruiría y alteraría radicalmente la estructura biológica del implante. También existe la posibilidad de que genere lípidos residuales tras la degradación, que potencialmente pueden ser citotóxicos y acelerar la degradación enzimática del andamio 13,14,15,16,17, incluso cuando se utilizan dosis tan bajas como 1,9 kGy y con daños directamente proporcionales a la dosis de radiación recibida 17.
Por lo tanto, el objetivo de este trabajo es tratar de identificar la dosis de radiación que permite obtener un implante estéril con mínimos efectos nocivos causados por la irradiación 2,18,19. La estrategia que seguimos consistió en la irradiación de tráqueas descelularizadas e irradiadas a diferentes dosis escalonadas dentro de un rango de kilograys (0,5, 1, 2, 3 kGy, etc.), hasta lograr un cultivo negativo. Se realizaron pruebas adicionales para aquellas dosis que lograron cultivos negativos, con el fin de confirmar la esterilización. Después de determinar la dosis mínima para obtener la esterilización, se verificó el impacto estructural y biomecánico de la irradiación en la tráquea. Todas las métricas se compararon con las tráqueas de conejo nativas de control. La esterilización de la construcción se probó in vivo mediante la implantación de las tráqueas en conejos blancos de Nueva Zelanda.
Protocolo
Se adhirió a la directiva europea 20170/63/UE para el cuidado y uso de animales de laboratorio y el protocolo de estudio fue aprobado por el Comité de Ética de la Universitat de València (Ley 86/609/CEE y 214/1997 y Código 2018/VSC/PEA/0122 Tipo 2 de la Generalitat Valenciana, España).
1. Descelularización traqueal
NOTA: El método de descelularización ha sido reportado en otra parte20.
- Eutanasia a conejos blancos adultos de Nueva Zelanda (Oryctolagus cuniculus) que pesan 3.5-4.1 kg con 133 mg/kg de pentobarbital sódico, usando una inyección de 200 mg/ml a través de la vena marginal del oído.
- Mientras asegura condiciones asépticas, realice una cervicotomía longitudinal central, diseccione los músculos cervicales y aborde la tráquea. Diseccionar el órgano circunferencial y longitudinalmente. Finalmente, transecto debajo del primer anillo y justo encima de la carina.
- Con un bisturí, secciona las tráqueas en trozos de 2 cm. Con unas tijeras, retire el tejido conectivo circundante y la capa interna de la mucosa6.
- Sumerja las muestras en 12 ml de solución salina tamponada con fosfato (PBS) que contenga 2% de dodecil sulfato de sodio (SDS), 5% de penicilina-estreptomicina y 5% de anfotericina B.
- Someter las tráqueas a agitación constante con un agitador magnético a 400 rpm durante 5 semanas a temperatura ambiente. Reemplazar la solución de descelularización semanalmente después de un choque osmótico de 2 h, mediante inmersión de la tráquea en agua destilada.
- Criogenizar las muestras utilizando una mezcla de 12 ml de suero bovino fetal al 80% (FBS) y 20% de dimetilsulfóxido (DMSO) en un recipiente de congelación a -80 °C.
- Cuando se vayan a utilizar las tráqueas (después de 13-15 días), descongelarlas en un baño maría a 37 °C y lavarlas sumergiéndolas en PBS después de que se complete la descongelación.
2. Esterilización
- Irradiación
- Colocar lotes de cuatro piezas traqueales de 2 cm cada una en un matraz de cultivo de 20 ml de metacrilato en T25 lleno de PBS hasta alcanzar un volumen total de 30 ml. Tenga cuidado de evitar que se formen burbujas, lo que podría causar la difusión de energía en la interfaz aire-líquido.
- Conducir la irradiación utilizando un acelerador lineal, con fotones de una energía nominal de 10 MV aplanando haces libres de filtro. Aplicar una tasa de dosis de 2.400 unidades monitoras por minuto en el isocentro, colocando las tráqueas a una distancia fuente-superficie de 100 cm a irradiar, con una profundidad de campo de 2,5 cm para un campo de radiación de 10 cm x 10 cm -de forma que cubra todo el recipiente- correspondiente a una dosis de 24 Gy/min.
- Aumente las dosis con cada lote de cuatro piezas; cuatro piezas se someterán a 0,5 kGy, cuatro a 1 kGy, cuatro a 2 kG, etc., hasta alcanzar la esterilización.
- Cultura
- Introducir las piezas en 30 mL del medio de Eagle modificado de Dulbecco (DMEM) con FBS inactivado al 10% sin antibióticos ni antifúngicos.
- Cultivarlos en una incubadora de tejidos estándar a 37 °C y 5% deCO2 durante 2 semanas e inspeccionarlos cada 24 h.
NOTA: Los parámetros de contaminación son cambios en el pH del medio de cultivo y, en consecuencia, cambios en el color y la turbidez del medio. Las tráqueas se cosecharon de lagomorfos libres de gérmenes, que no estaban enfermos y, por lo tanto, se esperaba que carecieran de bacterias anaeróbicas en sus tráqueas.
3. Análisis histológico
NOTA: Tiñe las piezas con hematoxilina y eosina21, tricrómico de Masson y orceína22.
- Tinción DAPI
- Determinar la viabilidad tisular utilizando DAPI (4′,6-diamidino-2-fenilindol). Esta tinción azul-fluorescente se une fuertemente a las regiones ricas en adenina y timina en las secuencias de ADN y, por lo tanto, permite que el ADN se vea mediante microscopía de fluorescencia.
- Incruste las muestras de tejido en un compuesto de temperatura de corte óptima (OCT).
- Corte las muestras con un criostato.
- Lave la muestra a teñir tres veces en agua destilada para eliminar el OCT. Coloque en un medio de montaje que incluya una solución de 30 nM de DAPI.
- Visualice la fluorescencia utilizando microscopía de fluorescencia.
- Análisis del contenido de ADN
- Corte segmentos de tráquea que midan aproximadamente 3 mm de largo con un bisturí.
- Incubar durante 2 h en proteinasa K (Tabla de materiales).
- Extraiga el ADN con un kit de extracción de ADN, siguiendo las instrucciones del fabricante.
- Mediante espectrofotometría, determinar la concentración de ADN midiendo la absorbancia a 260/280 utilizando un espectrofotómetro.
- Mida el tamaño de las muestras de ADN extraídas mediante cromatografía capilar con un bioanalizador.
4. Estudio biomecánico
NOTA: La resistencia traqueal a las fuerzas longitudinales y transversales se mide mediante ensayos de tracción axial y compresión radial23.
- Medición traqueal
- Mida la longitud traqueal, el grosor de la pared y el diámetro externo con una pinza Vernier.
- Calcule los valores promedio a partir de tres mediciones aleatorias de cada una de las variables.
- En las pruebas de compresión radial, calcular el diámetro anteroposterior detectando el punto en el que la placa entra en contacto con la muestra.
- Realice todas las pruebas a temperatura ambiente.
- Ensayos de tracción
- Realice pruebas de tracción en un control de desplazamiento de máquina de prueba universal (UTM) de escritorio de tracción, equipado con una carga de 100 N (resolución de fuerza de 0.1 N, 0.001 mm de posición y 0.1 s). La máquina de prueba está equipada con sensores de fuerza y posición, y está conectada a una computadora con software diseñado específicamente por el fabricante23.
- Registra datos cada 0,4 s y expórtalos a una hoja de cálculo.
- Construir mordazas de tracción adaptadas al calibre medio de las tráqueas de conejo a partir de tubos huecos monocapa, de cloruro de polivinilo cristalino (PVC) no tóxicos y monocapa con un diámetro externo de 1 cm y un espesor de pared de 1,5 mm.
- Dividir los conductos en segmentos de 3 cm de largo.
- Taladrar 12 orificios preformados para la sutura termino-terminal, a 2 mm del borde de las mandíbulas y separados por una distancia de 2,5 mm, para evitar el sesgo debido a las suturas.
- Fijar los tubos de vidrio de PVC a la tráquea del conejo mediante anastomosis termino-terminal con una sutura continua a través de orificios preformados alternos (cada 5 mm), a 2 mm del borde de la tráquea y con una sutura de monofilamento de nylon 6-0.
- Estirar todas las piezas a una velocidad de desplazamiento de 5,0 mm/min.
- Registre las variables tensión máxima (σ máx., en N/mm2) y deformación (εmáx., sin unidades), junto con la energía almacenada por unidad de volumen de tráquea (W/Vol, en mJ/mm), y el módulo de Young (E, en MPa).
- Pruebas de compresión radial
- Realice pruebas de compresión radial en un escritorio UTM de compresión, equipado con una célula de carga de 15 N (resolución de fuerza 0.001 N, posición 0.001 mm y tiempo 0.1 s) para obtener datos de fuerza (N), posición (mm) y tiempo (s). Grabe datos y expórtelos a una hoja de cálculo a intervalos de 0,5 s.
- Coloque las tráqueas con el área membranosa apoyada en la placa inferior. La placa se eleva gradualmente hacia la placa superior a una velocidad constante de 5 mm / min.
- Calcular cada unidad por unidad de longitud de la muestra (f en N/mm), rigidez (R en Mpa·mm), y la energía por unidad de superficie (W / S en mJ/mm2) necesaria para ocluir completamente la tráquea.
5. Técnica quirúrgica
NOTA: La técnica quirúrgica ha sido ampliamente reportada en otros lugares20.
- Coloque un stent de PVC intraluminal estéril, tamaño 14 Fr (que permita que se deslice libremente sin comprimir las paredes), con un margen de 3-4 mm en cada extremo.
- Fije el stent con una sola puntada de monofilamento de nylon 6-0 a través del espacio intercartilaginoso del primer cartílago.
- Proceder a anestesiar a los conejos.
- Premedicar a los sujetos (3,65-4,05 kg de conejos blancos machos de Nueva Zelanda) con analgésicos intramusculares (35 mg/kg de ketamina) con un sedante, relajante muscular y analgésico (2,5 mg/kg de xilazina).
- Afeite la zona de incisión fuera de la zona de operación y limpie el área quirúrgica para eliminar el vello.
- Administrar analgésicos más profilaxis antibiótica: 0,05 mg/kg de buprenorfina intramuscular y 10 mg/kg de enrofloxacino.
- Coloque un catéter venoso en la vena marginal del oído de cada conejo.
- Anestesia inductiva con un bolo intravenoso de 10 mg/kg de propofol.
- Controle los signos vitales del animal mediante un electrocardiograma de tres derivaciones, oximetría de pulso y medición de presión no invasiva. Cada 30 minutos, aplique suero fisiológico en los ojos para evitar la sequedad mientras está bajo anestesia.
- Verifique el plano anestésico utilizando el método de pellizco del dedo del pie.
- Mantener la anestesia con isoflurano inhalado al 1,5%-2% de la concentración alveolar mínima sin perder la ventilación espontánea y proporcionar soporte térmico al conejo con una almohadilla térmica.
- Desinfecte la zona de la incisión varias veces con un movimiento circular con un exfoliante a base de yodo. En condiciones asépticas en todo momento y con material estéril, realizar una incisión torácica central longitudinal de 3 cm, y cosechar colgajos pediculados bilaterales compuestos por fascia pectoral y un componente muscular.
- Envuelva las tráqueas con el colgajo en cuatro conejos, uno en cada hemitórax (por lo tanto, un total de ocho tráqueas).
- Cuando se complete la cirugía, revertir la anestesia interrumpiendo la administración de isoflurano.
- Período postquirúrgico
- Mantenga a los animales en la sala de operaciones hasta que se hayan recuperado completamente de la anestesia. Cuando se hayan recuperado por completo, devuélvalos a su entorno con otros conejos.
- Tratar a los conejos con antibióticos (0,5 mL/kg de enrofloxacino al 2,5%) y analgésicos (meloxicam 5 mg/mL; metacam 0,05 mL/kg) cada 24 h durante 5 días.
- Dejar los implantes in situ durante el tiempo deseado.
- Antes de la eutanasia, premedicar a los conejos con analgésicos intramusculares (35 mg / kg de ketamina) y un sedante, relajante muscular y analgésico (2,5 mg / kg de xilazina). Luego eutanasia a los conejos con 133 mg / kg de pentobarbital sódico usando una inyección de 200 mg / ml a través de la vena marginal del oído y cosechar las tráqueas.
- Realizar pruebas biomecánicas e histológicas en las tráqueas.
6. Análisis estadístico
- Ajuste todos los modelos por el método bayesiano en el software R, Versión 3.5.3 R Core (R Foundation for Statistical Computing. 2019).
- Analizar las variables de estudio, excepto f y R, utilizando modelos de regresión lineal múltiple.
- Para las variables f y R , aplicar modelos de regresión lineal mixta. En estos modelos, además de las variables de interés relacionadas con el tratamiento y condición de cada tráquea, se introduce el porcentaje de oclusión como efecto monótono y un término independiente por tráquea como factor aleatorio.
Resultados
Descelularización
La tinción DAPI muestra la ausencia de ADN, y no se detectaron valores de ADN superiores a 50 ng en ninguna de las tráqueas por electroforesis, siendo todos los fragmentos menores de 200 pb20.
Cultivo microbiano
Dos de las ocho piezas sometidas a 0,5 kGy mostraron cambio de color en menos de 1 semana. Ninguna de las piezas irradiadas a 1 kGy y 2 kGy mostró ningún cambio de color (Figura 1).
Análisis histológico
No se detectaron cambios en el patrón de distribución de colágeno o fibra elástica en ninguno de los especímenes analizados (Figura 2).
Determinación de la dosis de radiación
Dados los resultados descritos anteriormente, que mostraron que la irradiación a 0,5 kGy no aseguró la esterilización de la muestra, mientras que las dosis de 1 kGy y 2 kGy sí lo hicieron, establecimos la dosis mínima de irradiación posible para lograr la esterilización del tejido como 1 kGy. Por lo tanto, probamos el impacto biomecánico de esta dosis en las tráqueas 2,17,23.
Estudio biomecánico
Ensayos de tracción axial
Los datos obtenidos en la prueba de tracción en tráqueas irradiadas se muestran en la Tabla 1. La figura 3 muestra las correspondientes curvas de tensión-deformación y los puntos de ruptura.
Por lo tanto, someter las piezas traqueales a irradiación gamma con fines de esterilización, a pesar de aumentar ligeramente los valores detectados, no causa efectos significativos en las características biomecánicas axiales de los órganos. Por lo tanto, tanto elσ máximo que las tráqueas pueden tolerar (0.05 MPa; IC [-0,046, 0,144] MPa), así como εmáx. (0,096 IC [-0,096, 0,281]), (0,022 MPa; IC [-0.23, 0.274] MPa), y W / Vol (desde 0.044 mJ / mm3; IC [-0,018, 0,106] mJ/mm3), aumentan muy ligeramente en esta muestra, pero en ningún caso son aplicables a la estimación poblacional.
Pruebas de compresión radial
Las pruebas de compresión realizadas tanto en las tráqueas nativas (controles) como en las tráqueas descelularizadas, criopreservadas e irradiadas se muestran en la Tabla 2. Los gráficos correspondientes se pueden ver en la Figura 4.
La irradiación gamma causa sólo una disminución mínima pero significativa de las características biomecánicas radiales en la fuerza variable por unidad de longitud, que varía en -0,017 N/mm; IC [-0,042, -0,004] N/mm, mientras que las variaciones mínimas detectadas en W/Vol (0,044 mJ/mm3; IC [-0,018, 0,106] mJ/mm3), R (-0,018 MPa · mm; IC [-0,145, 0,083] MPa · mm), y W/S (-0,081 mJ/mm2; IC [-0,95, 0,74] mJ/mm2), en ningún caso son aplicables a la estimación poblacional (Figura 5).
Implantar
Examen macroscópico
Ninguno de los animales mostró síntomas inflamatorios o infecciosos durante el postoperatorio; Su dieta se restableció según lo planeado y los antibióticos y analgésicos se suspendieron el quinto día. Tras la eutanasia, la integración de la tráquea y el colgajo se observó macroscópicamente, sin signos visibles de inflamación.
Examen histológico
El examen histológico mostró que el colgajo formaba tejido conectivo altamente organizado, estrechamente vinculado a los anillos traqueales, mostrando continuidad entre ellos y el tejido, en forma de pericondrio de la tráquea nativa. El cartílago estaba intacto y no mostraba signos de necrosis. Además, se observó la presencia de macrófagos y algunas células gigantes aisladas formando láminas. Aparte de la escasa presencia de eosinófilos, se observó la celularidad inflamatoria aguda leve posquirúrgica habitual (Figura 6). También se observó una neovascularización incipiente alrededor de la tráquea.
Evaluación biomecánica
Después de ser implantado en el lagomorfo, las características de la tráquea permanecieron sin cambios, excepto por la fuerza por unidad de longitud, que recuperó las características de la tráquea nativa solo 2 semanas después del trasplante (0,006 N/mm, IC [-0,026, 0,04] N/mm) (Figura 7).

Figura 1: Tráqueas irradiadas en DMEM sin antibióticos ni antifúngicos. El color de los dos especímenes de la izquierda (0,5 kGy) ha cambiado, lo que indica un cambio en el pH, y es un signo indirecto de crecimiento bacteriano. También hay un aumento de la turbidez en el primer espécimen de la izquierda. Los dos especímenes de la derecha (1 kGy) no muestran ningún cambio de color. Haga clic aquí para ver una versión más grande de esta figura.
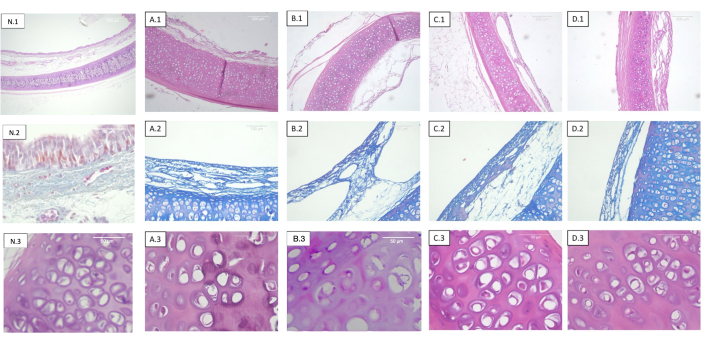
Figura 2: Tráqueas descelularizadas e irradiadas a diferentes dosis. Cada fila corresponde a una tinción diferente y cada columna a una dosis de esterilización diferente. 1) Hematoxilina-eosina. Vista panorámica del cartílago, mucosa, submucosa y serosa. 2) Tinción tricrómica de Masson. Submucosa traqueal. 3) Hematoxilina-eosina. Vista detallada del cartílago traqueal. A) Tráqueas no irradiadas (control). (B) Tráqueas irradiadas a 0,5 kGy. (C) Tráqueas irradiadas a 1 kGy. D) Tráqueas irradiadas a 2 kGy. Se observa la ausencia de cambios histológicos objetivos con respecto a la dosis de radiación. Abreviatura: N = tráquea nativa. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Curvas tensión-deformación para tráqueas descelularizadas e irradiadas. El punto de ruptura está marcado en naranja. Haga clic aquí para ver una versión más grande de esta figura.
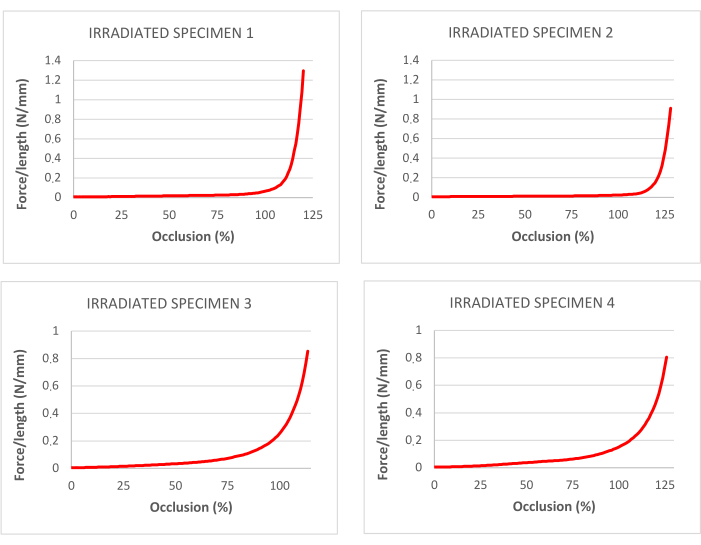
Figura 4: curvas para el porcentaje de oclusión correspondiente a los ensayos de tracción en tráqueas descelularizadas e irradiadas. Haga clic aquí para ver una versión más grande de esta figura.
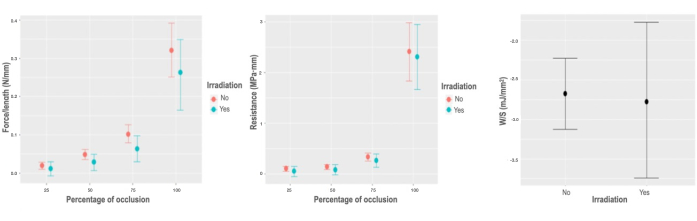
Figura 5: Respuesta biomecánica a la irradiación. (A) Gráfico de efectos marginales sobre la fuerza variable por unidad de longitud, según el porcentaje de oclusión de la interacción de irradiación. (B) Gráfico de efectos marginales sobre la fuerza variable por unidad de longitud, según el porcentaje de oclusión de la interacción de irradiación. (C) Gráfica de dependencia parcial del modelo de energía almacenada por unidad de área para la variable de irradiación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Vista de la tráquea implantada a las 2 semanas . (A) Tinción tricrómica de Masson. Se observa tejido conectivo neoformado de la superficie externa traqueal organizada en capas concéntricas de fibras y células. (B) Hematoxilina-eosina. Vista panorámica del cartílago perfectamente conservado. Haga clic aquí para ver una versión más grande de esta figura.
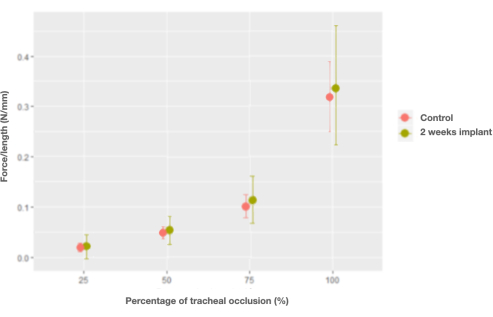
Figura 7: Gráfico de los efectos marginales de la interacción entre la fuerza por unidad de longitud y el porcentaje de tráqueas de oclusión y control (nativas) frente a los implantes de tráquea a las 2 semanas. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Ensayos de tracción en tráqueas irradiadas. Los controles son tráqueas de conejo nativas. Haga clic aquí para descargar esta tabla.
Tabla 2: Ensayos de compresión en tráqueas irradiadas y descelularizadas. Los controles son tráqueas de conejo nativas. Haga clic aquí para descargar esta tabla.
Discusión
Existen varias estrategias de esterilización. ElCO2supercrítico penetra completamente en los tejidos, acidificando el medio y deconstruyendo la bicapa de fosfolípidos celulares con eliminación simple mediante la despresurización del implante 8,14,25. También se ha utilizado radiación ultravioleta y se ha publicado su efectividad en la tráquea de roedores, aunque hay pocos relatos en la literatura10. Otros métodos utilizados incluyen la aplicación de sustancias como ácido peracético, etanol, peróxido de oxígeno o agua electrolizada, que han dado resultados irregulares y se ha demostrado que afectan en gran medida los tejidos11,12. En contraste con las estrategias antes mencionadas, la irradiación gamma no solo ha demostrado ser completamente efectiva en términos de esterilización, sino que también se ha estudiado exhaustiva y profusamente, tanto en lo que respecta a su dosis como a sus efectos esterilizantes. De hecho, se ha estudiado tanto que existe una norma ISO para el uso de radiación gamma en esterilización, en la que la dosis para la esterilización de material inerte a implantar en humanos se establece en 25 kGy13,14,15.
Por otro lado, además del material esterilizado, también se ha demostrado que la irradiación causa efectos colaterales como limitación de la técnica. Estos incluyen la destrucción y alteración de matrices mediante la desnaturalización de moléculas de proteínas, incluido el colágeno, y la generación de moléculas residuales, que incluso pueden volverse tóxicas. En consecuencia, esta degradación de la estructura del órgano afecta tanto a sus características biológicas como a las biomecánicas, siendo los efectos nocivos de la irradiación directamente proporcionales a su dosis y observados a dosis relativamente bajas 13,14,15,16,17. Aquí, el objetivo era, por lo tanto, doble: por un lado, obtener una construcción estéril para asegurar un implante viable, y por otro preservar las características biológicas y biomecánicas de la matriz, ya que el implante sería inútil a menos que ambos se mantuvieran26. Por lo tanto, el desafío fue seleccionar una estrategia que permitiera un equilibrio entre la esterilización exitosa y la preservación de la estructura del tejido.
En este documento, se estableció 1 kGy como dosis mínima para la esterilización. El examen histológico mostró que esta dosis de irradiación no tiene impacto en el tejido. Además, la caracterización biomecánica de las tráqueas irradiadas determinó que el uso de irradiación no hace absolutamente ninguna diferencia en los parámetros de tracción. Hubo una disminución leve pero estadísticamente significativa en la fuerza por unidad de longitud que la tráquea fue capaz de tolerar en las pruebas de compresión radial, sin embargo, esto no afecta sus otras características radiales.
Si bien hay algunos artículos que discuten la imposibilidad de esterilización y la desestructuración causada por dosis tan bajas como 1,5 kGy 19, la gran mayoría están en línea con los datos presentados 2,18,19. De esta manera, los autores observan que la esterilización ósea a dosis de 10, 15, 20 y 25 kGy logra una esterilización completa, aunque a cambio de una reducción en la capacidad de incubación celular y un aumento en los productos de degradación de colágeno a dosis superiores a 15 kGy18. Una dosis de 1,5 kGy no obtuvo esterilización en válvulas cardíacas descelularizadas, pero sí causó daños a las cualidades mecánicas de las muestras tanto in vivo como in vitro; mientras tanto, una dosis de 3 kGy logró la esterilización, pero causó desestructuración y fibrosis19. En cuanto a la tráquea, Johnson et al. compararon los efectos de la esterilización a la dosis ISO de 25 kGy con una dosis de 5 kGy. Ambas dosis obtuvieron esterilización terminal, con la dosis de 5 kGy alterando ligeramente la estructura de la muestra y la dosis de 25 kGy desestructurando completamente la tráquea2.
Además, la esterilización efectiva se confirma gracias a la ausencia de eventos infecciosos con respecto al implante después de 2 semanas, con la esterilización totalmente tolerada por los órganos. Además, la estructura se conservó por completo, sin necrosis ni desnaturalización del órgano. Además, como hallazgo adicional, se observó que la alteración menor en las características biomecánicas - a la fuerza que la tráquea es capaz de tolerar por unidad de longitud - volvió a los valores de una tráquea nativa sólo 2 semanas después de la implantación; Por lo tanto, este efecto puede ser ignorado según la gestión final de la construcción.
Por lo tanto, este trabajo presenta la posibilidad de obtener órganos completamente estériles a dosis mucho más bajas que la dosis recomendada de 25 kGy; la propuesta soluciona los problemas de esterilización de las tráqueas de conejo de Nueva Zelanda con una dosis de 1 kGy. Esta dosis asegura que se mantengan las características histológicas, ultraestructurales y biomecánicas de estos órganos, y muestra una tolerancia perfecta a la implantación. Una limitación del estudio es que se realiza solo en tráqueas de conejo esterilizadas, que generalmente requieren una dosis más baja debido a que son de menor tamaño; sin embargo, se puede concluir que las cifras excesivamente altas establecidas en la norma ISO para implantes inertes no son necesarias para la esterilización de tráqueas descelularizadas, siendo así un gran logro debido al daño muy reducido al tejido. Además, en futuros estudios, dependiendo del animal, y por lo tanto del tamaño de su tráquea, estas dosis pueden ajustarse a dosis mucho más bajas y, en consecuencia, más respetuosas con la estructura y función del órgano.
Divulgaciones
Ninguno de los autores tiene ningún conflicto de intereses.
Agradecimientos
Este trabajo ha sido apoyado por la Beca 2018 de la Sociedad Española de Cirugía Torácica al Estudio Nacional Multicéntrico [Número 180101 otorgado a Néstor J.Martínez-Hernández] y PI16-01315 [otorgado a Manuel Mata-Roig] por el Instituto de Salud Carlos III. El CIBERER está financiado por el VI Plan Nacional de I&D&I 2018-2011, Iniciativa Ingenio 2010, Programa Consolider, Acciones CIBER y el Instituto de Salud Carlos III, con la ayuda del Fondo Europeo de Desarrollo Regional.
Materiales
| Name | Company | Catalog Number | Comments |
| 6-0 nylon monofilament suture | Monosoft. Covidien; Mansfield, MA, USA | SN-5698G | |
| Amphotericin B 5% | Gibco Thermo Fisher Scientific; Waltham, MA USA | 15290018 | |
| Bioanalyzer | Agilent, Santa Clara, CA, USA | G2939BA | |
| Buprenorphine | Buprex. Reckitt Benckiser Healthcare; Hull, Reino Unido | N02AE01 | |
| Compression desktop UTM | Microtest, Madrid, Spain | EM1/10/FR | |
| Cryostate | Leyca CM3059, Leyca Biosystems, Wetzlar, Alemania | CM3059 | |
| DAPI (4',6-diamino-2-phenylindole) | DAPI. Sigma-Aldrich, Missouri, USA | D9542 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich; MO, USA | D2650 | |
| DMEM | Thermo Fisher Scientific; Waltham, MA, USA | 11965084 | |
| DNA extraction kit | DNeasy extraction kit Quiagen, Hilden, Germany | 4368814 | |
| Enrofloxacin, 2.5% | Boehringer Ingelheim, Ingelheim am Rhein, Germany | 0035-0002 | |
| Fetal bovine serum (FBS) | GE Healthcare Hyclone; Madrid, Spain | SH20898.03IR | |
| Fluorescence microscope | Leyca DM2500 (Leica, Wetzlar, Germany) | DM2500?? | |
| Freezing Container | Mr Frosty. Thermo Fisher; Madrid, Spain | 5100-0001 | |
| Isofluorane | Isoflo; Proyma Ganadera; Ciudad Real, Spain | 8.43603E+12 | |
| Ketamin | Imalgene. Merial; Toulouse, Francia | BOE127823 | |
| Linear accelerator | "True Beam". Varian, Palo Alto, California, USA | H191001 | |
| Magnetic stirrer | Orbital Shaker PSU-10i. Biosan; Riga, Letonia | BS-010144-AAN | |
| Meloxicam 5 mg/ml | Boehringer Ingelheim, Ingelheim am Rhein, Germany | 6283-MV | |
| OCT (Optimal Cutting Temperature Compound) | Fischer Scientific, Madrid, Spain | 12678646 | |
| Penicillin-streptomycin 5% | Gibco Thermo Fisher Scientific; Waltham, MA USA | 15140122 | |
| Pentobarbital sodium | Dolethal. Vetoquinol; Madrid, España | 3.60587E+12 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich; MO, USA | P2272 | |
| Propofol | Propofol Lipuro. B. Braun Melsungen AG; Melsungen, Alemania | G 151030 | |
| Proteinase K | Gibco Thermo Fisher Scientific; Waltham, Massachussetts, USA | S3020 | |
| PVC hollow tubes | Cristallo Extra; FITT, Sandrigo, Italy | hhdddyyZ | |
| PVC stent | ArgyleTM Medtronic; Istanbul, Turkey | 019 5305 1 | |
| R software, Version 3.5.3 R Core | R Foundation for Statistical Computing | R 3.5.3 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich; MO, USA | 8,17,034 | |
| Spectrophotometer | Nanodrop, Life Technologies; Isogen Life Science. Utrech, Netherlands | ND-ONEC-W | |
| Spreadsheet | Microsoft Excel for Mac, Version 16.23, Redmond, WA, USA | 2864993241 | |
| Traction Universal Testing Machine | Testing Machines, Veenendaal, Netherlands | 84-01 | |
| UTM Software | TestWorks 4, MTS Systems Corporation, Eden Prairie, MN, USA | 100-093-627 F | |
| VECTASHIELD Mounting Medium | Vector Labs, Burlingame; CA; USA | H-1000-10 | |
| Xylacine | Xilagesic. Calier; Barcelona, España | 20102-003 |
Referencias
- Ch'ng, S., et al. Reconstruction of the (Crico)trachea for malignancy in the virgin and irradiated neck. Journal of Plastic, Reconstructive & Aesthetic Surgery. 65 (12), 1645-1653 (2012).
- Johnson, C. M., Guo, D. H., Ryals, S., Postma, G. N., Weinberger, P. M. The feasibility of gamma radiation sterilization for decellularized tracheal grafts. Laryngoscope. 127 (8), 258-264 (2017).
- de Donato, G., et al. Prosthesis infection: prevention and treatment. The Journal of Cardiovascular Surgery. 55 (6), 779-792 (2014).
- Vangsness, C. T., Dellamaggiora, R. D. Current safety sterilization and tissue banking issues for soft tissue allografts. Clinics in Sports Medicine. 28 (2), 183-189 (2009).
- Den Hondt, M., Vanaudenaerde, B. M., Delaere, P., Vranckx, J. J. Twenty years of experience with the rabbit model, a versatile model for tracheal transplantation research. Plastic and Aesthetic Research. 3 (7), 223-230 (2016).
- Hysi, I., et al. Successful orthotopic transplantation of short tracheal segments without immunosuppressive therapy. European Journal of Cardiothoracic Surgery. 47 (2), 54-61 (2015).
- Wurtz, A., et al. Tracheal reconstruction with a composite graft: Fascial flap-wrapped allogenic aorta with external cartilage-ring support. Interactive Cardiovascular and Thoracic Surgery. 16 (1), 37-43 (2013).
- White, A., Burns, D., Christensen, T. W. Effective terminal sterilization using supercritical carbon dioxide. Journal of Biotechnology. 123 (4), 504-515 (2006).
- Qiu, Q. Q., et al. Inactivation of bacterial spores and viruses in biological material using supercritical carbon dioxide with sterilant. Journal of Biomedical Materials Research. Part B, Applied Biomaterials. 91 (2), 572-578 (2009).
- Lange, P., et al. Pilot study of a novel vacuum-assisted method for decellularization of tracheae for clinical tissue engineering applications. Journal of Tissue Engineering and Regenerative Medicine. 11 (3), 800-811 (2017).
- Wedum, A. G., Hanel, E., Phillips, G. B. Ultraviolet sterilization in microbiological laboratories. Public Health Reports. 71 (4), 331-336 (1956).
- Hennessy, R. S., et al. Supercritical carbon dioxide-based sterilization of decellularized heart valves. JACC. Basic to Translational Science. 2 (1), 71-84 (2017).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Balestrini, J. L., et al. Sterilization of lung matrices by supercritical carbon dioxide. Tissue Engineering. Part C, Methods. 22 (3), 260-269 (2016).
- AENOR. UNE-EN. ISO 11737-1:2006. Esterilización de productos sanitarios. Métodos biológicos. Parte 1: Determinación de la población de microorganismos en los productos. AENOR. UNE-EN. , (2006).
- Uriarte, J. J., et al. Mechanical properties of acellular mouse lungs after sterilization by gamma irradiation. Journal of the Mechanical Behavior of Biomedical Materials. 40, 168-177 (2014).
- Sun, W. Q., Leung, P. Calorimetric study of extracellular tissue matrix degradation and instability after gamma irradiation. Acta Biomaterialia. 4 (4), 817-826 (2008).
- Nguyen, H., et al. Reducing the radiation sterilization dose improves mechanical and biological quality while retaining sterility assurance levels of bone allografts. Bone. 57 (1), 194-200 (2013).
- Helder, M. R. K., et al. Low-dose gamma irradiation of decellularized heart valves results in tissue injury in vitro and in vivo. The Annals of Thoracic Surgery. 101 (2), 667-674 (2016).
- Martínez-Hernández, N. J., et al. Decellularized tracheal prelamination implant: A proposed bilateral double organ technique. Artificial Organs. 45 (12), 1491-1500 (2021).
- Feldman, A. T., Wolfe, D. Tissue processing and hematoxylin and eosin staining. Methods in Molecular Biology. 1180, 31-43 (2014).
- López Caballero, J., Peña, M., De Federico, M. Coloraciones para fibras colágenas y elásticas del tejido conjuntivo. Coloraciones para sustancia amiloidea. Laboratorio de Anatomía Patologica. , 175-195 (1993).
- Martínez-Hernández, N. J., et al. A standardised approach to the biomechanical evaluation of tracheal grafts. Biomolecules. 11 (10), 1461 (2021).
- Kajbafzadeh, A. M., Javan-Farazmand, N., Monajemzadeh, M., Baghayee, A. Determining the optimal decellularization and sterilization protocol for preparing a tissue scaffold of a human-sized liver tissue. Tissue Engineering. Part C, Methods. 19 (8), 642-651 (2013).
- Wehmeyer, J. L., Natesan, S., Christy, R. J. Development of a sterile amniotic membrane tissue graft using supercritical carbon dioxide. Tissue Engineering. Part C, Methods. 21 (7), 649-659 (2015).
- Ross, E. A., et al. Mouse stem cells seeded into decellularized rat kidney scaffolds endothelialize and remodel basement membranes. Organogenesis. 8 (2), 49-55 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados