Method Article
탈세포화된 기관 이식편을 위한 저선량 감마선 멸균
요약
기관 조직 이식에는 멸균이 필수적입니다. 여기에서 우리는 장기가 완전히 견딜 수 있는 저선량 감마선 조사를 사용하는 멸균 프로토콜을 제시합니다.
초록
이식이 올바르게 진행되도록하는 주요 측면 중 하나는 배지의 무균 성입니다. 탈세포화된 기관 이식은 원래 환경과 접촉하여 처음부터 무균이 되지 않은 장기를 이식하는 것을 포함합니다. 탈세포화 프로토콜(세제 노출[2% 도데실황산나트륨], 연속 교반 및 삼투압 충격을 통해)은 무균 조치에 따라 수행되지만 살균을 제공하지는 않습니다. 따라서 주요 과제 중 하나는 생체 내 이식 전에 무균성을 보장하는 것입니다. 무기 물질에 대한 감마선 멸균 프로토콜이 확립되어 있지만 유기 물질에 대한 그러한 조치는 없습니다. 또한, 확립된 방사선량(25kGy)이 임플란트를 완전히 파괴할 수 있기 때문에 무기 재료에 대한 프로토콜을 유기 재료에 적용할 수 없습니다. 이 논문은 탈세포화된 토끼 기관에서 증가된 방사선량의 영향을 연구합니다. 우리는 용량 범위(kGy)를 유지하고 멸균이 달성되는 최소 용량을 찾을 때까지 증량된 용량을 테스트했습니다. 복용량을 결정한 후, 우리는 조직 학적으로나 생체 역학적으로 장기에 미치는 영향을 연구했습니다. 우리는 0.5kGy가 무균을 달성하지 못했지만 1kGy와 2kGy의 용량은 모두 달성했으며 따라서 1kGy는 멸균을 달성하는 데 필요한 최소 용량이라고 결정했습니다. 현미경 연구는 멸균되지 않은 장기와 비교하여 관련 변화를 나타내지 않았습니다. 축 방향 생체 역학적 특성은 전혀 변경되지 않았으며 기관이 방사상으로 견딜 수있는 단위 길이당 힘의 약간만 감소했습니다. 따라서 우리는 1 kGy가 장기에 미치는 영향을 최소화하면서 탈세포 화 된 토끼 기관의 완전한 살균을 달성한다고 결론 지을 수 있습니다.
서문
임플란트의 살균은 생존력을위한 기본 요건입니다. 실제로 성공한 것으로 입증 된 보철물은 멸균 부위 (혈관, 심장, 뼈 등)에 이식 된 보철물입니다. 1. 기관은 두 개의 표면을 가지고 있습니다 : 외부 환경과 접촉하는 표면은 멸균되지 않으며, 다른 표면은 멸균 된 종격동을 향한 표면입니다. 따라서 기관이 추출되는 순간부터 멸균 기관이 아닙니다. 후속 탈세포화 공정이 최대 멸균 조건에서 수행됨에도 불구하고, 이는 멸균 단계2가 아니다. 이물질의 주입 자체는 그것이 생산하는 프로박테리아 미세환경으로 인한 감염의 위험을 수반한다3그리고 물질이 멸균된 경우에도 기증자로부터 수혜자에게 질병이 전파될 위험이 최대 0.014%에 달한다4. 기관의 올바른 혈관 형성을 보장하기 위해 거의 모든 실험적 이식 프로토콜에서 먼저 무균 부위(근육, 근막, 망막, 피하 등)에 이종 성 임플란트 5,6,7을 거칩니다. 이 배지에 비멸균 요소를 주입하면 영역3의 감염으로 이어질 수 있기 때문입니다.
멸균 임플란트를 얻기 위한 다양한 가능한 전략이 있습니다. 초임계CO2를 사용하여 말단 멸균 8,9를 달성하였다. 자외선 또는 과초산, 에탄올, 과산화산소 및 전해수와 같은 물질로 처리하는 것과 같은 다른 방법은 거의 항상 복용량에 따라 멸균 성공률이 다르지만 임플란트의 생체역학적 특성에 영향을 미치는 것으로 나타났습니다. 실제로, 에틸렌 옥사이드와 같은 일부 물질은 주입된 매트릭스의 구조를 실질적으로 변화시킬 수 있고, 심지어 바람직하지 않은 면역원성 효과를 야기할 수 있다. 이러한 이유로, 이들 전략들 중 다수는 생물학적 모델(2,10,11,12,13)에 적용될 수 없다.
가장 널리 연구되고 인정되는 멸균 전략은 감마선 선량이 25kGy인 인간에게 이식된 의료 기기의 멸균에 대한 ISO 11737-1:2006 표준에 의해 수립된 전략입니다. 그러나이 규정은 불활성, 비 생물학적 요소14,15의 살균에만 초점을 맞추고 있습니다. 또한, 근치적 암종 치료에서 방사선 요법 선량은 의료기기 멸균에 사용되는 선량보다 3배 더 낮다1. 이를 염두에두고, 우리는 상기 용량이 미생물을 죽일뿐만 아니라 임플란트의 생물학적 구조를 파괴하고 근본적으로 변화시킬 것이라고 결론 지을 수 있습니다. 또한 분해시 잔류 지질을 생성할 가능성이 있으며, 이는 잠재적으로 세포독성을 가질 수 있고 스캐폴드(13,14,15,16,17)의 효소적 분해를 가속화할 수 있으며, 이는 1.9 kGy만큼 낮은 선량을 사용하고 방사선량에 정비례하는 손상을 입는 경우에도 마찬가지이다 17.
따라서, 본 논문의 목적은 방사선 조사에 의해 야기되는 최소한의 유해한 영향으로 멸균 임플란트가 얻어질 수 있도록 하는 방사선량을 확인하려고 시도하는 것이다 2,18,19. 우리가 따랐던 전략은 부정적인 배양을 달성할 때까지 킬로그레이 범위(0.5, 1, 2, 3kGy 등) 내에서 다양한 증량량으로 탈세포화 및 조사된 기관을 조사하는 것이었습니다. 살균을 확인하기 위해 음성 배양을 달성 한 용량에 대해 추가 테스트가 수행되었습니다. 멸균을 얻기위한 최소 선량을 결정한 후, 기관에 대한 조사의 구조적 및 생체 역학적 영향을 점검 하였다. 모든 메트릭을 대조군 토착 토끼 기관과 비교했습니다. 이어서, 구조물의 살균을 뉴질랜드 백색 토끼에 기관을 이식함으로써 생체 내에서 시험하였다.
프로토콜
실험 동물의 관리 및 사용에 대한 유럽 지침 20170/63/EU를 준수했으며 연구 프로토콜은 발렌시아 대학교 윤리 위원회의 승인을 받았습니다(법률 86/609/EEC 및 214/1997 및 코드 2018/VSC/PEA/0122 스페인 발렌시아 정부).
1. 기관 탈세포화
참고: 탈세포화 방법은 다른 곳에서 보고된 바있다 20.
- 기증자 수컷 성인 뉴질랜드 백색 토끼(Oryctolagus cuniculus)를 체중 3.5-4.1kg과 133mg/kg 펜토바르비탈 나트륨으로 안락사시키고 가장자리 귀 정맥을 통해 200mg/mL 주사합니다.
- 무균 상태를 유지하면서 중앙 세로 자궁 경부 절개술을 시행하고 자궁 경부 근육을 해부하고 기관에 접근하십시오. 장기를 원주 방향 및 세로로 해부하십시오. 마지막으로, 첫 번째 고리 아래와 카리나 바로 위에 횡단합니다.
- 메스로 기관을 2cm 조각으로 나눕니다. 가위로 주변 결합 조직과 내부 점막층6을 제거합니다.
- 2% 소듐 도데실 설페이트(SDS), 5% 페니실린-스트렙토마이신 및 5% 암포테리신 B를 함유한 12mL의 인산염 완충 식염수(PBS) 용액에 표본을 담그십시오.
- 기관지를 실온에서 5주 동안 400rpm의 자기 교반기로 일정하게 교반합니다. 기관을 증류수에 담그는 방법으로 2시간 삼투압 충격 후 매주 탈세포화 용액을 교체하십시오.
- -80°C의 냉동 용기에서 80% 소 태아 혈청(FBS)과 20% 디메틸 설폭사이드(DMSO)의 혼합물 12mL를 사용하여 검체를 극저온 분석합니다.
- 기관을 사용할 때(13-15일 후) 37°C의 수조에서 해동하고 해동이 완료된 후 PBS에 담가 세척합니다.
2. 살균
- 방사선 조사
- 총 부피가 30mL가 될 때까지 PBS로 채워진 T25 배양 플라스크에 메타크릴레이트 20mL에 각각 2cm 크기의 기관 조각 4개 배치를 놓습니다. 공기-액체 계면에서 에너지 확산을 일으킬 수 있는 기포가 형성되지 않도록 주의하십시오.
- 선형 가속기를 사용하여 10MV의 공칭 에너지의 광자가 필터 프리 빔을 평평하게 하여 조사를 수행합니다. 등중심에서 분당 2,400 모니터 단위의 선량률을 적용하고, 10cm x 10cm의 방사선장에 대해 2.5cm의 피사계 심도로 방사선을 조사할 소스 표면 거리 100cm에 기관을 배치하여 전체 용기를 덮도록 합니다.
- 각 4개 배치로 복용량을 확대합니다. 살균에 도달 할 때까지 4 개, 0.5 kGy, 4 개에서 1 kGy, 4 개에서 2 kG 등을 받게됩니다.
- 문화
- 항생제나 항진균제 없이 비활성화된 10% FBS가 있는 Dulbecco의 변형 독수리 배지(DMEM) 30mL에 조각을 넣습니다.
- 37°C 및 5%CO2의 표준 조직 인큐베이터에서 2주 동안 배양하고 24시간마다 검사합니다.
참고: 오염 매개변수는 배양 배지의 pH 변화와 그에 따른 배지의 색상 및 탁도 변화입니다. 기관은 병에 걸리지 않은 무균 lagomorphs에서 수확되었으므로 기관에 혐기성 박테리아가 없을 것으로 예상됩니다.
3. 조직학적 분석
참고: 헤마톡실린과 에오신21, 마손의 삼색, 오르세인22를 사용하여 조각을 얼룩지게 합니다.
- DAPI 염색
- DAPI(4′,6-diamidino-2-phenylindole)를 사용하여 조직 생존력을 결정합니다. 이 청색 형광 염색은 DNA 서열의 아데닌 및 티민이 풍부한 영역에 강하게 결합하므로 형광 현미경을 통해 DNA를 볼 수 있습니다.
- 조직 샘플을 최적 절단 온도(OCT) 화합물에 삽입합니다.
- 저온 유지 장치를 사용하여 샘플을 자릅니다.
- 염색하고자 하는 시료를 증류수로 3회 세척하여 OCT를 제거하고 30 nM DAPI 용액이 포함된 마운팅 배지에 넣는다.
- 형광 현미경을 사용하여 형광을 시각화합니다.
- DNA 함량 분석
- 메스를 사용하여 약 3mm 길이의 기관 부분을 자릅니다.
- proteinase K (재료 표)에서 2 시간 동안 배양합니다.
- 제조업체의 지침에 따라 DNA 추출 키트로 DNA를 추출합니다.
- 분광 광도계를 사용하여 260/280에서 흡광도를 측정하여 DNA 농도를 결정합니다.
- 바이오분석기와 함께 모세관 크로마토그래피를 사용하여 추출된 DNA 샘플의 크기를 측정합니다.
4. 생체 역학 연구
참고: 종방향 및 횡방향 힘에 대한 기관 저항은 축 방향 인장 및 반경 방향 압축 시험23을 통해 측정됩니다.
- 기관 측정
- 버니어 캘리퍼스를 사용하여 기관 길이, 벽 두께 및 외경을 측정합니다.
- 각 변수에 대한 세 개의 랜덤 측정값에서 평균값을 계산합니다.
- 방사형 압축 시험에서는 플레이트가 시편과 접촉하는 지점을 감지하여 전후 직경을 계산합니다.
- 실온에서 모든 테스트를 수행하십시오.
- 인장 시험
- 100N 하중(0.1N 하중 분해능, 0.001mm 위치 및 0.1초)이 장착된 견인 데스크탑 만능재료시험기(UTM) 변위 제어장치에서 인장 시험을 수행합니다. 시험기에는 힘 및 위치 센서가 장착되어 있으며, 제조업체(23)에 의해 특별히 설계된 소프트웨어가 있는 컴퓨터에 연결된다.
- 0.4초마다 데이터를 기록하고 스프레드시트로 내보냅니다.
- 외부 직경이 1cm이고 벽 두께가 1.5mm인 순수한 단층, 무독성 결정 폴리염화비닐(PVC) 중공 튜브로 토끼 기관의 평균 구경에 맞게 조정된 인장 죠를 구성합니다.
- 전도체를 3cm 길이의 세그먼트로 나눕니다.
- 봉합사로 인한 편향을 방지하기 위해 턱 가장자리에서 2mm, 2.5mm 간격으로 말단 봉합사를 위한 12개의 미리 형성된 구멍을 뚫습니다.
- PVC 유리관을 기관 가장자리에서 2mm 떨어진 곳에 6-0 나일론 모노필라멘트 봉합사를 사용하여 미리 형성된 대체 구멍(5mm마다)을 통해 연속 봉합사를 사용하여 말단 문합으로 토끼 기관에 부착합니다.
- 5.0mm/min의 변위 속도로 모든 조각을 늘립니다.
- 변수 최대 응력(최대 σ, N/mm2) 및 변형률(최대 ε, 단위 없음)을 기관 부피 단위당 저장된 에너지(W/Vol, mJ/mm) 및 영률(E, MPa)과 함께 기록합니다.
- 방사형 압축 시험
- 15N 로드셀(힘 분해능 0.001N, 위치 0.001mm, 시간 0.1초)이 장착된 압축 데스크탑 UTM에서 방사형 압축 테스트를 수행하여 힘 데이터(N), 위치(mm) 및 시간(초)을 얻습니다. 데이터를 기록하고 0.5초 간격으로 스프레드시트로 내보냅니다.
- 멤브레인 부위가 하부 판에 놓이도록 기관을 놓습니다. 플레이트는 5mm/min의 일정한 속도로 상판을 향해 점차 상승합니다.
- 기관을 완전히 폐색하는 데 필요한 시료 길이의 단위당 모든 단위(f , N/mm), 강성(R , Mpa·mm) 및 단위당 표면적당 에너지(W / S , mJ/mm2)를 계산합니다.
5. 수술 기법
참고: 수술 기법은 다른 곳에서도 널리 보고되었다20.
- 멸균 관내 PVC 스텐트, 크기 14 Fr (벽을 압축하지 않고 자유롭게 미끄러질 수 있음)을 양쪽 끝에 3-4mm의 여백으로 놓습니다.
- 첫 번째 연골의 연골간 공간을 통해 단일 6-0 나일론 모노필라멘트 스티치로 스텐트를 고정합니다.
- 토끼를 마취하십시오.
- 피험자(3.65-4.05kg 수컷 뉴질랜드 백색 토끼)에게 진정제, 근육 이완제 및 진통제(2.5mg/kg 자일라진)와 함께 근육내 진통제(35mg/kg 케타민)를 사전 투여합니다.
- 수술 부위에서 절개 부위를 면도하고 수술 부위를 청소하여 머리카락을 제거합니다.
- 진통제와 항생제 예방: 0.05mg/kg 근육주사 부프레노르핀 및 10mg/kg 엔로플록사신.
- 각 토끼의 가장자리 귀 정맥에 정맥 카테터를 넣으십시오.
- 프로포폴 10mg/kg 볼루스를 정맥 주사하여 마취를 유도합니다.
- 3리드 심전도, 맥박 산소 측정 및 비침습적 압력 측정을 사용하여 동물의 활력 징후를 모니터링합니다. 30분마다 마취 상태에서 건조를 방지하기 위해 눈에 생리학적 세럼을 바릅니다.
- 발가락 핀치 방법을 사용하여 마취면을 확인합니다.
- 흡입 된 이소 플루 란으로 마취를 자연 환기를 잃지 않고 최소 폐포 농도의 1.5 % -2 %로 유지하고 가열 패드로 토끼에게 열 지원을 제공하십시오.
- 절개 부위를 요오드 기반 스크럽으로 원을 그리며 여러 번 소독하십시오. 항상 무균 상태에서 멸균 물질을 사용하여 세로 3cm 중앙 흉부 절개를 하고 가슴 근막과 근육 구성 요소로 구성된 양측 척추경 플랩을 수확합니다.
- 각 반흉부에 하나씩 4 마리의 토끼에 플랩으로 기관을 감싼다.
- 수술이 완료되면 이소플루란 투여를 중단하여 마취를 역전시킵니다.
- 수술 후 기간
- 마취에서 완전히 회복 될 때까지 동물을 수술실에 보관하십시오. 그들이 완전히 회복되면 다른 토끼와 함께 환경으로 되돌려 보내십시오.
- 토끼를 항생제(0.5mL/kg 2.5% 엔로플록사신)와 진통제(5mg/mL 멜록시캄, 0.05mL/kg 메타캠)로 5일 동안 24시간마다 치료합니다.
- 원하는 시간 동안 임플란트를 제자리에 두십시오.
- 안락사 전에 근육 내 진통제(35mg/kg 케타민)와 진정제, 근육 이완제 및 진통제(2.5mg/kg 자일라진)로 토끼를 미리 치료합니다. 그런 다음 가장자리 귀 정맥을 통해 200mg/mL 주사를 사용하여 133mg/kg 펜토바르비탈 나트륨으로 토끼를 안락사시키고 기관을 적출합니다.
- 기관에 대한 생체 역학 및 조직 학적 검사를 수행하십시오.
6. 통계 분석
- R 소프트웨어, 버전 3.5.3 R Core에서 베이지안 방법으로 모든 모델을 조정합니다(R Foundation for Statistical Computing. 2019).
- 다중 선형 회귀 모형을 사용하여 f 및 R을 제외한 연구 변수를 분석합니다.
- f 변수와 R 변수의 경우 혼합 선형 회귀 모델을 적용합니다. 이 모델에서는 각 기관의 치료 및 상태와 관련된 관심 변수 외에도 폐색 비율을 단조 효과로 도입하고 기관당 독립 항을 무작위 요인으로 도입합니다.
결과
탈세포화
DAPI 염색은 DNA의 부재를 보여주고, 전기영동에 의해 임의의 기관에서 50 ng 이상의 DNA 값이 검출되지 않았으며, 모든 단편은200 bp 20보다 작았다.
미생물 배양
0.5 kGy를 받은 8개 조각 중 2개는 1주일 이내에 색 변화를 보였다. 1 kGy 및 2 kGy에서 조사된 조각들 중 어느 것도 색 변화를 나타내지 않았다(그림 1).
조직학적 분석
분석된 시편에서 콜라겐 또는 탄성 섬유 분포 패턴의 변화는 감지되지 않았습니다(그림 2).
방사선량 결정
0.5 kGy에서의 조사는 시편의 멸균을 보장하지 않는 반면, 1 kGy 및 2 kGy의 선량은 그랬다는 것을 보여준 위에서 설명한 결과를 감안할 때, 우리는 조직의 멸균을 달성하기 위해 가능한 최소 조사 량을 1 kGy로 설정했습니다. 따라서 우리는 기관 2,17,23에 대한 이 용량의 생체역학적 영향을 테스트했습니다.
생체 역학 연구
축방향 인장 시험
조사된 기관지에 대한 인장 시험에서 얻어진 데이터는 표 1에 나타낸다. 그림 3 은 해당 응력-변형률 곡선과 파괴점을 보여줍니다.
따라서, 멸균 목적으로 기관 조각에 감마선을 가하는 것은 검출 된 값을 약간 증가 시키더라도 장기의 축 방향 생체 역학적 특성에 큰 영향을 미치지 않는다. 따라서 기관이 견딜 수 있는최대 σ(0.05MPa; CI [-0.046, 0.144]MPa), εmax (0.096 CI [-0.096, 0.281]), (0.022 MPa; CI[-0.23, 0.274]MPa) 및 W/Vol (0.044 mJ/mm3에서; CI [-0.018, 0.106] mJ/mm3)는 이 표본에서 매우 약간 증가했지만 어떤 경우에도 모집단 추정치에 적용할 수 없습니다.
방사형 압축 시험
천연 기관(대조군)과 탈세포화, 냉동 보존 및 조사된 기관 모두에서 수행된 압축 테스트는 표 2에 나와 있습니다. 해당 그래프는 그림 4에서 볼 수 있습니다.
감마선 조사는 -0.017 N/mm만큼 변하는 단위 길이당 가변 힘에서 방사형 생체역학적 특성을 최소한이지만 현저하게 감소시킵니다. CI [-0.042, -0.004] N/mm, W/Vol(0.044 mJ/mm3; CI [-0.018, 0.106]mJ/mm3), R(-0.018 MPa·mm; CI [-0.145, 0.083]MPa·mm) 및 W/S(-0.081 mJ/mm2; CI [-0.95, 0.74] mJ/mm2)는 어떠한 경우에도 모집단 추정치에 적용할 수 없습니다(그림 5).
심다
육안 검사
어떤 동물도 수술 후 기간 동안 염증 또는 감염성 증상을 나타내지 않았습니다. 그들의 식단은 계획대로 회복되었고 항생제와 진통제는 5일째에 중단되었습니다. 안락사 시, 기관과 피판의 통합은 거시적으로 관찰되었으며 눈에 띄는 염증 징후는 없었습니다.
조직 검사
조직 학적 검사는 플랩이 기관 고리와 밀접하게 연결되어 천연 기관의 연골 주위 형태로 기관 고리와 밀접하게 연결된 고도로 조직 된 결합 조직을 형성하는 것으로 나타났습니다. 연골은 손상되지 않았으며 괴사의 징후는 보이지 않았습니다. 또한, 대식세포 및 일부 분리된 거대 세포가 시트를 형성하는 존재가 관찰되었다. 호산구가 거의 존재하지 않는 것 외에, 일반적인 수술 후 경미한 급성 염증성 세포질이 관찰되었다(도 6). 초기 신생혈관 형성도 기관 주변에서 관찰되었습니다.
생체역학적 평가
lagomorph에 이식된 후 기관의 특성은 이식 후 2주 만에 본래 기관의 특성을 회복한 단위 길이당 힘을 제외하고는 변하지 않았습니다(0.006 N/mm, CI [-0.026, 0.04] N/mm)(그림 7).

그림 1: 항생제나 항진균제가 없는 DMEM의 방사선 조사된 기관. 왼쪽에 있는 두 표본(0.5kGy)의 색상이 변경되어 pH의 변화를 나타내며 박테리아 성장의 간접적인 징후입니다. 왼쪽의 첫 번째 시편에서도 탁도가 증가합니다. 오른쪽의 두 표본(1kGy)은 색상 변화가 없습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
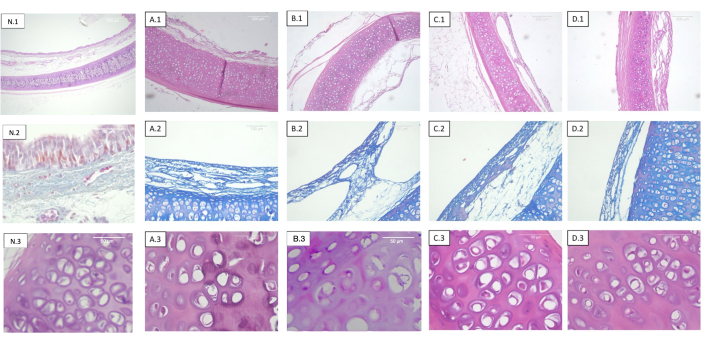
그림 2: 기관이 탈세포화되고 다른 용량으로 조사됨. 각 행은 상이한 염색에 해당하고 각 열은 상이한 멸균 투여량에 상응한다. 1) 헤마톡실린-에오신. 연골, 점막, 점막하 및 장막의 탁 트인 전망. 2) Masson의 삼색 얼룩. 기관 점막하층. 3) 헤마톡실린-에오신. 기관 연골의 상세보기. (A) 조사되지 않은 기관(대조군). (B) 0.5kGy에서 조사된 기관. (C) 1kGy에서 조사된 기관. (D) 2kGy에서 조사된 기관. 방사선량에 대한 객관적인 조직학적 변화의 부재가 관찰된다. 약어: N = 천연 기관. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 탈세포화 및 조사된 기관에 대한 응력-변형률 곡선. 중단점은 주황색으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
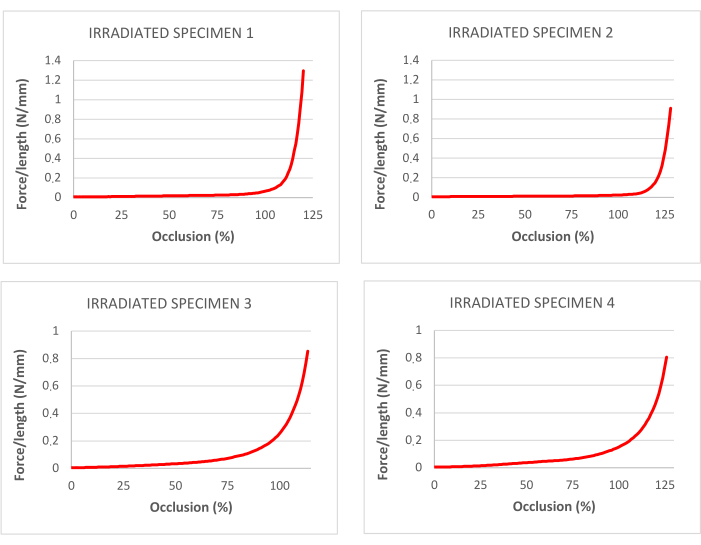
그림 4: 탈세포 및 방사선 조사된 기관의 견인 테스트에 해당하는 폐색 비율에 대한 곡선. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
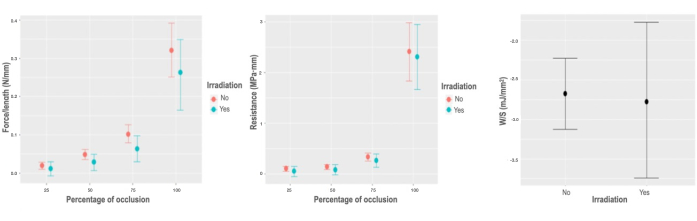
그림 5: 방사선 조사에 대한 생체역학적 반응. (A) 조사 상호 작용의 폐색 비율에 따른 길이 단위당 가변 힘에 대한 한계 효과 그래프. (B) 조사 상호 작용의 폐색 비율에 따른 단위 길이당 가변 힘에 대한 한계 효과 그래프. (C) 조사 변수에 대한 단위 면적당 저장된 에너지 모델의 부분 의존성 플롯. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 2주째 이식된 기관의 모습 . (A) Masson의 삼색 염색. 섬유와 세포의 동심원층으로 구성된 기관 외부 표면의 신형 결합 조직이 관찰됩니다. (B) 헤마톡실린-에오신. 완벽하게 보존된 연골의 탁 트인 전망. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
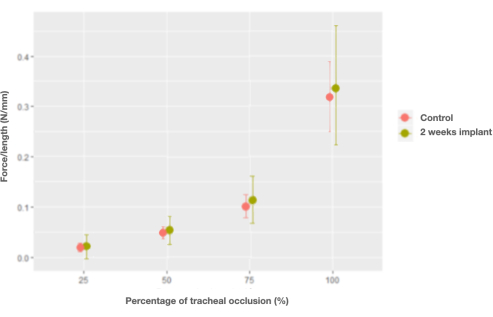
그림 7: 2주차에 단위 길이당 힘과 폐색 및 대조군(네이티브) 기관 대 기관 임플란트 비율 간의 상호 작용의 한계 효과 그래프. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 조사된 기관의 인장 시험. 대조군은 토착 토끼 기관입니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: 방사선 조사되고 탈세포화된 기관에 대한 압축 테스트. 대조군은 토착 토끼 기관입니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
존재하는 몇 가지 살균 전략이 있습니다. 초임계 CO2는 조직을 완전히 관통하여 배지를 산성화하고 임플란트 8,14,25의 감압에 의한 간단한 제거로 세포 인지질 이중층을 분해합니다. 자외선도 사용되어 왔으며 설치류 기관에서의 효과가 발표되었지만 문헌10에는 몇 가지 보고서 만 있습니다. 사용된 다른 방법으로는 과초산, 에탄올, 과산화산소 또는 전해수와 같은 물질의 적용이 포함되는데, 이는 불규칙한 결과를 제공하고 조직에 큰 영향을 미치는 것으로 나타났습니다11,12. 앞서 언급 한 전략과는 달리, 감마선 조사는 살균 측면에서 완전히 효과적 일뿐만 아니라 복용량과 살균 효과에 관해서도 철저하고 풍부하게 연구되었습니다. 사실, 인간에게 이식 될 불활성 물질의 살균 선량이 25 kGy13,14,15로 설정되어있는 살균에 감마선 사용에 대한 ISO 표준이 있다는 것이 너무 많이 연구되었습니다.
한편, 살균 물질 이외에, 방사선 조사는 기술의 한계로서 부수적 효과를 유발하는 것으로 나타났다. 여기에는 콜라겐을 포함한 단백질 분자를 변성시키고 독성을 유발할 수 있는 잔류 분자를 생성하여 매트릭스를 파괴 및 변경하는 것이 포함됩니다. 이러한 장기 구조의 열화는 결과적으로 생물학적 및 생체역학적 특성 모두에 영향을 미치며, 방사선 조사의 해로운 영향은 선량에 정비례하고 상대적으로 낮은 선량에서 관찰됩니다 13,14,15,16,17. 따라서 여기서, 목적은 두 가지였다: 한편으로는 생존 가능한 임플란트를 보장하기 위해 멸균 구조물을 얻는 것이고, 다른 한편으로는 매트릭스의 생물학적 및 생체역학적 특성을 보존하는 것인데, 둘 다 유지되지 않으면 임플란트는 무의미할 것이기 때문이다26. 따라서 도전 과제는 성공적인 살균과 조직 구조 보존 사이의 균형을 허용하는 전략을 선택하는 것이 었습니다.
본원에서, 1 kGy는 멸균을 위한 최소 용량으로 설정되었다. 조직 학적 검사는이 방사선 조사량이 조직에 영향을 미치지 않는 것으로 나타났습니다. 또한, 조사된 기관의 생체역학적 특성화는 조사의 사용이 견인 매개변수에 전혀 차이가 없음을 결정했습니다. 기관이 방사형 압축 시험에서 견딜 수 있었던 단위 길이당 힘이 약간이지만 통계적으로 유의미하게 감소했지만 이는 다른 방사형 특성에는 영향을 미치지 않습니다.
멸균의 불가능성과 1.5kGy19의 낮은 선량으로 인한 파괴에 대해 논의하는 몇 가지 논문이 있지만, 대다수는 제시된 데이터 2,18,19와 일치합니다. 이러한 방식으로 저자들은 10, 15, 20 및 25 kGy 용량의 뼈 멸균이 완전한 멸균을 달성하지만, 15 kGy 이상의 용량에서 세포 배양 용량의 감소와 콜라겐 분해 생성물의 증가를 관찰합니다18. 1.5 kGy의 용량은 탈세포 화 된 심장 판막에서 멸균을 얻지 못했지만 생체 내 및 시험관 내에서 표본의 기계적 특성에 손상을 입혔습니다. 한편, 3 kGy의 용량은 살균을 달성했지만 구조화와 섬유증을 일으켰다19. 기관과 관련하여 Johnson et al. ISO 선량 25kGy에서 멸균 효과를 5kGy 선량과 비교했습니다. 두 용량 모두 최종 멸균을 얻었으며, 5kGy의 용량은 표본의 구조를 약간 변경하고 25kGy의 용량은 기관을 완전히 파괴했습니다2.
또한, 2 주 후에 임플란트와 관련하여 감염 사건이 없기 때문에 효과적인 살균이 확인되며, 살균은 장기에 의해 완전히 용인됩니다. 또한 장기의 괴사나 변성 없이 구조가 완전히 보존되었습니다. 또한, 추가 발견으로, 생체역학적 특성의 사소한 변화(기관이 단위 길이당 견딜 수 있는 힘)가 이식 후 2주 만에 천연 기관의 값으로 되돌아가는 것이 관찰되었습니다. 따라서 이 효과는 시공물의 최종 관리에 따라 무시할 수 있습니다.
따라서이 논문은 권장 용량 인 25 kGy보다 훨씬 낮은 용량으로 완전히 멸균 된 장기를 얻을 수있는 가능성을 제시합니다. 이 제안은 1kGy의 용량으로 뉴질랜드 토끼 기관의 살균 문제를 해결합니다. 이 용량은 이러한 기관의 조직학적, 초구조적 및 생체역학적 특성이 유지되도록 하고 이식에 대한 완벽한 내성을 보여줍니다. 이 연구의 한계는 멸균 된 토끼 기관에서만 수행된다는 것인데, 일반적으로 크기가 작기 때문에 더 낮은 용량이 필요합니다. 그러나 불활성 임플란트에 대한 ISO 표준에서 확립 된 지나치게 높은 수치는 탈세포 화 된 기관의 살균에 필요하지 않으므로 조직에 대한 피해가 크게 감소하기 때문에 큰 성과라고 결론 지을 수 있습니다. 또한, 향후 연구에서 동물에 따라, 따라서 기관의 크기에 따라 이러한 용량은 결과적으로 장기의 구조와 기능을 더 존중하는 훨씬 더 낮은 용량으로 조정될 수 있습니다.
공개
저자 중 누구도 이해 상충이 없습니다.
감사의 말
이 논문은 2018년 스페인 흉부외과 학회(Spanish Society of Thoracic Surgery)의 지원을 받아 국립 다중심 연구(National Multicentric Study)[Néstor J.Martínez-Hernández에게 수여된 180101번] 및 Instituto de Salud Carlos III의 PI16-01315[Manuel Mata-Roig에게 수여됨]의 지원을 받았습니다. CIBERER는 VI National R & D & I Plan 2018-2011, Iniciativa Ingenio 2010, Consolider Program, CIBER Actions 및 Instituto de Salud Carlos III의 지원을 받아 유럽 지역 개발 기금 (European Regional Development Fund)의 지원을 받고 있습니다.
자료
| Name | Company | Catalog Number | Comments |
| 6-0 nylon monofilament suture | Monosoft. Covidien; Mansfield, MA, USA | SN-5698G | |
| Amphotericin B 5% | Gibco Thermo Fisher Scientific; Waltham, MA USA | 15290018 | |
| Bioanalyzer | Agilent, Santa Clara, CA, USA | G2939BA | |
| Buprenorphine | Buprex. Reckitt Benckiser Healthcare; Hull, Reino Unido | N02AE01 | |
| Compression desktop UTM | Microtest, Madrid, Spain | EM1/10/FR | |
| Cryostate | Leyca CM3059, Leyca Biosystems, Wetzlar, Alemania | CM3059 | |
| DAPI (4',6-diamino-2-phenylindole) | DAPI. Sigma-Aldrich, Missouri, USA | D9542 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich; MO, USA | D2650 | |
| DMEM | Thermo Fisher Scientific; Waltham, MA, USA | 11965084 | |
| DNA extraction kit | DNeasy extraction kit Quiagen, Hilden, Germany | 4368814 | |
| Enrofloxacin, 2.5% | Boehringer Ingelheim, Ingelheim am Rhein, Germany | 0035-0002 | |
| Fetal bovine serum (FBS) | GE Healthcare Hyclone; Madrid, Spain | SH20898.03IR | |
| Fluorescence microscope | Leyca DM2500 (Leica, Wetzlar, Germany) | DM2500?? | |
| Freezing Container | Mr Frosty. Thermo Fisher; Madrid, Spain | 5100-0001 | |
| Isofluorane | Isoflo; Proyma Ganadera; Ciudad Real, Spain | 8.43603E+12 | |
| Ketamin | Imalgene. Merial; Toulouse, Francia | BOE127823 | |
| Linear accelerator | "True Beam". Varian, Palo Alto, California, USA | H191001 | |
| Magnetic stirrer | Orbital Shaker PSU-10i. Biosan; Riga, Letonia | BS-010144-AAN | |
| Meloxicam 5 mg/ml | Boehringer Ingelheim, Ingelheim am Rhein, Germany | 6283-MV | |
| OCT (Optimal Cutting Temperature Compound) | Fischer Scientific, Madrid, Spain | 12678646 | |
| Penicillin-streptomycin 5% | Gibco Thermo Fisher Scientific; Waltham, MA USA | 15140122 | |
| Pentobarbital sodium | Dolethal. Vetoquinol; Madrid, España | 3.60587E+12 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich; MO, USA | P2272 | |
| Propofol | Propofol Lipuro. B. Braun Melsungen AG; Melsungen, Alemania | G 151030 | |
| Proteinase K | Gibco Thermo Fisher Scientific; Waltham, Massachussetts, USA | S3020 | |
| PVC hollow tubes | Cristallo Extra; FITT, Sandrigo, Italy | hhdddyyZ | |
| PVC stent | ArgyleTM Medtronic; Istanbul, Turkey | 019 5305 1 | |
| R software, Version 3.5.3 R Core | R Foundation for Statistical Computing | R 3.5.3 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich; MO, USA | 8,17,034 | |
| Spectrophotometer | Nanodrop, Life Technologies; Isogen Life Science. Utrech, Netherlands | ND-ONEC-W | |
| Spreadsheet | Microsoft Excel for Mac, Version 16.23, Redmond, WA, USA | 2864993241 | |
| Traction Universal Testing Machine | Testing Machines, Veenendaal, Netherlands | 84-01 | |
| UTM Software | TestWorks 4, MTS Systems Corporation, Eden Prairie, MN, USA | 100-093-627 F | |
| VECTASHIELD Mounting Medium | Vector Labs, Burlingame; CA; USA | H-1000-10 | |
| Xylacine | Xilagesic. Calier; Barcelona, España | 20102-003 |
참고문헌
- Ch'ng, S., et al. Reconstruction of the (Crico)trachea for malignancy in the virgin and irradiated neck. Journal of Plastic, Reconstructive & Aesthetic Surgery. 65 (12), 1645-1653 (2012).
- Johnson, C. M., Guo, D. H., Ryals, S., Postma, G. N., Weinberger, P. M. The feasibility of gamma radiation sterilization for decellularized tracheal grafts. Laryngoscope. 127 (8), 258-264 (2017).
- de Donato, G., et al. Prosthesis infection: prevention and treatment. The Journal of Cardiovascular Surgery. 55 (6), 779-792 (2014).
- Vangsness, C. T., Dellamaggiora, R. D. Current safety sterilization and tissue banking issues for soft tissue allografts. Clinics in Sports Medicine. 28 (2), 183-189 (2009).
- Den Hondt, M., Vanaudenaerde, B. M., Delaere, P., Vranckx, J. J. Twenty years of experience with the rabbit model, a versatile model for tracheal transplantation research. Plastic and Aesthetic Research. 3 (7), 223-230 (2016).
- Hysi, I., et al. Successful orthotopic transplantation of short tracheal segments without immunosuppressive therapy. European Journal of Cardiothoracic Surgery. 47 (2), 54-61 (2015).
- Wurtz, A., et al. Tracheal reconstruction with a composite graft: Fascial flap-wrapped allogenic aorta with external cartilage-ring support. Interactive Cardiovascular and Thoracic Surgery. 16 (1), 37-43 (2013).
- White, A., Burns, D., Christensen, T. W. Effective terminal sterilization using supercritical carbon dioxide. Journal of Biotechnology. 123 (4), 504-515 (2006).
- Qiu, Q. Q., et al. Inactivation of bacterial spores and viruses in biological material using supercritical carbon dioxide with sterilant. Journal of Biomedical Materials Research. Part B, Applied Biomaterials. 91 (2), 572-578 (2009).
- Lange, P., et al. Pilot study of a novel vacuum-assisted method for decellularization of tracheae for clinical tissue engineering applications. Journal of Tissue Engineering and Regenerative Medicine. 11 (3), 800-811 (2017).
- Wedum, A. G., Hanel, E., Phillips, G. B. Ultraviolet sterilization in microbiological laboratories. Public Health Reports. 71 (4), 331-336 (1956).
- Hennessy, R. S., et al. Supercritical carbon dioxide-based sterilization of decellularized heart valves. JACC. Basic to Translational Science. 2 (1), 71-84 (2017).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Balestrini, J. L., et al. Sterilization of lung matrices by supercritical carbon dioxide. Tissue Engineering. Part C, Methods. 22 (3), 260-269 (2016).
- AENOR. UNE-EN. ISO 11737-1:2006. Esterilización de productos sanitarios. Métodos biológicos. Parte 1: Determinación de la población de microorganismos en los productos. AENOR. UNE-EN. , (2006).
- Uriarte, J. J., et al. Mechanical properties of acellular mouse lungs after sterilization by gamma irradiation. Journal of the Mechanical Behavior of Biomedical Materials. 40, 168-177 (2014).
- Sun, W. Q., Leung, P. Calorimetric study of extracellular tissue matrix degradation and instability after gamma irradiation. Acta Biomaterialia. 4 (4), 817-826 (2008).
- Nguyen, H., et al. Reducing the radiation sterilization dose improves mechanical and biological quality while retaining sterility assurance levels of bone allografts. Bone. 57 (1), 194-200 (2013).
- Helder, M. R. K., et al. Low-dose gamma irradiation of decellularized heart valves results in tissue injury in vitro and in vivo. The Annals of Thoracic Surgery. 101 (2), 667-674 (2016).
- Martínez-Hernández, N. J., et al. Decellularized tracheal prelamination implant: A proposed bilateral double organ technique. Artificial Organs. 45 (12), 1491-1500 (2021).
- Feldman, A. T., Wolfe, D. Tissue processing and hematoxylin and eosin staining. Methods in Molecular Biology. 1180, 31-43 (2014).
- López Caballero, J., Peña, M., De Federico, M. Coloraciones para fibras colágenas y elásticas del tejido conjuntivo. Coloraciones para sustancia amiloidea. Laboratorio de Anatomía Patologica. , 175-195 (1993).
- Martínez-Hernández, N. J., et al. A standardised approach to the biomechanical evaluation of tracheal grafts. Biomolecules. 11 (10), 1461 (2021).
- Kajbafzadeh, A. M., Javan-Farazmand, N., Monajemzadeh, M., Baghayee, A. Determining the optimal decellularization and sterilization protocol for preparing a tissue scaffold of a human-sized liver tissue. Tissue Engineering. Part C, Methods. 19 (8), 642-651 (2013).
- Wehmeyer, J. L., Natesan, S., Christy, R. J. Development of a sterile amniotic membrane tissue graft using supercritical carbon dioxide. Tissue Engineering. Part C, Methods. 21 (7), 649-659 (2015).
- Ross, E. A., et al. Mouse stem cells seeded into decellularized rat kidney scaffolds endothelialize and remodel basement membranes. Organogenesis. 8 (2), 49-55 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유