Method Article
Stérilisation par rayonnement gamma à faible dose pour les greffes trachéales décellularisées
Dans cet article
Résumé
L’obtention de la stérilisation est essentielle pour la greffe de tissu trachéal. Nous présentons ici un protocole de stérilisation utilisant une irradiation gamma à faible dose qui est entièrement tolérée par les organes.
Résumé
L’un des principaux aspects clés pour assurer l’évolution correcte d’une greffe est la stérilité du milieu. La transplantation trachéale décellularisée consiste à implanter un organe qui était à l’origine en contact avec l’environnement, n’étant donc pas stérile dès le départ. Bien que le protocole de décellularisation (par exposition au détergent [dodécylsulfate de sodium à 2%), agitation continue et chocs osmotiques) soit effectué conformément aux mesures aseptiques, il ne permet pas la stérilisation. Par conséquent, l’un des principaux défis est d’assurer la stérilité avant l’implantation in vivo . Bien qu’il existe des protocoles établis de stérilisation par rayonnement gamma pour les matières inorganiques, il n’existe pas de telles mesures pour les matières organiques. De plus, les protocoles en place pour les matières inorganiques ne peuvent pas être appliqués aux matières organiques, car la dose de rayonnement établie (25 kGy) détruirait complètement l’implant. Cet article étudie l’effet d’une dose de rayonnement accrue dans une trachée de lapin décellularisée. Nous avons maintenu la plage de doses (kGy) et testé les doses croissantes jusqu’à ce que nous trouvions la dose minimale à laquelle la stérilisation est réalisée. Après avoir déterminé la dose, nous en avons étudié les effets sur l’organe, à la fois histologiquement et biomécaniquement. Nous avons déterminé que même si 0,5 kGy n’atteignait pas la stérilité, des doses de 1 kGy et de 2 kGy l’étaient, 1 kGy étant donc la dose minimale nécessaire pour obtenir la stérilisation. Les études microscopiques n’ont montré aucun changement pertinent par rapport aux organes non stérilisés. Les caractéristiques biomécaniques axiales n’ont pas été modifiées du tout, et seule une légère réduction de la force par unité de longueur que l’organe peut tolérer radialement a été observée. Nous pouvons donc conclure que 1 kGy permet une stérilisation complète de la trachée de lapin décellularisée avec des effets minimes, voire nuls, sur l’organe.
Introduction
La stérilisation d’un implant est une condition de base pour sa viabilité; En fait, les prothèses qui ont fait leurs preuves sont celles implantées dans des zones stériles (vaisseaux sanguins, cœur, os, etc.) 1. La trachée a deux surfaces : une surface en contact avec le milieu extérieur, qui n’est donc pas stérile, et une surface vers le médiastin, qui est stérile. Par conséquent, à partir du moment où la trachée est extraite, ce n’est pas un organe stérile. Bien que le processus de décellularisation ultérieur soit effectué dans des conditions stériles maximales, il ne s’agit pas d’une étape de stérilisation2. L’implantation de corps étrangers entraîne en soi un risque d’infection en raison du microenvironnement probactérien qu’elle produit3et un risque de transmission de la maladie allant jusqu’à 0,014% du donneur au receveur, même si le matériel a été stérilisé4. Pour assurer une vascularisation correcte de la trachée, dans presque tous les protocoles de transplantation expérimentale, elle subit d’abord un implant hétérotopique 5,6,7 dans une zone stérile (muscle, fascia, épiploon, sous-cutané, etc.); En effet, l’implantation d’un élément non stérile dans ce milieu entraînerait une infection de la zone3.
Il existe une gamme de stratégies possibles pour obtenir un implant stérile. L’utilisation du CO2supercritique a permis d’obtenir une stérilisation terminale 8,9. D’autres méthodes, telles que le rayonnement ultraviolet ou le traitement avec des substances telles que l’acide peracétique, l’éthanol, le peroxyde d’oxygène et l’eau électrolysée, ont obtenu des taux de réussite différents dans la stérilisation, presque toujours en fonction de leurs dosages, mais il a été démontré qu’elles affectent les caractéristiques biomécaniques des implants. En effet, certaines substances, comme l’oxyde d’éthylène, peuvent modifier substantiellement la structure de la matrice implantée et peuvent même provoquer des effets immunogènes indésirables. Pour cette raison, bon nombre de ces stratégies ne peuvent pas être appliquées aux modèles biologiques 2,10,11,12,13.
La stratégie de stérilisation la plus étudiée et acceptée est celle établie par la norme ISO 11737-1:2006 pour la stérilisation des dispositifs médicaux implantés chez l’homme, avec une dose de rayonnement gamma de 25 kGy. Cependant, ce règlement se concentre uniquement sur la stérilisation des éléments inertes et non biologiques14,15. De plus, les doses de radiothérapie dans le traitement radical du carcinome sont inférieures de trois ordres de grandeur à celles utilisées pour stériliser les dispositifs médicaux1. Dans cette optique, nous pouvons conclure que ladite dose tuerait non seulement le microbiote, mais détruirait et modifierait radicalement la structure biologique de l’implant. Il est également possible qu’il génère des lipides résiduels lors de la dégradation, ce qui peut potentiellement être cytotoxique et accélérer la dégradation enzymatique de l’échafaudage 13,14,15,16,17, même en utilisant des doses aussi faibles que 1,9 kGy et avec des dommages directement proportionnels à la dose de rayonnement reçue 17.
Ainsi, l’objectif de cet article est d’essayer d’identifier la dose de rayonnement qui permet d’obtenir un implant stérile avec un minimum d’effets nocifs causés par l’irradiation 2,18,19. La stratégie que nous avons suivie impliquait l’irradiation de trachées décellularisées et irradiées à différentes doses accrues dans une gamme de kilograys (0,5, 1, 2, 3 kGy, etc.), jusqu’à obtenir une culture négative. Des tests supplémentaires ont été effectués pour les doses qui ont obtenu des cultures négatives, afin de confirmer la stérilisation. Après avoir déterminé la dose minimale pour obtenir la stérilisation, l’impact structurel et biomécanique de l’irradiation sur la trachée a été vérifié. Tous les paramètres ont été comparés avec les trachées de lapin indigènes témoins. La stérilisation de la construction a ensuite été testée in vivo en implantant les trachées dans des lapins blancs néo-zélandais.
Protocole
La directive européenne 20170/63/UE pour le soin et l’utilisation des animaux de laboratoire a été respectée et le protocole d’étude a été approuvé par le Comité d’éthique de l’Université de Valence (loi 86/609/CEE et 214/1997 et Code 2018/VSC/PEA/0122 Type 2 du gouvernement de Valence, Espagne).
1. Décellularisation trachéale
NOTE: La méthode de décellularisation a été signalée ailleurs20.
- Euthanasier des lapins blancs de Nouvelle-Zélande mâles mâles adultes (Oryctolagus cuniculus) pesant de 3,5 à 4,1 kg avec 133 mg/kg de pentobarbital sodique, en injectant 200 mg/mL par la veine marginale de l’oreille.
- Tout en assurant des conditions d’asepsie, effectuez une cervicotomie longitudinale centrale, disséquez les muscles cervicaux et approchez la trachée. Disséquer l’organe circonférentiellement et longitudinalement. Enfin, transectez sous le premier anneau et juste au-dessus de la carène.
- Avec un scalpel, couper les trachées en morceaux de 2 cm. Avec des ciseaux, retirez le tissu conjonctif environnant et la couche6 de la muqueuse interne.
- Immerger les échantillons dans 12 mL de solution saline tamponnée au phosphate (PBS) contenant 2 % de dodécylsulfate de sodium (SDS), 5 % de pénicilline-streptomycine et 5 % d’amphotéricine B.
- Soumettre les trachées à une agitation constante à l’aide d’un agitateur magnétique à 400 tr/min pendant 5 semaines à température ambiante. Remplacer la solution de décellularisation chaque semaine après un choc osmotique de 2 h, par immersion de la trachée dans de l’eau distillée.
- Cryogéniser les échantillons à l’aide d’un mélange de 12 mL de sérum fœtal bovin (FBS) à 80 % et de 20 % de diméthylsulfoxyde (DMSO) dans un contenant congelé à -80 °C.
- Lorsque les trachées vont être utilisées (après 13-15 jours), décongelez-les au bain-marie à 37 °C et lavez-les en les immergeant dans du PBS une fois la décongélation terminée.
2. Stérilisation
- Irradiation
- Placer des lots de quatre morceaux trachéaux de 2 cm chacun dans un 20 mL de méthacrylate dans une fiole de culture T25 remplie de PBS jusqu’à ce qu’un volume total de 30 mL soit atteint. Veillez à éviter la formation de bulles qui pourraient provoquer une diffusion d’énergie dans l’interface air-liquide.
- Effectuer l’irradiation à l’aide d’un accélérateur linéaire, avec des photons d’une énergie nominale de 10 MV aplatissant les faisceaux sans filtre. Appliquer un débit de dose de 2 400 unités de surveillance par minute à l’isocentre, en plaçant les trachées à une distance source-surface de 100 cm à irradier, avec une profondeur de champ de 2,5 cm pour un champ de rayonnement de 10 cm x 10 cm - de manière à couvrir tout le récipient - correspondant à une dose de 24 Gy/min.
- Augmenter les doses avec chaque lot de quatre pièces; quatre pièces seront soumises à 0,5 kGy, quatre à 1 kGy, quatre à 2 kG, etc., jusqu’à ce que la stérilisation soit atteinte.
- Culture
- Introduire les morceaux dans 30 ml du milieu Eagle’s Medium modifié (DMEM) de Dulbecco avec 10% FBS inactivé sans antibiotiques ni antifongiques.
- Cultivez-les dans un incubateur de tissus standard à 37 °C et 5% de CO 2 pendant2 semaines et inspectez-les toutes les 24 heures.
REMARQUE : Les paramètres de contamination sont les changements dans le pH du milieu de culture et, par conséquent, les changements dans la couleur et la turbidité du milieu. Les trachées ont été récoltées sur des lagomorphes exempts de germes, qui n’étaient pas malades et devaient donc être dépourvus de bactéries anaérobies dans leurs trachées.
3. Analyse histologique
NOTE: Colorer les morceaux avec de l’hématoxyline et de l’éosine21, le trichrome de Masson et l’orcéine22.
- Coloration DAPI
- Déterminer la viabilité tissulaire à l’aide du DAPI (4′,6-diamidino-2-phénylindole). Cette coloration bleu-fluorescente se lie fortement aux régions riches en adénine et en thymine dans les séquences d’ADN, et permet donc de visualiser l’ADN par microscopie à fluorescence.
- Incorporer les échantillons de tissus dans un composé à température de coupe optimale (OCT).
- Couper les échantillons à l’aide d’un cryostat.
- Lavez l’échantillon à teindre trois fois dans de l’eau distillée pour éliminer l’OCT. Placer dans un support de montage comprenant une solution de DAPI à 30 nM.
- Visualisez la fluorescence à l’aide de la microscopie à fluorescence.
- Analyse du contenu de l’ADN
- Couper des segments de trachée mesurant environ 3 mm de long à l’aide d’un scalpel.
- Incuber pendant 2 h dans la protéinase K (Table of Materials).
- Extrayez l’ADN avec un kit d’extraction d’ADN, en suivant les instructions du fabricant.
- Au moyen de la spectrophotométrie, déterminer la concentration d’ADN en mesurant l’absorbance à 260/280 à l’aide d’un spectrophotomètre.
- Mesurer la taille des échantillons d’ADN extraits par chromatographie capillaire avec un bioanalyseur.
4. Étude biomécanique
NOTA: La résistance trachéale aux forces longitudinales et transversales est mesurée par des essais de traction axiale et de compression radiale23.
- Mesure trachéale
- Mesurez la longueur trachéale, l’épaisseur de paroi et le diamètre extérieur à l’aide d’un étrier Vernier.
- Calculez les valeurs moyennes à partir de trois mesures aléatoires de chacune des variables.
- Dans les essais de compression radiale, calculer le diamètre antéropostérieur en détectant le point auquel la plaque entre en contact avec l’échantillon.
- Effectuer tous les tests à température ambiante.
- Essais de traction
- Effectuer des essais de traction sur une machine d’essai universelle (UTM) de bureau de traction, équipée d’une charge de 100 N (résolution de force de 0,1 N, 0,001 mm de position et 0,1 s). La machine d’essai est équipée de capteurs de force et de position, et est connectée à un ordinateur avec un logiciel spécialement conçu par le fabricant23.
- Enregistrez les données toutes les 0,4 s et exportez-les vers une feuille de calcul.
- Construire des mâchoires tendues adaptées au calibre moyen des trachées de lapin à partir de tubes creux en polychlorure de vinyle (PVC) cristallins monocouches purs et non toxiques d’un diamètre extérieur de 1 cm et d’une épaisseur de paroi de 1,5 mm.
- Couper les conduites en segments de 3 cm de long.
- Percez 12 trous préformés pour la suture termino-terminale, à 2 mm du bord des mâchoires et séparés par une distance de 2,5 mm, pour éviter les biais dus aux sutures.
- Fixer les tubes de verre PVC à la trachée de lapin par anastomose termino-terminale avec une suture continue à travers des trous préformés alternés (tous les 5 mm), à 2 mm du bord de la trachée et avec une suture monofilament en nylon 6-0.
- Étirer toutes les pièces à une vitesse de déplacement de 5,0 mm/min.
- Enregistrer les variables contrainte maximale (σ max, en N/mm2) et déformation (εmax, sans unités), ainsi que l’énergie stockée par unité de volume de trachée (W/Vol, en mJ/mm) et le module de Young (E, en MPa).
- Essais de compression radiale
- Effectuer des tests de compression radiale sur un UTM de bureau de compression, équipé d’un capteur de pesage de 15 N (résolution de force 0,001 N, position 0,001 mm et temps 0,1 s) pour obtenir des données de force (N), position (mm) et temps (s). Enregistrez les données et exportez-les vers une feuille de calcul à intervalles de 0,5 s.
- Placez les trachées avec la zone membraneuse reposant sur la plaque inférieure. La plaque monte progressivement vers la plaque supérieure à une vitesse constante de 5 mm/min.
- Calculez chaque unité par unité de longueur de l’échantillon (f en N/mm), de rigidité (R en Mpa·mm) et d’énergie par unité de surface (W / S en mJ/mm2) nécessaire pour obstruer complètement la trachée.
5. Technique chirurgicale
NOTE: La technique chirurgicale a été largement rapportée ailleurs20.
- Placez un stent en PVC intraluminal stérile, taille 14 Fr (ce qui lui permet de glisser librement sans comprimer les parois), avec une marge de 3-4 mm à chaque extrémité.
- Fixez l’endoprothèse avec un seul point de monofilament en nylon 6-0 à travers l’espace intercartilagineux du premier cartilage.
- Procéder à l’anesthésie des lapins.
- Prémédiquer les sujets (3,65-4,05 kg de lapins blancs néo-zélandais mâles) avec des analgésiques intramusculaires (35 mg / kg de kétamine) avec un sédatif, un relaxant musculaire et un analgésique (2,5 mg / kg de xylazine).
- Rasez la zone d’incision hors de la zone opératoire et nettoyez la zone chirurgicale pour enlever les poils.
- Administrer des analgésiques plus une antibioprophylaxie : 0,05 mg/kg de buprénorphine intramusculaire et 10 mg/kg d’enrofloxacine.
- Placez un cathéter veineux dans la veine marginale de l’oreille de chaque lapin.
- Inducter l’anesthésie avec un bolus intraveineux de 10 mg/kg de propofol.
- Surveillez les signes vitaux de l’animal à l’aide d’un électrocardiogramme à trois dérivations, d’une oxymétrie de pouls et d’une mesure de pression non invasive. Toutes les 30 minutes, appliquez du sérum physiologique sur les yeux pour prévenir la sécheresse sous anesthésie.
- Vérifiez le plan anesthésique à l’aide de la méthode du pincement des orteils.
- Maintenir l’anesthésie avec de l’isoflurane inhalé à 1,5% -2% de la concentration alvéolaire minimale sans perdre la ventilation spontanée et fournir un soutien thermique au lapin avec un coussin chauffant.
- Désinfectez la zone d’incision plusieurs fois dans un mouvement circulaire avec un gommage à base d’iode. Dans des conditions aseptiques en tout temps et avec du matériel stérile, pratiquer une incision thoracique centrale longitudinale de 3 cm et prélever des lambeaux pédiculaires bilatéraux composés d’un fascia pectoral et d’un composant musculaire.
- Enveloppez les trachées avec le lambeau dans quatre lapins, un sur chaque hémithorax (soit un total de huit trachées).
- Lorsque la chirurgie est terminée, inversez l’anesthésie en interrompant l’administration d’isoflurane.
- Période postopératoire
- Gardez les animaux dans la salle d’opération jusqu’à ce qu’ils soient complètement rétablis de l’anesthésie. Lorsqu’ils se sont complètement rétablis, retournez-les dans leur environnement avec d’autres lapins.
- Traiter les lapins avec des antibiotiques (0,5 mL/kg d’enrofloxacine à 2,5 %) et des analgésiques (5 mg/mL de méloxicam; 0,05 mL/kg de métacam) toutes les 24 heures pendant 5 jours.
- Laissez les implants in situ pendant la durée souhaitée.
- Avant l’euthanasie, prémédiquer les lapins avec des analgésiques intramusculaires (35 mg/kg de kétamine) et un sédatif, un relaxant musculaire et un analgésique (2,5 mg/kg de xylazine). Ensuite, euthanasier les lapins avec 133 mg/kg de pentobarbital sodique en injectant 200 mg/mL par la veine marginale de l’oreille et récolter les trachées.
- Effectuer des tests biomécaniques et histologiques sur les trachées.
6. Analyse statistique
- Ajustez tous les modèles par la méthode bayésienne sur le logiciel R, version 3.5.3 R Core (R Foundation for Statistical Computing. 2019).
- Analyser les variables de l’étude, à l’exception de f et R, à l’aide de modèles de régression linéaire multiples.
- Pour les variables f et R , appliquer des modèles de régression linéaire mixte. Dans ces modèles, en plus des variables d’intérêt liées au traitement et à l’état de chaque trachée, introduisez le pourcentage d’occlusion comme effet monotone et un terme indépendant par trachée comme facteur aléatoire.
Résultats
Décellularisation
La coloration DAPI montre l’absence d’ADN, et aucune valeur d’ADN supérieure à 50 ng n’a été détectée dans aucune des trachées par électrophorèse, tous les fragments étant inférieurs à 200 bp20.
Culture microbienne
Deux des huit pièces soumises à 0,5 kGy ont montré un changement de couleur en moins de 1 semaine. Aucune des pièces irradiées à 1 kGy et 2 kGy n’a montré de changement de couleur (Figure 1).
Analyse histologique
Aucun changement dans le schéma de distribution du collagène ou des fibres élastiques n’a été détecté dans aucun des échantillons analysés (figure 2).
Détermination de la dose de rayonnement
Compte tenu des résultats décrits ci-dessus, qui ont montré que l’irradiation à 0,5 kGy n’assurait pas la stérilisation de l’échantillon, alors que des doses de 1 kGy et 2 kGy le faisaient, nous avons établi la dose minimale d’irradiation possible pour obtenir la stérilisation du tissu à 1 kGy. Nous avons donc testé l’impact biomécanique de cette dose sur les trachées 2,17,23.
Étude biomécanique
Essais de traction axiale
Les données obtenues lors de l’essai de traction sur trachées irradiées sont présentées au tableau 1. La figure 3 montre les courbes contrainte-déformation et les points de rupture correspondants.
Ainsi, le fait de soumettre des morceaux trachéaux à une irradiation gamma à des fins de stérilisation, malgré une légère augmentation des valeurs détectées, n’entraîne pas d’effets significatifs sur les caractéristiques biomécaniques axiales des organes. Par conséquent, les deux σmax que les trachées peuvent tolérer (0,05 MPa; IC [-0,046, 0,144] MPa), ainsi que εmax (0,096 IC [-0,096, 0,281]), (0,022 MPa ; CI [-0,23, 0,274] MPa) et W / Vol (à partir de 0,044 mJ / mm3; IC [-0,018, 0,106] mJ/mm3), sont très légèrement augmentés dans cet échantillon, mais ne sont en aucun cas applicables à l’estimation de la population.
Essais de compression radiale
Les essais de compression effectués sur les trachées natives (témoins) et sur les trachées décellularisées, cryoconservées et irradiées sont présentés dans le tableau 2. Les graphiques correspondants peuvent être vus à la figure 4.
L’irradiation gamma ne provoque qu’une diminution minime mais significative des caractéristiques biomécaniques radiales de la force variable par unité de longueur, qui varie de -0,017 N/mm; IC [-0,042, -0,004] N/mm, tandis que les variations minimales détectées en W/Vol (0,044 mJ/mm3; CI [-0,018, 0,106] mJ/mm3), R (-0,018 MPa · mm; CI [-0,145, 0,083] MPa · mm) et W/S (-0,081 mJ/mm2; IC [-0,95, 0,74] mJ/mm2), ne sont en aucun cas applicables à l’estimation de la population (Figure 5).
Implant
Examen macroscopique
Aucun des animaux n’a présenté de symptômes inflammatoires ou infectieux au cours de la période postopératoire; Leur régime alimentaire a été rétabli comme prévu et les antibiotiques et les analgésiques ont été suspendus le cinquième jour. Lors de l’euthanasie, l’intégration de la trachée et du lambeau a été observée macroscopiquement, sans signes visibles d’inflammation.
Examen histologique
L’examen histologique a montré que le lambeau formait un tissu conjonctif très organisé - étroitement lié aux anneaux trachéaux, montrant une continuité entre eux et le tissu - sous la forme du périchondre de la trachée native. Le cartilage était intact et ne présentait aucun signe de nécrose. De plus, la présence de macrophages et de quelques cellules géantes isolées formant des feuilles a été observée. Outre la présence rare d’éosinophiles, une cellularité inflammatoire aiguë légère postopératoire habituelle a été observée (Figure 6). Une néovascularisation naissante a également été observée autour de la trachée.
Évaluation biomécanique
Après avoir été implantée dans le lagomorphe, les caractéristiques de la trachée sont restées inchangées, à l’exception de la force par unité de longueur, qui a récupéré les caractéristiques de la trachée native seulement 2 semaines après la greffe (0,006 N/mm, IC [-0,026, 0,04] N/mm) (Figure 7).

Figure 1 : Trachées irradiées dans le DMEM sans antibiotiques ni antifongiques. La couleur des deux spécimens à gauche (0,5 kGy) a changé, indiquant un changement de pH, et est un signe indirect de croissance bactérienne. Il y a également une turbidité accrue dans le premier spécimen à gauche. Les deux spécimens de droite (1 kGy) ne montrent aucun changement de couleur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
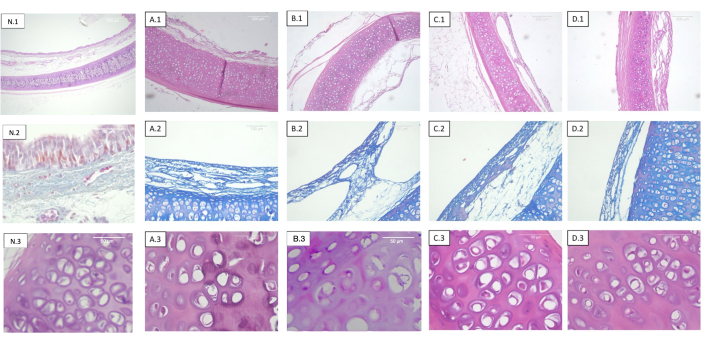
Figure 2 : Trachées décellularisées et irradiées à différentes doses. Chaque rangée correspond à une coloration différente et chaque colonne à un dosage de stérilisation différent. 1) Hématoxyline-éosine. Vue panoramique du cartilage, de la muqueuse, de la sous-muqueuse et de la séreuse. 2) La coloration trichrome de Masson. Sous-muqueuse trachéale. 3) Hématoxyline-éosine. Vue détaillée du cartilage trachéal. A) Trachées non irradiées (témoin). (B) Trachées irradiées à 0,5 kGy. C) Trachées irradiées à 1 kGy. D) Trachées irradiées à 2 kGy. L’absence de changements histologiques objectifs par rapport à la dose de rayonnement est observée. Abréviation : N = trachée indigène. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Courbes contrainte-déformation pour les trachées décellularisées et irradiées. Le point de rupture est marqué en orange. Veuillez cliquer ici pour voir une version agrandie de cette figure.
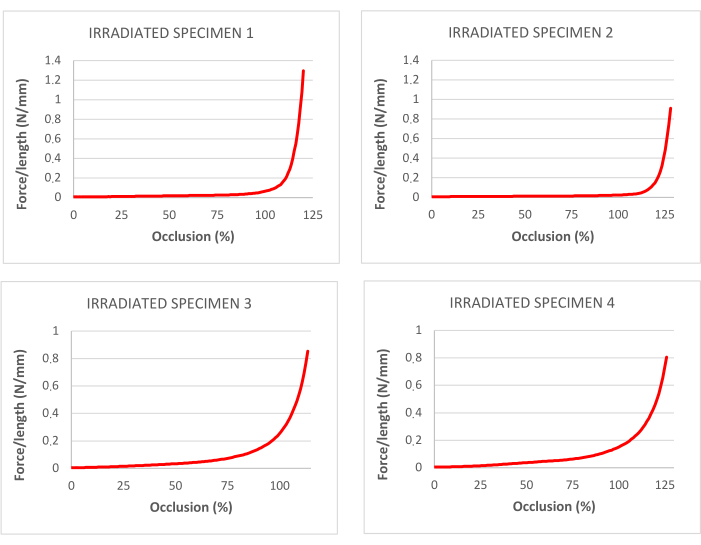
Figure 4 : courbes de pourcentage d’occlusion correspondant aux essais de traction dans les trachées décellularisées et irradiées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
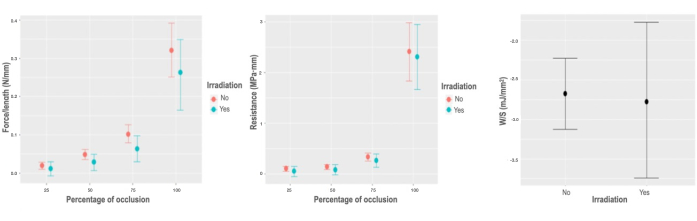
Figure 5 : Réponse biomécanique à l’irradiation. (A) Graphique des effets marginaux sur la force variable par unité de longueur, selon le pourcentage d’occlusion de l’interaction d’irradiation. (B) Graphique des effets marginaux sur la force variable par unité de longueur, selon le pourcentage d’occlusion de l’interaction d’irradiation. (C) Diagramme de dépendance partielle du modèle d’énergie stockée par unité de surface pour la variable d’irradiation. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Vue de la trachée implantée à 2 semaines. (A) Coloration trichrome de Masson. On observe un tissu conjonctif néoformé de la surface externe trachéale organisée en couches concentriques de fibres et de cellules. (B) Hématoxyline-éosine. Vue panoramique sur un cartilage parfaitement préservé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
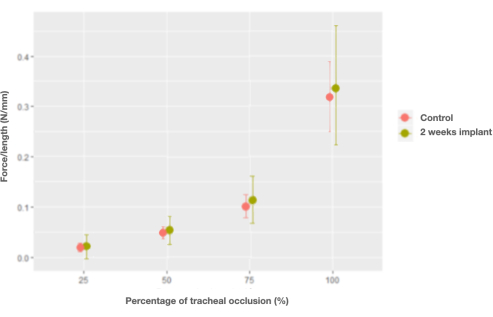
Figure 7 : Graphique des effets marginaux de l’interaction entre la force par unité de longueur et le pourcentage d’occlusion et de trachées témoins (natives) par rapport aux implants de trachée à 2 semaines. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1: Essais de traction sur trachées irradiées. Les témoins sont les trachées de lapin indigènes. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2: Essais de compression sur trachées irradiées et décellularisées. Les témoins sont les trachées de lapin indigènes. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Il existe plusieurs stratégies de stérilisation. LeCO2supercritique pénètre complètement dans les tissus, acidifiant le milieu et déconstruisant la bicouche phospholipide cellulaire par simple élimination par dépressurisation de l’implant 8,14,25. Le rayonnement ultraviolet a également été utilisé et son efficacité dans la trachée de rongeurs a été publiée, bien qu’il n’y ait que quelques rapports dans la littérature10. D’autres méthodes utilisées comprennent l’application de substances telles que l’acide peracétique, l’éthanol, le peroxyde d’oxygène ou l’eau électrolysée, qui ont donné des résultats irréguliers et ont montré qu’elles affectent grandement les tissus11,12. Contrairement aux stratégies susmentionnées, l’irradiation gamma s’est non seulement révélée totalement efficace en termes de stérilisation, mais a également été étudiée de manière approfondie et approfondie, tant en ce qui concerne sa dose que ses effets stérilisants. En fait, il a été tellement étudié qu’il existe une norme ISO pour l’utilisation du rayonnement gamma dans la stérilisation, dans laquelle la dose pour la stérilisation du matériel inerte à implanter chez l’homme est établie à 25 kGy13,14,15.
D’autre part, en plus du matériel stérilisant, il a également été démontré que l’irradiation provoque des effets collatéraux en tant que limitation de la technique. Il s’agit notamment de la destruction et de l’altération des matrices en dénaturant les molécules de protéines, y compris le collagène, et en générant des molécules résiduelles, qui peuvent même devenir toxiques. Cette dégradation de la structure de l’organe affecte donc à la fois ses caractéristiques biologiques et biomécaniques, les effets délétères de l’irradiation étant directement proportionnels à sa dose et étant observés à des doses relativement faibles 13,14,15,16,17. Ici, l’objectif était donc double : d’une part, obtenir une construction stérile afin d’assurer un implant viable, et d’autre part préserver les caractéristiques biologiques et biomécaniques de la matrice, car l’implant serait futile si les deux n’étaient pas maintenus26. Ainsi, le défi consistait à choisir une stratégie qui permettait un équilibre entre une stérilisation réussie et la préservation de la structure des tissus.
Ici, 1 kGy a été établi comme dose minimale pour la stérilisation. L’examen histologique a montré que cette dose d’irradiation n’a aucun impact sur le tissu. De plus, la caractérisation biomécanique des trachées irradiées a déterminé que l’utilisation de l’irradiation ne fait absolument aucune différence sur les paramètres de traction. Il y a eu une diminution légère mais statistiquement significative de la force par unité de longueur que la trachée a pu tolérer dans les essais de compression radiale, mais cela n’affecte pas ses autres caractéristiques radiales.
Bien qu’il existe quelques articles qui discutent de l’impossibilité de la stérilisation et de la déstructuration causée par des doses aussi faibles que 1,5 kGy 19, la grande majorité est conforme aux données présentées 2,18,19. De cette façon, les auteurs observent que la stérilisation osseuse à des doses de 10, 15, 20 et 25 kGy permet une stérilisation complète, bien qu’en échange d’une réduction de la capacité d’incubation cellulaire et d’une augmentation des produits de dégradation du collagène à des doses supérieures à 15 kGy18. Une dose de 1,5 kGy n’a pas permis d’obtenir la stérilisation dans des valves cardiaques décellularisées, mais a endommagé les qualités mécaniques des échantillons tant in vivo qu’in vitro; pendant ce temps, une dose de 3 kGy a permis une stérilisation, mais a provoqué une déstructuration et une fibrose19. En ce qui concerne la trachée, Johnson et al. ont comparé les effets de la stérilisation à la dose ISO de 25 kGy avec une dose de 5 kGy. Les deux doses ont obtenu une stérilisation terminale, la dose de 5 kGy modifiant légèrement la structure de l’échantillon et la dose de 25 kGy déstructurant complètement la trachée2.
De plus, une stérilisation efficace est confirmée grâce à l’absence d’événements infectieux en ce qui concerne l’implant après 2 semaines, la stérilisation étant entièrement tolérée par les organes. De plus, la structure a été complètement préservée, sans nécrose ni dénaturation de l’organe. En outre, à titre de constatation supplémentaire, il a été observé que la modification mineure des caractéristiques biomécaniques - à la force que la trachée est capable de tolérer par unité de longueur - est revenue aux valeurs d’une trachée native seulement 2 semaines après l’implantation; Par conséquent, cet effet peut être ignoré dans la gestion finale de la construction.
Par conséquent, cet article présente la possibilité d’obtenir des organes complètement stériles à des doses beaucoup plus faibles que la dose recommandée de 25 kGy; la proposition résout le problème de la stérilisation des trachées de lapin néo-zélandais avec une dose de 1 kGy. Cette dose assure le maintien des caractéristiques histologiques, ultrastructurelles et biomécaniques de ces organes et montre une parfaite tolérance à l’implantation. Une limite de l’étude est qu’elle est menée uniquement sur des trachées de lapin stérilisées, qui nécessitent généralement une dose plus faible en raison de leur plus petite taille; cependant, on peut conclure que les chiffres excessivement élevés établis dans la norme ISO pour les implants inertes ne sont pas nécessaires pour la stérilisation des trachées décellularisées, ce qui constitue une énorme réussite en raison de la réduction considérable des dommages causés aux tissus. De plus, dans les études futures, en fonction de l’animal, et donc de la taille de sa trachée, ces doses pourront être ajustées à des doses beaucoup plus faibles, par conséquent plus respectueuses de la structure et de la fonction de l’organe.
Déclarations de divulgation
Aucun des auteurs n’a de conflit d’intérêts.
Remerciements
Cet article a été soutenu par la subvention 2018 de la Société espagnole de chirurgie thoracique à l’étude multicentrique nationale [numéro 180101 attribué à Néstor J.Martínez-Hernández] et PI16-01315 [décerné à Manuel Mata-Roig] par l’Instituto de Salud Carlos III. CIBERER est financé par le VI Plan national de R&D&I 2018-2011, Iniciativa Ingenio 2010, le Programme de consolidation, les Actions CIBER et l’Instituto de Salud Carlos III, avec l’aide du Fonds européen de développement régional.
matériels
| Name | Company | Catalog Number | Comments |
| 6-0 nylon monofilament suture | Monosoft. Covidien; Mansfield, MA, USA | SN-5698G | |
| Amphotericin B 5% | Gibco Thermo Fisher Scientific; Waltham, MA USA | 15290018 | |
| Bioanalyzer | Agilent, Santa Clara, CA, USA | G2939BA | |
| Buprenorphine | Buprex. Reckitt Benckiser Healthcare; Hull, Reino Unido | N02AE01 | |
| Compression desktop UTM | Microtest, Madrid, Spain | EM1/10/FR | |
| Cryostate | Leyca CM3059, Leyca Biosystems, Wetzlar, Alemania | CM3059 | |
| DAPI (4',6-diamino-2-phenylindole) | DAPI. Sigma-Aldrich, Missouri, USA | D9542 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich; MO, USA | D2650 | |
| DMEM | Thermo Fisher Scientific; Waltham, MA, USA | 11965084 | |
| DNA extraction kit | DNeasy extraction kit Quiagen, Hilden, Germany | 4368814 | |
| Enrofloxacin, 2.5% | Boehringer Ingelheim, Ingelheim am Rhein, Germany | 0035-0002 | |
| Fetal bovine serum (FBS) | GE Healthcare Hyclone; Madrid, Spain | SH20898.03IR | |
| Fluorescence microscope | Leyca DM2500 (Leica, Wetzlar, Germany) | DM2500?? | |
| Freezing Container | Mr Frosty. Thermo Fisher; Madrid, Spain | 5100-0001 | |
| Isofluorane | Isoflo; Proyma Ganadera; Ciudad Real, Spain | 8.43603E+12 | |
| Ketamin | Imalgene. Merial; Toulouse, Francia | BOE127823 | |
| Linear accelerator | "True Beam". Varian, Palo Alto, California, USA | H191001 | |
| Magnetic stirrer | Orbital Shaker PSU-10i. Biosan; Riga, Letonia | BS-010144-AAN | |
| Meloxicam 5 mg/ml | Boehringer Ingelheim, Ingelheim am Rhein, Germany | 6283-MV | |
| OCT (Optimal Cutting Temperature Compound) | Fischer Scientific, Madrid, Spain | 12678646 | |
| Penicillin-streptomycin 5% | Gibco Thermo Fisher Scientific; Waltham, MA USA | 15140122 | |
| Pentobarbital sodium | Dolethal. Vetoquinol; Madrid, España | 3.60587E+12 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich; MO, USA | P2272 | |
| Propofol | Propofol Lipuro. B. Braun Melsungen AG; Melsungen, Alemania | G 151030 | |
| Proteinase K | Gibco Thermo Fisher Scientific; Waltham, Massachussetts, USA | S3020 | |
| PVC hollow tubes | Cristallo Extra; FITT, Sandrigo, Italy | hhdddyyZ | |
| PVC stent | ArgyleTM Medtronic; Istanbul, Turkey | 019 5305 1 | |
| R software, Version 3.5.3 R Core | R Foundation for Statistical Computing | R 3.5.3 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich; MO, USA | 8,17,034 | |
| Spectrophotometer | Nanodrop, Life Technologies; Isogen Life Science. Utrech, Netherlands | ND-ONEC-W | |
| Spreadsheet | Microsoft Excel for Mac, Version 16.23, Redmond, WA, USA | 2864993241 | |
| Traction Universal Testing Machine | Testing Machines, Veenendaal, Netherlands | 84-01 | |
| UTM Software | TestWorks 4, MTS Systems Corporation, Eden Prairie, MN, USA | 100-093-627 F | |
| VECTASHIELD Mounting Medium | Vector Labs, Burlingame; CA; USA | H-1000-10 | |
| Xylacine | Xilagesic. Calier; Barcelona, España | 20102-003 |
Références
- Ch'ng, S., et al. Reconstruction of the (Crico)trachea for malignancy in the virgin and irradiated neck. Journal of Plastic, Reconstructive & Aesthetic Surgery. 65 (12), 1645-1653 (2012).
- Johnson, C. M., Guo, D. H., Ryals, S., Postma, G. N., Weinberger, P. M. The feasibility of gamma radiation sterilization for decellularized tracheal grafts. Laryngoscope. 127 (8), 258-264 (2017).
- de Donato, G., et al. Prosthesis infection: prevention and treatment. The Journal of Cardiovascular Surgery. 55 (6), 779-792 (2014).
- Vangsness, C. T., Dellamaggiora, R. D. Current safety sterilization and tissue banking issues for soft tissue allografts. Clinics in Sports Medicine. 28 (2), 183-189 (2009).
- Den Hondt, M., Vanaudenaerde, B. M., Delaere, P., Vranckx, J. J. Twenty years of experience with the rabbit model, a versatile model for tracheal transplantation research. Plastic and Aesthetic Research. 3 (7), 223-230 (2016).
- Hysi, I., et al. Successful orthotopic transplantation of short tracheal segments without immunosuppressive therapy. European Journal of Cardiothoracic Surgery. 47 (2), 54-61 (2015).
- Wurtz, A., et al. Tracheal reconstruction with a composite graft: Fascial flap-wrapped allogenic aorta with external cartilage-ring support. Interactive Cardiovascular and Thoracic Surgery. 16 (1), 37-43 (2013).
- White, A., Burns, D., Christensen, T. W. Effective terminal sterilization using supercritical carbon dioxide. Journal of Biotechnology. 123 (4), 504-515 (2006).
- Qiu, Q. Q., et al. Inactivation of bacterial spores and viruses in biological material using supercritical carbon dioxide with sterilant. Journal of Biomedical Materials Research. Part B, Applied Biomaterials. 91 (2), 572-578 (2009).
- Lange, P., et al. Pilot study of a novel vacuum-assisted method for decellularization of tracheae for clinical tissue engineering applications. Journal of Tissue Engineering and Regenerative Medicine. 11 (3), 800-811 (2017).
- Wedum, A. G., Hanel, E., Phillips, G. B. Ultraviolet sterilization in microbiological laboratories. Public Health Reports. 71 (4), 331-336 (1956).
- Hennessy, R. S., et al. Supercritical carbon dioxide-based sterilization of decellularized heart valves. JACC. Basic to Translational Science. 2 (1), 71-84 (2017).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Balestrini, J. L., et al. Sterilization of lung matrices by supercritical carbon dioxide. Tissue Engineering. Part C, Methods. 22 (3), 260-269 (2016).
- AENOR. UNE-EN. ISO 11737-1:2006. Esterilización de productos sanitarios. Métodos biológicos. Parte 1: Determinación de la población de microorganismos en los productos. AENOR. UNE-EN. , (2006).
- Uriarte, J. J., et al. Mechanical properties of acellular mouse lungs after sterilization by gamma irradiation. Journal of the Mechanical Behavior of Biomedical Materials. 40, 168-177 (2014).
- Sun, W. Q., Leung, P. Calorimetric study of extracellular tissue matrix degradation and instability after gamma irradiation. Acta Biomaterialia. 4 (4), 817-826 (2008).
- Nguyen, H., et al. Reducing the radiation sterilization dose improves mechanical and biological quality while retaining sterility assurance levels of bone allografts. Bone. 57 (1), 194-200 (2013).
- Helder, M. R. K., et al. Low-dose gamma irradiation of decellularized heart valves results in tissue injury in vitro and in vivo. The Annals of Thoracic Surgery. 101 (2), 667-674 (2016).
- Martínez-Hernández, N. J., et al. Decellularized tracheal prelamination implant: A proposed bilateral double organ technique. Artificial Organs. 45 (12), 1491-1500 (2021).
- Feldman, A. T., Wolfe, D. Tissue processing and hematoxylin and eosin staining. Methods in Molecular Biology. 1180, 31-43 (2014).
- López Caballero, J., Peña, M., De Federico, M. Coloraciones para fibras colágenas y elásticas del tejido conjuntivo. Coloraciones para sustancia amiloidea. Laboratorio de Anatomía Patologica. , 175-195 (1993).
- Martínez-Hernández, N. J., et al. A standardised approach to the biomechanical evaluation of tracheal grafts. Biomolecules. 11 (10), 1461 (2021).
- Kajbafzadeh, A. M., Javan-Farazmand, N., Monajemzadeh, M., Baghayee, A. Determining the optimal decellularization and sterilization protocol for preparing a tissue scaffold of a human-sized liver tissue. Tissue Engineering. Part C, Methods. 19 (8), 642-651 (2013).
- Wehmeyer, J. L., Natesan, S., Christy, R. J. Development of a sterile amniotic membrane tissue graft using supercritical carbon dioxide. Tissue Engineering. Part C, Methods. 21 (7), 649-659 (2015).
- Ross, E. A., et al. Mouse stem cells seeded into decellularized rat kidney scaffolds endothelialize and remodel basement membranes. Organogenesis. 8 (2), 49-55 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon