Method Article
脱細胞化気管移植片のための低線量ガンマ線滅菌
要約
気管組織移植には滅菌が不可欠です。ここでは、臓器に完全に耐えられる低線量ガンマ線照射を使用した滅菌プロトコルを提示します。
要約
移植が正しく進化することを確実にするための主な重要な側面の1つは、培地の無菌性です。脱細胞化気管移植では、もともと環境と接触していた臓器を移植するため、最初から無菌ではありません。脱細胞化プロトコル(洗剤博覧会[2%ドデシル硫酸ナトリウム]、連続攪拌、浸透圧ショックによる)は無菌対策に沿って実施されますが、滅菌は提供されません。したがって、主な課題の1つは、 in vivo 移植前の無菌性を確保することです。無機材料には確立されたガンマ線滅菌プロトコルがありますが、有機材料にはそのような対策はありません。さらに、確立された放射線量(25 kGy)はインプラントを完全に破壊するため、無機材料に対して実施されているプロトコルを有機材料に適用することはできません。この論文は、脱細胞化ウサギ気管における放射線量の増加の影響を研究しています。用量範囲(kGy)を維持し、滅菌が達成される最小用量が見つかるまで、漸増用量をテストしました。用量を決定した後、組織学的および生体力学的に臓器への影響を研究しました。0.5 kGyは無菌性を達成しなかったが、1 kGyと2 kGyの両方の用量は無菌性を達成し、したがって1 kGyが滅菌を達成するために必要な最小用量であると判断した。顕微鏡研究では、滅菌されていない臓器と比較して関連する変化は示されませんでした。軸方向の生体力学的特性はまったく変化せず、臓器が放射状に耐えることができる単位長さあたりの力のわずかな減少のみが観察されました。したがって、1 kGyは、臓器への影響が最小限であるとしても、脱細胞化ウサギ気管の完全な滅菌を達成すると結論付けることができます。
概要
インプラントの滅菌は、その実行可能性の基本的な必要条件です。実際、成功していることが証明されているプロテーゼは、無菌領域(血管、心臓、骨など)に埋め込まれたものです。1.気管には、外部環境と接触する表面(したがって無菌ではない)と縦隔に向かう表面(無菌)の2つの表面があります。したがって、気管が抜去された瞬間から、それは無菌臓器ではありません。その後の脱細胞化プロセスが最大の無菌条件下で行われているにもかかわらず、それは滅菌工程2ではない。異物の移植自体は、それが生成する細菌微小環境による感染のリスクを伴います3 そして、材料が滅菌されていても、ドナーからレシピエントへの病気の伝染のリスクは最大0.014%です4。気管の正しい血管新生を確実にするために、ほとんどすべての実験的移植プロトコルにおいて、それは最初に無菌領域(筋肉、筋膜、大網、皮下など)に異所性インプラント5,6,7を受ける。これは、この培地に非滅菌要素を移植すると、領域3の感染につながるためです。
滅菌インプラントを得るための可能な戦略の範囲があります。超臨界CO2を用いて、最終滅菌8,9を達成した。紫外線照射や過酢酸、エタノール、過酸化酸素、電解水などの物質による処理などの他の方法は、ほとんどの場合、投与量に応じて滅菌の成功率が異なりますが、インプラントの生体力学的特性に影響を与えることが示されています。実際、エチレンオキシドなどのいくつかの物質は、移植されたマトリックスの構造を実質的に変化させる可能性があり、望ましくない免疫原性効果を引き起こす可能性さえあります。このため、これらの戦略の多くは、生物学的モデル2、10、11、12、13には適用できない。
最も広く研究され受け入れられている滅菌戦略は、ガンマ線量25 kGyのヒトに埋め込まれた医療機器の滅菌に関するISO 11737-1:2006規格によって確立されたものです。しかしながら、この規制は、不活性な非生物学的要素の滅菌にのみ焦点を当てている14,15。さらに、癌腫の根治的治療における放射線療法の線量は、医療機器の滅菌に使用される線量よりも3桁低くなっています1。これを念頭に置いて、上記の用量は微生物叢を殺すだけでなく、インプラントの生物学的構造を破壊し、根本的に変えると結論付けることができます。また、分解時に残留脂質を生成する可能性があり、これは細胞毒性があり、1.9 kGyという低い線量を使用し、受けた放射線量に正比例する損傷を伴う場合でも、足場13,14,15,16,17の酵素分解を加速する可能性があります17。
したがって、この論文の目的は、照射によって引き起こされる有害な影響を最小限に抑えて滅菌インプラントを得ることを可能にする放射線量を特定しようとすることです2,18,19。私たちが従った戦略は、負の培養を達成するまで、キログレイの範囲(0.5、1、2、3 kGyなど)内の異なるエスカレート線量で脱細胞化および照射された気管の照射を含みました。滅菌を確認するために、陰性培養を達成した用量について追加の試験を行った。滅菌を得るための最小線量を決定した後、気管に対する照射の構造的および生体力学的影響をチェックした。すべての測定基準を対照のネイティブウサギ気管と比較した。次に、構築物の滅菌を、気管をニュージーランドの白ウサギに移植することによってin vivoでテストしました。
プロトコル
実験動物の世話と使用に関する欧州指令20170/63 / EUが遵守され、研究プロトコルはバレンシア大学の倫理委員会によって承認されました(スペインのバレンシア政府の法律86/609 / EECおよび214/1997およびコード2018 / VSC / PEA / 0122タイプ2)。
1.気管脱細胞化
注:脱細胞化法は他の場所で報告されている20。
- 辺縁耳静脈からの200 mg / mL注射を使用して、体重3.5〜4.1 kg、133 mg / kgのペントバルビタールナトリウムでドナーのオスの成体ニュージーランド白ウサギ(Oryctolagus cuniculus)を安楽死させます。
- 無菌状態を確保しながら、中央縦頸部切開を行い、頸部筋を解剖し、気管にアプローチします。臓器を円周方向および縦方向に解剖します。最後に、最初のリングの下とカリーナのすぐ上を通過します。
- メスで、気管を2 cmの小片に分割します。ハサミで周囲の結合組織と粘膜内層6を取り除く。
- 2%ドデシル硫酸ナトリウム(SDS)、5%ペニシリン-ストレプトマイシン、および5%アムホテリシンBを含む12mLのリン酸緩衝生理食塩水(PBS)溶液に検体を沈めます。
- 気管をマグネチックスターラーで400rpmで室温で5週間絶えず攪拌します。気管を蒸留水に浸すことによって、2時間の浸透圧ショックの後、毎週脱細胞化溶液を交換してください。
- -80°Cの凍結容器で、80%ウシ胎児血清(FBS)と20%ジメチルスルホキシド(DMSO)の12 mL混合物を使用して検体を凍結します。
- 気管を使用する場合(13〜15日後)、37°Cの水浴で解凍し、解凍が完了したらPBSに浸して洗浄します。
2.滅菌
- 照射
- PBSで満たされたT25培養フラスコに、それぞれ2cmの4つの気管片のバッチを、総容量30mLに達するまでPBSで満たされた20 mLのメタクリレートに入れます。気液界面でのエネルギー拡散を引き起こす可能性のある気泡の形成を防ぐように注意してください。
- 線形加速器を使用して、公称エネルギー10 MVの光子を平坦化フィルターフリービームで照射します。等心に毎分2,400モニター単位の線量率を適用し、照射する光源表面距離100cm、放射線場10cm×10cmの被写界深度2.5cmで気管を配置し、容器全体を覆うようにし、24Gy/minの線量に対応する。
- 各4ピースバッチで用量をエスカレートします。滅菌に達するまで、4個は0.5 kGy、4〜1 kGy、4〜2 kGなどにさらされます。
- 文化
- 抗生物質や抗真菌剤を含まない不活化10%FBSを含むダルベッコ改変イーグル培地(DMEM)30 mLに小片を導入します。
- 標準的な組織インキュベーターで37°C、5%CO2で2週間培養し、24時間ごとに検査します。
注:汚染パラメータは、培地のpHの変化であり、したがって、培地の色と濁度の変化です。気管は無菌のウサギ目から採取されたが、これは病気ではなく、気管内に嫌気性細菌がないと予想される。
3.組織学的分析
注:ヘマトキシリンとエオジン21、マッソンのトリクローム、およびオルセイン22を使用してピースを染色します。
- ダピ染色
- DAPI(4',6-ジアミジノ-2-フェニルインドール)を使用して組織の生存率を決定します。この青色蛍光染色は、DNA配列のアデニンおよびチミンに富む領域に強く結合するため、蛍光顕微鏡 で DNAを見ることができます。
- 組織サンプルを最適な切断温度(OCT)コンパウンドに埋め込みます。
- クライオスタットを使用してサンプルを切断します。
- 染色するサンプルを蒸留水で3回洗浄してOCTを除去し、DAPIの30 nM溶液を含む封入剤に入れます。
- 蛍光顕微鏡を使用して蛍光を可視化します。
- DNA含量解析
- メスを使用して長さ約3 mmの気管のセグメントを切り取ります。
- プロテイナーゼK(材料表)中で2時間インキュベートします。
- 製造元の指示に従って、DNA抽出キットでDNAを抽出します。
- 分光光度法により、分光光度計を使用して260/280の吸光度を測定することにより、DNAの濃度を決定します。
- 抽出したDNAサンプルのサイズを、バイオアナライザー付きキャピラリークロマトグラフィーを用いて測定します。
4.生体力学的研究
注意: 縦方向および横方向の力に対する気管の抵抗は、軸方向の引張および半径方向の圧縮試験23によって測定されます。
- 気管測定
- 気管の長さ、肉厚、外径をノギスで測定します。
- 各変数の3つのランダム測定値から平均値を計算します。
- ラジアル圧縮試験では、プレートが試験片と接触する点を検出して前後直径を計算します。
- すべてのテストを室温で実行します。
- 引張試験
- 100 Nの荷重(0.1 Nの力分解能、0.001 mmの位置、0.1 s)を備えたトラクションデスクトップ万能試験機(UTM)変位制御で引張試験を実施します。試験機には力センサと位置センサが装備されており、メーカ23によって特別に設計されたソフトウェアを備えたコンピュータに接続されている。
- 0.4秒ごとにデータを記録し、スプレッドシートにエクスポートします。
- 外径1 cm、壁厚1.5 mmの純粋な単層無毒結晶ポリ塩化ビニル(PVC)中空チューブから、ウサギ気管の平均口径に適合した引張ジョーを構築します。
- 伝導を3 cmの長さのセグメントに分割します。
- 縫合糸による偏りを防ぐために、顎の端から2 mm、2.5 mmの距離だけ離された、末端縫合糸用の12個の事前に形成された穴を開けます。
- 気管の端から2 mm離れた交互の事前に形成された穴(5 mmごと)を通して連続縫合糸を使用し、6-0ナイロンモノフィラメント縫合糸を使用して、末端吻合によってPVCガラス管をウサギの気管に取り付けます。
- 5.0 mm/minの変位速度ですべてのピースを引き伸ばします。
- 最大応力(最大σ、N / mm2)およびひずみ(ε最大、単位なし)を、気管容積の単位あたりに蓄えられたエネルギー(W / Vol、mJ / mm)、およびヤング率(E、MPa)とともに記録します。
- ラジアル圧縮試験
- 15 Nロードセル(力分解能0.001 N、位置0.001 mm、時間0.1秒)を備えた圧縮デスクトップUTMでラジアル圧縮試験を行い、力データ(N)、位置(mm)、および時間を取得します。データを記録し、0.5秒間隔でスプレッドシートにエクスポートします。
- 膜領域を下のプレートに置いて気管を置きます。プレートは5mm/minの一定速度で天板に向かって徐々に上昇します。
- 気管を完全に閉塞させるために必要なサンプルの単位長さ(N / mmのf )、剛性(Mpa・mmのR)、および表面積の単位あたりのエネルギー(m J / mm2のW / S)のすべての単位を計算します。
5.手術手技
注:外科的手法は他の場所で広く報告されています20。
- サイズ14 Fr(壁を圧縮せずに自由にスライドできる)の滅菌管腔内PVCステントを、両端に3〜4 mmのマージンを置いて配置します。
- 最初の軟骨の軟骨間空間を通して単一の6-0ナイロンモノフィラメントステッチでステントを固定します。
- ウサギの麻酔に進みます。
- 鎮静剤、筋弛緩剤、鎮痛剤(2.5 mg / kgキシラジン)を含む筋肉内鎮痛薬(35 mg / kgケタミン)で被験者(3.65-4.05 kgのオスのニュージーランド白ウサギ)を事前に投与します。.
- 手術領域から切開領域を剃り、手術領域をきれいにして脱毛します。
- 鎮痛薬と抗生物質予防を投与します:0.05 mg / kg筋肉内ブプレノルフィンおよび10 mg / kgエンロフロキサシン。.
- 各ウサギの辺縁耳静脈に静脈カテーテルを入れます。
- プロポフォールの静脈内10 mg / kgボーラスによる誘導麻酔。
- 3誘導心電図、パルスオキシメトリ、および非侵襲的圧力測定を使用して、動物のバイタルサインを監視します。30分ごとに生理的血清を目に塗り、麻酔下での乾燥を防ぎます。
- つま先ピンチ法を使用して麻酔面を確認します。
- 自発換気を失うことなく、吸入イソフルランによる麻酔を最小肺胞濃度の1.5%〜2%に維持し、加熱パッドでウサギに熱サポートを提供します。
- ヨウ素ベースのスクラブで円を描くように切開ゾーンを数回消毒します。常に無菌条件下で、無菌材料を使用して、縦方向に3 cmの中央胸部切開を行い、胸筋膜と筋肉成分で構成される両側の有茎フラップを収穫します。
- 気管をフラップで包み、各半胸部に1匹ずつ、4匹のウサギを巻きます(したがって、合計8匹の気管)。
- 手術が完了したら、イソフルラン投与を中断して麻酔を逆にします。
- 術後期間
- 麻酔から完全に回復するまで、動物を手術室に保管してください。彼らが完全に回復したら、他のウサギと一緒に彼らの環境に戻します。
- ウサギを抗生物質(0.5 mL / kgの2.5%エンロフロキサシン)と鎮痛薬(5 mg / mLメロキシカム、0.05 mL / kgメタカム)で24時間ごとに5日間治療します。.
- インプラントを希望の時間 その場に置いて おきます。
- 安楽死の前に、筋肉内鎮痛薬(35 mg / kgケタミン)と鎮静剤、筋弛緩薬、鎮痛薬(2.5 mg / kgキシラジン)をウサギに事前に投与します。.次に、辺縁耳静脈から200 mg / mLの注射を使用して、133 mg / kgのペントバルビタールナトリウムでウサギを安楽死させ、気管を採取します。.
- 気管の生体力学的および組織学的検査を行います。
6. 統計解析
- R ソフトウェア、バージョン 3.5.3 R Core (R Foundation for Statistical Computing. 2019) でベイズ法ですべてのモデルを調整します。
- 多重線形回帰モデルを使用して、 f と R を除くスタディ変数を分析します。
- f 変数と R 変数には、混合線形回帰モデルを適用します。これらのモデルでは、各気管の治療と状態に関連する関心のある変数に加えて、単調効果として閉塞の割合を導入し、変量因子として気管あたりの独立項を導入します。
結果
脱細胞化
DAPI染色はDNAの不在を示し、電気泳動によっていずれの気管においても50ngを超えるDNA値は検出されず、すべての断片が200bp未満であった20。
微生物培養
0.5 kGyに供した8個のうち2個は1週間以内に色変化を示した。1 kGyと2 kGyで照射された破片はいずれも色の変化を示さなかった(図1)。
組織学的解析
コラーゲンまたは弾性線維の分布パターンの変化は、分析されたどの標本でも検出されませんでした(図2)。
放射線量の決定
以上の結果から、0.5 kGyでの照射では検体の滅菌が保証されないのに対し、1 kGyと2 kGyの照射では1 kGyの滅菌を達成するための最小照射線量を設定しました。したがって、気管に対するこの用量の生体力学的影響を試験した2、17、23。
生体力学的研究
軸方向引張試験
照射された気管に対する引張試験で得られたデータを 表 1に示す。 図3 は、対応する応力-ひずみ曲線と破断点を示しています。
したがって、滅菌目的で気管片をガンマ線照射に供することは、検出値をわずかに増加させるにもかかわらず、臓器の軸方向の生体力学的特性に有意な影響を引き起こさない。したがって、気管が許容できる最大σの両方(0.05 MPa;CI [-0.046, 0.144] MPa)、および最大ε (0.096 CI [-0.096, 0.281])、(0.022 MPa;CI [-0.23, 0.274] MPa)、およびW / Vol(0.044 mJ / mm3から;CI [-0.018, 0.106] mJ/mm3)は、このサンプルではごくわずかに増加していますが、いずれの場合も母集団推定値には当てはまりません。
ラジアル圧縮試験
天然気管(対照)と脱細胞化、凍結保存、および照射された気管の両方で実施された圧縮試験を 表 2に示します。対応するグラフを 図4に示します。
ガンマ線照射は、単位長さあたりの可変力で半径方向の生体力学的特性のごくわずかではあるが有意な減少のみを引き起こし、これは-0.017 N / mmで変化する。CI [-0.042, -0.004] N/mm、W/Volで検出された最小変動(0.044 mJ/mm3; CI [-0.018, 0.106] mJ/mm3), R (-0.018 MPa · mm;CI [-0.145, 0.083] MPa · mm)、およびW/S (-0.081 mJ/mm2;CI [-0.95, 0.74] mJ/mm2)は、母集団推定値には適用されない(図5)。
インプラント
肉眼検査
いずれの動物も術後期間中に炎症性または感染性の症状を示さなかった。彼らの食事は計画通りに再開され、抗生物質と鎮痛薬は5日目に中断されました。安楽死の際、気管と皮弁の統合が肉眼的に観察され、炎症の目に見える兆候はありませんでした。
組織学的検査
組織学的検査は、フラップが高度に組織化された結合組織を形成していることを示しました-気管輪に密接に関連し、それらと組織との間の連続性を示しています-天然気管の軟骨膜の形で。軟骨は無傷で、壊死の兆候は見られませんでした。さらに、マクロファージおよびシートを形成するいくつかの単離された巨細胞の存在が観察された。好酸球の存在が少ないこと以外に、通常の術後軽度の急性炎症細胞性が観察されました(図6)。気管周辺にも初期血管新生が認められた。
生体力学的評価
ウサギ形に移植された後、気管の特性は、移植後わずか2週間で天然気管の特性が回復した単位長さあたりの力を除いて変化しませんでした(0.006 N / mm、CI [-0.026、0.04] N / mm)(図7)。

図1:抗生物質または抗真菌剤を含まないDMEMで照射された気管。 左側の2つの標本の色(0.5 kGy)が変化し、pHの変化を示しており、細菌の増殖の間接的な兆候です。左側の最初の標本でも濁度が増加しています。右の2つの標本(1 kGy)は色の変化を示していません。 この図の拡大版を表示するには、ここをクリックしてください。
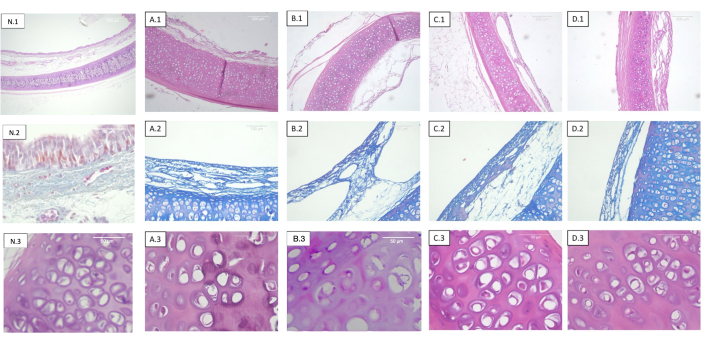
図2:気管を脱細胞化し、異なる線量で照射した。 各行は異なる染色に対応し、各列は異なる滅菌投与量に対応します。1)ヘマトキシリン-エオシン。軟骨、粘膜、粘膜下組織、および漿膜のパノラマビュー。2)マッソンのトリクローム染色。気管粘膜下組織。3)ヘマトキシリン-エオシン。気管軟骨の詳細図。(A)非照射気管(対照)。(B)気管は0.5kGyで照射された。(C)気管は1kGyで照射された。(D)気管は2kGyで照射された。放射線量に関する客観的な組織学的変化がないことが観察される。略語:N =ネイティブ気管。 この図の拡大版を表示するには、ここをクリックしてください。

図3:脱細胞化および照射された気管の応力-ひずみ曲線。 ブレークポイントはオレンジ色でマークされています。 この図の拡大版を表示するには、ここをクリックしてください。
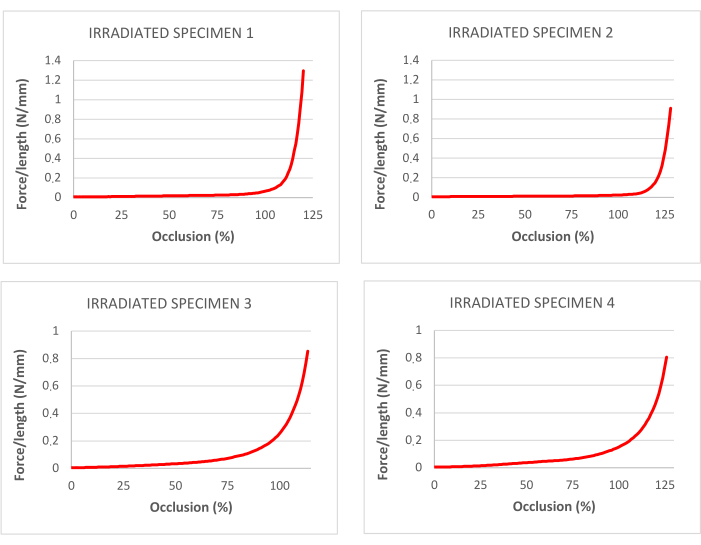
図4:脱細胞化および照射された気管における牽引試験に対応する閉塞の割合の曲線。 この図の拡大版を表示するには、ここをクリックしてください。
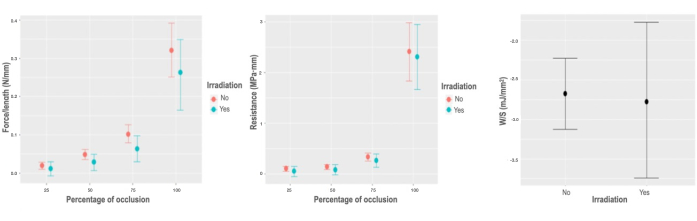
図5:照射に対する生体力学的応答。 (A)照射相互作用の閉塞の割合による、単位長さあたりの可変力に対する周辺効果のグラフ。(B)照射相互作用の閉塞の割合による、単位長さ当たりの可変力に対する周辺効果のグラフ。(C)照射変数の単位面積当たりの蓄積エネルギーモデルの部分依存プロット。 この図の拡大版を表示するには、ここをクリックしてください。

図6:2週間後の移植気管の図。 (A)マッソンのトリクローム染色。繊維および細胞の同心円状の層に組織された気管外表面の新形成結合組織が観察される。(B)ヘマトキシリン・エオシン。完全に保存された軟骨のパノラマビュー。この図の拡大版を表示するには、ここをクリックしてください。
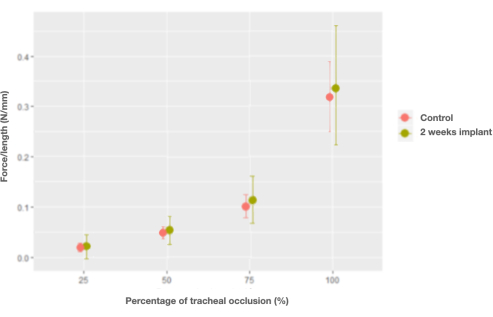
図7:2週間での単位長さあたりの力と閉塞および制御(ネイティブ)気管と気管インプラントの割合との相互作用の限界効果のグラフ。 この図の拡大版を表示するには、ここをクリックしてください。
表1:照射された気管の引張試験。 コントロールはネイティブのウサギの気管です。 この表をダウンロードするには、ここをクリックしてください。
表2:照射された脱細胞化気管の圧縮試験。 コントロールはネイティブのウサギの気管です。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
存在するいくつかの滅菌戦略があります。超臨界CO2は組織に完全に浸透し、培地を酸性化し、インプラントの減圧による単純な除去で細胞リン脂質二重層を分解する8、14、25。紫外線も使用されており、げっ歯類の気管におけるその有効性は発表されているが、文献10には少数の報告しかない。使用される他の方法には、過酢酸、エタノール、過酸化酸素、または電解水などの物質の適用が含まれ、これらは不規則な結果をもたらし、組織に大きな影響を与えることが示されています11,12。前述の戦略とは対照的に、ガンマ線照射は滅菌の面で完全に効果的であることが示されているだけでなく、その線量と滅菌効果の両方に関して徹底的かつ豊富に研究されています。実際、滅菌におけるガンマ線の使用に関するISO規格があり、ヒトに移植される不活性材料の滅菌のための線量は25 kGy13,14,15に確立されています。
一方、殺菌材料に加えて、照射は技術の限界として付随的な効果を引き起こすことも示されている。これらには、コラーゲンを含むタンパク質分子を変性させることによるマトリックスの破壊と変化、および有毒になる可能性のある残留分子の生成が含まれます。その結果、臓器構造のこの劣化は、その生物学的および生体力学的特性の両方に影響を及ぼし、放射線の有害な影響はその線量に正比例し、比較的低い線量で観察されます13,14,15,16,17。したがって、ここでの目的は2つありました:一方では、実行可能なインプラントを確保するために滅菌構築物を得ること、もう一方では、両方を維持しない限りインプラントは無駄であるため、マトリックスの生物学的および生体力学的特性を維持することです26。したがって、課題は、滅菌の成功と組織構造の維持のバランスを可能にする戦略を選択することでした。
ここでは、滅菌の最小線量として1kGyが確立された。組織学的検査は、この線量の照射が組織に影響を与えないことを示した。さらに、照射された気管の生体力学的特性評価により、照射の使用は牽引パラメータに全く違いをもたらさないと判断された。気管が半径方向の圧縮試験で許容できた単位長さあたりの力には、わずかではあるが統計的に有意な減少がありましたが、これは他の半径方向の特性には影響しません。
滅菌の不可能性と1.5 kGy 19という低い線量によって引き起こされる破壊について議論している論文がいくつかありますが、大多数は提示されたデータ2,18,19と一致しています。このようにして、著者らは、10、15、20、および25 kGyの用量で骨を滅菌すると、細胞インキュベーション能力の低下と15 kGyを超える用量でのコラーゲン分解生成物の増加と引き換えに、完全な滅菌を達成することを観察しました18。1.5 kGyの用量は、脱細胞化心臓弁では滅菌されませんでしたが、in vivoおよびin vitroの両方で検体の機械的品質に損傷を与えました。一方、3 kGyの用量は滅菌を達成しましたが、破壊と線維症を引き起こしました19。気管に関して、Johnsonらは、25kGyのISO線量と5kGyの線量での滅菌の効果を比較した。両方の用量は最終滅菌を得、5kGyの用量は検体の構造をわずかに変化させ、25kGyの用量は気管を完全に破壊した2。
さらに、2週間後にインプラントに関して感染イベントがないため、効果的な滅菌が確認され、滅菌は臓器によって完全に許容されます。また、構造は完全に保存されており、臓器の壊死や変性はありませんでした。さらに、追加の発見として、生体力学的特性のわずかな変化(気管が単位長さあたりに耐えることができる力)が、移植後わずか2週間でネイティブ気管の値に戻ることが観察されました。したがって、この効果は、構成の最終的な管理に従って無視できます。
したがって、この論文は、推奨用量の25 kGyよりもはるかに低い用量で完全に無菌の臓器を得る可能性を示しています。この提案は、ニュージーランドのウサギの気管を1 kGyの用量で滅菌することをトラブルシューティングします。この用量は、これらの臓器の組織学的、微細構造的、および生体力学的特性が維持されることを保証し、移植に対する完全な耐性を示します。この研究の制限は、サイズが小さいために一般的により少ない投与量を必要とする滅菌されたウサギの気管に対してのみ実施されることです。しかしながら、不活性インプラントのISO規格で確立された過度に高い数値は、脱細胞化気管の滅菌には必要ではなく、したがって組織への害が大幅に減少したため大きな成果であると結論付けることができます。さらに、将来の研究では、動物に応じて、したがってその気管のサイズに応じて、これらの用量は、結果として臓器の構造と機能をより尊重するはるかに低い用量に調整される可能性があります。
開示事項
著者の誰も利益相反を持っていません。
謝辞
この論文は、2018年のスペイン胸部外科学会の全国多中心研究助成金[ネストルJ.マルティネスエルナンデスに授与された番号180101]およびPI16-01315[マヌエルマタロイグに授与]によってサポートされました。CIBERERは、欧州地域開発基金の支援を受けて、VI National R&D&I PLAN 2018-2011、Iniciativa Ingenio 2010、Consolider Program、CIBER Actions、Instituto de Salud Carlos IIIから資金提供を受けています。
資料
| Name | Company | Catalog Number | Comments |
| 6-0 nylon monofilament suture | Monosoft. Covidien; Mansfield, MA, USA | SN-5698G | |
| Amphotericin B 5% | Gibco Thermo Fisher Scientific; Waltham, MA USA | 15290018 | |
| Bioanalyzer | Agilent, Santa Clara, CA, USA | G2939BA | |
| Buprenorphine | Buprex. Reckitt Benckiser Healthcare; Hull, Reino Unido | N02AE01 | |
| Compression desktop UTM | Microtest, Madrid, Spain | EM1/10/FR | |
| Cryostate | Leyca CM3059, Leyca Biosystems, Wetzlar, Alemania | CM3059 | |
| DAPI (4',6-diamino-2-phenylindole) | DAPI. Sigma-Aldrich, Missouri, USA | D9542 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich; MO, USA | D2650 | |
| DMEM | Thermo Fisher Scientific; Waltham, MA, USA | 11965084 | |
| DNA extraction kit | DNeasy extraction kit Quiagen, Hilden, Germany | 4368814 | |
| Enrofloxacin, 2.5% | Boehringer Ingelheim, Ingelheim am Rhein, Germany | 0035-0002 | |
| Fetal bovine serum (FBS) | GE Healthcare Hyclone; Madrid, Spain | SH20898.03IR | |
| Fluorescence microscope | Leyca DM2500 (Leica, Wetzlar, Germany) | DM2500?? | |
| Freezing Container | Mr Frosty. Thermo Fisher; Madrid, Spain | 5100-0001 | |
| Isofluorane | Isoflo; Proyma Ganadera; Ciudad Real, Spain | 8.43603E+12 | |
| Ketamin | Imalgene. Merial; Toulouse, Francia | BOE127823 | |
| Linear accelerator | "True Beam". Varian, Palo Alto, California, USA | H191001 | |
| Magnetic stirrer | Orbital Shaker PSU-10i. Biosan; Riga, Letonia | BS-010144-AAN | |
| Meloxicam 5 mg/ml | Boehringer Ingelheim, Ingelheim am Rhein, Germany | 6283-MV | |
| OCT (Optimal Cutting Temperature Compound) | Fischer Scientific, Madrid, Spain | 12678646 | |
| Penicillin-streptomycin 5% | Gibco Thermo Fisher Scientific; Waltham, MA USA | 15140122 | |
| Pentobarbital sodium | Dolethal. Vetoquinol; Madrid, España | 3.60587E+12 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich; MO, USA | P2272 | |
| Propofol | Propofol Lipuro. B. Braun Melsungen AG; Melsungen, Alemania | G 151030 | |
| Proteinase K | Gibco Thermo Fisher Scientific; Waltham, Massachussetts, USA | S3020 | |
| PVC hollow tubes | Cristallo Extra; FITT, Sandrigo, Italy | hhdddyyZ | |
| PVC stent | ArgyleTM Medtronic; Istanbul, Turkey | 019 5305 1 | |
| R software, Version 3.5.3 R Core | R Foundation for Statistical Computing | R 3.5.3 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich; MO, USA | 8,17,034 | |
| Spectrophotometer | Nanodrop, Life Technologies; Isogen Life Science. Utrech, Netherlands | ND-ONEC-W | |
| Spreadsheet | Microsoft Excel for Mac, Version 16.23, Redmond, WA, USA | 2864993241 | |
| Traction Universal Testing Machine | Testing Machines, Veenendaal, Netherlands | 84-01 | |
| UTM Software | TestWorks 4, MTS Systems Corporation, Eden Prairie, MN, USA | 100-093-627 F | |
| VECTASHIELD Mounting Medium | Vector Labs, Burlingame; CA; USA | H-1000-10 | |
| Xylacine | Xilagesic. Calier; Barcelona, España | 20102-003 |
参考文献
- Ch'ng, S., et al. Reconstruction of the (Crico)trachea for malignancy in the virgin and irradiated neck. Journal of Plastic, Reconstructive & Aesthetic Surgery. 65 (12), 1645-1653 (2012).
- Johnson, C. M., Guo, D. H., Ryals, S., Postma, G. N., Weinberger, P. M. The feasibility of gamma radiation sterilization for decellularized tracheal grafts. Laryngoscope. 127 (8), 258-264 (2017).
- de Donato, G., et al. Prosthesis infection: prevention and treatment. The Journal of Cardiovascular Surgery. 55 (6), 779-792 (2014).
- Vangsness, C. T., Dellamaggiora, R. D. Current safety sterilization and tissue banking issues for soft tissue allografts. Clinics in Sports Medicine. 28 (2), 183-189 (2009).
- Den Hondt, M., Vanaudenaerde, B. M., Delaere, P., Vranckx, J. J. Twenty years of experience with the rabbit model, a versatile model for tracheal transplantation research. Plastic and Aesthetic Research. 3 (7), 223-230 (2016).
- Hysi, I., et al. Successful orthotopic transplantation of short tracheal segments without immunosuppressive therapy. European Journal of Cardiothoracic Surgery. 47 (2), 54-61 (2015).
- Wurtz, A., et al. Tracheal reconstruction with a composite graft: Fascial flap-wrapped allogenic aorta with external cartilage-ring support. Interactive Cardiovascular and Thoracic Surgery. 16 (1), 37-43 (2013).
- White, A., Burns, D., Christensen, T. W. Effective terminal sterilization using supercritical carbon dioxide. Journal of Biotechnology. 123 (4), 504-515 (2006).
- Qiu, Q. Q., et al. Inactivation of bacterial spores and viruses in biological material using supercritical carbon dioxide with sterilant. Journal of Biomedical Materials Research. Part B, Applied Biomaterials. 91 (2), 572-578 (2009).
- Lange, P., et al. Pilot study of a novel vacuum-assisted method for decellularization of tracheae for clinical tissue engineering applications. Journal of Tissue Engineering and Regenerative Medicine. 11 (3), 800-811 (2017).
- Wedum, A. G., Hanel, E., Phillips, G. B. Ultraviolet sterilization in microbiological laboratories. Public Health Reports. 71 (4), 331-336 (1956).
- Hennessy, R. S., et al. Supercritical carbon dioxide-based sterilization of decellularized heart valves. JACC. Basic to Translational Science. 2 (1), 71-84 (2017).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Balestrini, J. L., et al. Sterilization of lung matrices by supercritical carbon dioxide. Tissue Engineering. Part C, Methods. 22 (3), 260-269 (2016).
- AENOR. UNE-EN. ISO 11737-1:2006. Esterilización de productos sanitarios. Métodos biológicos. Parte 1: Determinación de la población de microorganismos en los productos. AENOR. UNE-EN. , (2006).
- Uriarte, J. J., et al. Mechanical properties of acellular mouse lungs after sterilization by gamma irradiation. Journal of the Mechanical Behavior of Biomedical Materials. 40, 168-177 (2014).
- Sun, W. Q., Leung, P. Calorimetric study of extracellular tissue matrix degradation and instability after gamma irradiation. Acta Biomaterialia. 4 (4), 817-826 (2008).
- Nguyen, H., et al. Reducing the radiation sterilization dose improves mechanical and biological quality while retaining sterility assurance levels of bone allografts. Bone. 57 (1), 194-200 (2013).
- Helder, M. R. K., et al. Low-dose gamma irradiation of decellularized heart valves results in tissue injury in vitro and in vivo. The Annals of Thoracic Surgery. 101 (2), 667-674 (2016).
- Martínez-Hernández, N. J., et al. Decellularized tracheal prelamination implant: A proposed bilateral double organ technique. Artificial Organs. 45 (12), 1491-1500 (2021).
- Feldman, A. T., Wolfe, D. Tissue processing and hematoxylin and eosin staining. Methods in Molecular Biology. 1180, 31-43 (2014).
- López Caballero, J., Peña, M., De Federico, M. Coloraciones para fibras colágenas y elásticas del tejido conjuntivo. Coloraciones para sustancia amiloidea. Laboratorio de Anatomía Patologica. , 175-195 (1993).
- Martínez-Hernández, N. J., et al. A standardised approach to the biomechanical evaluation of tracheal grafts. Biomolecules. 11 (10), 1461 (2021).
- Kajbafzadeh, A. M., Javan-Farazmand, N., Monajemzadeh, M., Baghayee, A. Determining the optimal decellularization and sterilization protocol for preparing a tissue scaffold of a human-sized liver tissue. Tissue Engineering. Part C, Methods. 19 (8), 642-651 (2013).
- Wehmeyer, J. L., Natesan, S., Christy, R. J. Development of a sterile amniotic membrane tissue graft using supercritical carbon dioxide. Tissue Engineering. Part C, Methods. 21 (7), 649-659 (2015).
- Ross, E. A., et al. Mouse stem cells seeded into decellularized rat kidney scaffolds endothelialize and remodel basement membranes. Organogenesis. 8 (2), 49-55 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved