Method Article
Niedrigdosis-Gammastrahlen-Sterilisation für dezellularisierte Trachealtransplantate
In diesem Artikel
Zusammenfassung
Die Sterilisation ist für die Transplantation von Trachealgewebe unerlässlich. Hier stellen wir ein Sterilisationsprotokoll mit niedrig dosierter Gammastrahlung vor, das von den Organen voll verträglich ist.
Zusammenfassung
Einer der wichtigsten Schlüsselaspekte, um sicherzustellen, dass sich ein Transplantat korrekt entwickelt, ist die Sterilität des Mediums. Bei der dezellularisierten Trachealtransplantation wird ein Organ implantiert, das ursprünglich mit der Umwelt in Kontakt stand und somit nicht von vornherein steril war. Während das Dezellularisierungsprotokoll (durch Detergenzienexposition [2% Natriumdodecylsulfat], kontinuierliches Rühren und osmotische Schocks) im Einklang mit aseptischen Maßnahmen durchgeführt wird, sieht es keine Sterilisation vor. Eine der größten Herausforderungen besteht daher darin, die Sterilität vor der In-vivo-Implantation sicherzustellen. Obwohl es etablierte Gammastrahlungs-Sterilisationsprotokolle für anorganische Materialien gibt, gibt es keine solchen Maßnahmen für organische Materialien. Darüber hinaus können die für anorganische Materialien geltenden Protokolle nicht auf organische Materialien angewendet werden, da die festgelegte Strahlendosis (25 kGy) das Implantat vollständig zerstören würde. In dieser Arbeit wird die Wirkung einer erhöhten Strahlendosis in einer dezellularisierten Kaninchenluftröhre untersucht. Wir behielten den Dosisbereich (kGy) bei und testeten eskalierte Dosen, bis wir die minimale Dosis gefunden hatten, bei der die Sterilisation erreicht wird. Nachdem wir die Dosis bestimmt hatten, untersuchten wir die Auswirkungen auf das Organ, sowohl histologisch als auch biomechanisch. Wir stellten fest, dass 0,5 kGy zwar keine Sterilität erreichten, Dosen von 1 kGy und 2 kGy jedoch schon, wobei 1 kGy daher die minimale Dosis war, die für die Sterilisation erforderlich war. Mikroskopische Untersuchungen zeigten keine relevanten Veränderungen im Vergleich zu nicht sterilisierten Organen. Die axialen biomechanischen Eigenschaften wurden überhaupt nicht verändert, und es wurde nur eine geringe Verringerung der Kraft pro Längeneinheit beobachtet, die das Organ radial tolerieren kann. Wir können daher schlussfolgern, dass 1 kGy eine vollständige Sterilisation der dezellularisierten Kaninchenluftröhre mit minimalen, wenn überhaupt, Auswirkungen auf das Organ erreicht.
Einleitung
Die Sterilisation eines Implantats ist eine Grundvoraussetzung für seine Lebensfähigkeit. Tatsächlich haben sich Prothesen bewährt, die in sterilen Bereichen (Blutgefäße, Herz, Knochen usw.) implantiert wurden. 1. Die Luftröhre hat zwei Oberflächen: eine Oberfläche in Kontakt mit der äußeren Umgebung, die daher nicht steril ist, und eine Oberfläche zum Mediastinum hin, die steril ist. Daher ist die Luftröhre ab dem Moment, in dem sie entnommen wird, kein steriles Organ. Obwohl der anschließende Dezellularisierungsprozess unter maximal sterilen Bedingungen durchgeführt wird, handelt es sich nicht um einen Sterilisationsschritt2. Die Implantation von Fremdmaterial an sich birgt aufgrund der probakteriellen Mikroumgebung, diees erzeugt,ein Infektionsrisiko 3 und ein Risiko von bis zu 0,014 % der Krankheitsübertragung vom Spender auf den Empfänger, selbst wenn das Material sterilisiert wurde4. Um eine korrekte Vaskularisierung der Luftröhre zu gewährleisten, wird sie in fast allen experimentellen Transplantationsprotokollen zunächst einer heterotopen Implantation 5,6,7 in einen sterilen Bereich (Muskel, Faszien, Omentum, subkutan usw.) unterzogen. Dies liegt daran, dass die Implantation eines nicht sterilen Elements in dieses Medium zu einer Infektion des Bereichs3 führen würde.
Es gibt eine Reihe möglicher Strategien, um ein steriles Implantat zu erhalten. Durch die Verwendung von überkritischemCO2wurde eine terminale Sterilisation 8,9 erreicht. Andere Methoden, wie z. B. ultraviolette Strahlung oder die Behandlung mit Substanzen wie Peressigsäure, Ethanol, Sauerstoffperoxid und elektrolysiertem Wasser, haben unterschiedliche Erfolgsraten bei der Sterilisation erzielt, die fast immer von ihrer Dosierung abhängen, aber es hat sich gezeigt, dass sie die biomechanischen Eigenschaften von Implantaten beeinflussen. In der Tat können einige Substanzen, wie z. B. Ethylenoxid, die Struktur der implantierten Matrix erheblich verändern und sogar unerwünschte immunogene Wirkungen hervorrufen. Aus diesem Grund können viele dieser Strategien nicht auf biologische Modelle 2,10,11,12,13 angewendet werden.
Die am weitesten untersuchte und akzeptierte Sterilisationsstrategie ist die in der Norm ISO 11737-1:2006 festgelegte Sterilisationsstrategie für die Sterilisation von Medizinprodukten, die in Menschen implantiert wurden, mit einer Gammastrahlendosis von 25 kGy. Diese Vorschrift konzentriert sich jedoch nur auf die Sterilisation von inerten, nicht-biologischen Elementen14,15. Darüber hinaus sind die Strahlentherapiedosen bei der radikalen Behandlung von Karzinomen um drei Größenordnungen niedriger als bei der Sterilisation von Medizinprodukten1. Vor diesem Hintergrund können wir schlussfolgern, dass diese Dosis nicht nur die Mikrobiota abtöten, sondern auch die biologische Struktur des Implantats zerstören und radikal verändern würde. Es besteht auch die Möglichkeit, dass es beim Abbau Restlipide erzeugt, die potenziell zytotoxisch sein und den enzymatischen Abbau des Gerüstsbeschleunigen können 13,14,15,16,17, selbst wenn Dosen von nur 1,9 kGy verwendet werden und die Schädigung direkt proportional zur erhaltenen Strahlendosis ist 17.
Das Ziel dieser Arbeit ist es daher, zu versuchen, die Strahlendosis zu identifizieren, die es ermöglicht, ein steriles Implantat mit minimalen schädlichen Auswirkungen durch Bestrahlung zu erhalten 2,18,19. Die Strategie, die wir verfolgten, beinhaltete die Bestrahlung von dezellularisierten und bestrahlten Luftröhren mit unterschiedlich eskalierten Dosen innerhalb eines Bereichs von Kilogray (0,5, 1, 2, 3 kGy usw.), bis eine negative Kultur erreicht wurde. Für die Dosen, die negative Kulturen erreichten, wurden zusätzliche Tests durchgeführt, um die Sterilisation zu bestätigen. Nach der Bestimmung der Mindestdosis für die Sterilisation wurden die strukturellen und biomechanischen Auswirkungen der Bestrahlung auf die Luftröhre überprüft. Alle Metriken wurden mit den kontrollierten einheimischen Kaninchentracheen verglichen. Die Sterilisation des Konstrukts wurde dann in vivo getestet, indem die Luftröhren in neuseeländische weiße Kaninchen implantiert wurden.
Protokoll
Die europäische Richtlinie 20170/63/EU für die Pflege und Verwendung von Versuchstieren wurde eingehalten und das Prüfprotokoll wurde von der Ethikkommission der Universität Valencia genehmigt (Gesetz 86/609/EWG und 214/1997 und Code 2018/VSC/PEA/0122 Typ 2 der Regierung von Valencia, Spanien).
1. Dezellularisierung der Trachea
ANMERKUNG: Über die Dezellularisierungsmethode wurde an anderer Stelleberichtet 20.
- Männliche erwachsene neuseeländische weiße Kaninchen (Oryctolagus cuniculus) mit einem Gewicht von 3,5 bis 4,1 kg mit 133 mg/kg Pentobarbital-Natrium mit einer Injektion von 200 mg/ml durch die marginale Ohrvene einschläfern.
- Führen Sie unter aseptischen Bedingungen eine zentrale Längszervikotomie durch, präparieren Sie die Halsmuskulatur und nähern Sie sich der Luftröhre. Präparieren Sie das Organ in Umfangs- und Längsrichtung. Zum Schluss transekten Sie unter dem ersten Ring und knapp über der Carina.
- Schneiden Sie die Luftröhren mit einem Skalpell in 2 cm große Stücke. Entfernen Sie mit einer Schere das umliegende Bindegewebe und die innere Schleimhautschicht6.
- Tauchen Sie die Proben in 12 ml phosphatgepufferte Kochsalzlösung (PBS), die 2 % Natriumdodecylsulfat (SDS), 5 % Penicillin-Streptomycin und 5 % Amphotericin B enthält.
- Setzen Sie die Luftröhren 5 Wochen lang bei Raumtemperatur einem ständigen Rühren mit einem Magnetrührer bei 400 U/min aus. Ersetzen Sie die Dezellularisierungslösung wöchentlich nach einem 2-stündigen osmotischen Schock durch Eintauchen der Luftröhre in destilliertes Wasser.
- Kryogene Sie die Proben mit einer 12-ml-Mischung aus 80 % fötalem Kälberserum (FBS) und 20 % Dimethylsulfoxid (DMSO) in einem Gefrierbehälter bei -80 °C.
- Wenn die Luftröhren verwendet werden sollen (nach 13-15 Tagen), tauen Sie sie in einem Wasserbad bei 37 °C auf und waschen Sie sie, indem Sie sie nach dem Auftauen in PBS tauchen.
2. Sterilisation
- Bestrahlung
- Chargen von vier Trachealstücken mit einer Größe von jeweils 2 cm in einen 20 ml Methacrylat in einen mit PBS gefüllten T25-Kulturkolben geben, bis ein Gesamtvolumen von 30 ml erreicht ist. Achten Sie darauf, dass sich keine Blasen bilden, die zu einer Energiediffusion in der Luft-Flüssigkeits-Grenzfläche führen könnten.
- Führen Sie die Bestrahlung mit einem Linearbeschleuniger mit Photonen mit einer Nennenergie von 10 MV durch, die filterfreie Strahlen abflachen. Wenden Sie eine Dosisleistung von 2.400 Monitoreinheiten pro Minute am Isozentrum an, wobei die Luftröhren in einem Abstand von 100 cm zwischen Quelle und Oberfläche platziert werden, mit einer Schärfentiefe von 2,5 cm für ein Strahlungsfeld von 10 cm x 10 cm, um den gesamten Behälter abzudecken, was einer Dosis von 24 Gy/min entspricht.
- Eskalieren Sie die Dosen mit jeder vierteiligen Charge; vier Stücke werden 0,5 kGy, vier bis 1 kGy, vier bis 2 kG usw. ausgesetzt, bis die Sterilisation erreicht ist.
- Kultur
- Geben Sie die Stücke in 30 ml Dulbeccos modifiziertes Adlermedium (DMEM) mit inaktivierten 10% FBS ohne Antibiotika oder Antimykotika.
- In einem handelsüblichen Gewebeinkubator bei 37 °C und 5 % CO2 kultivieren und alle 24 h inspizieren.
HINWEIS: Die Kontaminationsparameter sind Änderungen des pH-Werts des Nährmediums und dementsprechend Änderungen der Farbe und Trübung des Mediums. Die Luftröhren wurden von keimfreien Hasenartigen geerntet, die nicht krank waren und daher frei von anaeroben Bakterien in ihren Luftröhren waren.
3. Histologische Analyse
Anmerkungen: Färben Sie die Stücke mit Hämatoxylin und Eosin21, Massons Trichrom und Orcein22.
- DAPI-Färbung
- Bestimmung der Gewebeviabilität mittels DAPI (4′,6-diamidino-2-phenylindol). Diese blau fluoreszierende Färbung bindet stark an Adenin- und Thymin-reiche Regionen in DNA-Sequenzen und ermöglicht daher die Betrachtung der DNA mittels Fluoreszenzmikroskopie.
- Betten Sie die Gewebeproben in eine Mischung mit optimaler Schneidtemperatur (OCT) ein.
- Schneiden Sie die Proben mit einem Kryostaten.
- Waschen Sie die zu färbende Probe dreimal in destilliertem Wasser, um die OG zu entfernen. Legen Sie sie in ein Eindeckmedium, das eine 30-nM-DAPI-Lösung enthält.
- Visualisierung der Fluoreszenz mittels Fluoreszenzmikroskopie.
- Analyse des DNA-Gehalts
- Schneiden Sie mit einem Skalpell etwa 3 mm lange Luftröhrensegmente ab.
- 2 h in Proteinase K (Materialtabelle) inkubieren.
- Extrahieren Sie die DNA mit einem DNA-Extraktionskit gemäß den Anweisungen des Herstellers.
- Mittels Spektralphotometrie wird die DNA-Konzentration bestimmt, indem die Absorption bei 260/280 mit einem Spektralphotometer gemessen wird.
- Messen Sie die Größe der extrahierten DNA-Proben mittels Kapillarchromatographie mit einem Bioanalysator.
4. Biomechanische Studie
ANMERKUNG: Der Trachealwiderstand gegen Längs- und Querkräfte wird durch axiale Zug- und Radialdruckversuche23 gemessen.
- Trachealmessung
- Messen Sie die Tracheallänge, die Wandstärke und den Außendurchmesser mit einem Messschieber.
- Berechnen Sie die Durchschnittswerte aus drei zufälligen Messungen jeder der Variablen.
- Berechnen Sie bei den radialen Druckversuchen den anteroposterioren Durchmesser, indem Sie den Punkt ermitteln, an dem die Platte mit der Probe in Kontakt kommt.
- Führen Sie alle Tests bei Raumtemperatur durch.
- Zugversuche
- Führen Sie Zugversuche an einer Traktions-Desktop-Universalprüfmaschine (UTM) durch, die mit einer Last von 100 N (0,1 N Kraftauflösung, 0,001 mm Position und 0,1 s) ausgestattet ist. Die Prüfmaschine ist mit Kraft- und Positionssensoren ausgestattet und mit einer speziell vom Hersteller entwickelten Software an einen Computer angeschlossen23.
- Zeichnen Sie Daten alle 0,4 s auf und exportieren Sie sie in eine Tabelle.
- Aus reinen einlagigen, ungiftigen Kristall-Polyvinylchlorid (PVC)-Hohlrohren mit einem Außendurchmesser von 1 cm und einer Wandstärke von 1,5 mm werden an das mittlere Kaliber der Kaninchentracheen angepasste Zugbacken konstruiert.
- Schneiden Sie die Leitungen in 3 cm lange Segmente.
- Bohren Sie 12 vorgeformte Löcher für die Termino-Terminal-Naht, 2 mm von der Kante der Backen entfernt und mit einem Abstand von 2,5 mm, um eine Verzerrung durch die Nähte zu vermeiden.
- Befestigen Sie die PVC-Glasröhrchen durch terminoterminale Anastomose mit einer durchgehenden Naht durch abwechselnde vorgeformte Löcher (alle 5 mm), 2 mm vom Rand der Luftröhre entfernt und mit einer monofilen 6-0-Nylonnaht an der Kaninchenluftröhre.
- Dehnen Sie alle Teile mit einer Verdrängungsrate von 5,0 mm/min.
- Erfassen Sie die Variablen maximale Spannung (σ max, in N/mm2) und Dehnung (εmax, ohne Einheiten) zusammen mit der gespeicherten Energie pro Einheit des Luftröhrenvolumens (W/Vol, in mJ/mm) und dem Elastizitätsmodul (E, in MPa).
- Radiale Druckversuche
- Führen Sie radiale Drucktests auf einem Kompressions-Desktop-UTM durch, das mit einer 15-N-Wägezelle (Kraftauflösung 0,001 N, Position 0,001 mm und Zeit 0,1 s) ausgestattet ist, um Kraftdaten (N), Position (mm) und Zeit (s) zu erhalten. Zeichnen Sie Daten auf und exportieren Sie sie in Intervallen von 0,5 Sekunden in eine Tabelle.
- Platzieren Sie die Luftröhren so, dass der membranöse Bereich auf der unteren Platte aufliegt. Die Platte steigt mit einer konstanten Geschwindigkeit von 5 mm/min allmählich in Richtung der oberen Platte an.
- Berechnen Sie jede Einheit pro Einheit der Länge der Probe (f in N/mm), der Steifigkeit (R in Mpa·mm) und der Energie pro Oberflächeneinheit (W / S in mJ/mm2), die erforderlich ist, um die Luftröhre vollständig zu verschließen.
5. Operationstechnik
ANMERKUNG: Über die Operationstechnik wurde an anderer Stelle ausführlich berichtet20.
- Setzen Sie einen sterilen intraluminalen PVC-Stent der Größe 14 Fr ein (der es ermöglicht, frei zu gleiten, ohne die Wände zu komprimieren), mit einem Rand von 3-4 mm an jedem Ende.
- Fixieren Sie den Stent mit einem einzigen 6-0 Nylon-Monofilamentstich durch den Knorpelfall des ersten Knorpels.
- Fahren Sie mit der Betäubung der Kaninchen fort.
- Die Probanden (3,65-4,05 kg männliche weiße neuseeländische Kaninchen) werden mit intramuskulären Analgetika (35 mg/kg Ketamin) mit einem Beruhigungsmittel, einem Muskelrelaxans und einem Analgetikum (2,5 mg/kg Xylazin) vorbehandelt.
- Rasieren Sie die Schnittzone aus der Operationszone heraus und reinigen Sie den Operationsbereich, um die Haare zu entfernen.
- Verabreichung von Analgetika plus Antibiotikaprophylaxe: 0,05 mg/kg intramuskuläres Buprenorphin und 10 mg/kg Enrofloxacin.
- Legen Sie bei jedem Kaninchen einen Venenkatheter in die marginale Ohrvene.
- Induktion der Anästhesie mit einem intravenösen Bolus von 10 mg/kg Propofol.
- Überwachen Sie die Vitalfunktionen des Tieres mit einem Dreikanal-Elektrokardiogramm, Pulsoximetrie und nicht-invasiver Druckmessung. Tragen Sie alle 30 Minuten ein physiologisches Serum auf die Augen auf, um Trockenheit während der Narkose zu vermeiden.
- Überprüfen Sie die Anästhesieebene mit der Zehenklemmmethode.
- Halten Sie die Anästhesie mit inhalativem Isofluran bei 1,5 % bis 2 % der minimalen Alveolarkonzentration aufrecht, ohne die spontane Belüftung zu verlieren, und unterstützen Sie das Kaninchen mit einem Heizkissen thermisch.
- Desinfizieren Sie die Einschnittzone mehrmals in kreisenden Bewegungen mit einem jodhaltigen Peeling. Machen Sie unter aseptischen Bedingungen und mit sterilem Material einen 3 cm langen zentralen Thoraxschnitt und ernten Sie bilaterale gestielte Lappen, die aus Brustfaszie und einer Muskelkomponente bestehen.
- Wickeln Sie die Luftröhren mit dem Lappen in vier Kaninchen ein, eines auf jedem Hemithorax (also insgesamt acht Luftröhren).
- Wenn die Operation abgeschlossen ist, machen Sie die Anästhesie rückgängig, indem Sie die Verabreichung von Isofluran unterbrechen.
- Postoperative Phase
- Behalten Sie die Tiere im Operationssaal, bis sie sich vollständig von der Narkose erholt haben. Wenn sie sich vollständig erholt haben, bringen Sie sie mit anderen Kaninchen in ihre Umgebung zurück.
- Behandeln Sie die Kaninchen 5 Tage lang alle 24 h mit Antibiotika (0,5 ml/kg 2,5 % Enrofloxacin) und Analgetika (5 mg/ml Meloxicam; 0,05 ml/kg Metacam).
- Lassen Sie die Implantate für die gewünschte Zeit an Ort und Stelle .
- Vor der Euthanasie werden die Kaninchen mit intramuskulären Analgetika (35 mg/kg Ketamin) und einem Beruhigungsmittel, Muskelrelaxans und Analgetikum (2,5 mg/kg Xylazin) behandelt. Dann werden die Kaninchen mit 133 mg/kg Pentobarbitalnatrium mit einer 200 mg/ml-Injektion durch die marginale Ohrvene eingeschläfert und die Luftröhren entnommen.
- Führen Sie biomechanische und histologische Tests an den Luftröhren durch.
6. Statistische Analyse
- Passen Sie alle Modelle mit der Bayes'schen Methode in der R-Software, Version 3.5.3 R Core (R Foundation for Statistical Computing. 2019) an.
- Analysieren Sie die Studienvariablen mit Ausnahme von f und R mithilfe mehrerer linearer Regressionsmodelle.
- Wenden Sie für die f - und R-Variablen gemischte lineare Regressionsmodelle an. In diesen Modellen wird zusätzlich zu den interessierenden Variablen, die sich auf die Behandlung und den Zustand jeder Luftröhre beziehen, der Prozentsatz der Okklusion als monotoner Effekt und ein unabhängiger Term pro Luftröhre als Zufallsfaktor eingeführt.
Ergebnisse
Dezellularisierung
Die DAPI-Färbung zeigt das Fehlen von DNA, und durch Elektrophorese wurden in keiner der Tracheen DNA-Werte über 50 ng nachgewiesen, wobei alle Fragmente kleiner als 200 bp20 waren.
Mikrobielle Kultur
Zwei der acht Stücke, die 0,5 kGy ausgesetzt wurden, zeigten eine Farbveränderung in weniger als 1 Woche. Keines der mit 1 kGy und 2 kGy bestrahlten Stücke zeigte eine Farbveränderung (Abbildung 1).
Histologische Analyse
Bei keiner der analysierten Proben wurden Veränderungen des Kollagen- oder elastischen Faserverteilungsmusters festgestellt (Abbildung 2).
Bestimmung der Strahlendosis
Ausgehend von den oben beschriebenen Ergebnissen, die zeigten, dass eine Bestrahlung mit 0,5 kGy keine Sterilisation der Probe gewährleistete, während Dosen von 1 kGy und 2 kGy dies taten, wurde die minimal mögliche Bestrahlungsdosis zur Sterilisation des Gewebes mit 1 kGy festgelegt. Daher haben wir die biomechanische Wirkung dieser Dosis auf die Luftröhren getestet 2,17,23.
Biomechanische Studie
Axiale Zugversuche
Die im Zugversuch an bestrahlten Luftröhren gewonnenen Daten sind in Tabelle 1 dargestellt. Abbildung 3 zeigt die entsprechenden Spannungs-Dehnungs-Kurven und Sollbruchstellen.
So hat die Bestrahlung von Trachealstücken mit Gammabestrahlung zu Sterilisationszwecken trotz einer leichten Erhöhung der detektierten Werte keine signifikanten Auswirkungen auf die axialen biomechanischen Eigenschaften der Organe. Daher sind sowohl die σMaximalwerte , die die Luftröhren vertragen können (0,05 MPa; KI [-0,046, 0,144] MPa) sowie εmax (0,096 KI [-0,096, 0,281]), (0,022 MPa; KI [-0,23, 0,274] MPa) und W/Vol (ab 0,044 mJ/mm3; KI [-0,018; 0,106] mJ/mm3), sind in dieser Stichprobe sehr leicht erhöht, aber in keinem Fall auf die Populationsschätzung anwendbar.
Radiale Druckversuche
Die Kompressionstests, die sowohl an den nativen Tracheen (Kontrollen) als auch an den dezellularisierten, kryokonservierten und bestrahlten Tracheen durchgeführt wurden, sind in Tabelle 2 dargestellt. Die entsprechenden Grafiken sind in Abbildung 4 zu sehen.
Gammabestrahlung verursacht nur eine minimale, aber signifikante Abnahme der radialen biomechanischen Eigenschaften der variablen Kraft pro Längeneinheit, die um -0,017 N/mm variiert; KI [-0,042, -0,004] N/mm, während die minimalen Variationen in W/Vol (0,044 mJ/mm3; KI [-0,018, 0,106] mJ/mm3), R (-0,018 MPa · mm; KI [-0,145, 0,083] MPa · mm) und W/S (-0,081 mJ/mm2; KI [-0,95, 0,74] mJ/mm2) sind in keinem Fall auf die Populationsschätzung anwendbar (Abbildung 5).
Einpflanzen
Makroskopische Untersuchung
Keines der Tiere zeigte in der postoperativen Phase entzündliche oder infektiöse Symptome; Ihre Diät wurde wie geplant wieder aufgenommen und Antibiotika und Analgetika wurden am fünften Tag ausgesetzt. Nach der Euthanasie wurde die Integration der Luftröhre und des Lappens makroskopisch beobachtet, ohne sichtbare Anzeichen einer Entzündung.
Histologische Untersuchung
Die histologische Untersuchung zeigte, dass der Lappen in Form des Perichondriums der nativen Luftröhre ein hochorganisiertes Bindegewebe bildete, das eng mit den Trachealringen verbunden ist und eine Kontinuität zwischen ihnen und dem Gewebe aufweist. Der Knorpel war intakt und zeigte keine Anzeichen von Nekrose. Darüber hinaus wurde die Anwesenheit von Makrophagen und einigen isolierten Riesenzellen, die Schichten bilden, beobachtet. Abgesehen von der seltenen Präsenz von Eosinophilen wurde eine übliche postoperative milde akute entzündliche Zellularität beobachtet (Abbildung 6). Eine beginnende Neovaskularisation wurde auch um die Luftröhre herum beobachtet.
Biomechanische Bewertung
Nach der Implantation in den Hasenartigen blieben die Eigenschaften der Luftröhre unverändert, mit Ausnahme der Kraft pro Längeneinheit, die die Eigenschaften der nativen Luftröhre nur 2 Wochen nach der Transplantation wiederherstellte (0,006 N/mm, KI [-0,026, 0,04] N/mm) (Abbildung 7).

Abbildung 1: Bestrahlte Luftröhren in DMEM ohne Antibiotika oder Antimykotika. Die Farbe der beiden Exemplare auf der linken Seite (0,5 kGy) hat sich verändert, was auf eine Änderung des pH-Werts hinweist, und ist ein indirektes Zeichen für Bakterienwachstum. Auch im ersten Exemplar links ist eine erhöhte Trübung zu erkennen. Die beiden Exemplare rechts (1 kGy) zeigen keine Farbveränderung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
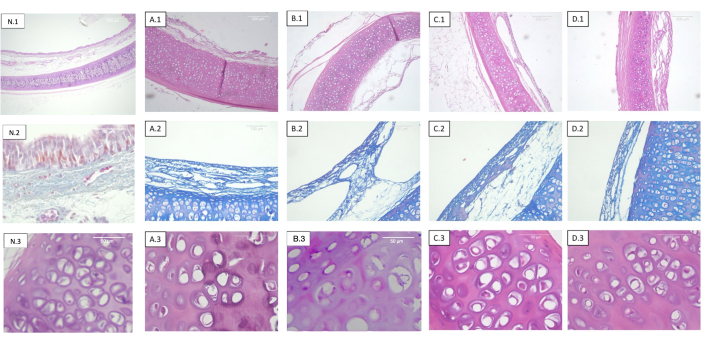
Abbildung 2: Luftröhren dezellularisiert und in unterschiedlichen Dosen bestrahlt. Jede Zeile entspricht einer anderen Färbung und jede Spalte einer anderen Sterilisationsdosierung. 1) Hämatoxylin-Eosin. Panoramablick auf Knorpel, Schleimhaut, Submukosa und Serosa. 2) Massons trichrome Färbung. Tracheale Submukosa. 3) Hämatoxylin-Eosin. Detailansicht des Trachealknorpels. (A) Nicht bestrahlte Luftröhren (Kontrolle). (B) Tracheen, die mit 0,5 kGy bestrahlt wurden. (C) Tracheen, die mit 1 kGy bestrahlt werden. (D) Tracheen, die mit 2 kGy bestrahlt werden. Es werden keine objektiven histologischen Veränderungen in Bezug auf die Strahlendosis beobachtet. Abkürzung: N = native Luftröhre. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Spannungs-Dehnungs-Kurven für dezellularisierte und bestrahlte Tracheen. Die Sollbruchstelle ist orange markiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
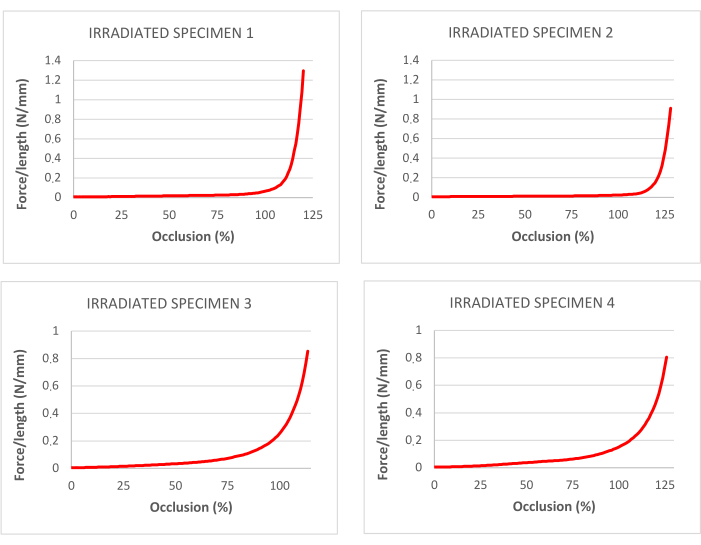
Abbildung 4: Kurven für den prozentualen Anteil der Okklusion, die den Traktionstests in dezellularisierten und bestrahlten Luftröhren entsprechen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
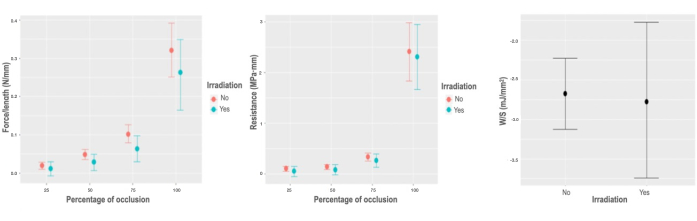
Abbildung 5: Biomechanische Reaktion auf Bestrahlung. (A) Diagramm der marginalen Auswirkungen auf die variable Kraft pro Längeneinheit, entsprechend dem Prozentsatz der Okklusion der Bestrahlungswechselwirkung. (B) Diagramm der marginalen Auswirkungen auf die variable Kraft pro Längeneinheit, entsprechend dem Prozentsatz der Okklusion der Bestrahlungsinteraktion. (C) Partielles Abhängigkeitsdiagramm des Modells der gespeicherten Energie pro Flächeneinheit für die Einstrahlungsvariable. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 6: Ansicht der implantierten Luftröhre nach 2 Wochen . (A) Masson-Trichrom-Färbung. Es wird ein neogebildetes Bindegewebe der trachealen Außenfläche beobachtet, das in konzentrischen Schichten von Fasern und Zellen organisiert ist. (B) Hämatoxylin-Eosin. Panoramablick auf perfekt erhaltenen Knorpel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
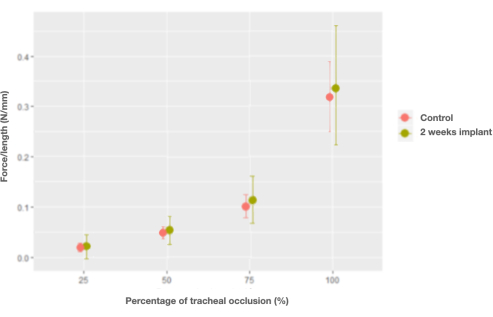
Abbildung 7: Diagramm der marginalen Effekte der Wechselwirkung zwischen Kraft pro Längeneinheit und Prozentsatz der Okklusions- und Kontrolltracheen (native) im Vergleich zu Tracheaimplantaten nach 2 Wochen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Zugversuche an bestrahlten Luftröhren. Die Kontrollen sind einheimische Kaninchenluftröhren. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Kompressionsversuche an bestrahlten, dezellularisierten Luftröhren. Die Kontrollen sind einheimische Kaninchenluftröhren. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Es gibt verschiedene Sterilisationsstrategien. Überkritisches CO2dringt vollständig in das Gewebe ein, säuert das Medium an und dekonstruiert die zelluläre Phospholipiddoppelschicht mit einfacher Eliminierung durch Druckentlastung des Implantats 8,14,25. Ultraviolette Strahlung wurde ebenfalls verwendet, und ihre Wirksamkeit in der Luftröhre von Nagetieren wurde veröffentlicht, obwohl es nur wenige Berichte in der Literatur gibt10. Andere verwendete Methoden umfassen die Anwendung von Substanzen wie Peressigsäure, Ethanol, Sauerstoffperoxid oder elektrolysiertem Wasser, die zu unregelmäßigen Ergebnissen geführt haben und nachweislich das Gewebe stark beeinträchtigen11,12. Im Gegensatz zu den oben genannten Strategien hat sich die Gammabestrahlung nicht nur in Bezug auf die Sterilisation als vollständig wirksam erwiesen, sondern wurde auch gründlich und umfassend untersucht, sowohl in Bezug auf ihre Dosis als auch auf ihre sterilisierende Wirkung. Tatsächlich wurde es so viel untersucht, dass es eine ISO-Norm für die Verwendung von Gammastrahlung bei der Sterilisation gibt, in der die Dosis für die Sterilisation von inertem Material, das beim Menschen implantiert werden soll, auf 25 kGyfestgelegt ist 13,14,15.
Andererseits hat sich gezeigt, dass neben der Sterilisation von Material auch die Bestrahlung Kollateraleffekte als Einschränkung der Technik verursacht. Dazu gehören die Zerstörung und Veränderung von Matrices durch Denaturierung von Proteinmolekülen, einschließlich Kollagen, und die Erzeugung von Restmolekülen, die sogar toxisch werden können. Diese Verschlechterung der Organstruktur wirkt sich folglich sowohl auf ihre biologischen als auch auf ihre biomechanischen Eigenschaften aus, wobei die schädlichen Auswirkungen der Bestrahlung direkt proportional zu ihrer Dosis sind und bei relativ niedrigen Dosen beobachtet werden 13,14,15,16,17. Hier ging es also um zwei Ziele: zum einen darum, ein steriles Konstrukt zu erhalten, um ein lebensfähiges Implantat zu gewährleisten, und zum anderen, die biologischen und biomechanischen Eigenschaften der Matrix zu erhalten, da das Implantat ohne Beibehaltung vergeblich wäre26. Die Herausforderung bestand also darin, eine Strategie zu wählen, die ein Gleichgewicht zwischen erfolgreicher Sterilisation und Erhalt der Gewebestruktur ermöglicht.
Darin wurde 1 kGy als Mindestdosis für die Sterilisation festgelegt. Die histologische Untersuchung zeigte, dass diese Bestrahlungsdosis keinen Einfluss auf das Gewebe hat. Des Weiteren ergab die biomechanische Charakterisierung der bestrahlten Luftröhren, dass der Einsatz von Bestrahlung keinerlei Einfluss auf die Traktionsparameter hat. Es gab eine leichte, aber statistisch signifikante Abnahme der Kraft pro Längeneinheit, die die Luftröhre in den radialen Kompressionstests tolerieren konnte, dies hat jedoch keinen Einfluss auf ihre anderen radialen Eigenschaften.
Es gibt zwar einige Arbeiten, die die Unmöglichkeit der Sterilisation und die Destrukturierung durch Dosen von nur 1,5 kGy 19 diskutieren, aber die überwiegende Mehrheit stimmt mit den präsentierten Datenüberein 2,18,19. Auf diese Weise beobachten die Autoren, dass die Sterilisation von Knochen in Dosen von 10, 15, 20 und 25 kGy eine vollständige Sterilisation erreicht, allerdings im Austausch für eine Verringerung der Zellinkubationskapazität und eine Zunahme der Kollagenabbauprodukte bei Dosen von mehr als 15 kGy18. Eine Dosis von 1,5 kGy führte nicht zu einer Sterilisation in dezellularisierten Herzklappen, verursachte jedoch eine Schädigung der mechanischen Eigenschaften der Proben sowohl in vivo als auch in vitro; In der Zwischenzeit führte eine Dosis von 3 kGy zur Sterilisation, verursachte jedoch Destrukturierung und Fibrose19. In Bezug auf die Luftröhre verglichen Johnson et al. die Auswirkungen der Sterilisation bei der ISO-Dosis von 25 kGy mit einer Dosis von 5 kGy. Beide Dosen führten zu einer terminalen Sterilisation, wobei die Dosis von 5 kGy die Struktur der Probe leicht veränderte und die Dosis von 25 kGy die Luftröhre vollständig destrukturierte2.
Darüber hinaus wird eine effektive Sterilisation bestätigt, da nach 2 Wochen keine infektiösen Ereignisse in Bezug auf das Implantat auftreten und die Sterilisation von den Organen vollständig toleriert wird. Auch die Struktur blieb vollständig erhalten, ohne Nekrose oder Denaturierung des Organs. Darüber hinaus wurde als zusätzliches Ergebnis beobachtet, dass die geringfügige Veränderung der biomechanischen Eigenschaften - auf die Kraft, die die Luftröhre pro Längeneinheit tolerieren kann - nur 2 Wochen nach der Implantation wieder auf die Werte einer nativen Luftröhre zurückkehrte; Daher kann dieser Effekt im Hinblick auf die endgültige Verwaltung des Konstrukts vernachlässigt werden.
Daher wird in dieser Arbeit die Möglichkeit vorgestellt, vollständig sterile Organe in viel niedrigeren Dosen als der empfohlenen Dosis von 25 kGy zu erhalten. Der Vorschlag behebt Probleme bei der Sterilisation von neuseeländischen Kaninchenluftröhren mit einer Dosis von 1 kGy. Diese Dosis stellt sicher, dass die histologischen, ultrastrukturellen und biomechanischen Eigenschaften dieser Organe erhalten bleiben, und zeigt eine perfekte Verträglichkeit gegenüber der Implantation. Eine Einschränkung der Studie besteht darin, dass sie nur an sterilisierten Kaninchentracheen durchgeführt wird, die aufgrund ihrer geringeren Größe im Allgemeinen eine niedrigere Dosierung erfordern. Es kann jedoch geschlussfolgert werden, dass die in der ISO-Norm für inerte Implantate festgelegten übermäßig hohen Werte für die Sterilisation von dezellularisierten Luftröhren nicht erforderlich sind und somit aufgrund der stark reduzierten Schädigung des Gewebes eine große Leistung darstellen. Darüber hinaus können diese Dosen in zukünftigen Studien je nach Tier und damit von der Größe der Luftröhre auf viel niedrigere Dosen angepasst werden, die folglich die Struktur und Funktion des Organs besser respektieren.
Offenlegungen
Keiner der Autoren hat einen Interessenkonflikt.
Danksagungen
Diese Arbeit wurde unterstützt durch das 2018 Spanish Society of Thoracic Surgery Grant to National Multicentric Study [Nummer 180101 vergeben an Néstor J. Martínez-Hernández] und PI16-01315 [verliehen an Manuel Mata-Roig] vom Instituto de Salud Carlos III. CIBERER wird durch den VI. Nationalen F&E&I-Plan 2018-2011, Iniciativa Ingenio 2010, das Consolider-Programm, CIBER Actions und das Instituto de Salud Carlos III mit Unterstützung des Europäischen Fonds für regionale Entwicklung finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| 6-0 nylon monofilament suture | Monosoft. Covidien; Mansfield, MA, USA | SN-5698G | |
| Amphotericin B 5% | Gibco Thermo Fisher Scientific; Waltham, MA USA | 15290018 | |
| Bioanalyzer | Agilent, Santa Clara, CA, USA | G2939BA | |
| Buprenorphine | Buprex. Reckitt Benckiser Healthcare; Hull, Reino Unido | N02AE01 | |
| Compression desktop UTM | Microtest, Madrid, Spain | EM1/10/FR | |
| Cryostate | Leyca CM3059, Leyca Biosystems, Wetzlar, Alemania | CM3059 | |
| DAPI (4',6-diamino-2-phenylindole) | DAPI. Sigma-Aldrich, Missouri, USA | D9542 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich; MO, USA | D2650 | |
| DMEM | Thermo Fisher Scientific; Waltham, MA, USA | 11965084 | |
| DNA extraction kit | DNeasy extraction kit Quiagen, Hilden, Germany | 4368814 | |
| Enrofloxacin, 2.5% | Boehringer Ingelheim, Ingelheim am Rhein, Germany | 0035-0002 | |
| Fetal bovine serum (FBS) | GE Healthcare Hyclone; Madrid, Spain | SH20898.03IR | |
| Fluorescence microscope | Leyca DM2500 (Leica, Wetzlar, Germany) | DM2500?? | |
| Freezing Container | Mr Frosty. Thermo Fisher; Madrid, Spain | 5100-0001 | |
| Isofluorane | Isoflo; Proyma Ganadera; Ciudad Real, Spain | 8.43603E+12 | |
| Ketamin | Imalgene. Merial; Toulouse, Francia | BOE127823 | |
| Linear accelerator | "True Beam". Varian, Palo Alto, California, USA | H191001 | |
| Magnetic stirrer | Orbital Shaker PSU-10i. Biosan; Riga, Letonia | BS-010144-AAN | |
| Meloxicam 5 mg/ml | Boehringer Ingelheim, Ingelheim am Rhein, Germany | 6283-MV | |
| OCT (Optimal Cutting Temperature Compound) | Fischer Scientific, Madrid, Spain | 12678646 | |
| Penicillin-streptomycin 5% | Gibco Thermo Fisher Scientific; Waltham, MA USA | 15140122 | |
| Pentobarbital sodium | Dolethal. Vetoquinol; Madrid, España | 3.60587E+12 | |
| Phosphate buffered saline (PBS) | Sigma-Aldrich; MO, USA | P2272 | |
| Propofol | Propofol Lipuro. B. Braun Melsungen AG; Melsungen, Alemania | G 151030 | |
| Proteinase K | Gibco Thermo Fisher Scientific; Waltham, Massachussetts, USA | S3020 | |
| PVC hollow tubes | Cristallo Extra; FITT, Sandrigo, Italy | hhdddyyZ | |
| PVC stent | ArgyleTM Medtronic; Istanbul, Turkey | 019 5305 1 | |
| R software, Version 3.5.3 R Core | R Foundation for Statistical Computing | R 3.5.3 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich; MO, USA | 8,17,034 | |
| Spectrophotometer | Nanodrop, Life Technologies; Isogen Life Science. Utrech, Netherlands | ND-ONEC-W | |
| Spreadsheet | Microsoft Excel for Mac, Version 16.23, Redmond, WA, USA | 2864993241 | |
| Traction Universal Testing Machine | Testing Machines, Veenendaal, Netherlands | 84-01 | |
| UTM Software | TestWorks 4, MTS Systems Corporation, Eden Prairie, MN, USA | 100-093-627 F | |
| VECTASHIELD Mounting Medium | Vector Labs, Burlingame; CA; USA | H-1000-10 | |
| Xylacine | Xilagesic. Calier; Barcelona, España | 20102-003 |
Referenzen
- Ch'ng, S., et al. Reconstruction of the (Crico)trachea for malignancy in the virgin and irradiated neck. Journal of Plastic, Reconstructive & Aesthetic Surgery. 65 (12), 1645-1653 (2012).
- Johnson, C. M., Guo, D. H., Ryals, S., Postma, G. N., Weinberger, P. M. The feasibility of gamma radiation sterilization for decellularized tracheal grafts. Laryngoscope. 127 (8), 258-264 (2017).
- de Donato, G., et al. Prosthesis infection: prevention and treatment. The Journal of Cardiovascular Surgery. 55 (6), 779-792 (2014).
- Vangsness, C. T., Dellamaggiora, R. D. Current safety sterilization and tissue banking issues for soft tissue allografts. Clinics in Sports Medicine. 28 (2), 183-189 (2009).
- Den Hondt, M., Vanaudenaerde, B. M., Delaere, P., Vranckx, J. J. Twenty years of experience with the rabbit model, a versatile model for tracheal transplantation research. Plastic and Aesthetic Research. 3 (7), 223-230 (2016).
- Hysi, I., et al. Successful orthotopic transplantation of short tracheal segments without immunosuppressive therapy. European Journal of Cardiothoracic Surgery. 47 (2), 54-61 (2015).
- Wurtz, A., et al. Tracheal reconstruction with a composite graft: Fascial flap-wrapped allogenic aorta with external cartilage-ring support. Interactive Cardiovascular and Thoracic Surgery. 16 (1), 37-43 (2013).
- White, A., Burns, D., Christensen, T. W. Effective terminal sterilization using supercritical carbon dioxide. Journal of Biotechnology. 123 (4), 504-515 (2006).
- Qiu, Q. Q., et al. Inactivation of bacterial spores and viruses in biological material using supercritical carbon dioxide with sterilant. Journal of Biomedical Materials Research. Part B, Applied Biomaterials. 91 (2), 572-578 (2009).
- Lange, P., et al. Pilot study of a novel vacuum-assisted method for decellularization of tracheae for clinical tissue engineering applications. Journal of Tissue Engineering and Regenerative Medicine. 11 (3), 800-811 (2017).
- Wedum, A. G., Hanel, E., Phillips, G. B. Ultraviolet sterilization in microbiological laboratories. Public Health Reports. 71 (4), 331-336 (1956).
- Hennessy, R. S., et al. Supercritical carbon dioxide-based sterilization of decellularized heart valves. JACC. Basic to Translational Science. 2 (1), 71-84 (2017).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Balestrini, J. L., et al. Sterilization of lung matrices by supercritical carbon dioxide. Tissue Engineering. Part C, Methods. 22 (3), 260-269 (2016).
- AENOR. UNE-EN. ISO 11737-1:2006. Esterilización de productos sanitarios. Métodos biológicos. Parte 1: Determinación de la población de microorganismos en los productos. AENOR. UNE-EN. , (2006).
- Uriarte, J. J., et al. Mechanical properties of acellular mouse lungs after sterilization by gamma irradiation. Journal of the Mechanical Behavior of Biomedical Materials. 40, 168-177 (2014).
- Sun, W. Q., Leung, P. Calorimetric study of extracellular tissue matrix degradation and instability after gamma irradiation. Acta Biomaterialia. 4 (4), 817-826 (2008).
- Nguyen, H., et al. Reducing the radiation sterilization dose improves mechanical and biological quality while retaining sterility assurance levels of bone allografts. Bone. 57 (1), 194-200 (2013).
- Helder, M. R. K., et al. Low-dose gamma irradiation of decellularized heart valves results in tissue injury in vitro and in vivo. The Annals of Thoracic Surgery. 101 (2), 667-674 (2016).
- Martínez-Hernández, N. J., et al. Decellularized tracheal prelamination implant: A proposed bilateral double organ technique. Artificial Organs. 45 (12), 1491-1500 (2021).
- Feldman, A. T., Wolfe, D. Tissue processing and hematoxylin and eosin staining. Methods in Molecular Biology. 1180, 31-43 (2014).
- López Caballero, J., Peña, M., De Federico, M. Coloraciones para fibras colágenas y elásticas del tejido conjuntivo. Coloraciones para sustancia amiloidea. Laboratorio de Anatomía Patologica. , 175-195 (1993).
- Martínez-Hernández, N. J., et al. A standardised approach to the biomechanical evaluation of tracheal grafts. Biomolecules. 11 (10), 1461 (2021).
- Kajbafzadeh, A. M., Javan-Farazmand, N., Monajemzadeh, M., Baghayee, A. Determining the optimal decellularization and sterilization protocol for preparing a tissue scaffold of a human-sized liver tissue. Tissue Engineering. Part C, Methods. 19 (8), 642-651 (2013).
- Wehmeyer, J. L., Natesan, S., Christy, R. J. Development of a sterile amniotic membrane tissue graft using supercritical carbon dioxide. Tissue Engineering. Part C, Methods. 21 (7), 649-659 (2015).
- Ross, E. A., et al. Mouse stem cells seeded into decellularized rat kidney scaffolds endothelialize and remodel basement membranes. Organogenesis. 8 (2), 49-55 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten