Method Article
Мышиная модель оротрахеальной интубации и вентилируемой хирургии реперфузии ишемии легких
* Эти авторы внесли равный вклад
В этой статье
Резюме
Мышиная хирургическая модель для создания реперфузии ишемии левого легкого (ИК) при сохранении вентиляции и предотвращении гипоксии.
Аннотация
Реперфузионное повреждение ишемией (ИК) часто является результатом процессов, которые включают преходящий период прерванного кровотока. В легких изолированный ИК позволяет экспериментально изучить этот специфический процесс с продолжением альвеолярной вентиляции, тем самым избегая усугубляющихся повреждающих процессов гипоксии и ателектаза. В клиническом контексте реперфузионное повреждение ишемии легких (также известное как легочная IRI или LIRI) вызвано многочисленными процессами, включая, но не ограничиваясь, легочной эмболией, реанимированной геморрагической травмой и трансплантацией легких. В настоящее время существуют ограниченные эффективные варианты лечения LIRI. Здесь мы представляем обратимую хирургическую модель ИК легких, включающую первую оротрахеальную интубацию, за которой следует односторонняя ишемия левого легкого и реперфузия с сохраненной альвеолярной вентиляцией или газообменом. Мыши подвергаются левой торакотомии, через которую левая легочная артерия обнажается, визуализируется, изолируется и сжимается с помощью обратимого скользящего узла. Затем хирургический разрез закрывается во время ишемического периода, а животное пробуждается и экстубируется. При спонтанном дыхании мыши реперфузия устанавливается путем высвобождения скользящего узла вокруг легочной артерии. Эта клинически значимая модель выживания позволяет оценить ИК-повреждение легких, фазу разрешения, последующее воздействие на функцию легких, а также модели с двумя ударами, включающие экспериментальную пневмонию. Несмотря на техническую сложность, эта модель может быть освоена в течение нескольких недель или месяцев с возможным показателем выживаемости или успеха 80-90%.
Введение
Реперфузионное повреждение ишемии (ИК) может возникнуть, когда кровоток восстанавливается к органу или тканевому слою после некоторого периода прерывания. В легких ИК может возникать изолированно или в сочетании с другими повреждающими процессами, такими как инфекция, гипоксия, ателектаз, волютраума (от больших приливных объемов во время искусственной вентиляции легких), баротравма (высокое пиковое или устойчивое давление во время механической вентиляции) или тупое (непроникающее) ушиб легких 1,2,3 . Остается несколько пробелов в наших знаниях о механизмах LIRI и влиянии параллельных процессов (например, инфекции) на результаты LIRI, а также варианты лечения LIRI ограничены. Модель in vivo чистого LIRI необходима для выявления патофизиологии ИК-повреждения легких в изоляции и изучения его вклада в любой процесс многократного попадания, компонентом которого является повреждение легких.
ИК-модели мышиных легких могут быть использованы для изучения специфической для легких патофизиологии нескольких процессов, включая трансплантацию легких3, легочную эмболию4 и повреждение легких после геморрагической травмы с реанимацией5. Используемые в настоящее время модели включают хирургическую трансплантацию легких6, зажимхилара 7, перфузию легкого ex vivo 8 и вентилируемое легкое IR9. Здесь мы предоставляем подробный протокол для мышиной вентилируемой ИК-модели стерильного повреждения легких. Существует множество преимуществ этого подхода (рисунок 2), в том числе то, что он вызывает минимальную гипоксию и минимальный ателектаз, и это модель хирургии выживания, которая позволяет проводить долгосрочные исследования.
Причины выбора этой модели LIRI по сравнению с другими моделями, такими как модели зажима Хилара и перфузии ex vivo , следующие: эта модель минимизирует воспалительный вклад ателектаза, механической вентиляции и гипоксии; сохраняет циклическую вентиляцию; он поддерживает неповрежденную иммунную систему in vivo , которая может реагировать на ИК-травму; и, наконец, в качестве процедуры выживания она позволяет проводить долгосрочный анализ механизмов получения вторичных травм (модели с 2 ударами) и разрешения травм. В целом, мы считаем, что эта вентилируемая ИК-модель легких обеспечивает «чистейшую» форму ИК-повреждения, которая может быть изучена экспериментально.
В других публикациях описано использование оротрахеальной интубации мышей для выполнения ИТ-инъекций или установок10,11, но не в качестве отправной точки для операции по выживанию, как это происходит в этой модели. Размещение оротрахеальной трубки позволяет выполнять операцию на легких, позволяя коллапсировать операционное легкое. Это также позволяет реинфляцию легкого в конце процедуры, что имеет решающее значение для пневмоторакса и для способности мыши возвращаться к спонтанной вентиляции по завершении процедур. Наконец, удаление закрепленной оротрахеальной трубки является простой процедурой, которая, в отличие от инвазивной трахеотомии, совместима с операцией по выживанию. Это позволяет проводить долгосрочные исследования, направленные на понимание прогрессирования и разрешения LIRI и связанных с ним расстройств, а также на создание моделей хронических травм.
протокол
Все процедуры и шаги, описанные ниже, были одобрены институциональным комитетом по уходу за животными и их использованию (IACUC) в Калифорнийском университете в Сан-Франциско. Можно использовать любой штамм мыши, хотя некоторые штаммы имеют более сильную ИК-воспалительную реакцию легких по сравнению с другими12. Мыши, которым примерно 12-15 недель (30-40 г) или старше, переносят и переживают ИК-операцию легких лучше, чем молодые мыши. Для этих операций могут использоваться как самцы, так и самки мышей.
1. Протокол интубации мыши
- Анестезия и подготовка к интубации
- Протрите брюшко мыши этаноловым тампоном. Обезболить мышь внутрибрюшинной инъекцией трибромэтанола (250-400 мг/кг). Оцените подходящую глубину анестезии по отсутствию рефлекса снятия педали. Нанесите глазную смазывающую мазь сейчас или позже (шаг 2.1.4).
ПРИМЕЧАНИЕ: Для этой процедуры трибромэтанол (и этомидат в качестве альтернативного варианта) обеспечивает стабильную анестезирующую плоскость, не влияя на гемодинамические условия, необходимые для этой операции. Этот анестетик используется только один раз, чтобы избежать риска перитонеальных спаек. Изофлуран также может быть использован, но мы не используем его здесь. Практикующий может свободно использовать любой рецепт анестетика, который он считает нужным. - Поместите обезболенную мышь на интубационную подставку или пластиковую опору в лежачем положении, подвешенном ее верхними резцами на закольцованных 4-0 швах (шелковых или других) поперек двух опорных анкеров.
- Чтобы держать мышь обездвиженной во время процедуры интубации, свободно приклейте нижнюю часть грудной клетки (или обе верхние конечности) к платформе.
- Поместите волоконно-оптический гибкий свет осторожно на трахею мыши, немного ниже голосовых связок. Отрегулируйте уровень освещенности таким образом, чтобы при взгляде в ротоглотку мыши было видно только темное поле, за исключением красного света, исходящего из-под голосовых связок, демонстрируя цель для возможного размещения эндотрахеальной трубки. Обратите внимание, что движения голосовых связок должны быть видны невооруженным глазом или, при необходимости, при увеличении.
- Протрите брюшко мыши этаноловым тампоном. Обезболить мышь внутрибрюшинной инъекцией трибромэтанола (250-400 мг/кг). Оцените подходящую глубину анестезии по отсутствию рефлекса снятия педали. Нанесите глазную смазывающую мазь сейчас или позже (шаг 2.1.4).
- Процедура интубации
- Держите пинцет доминирующей рукой и используйте их, чтобы осторожно схватить и вытянуть язык из ротовой полости.
- Откройте нижнюю челюсть с помощью щипцов, удерживаемых недоминирующей рукой, а затем протолкните щипцы в гортань, чтобы осторожно поднять надгортанник. В это время отпустите язык от пинцета.
- Ищите голосовые связки. Они должны открываться и закрываться в соответствии с каждым вдохом. Удерживая канюлю с предварительно загруженным направляющим проводом, вставьте наконечник проволоки через голосовые связки.
- Будучи очень осторожным, чтобы не перемещать проволоку, удерживая ее часть, которая находится за пределами канюли, но чуть выше голосовых связок, выведите канюлю, оставив только проволоку на месте с дистальным концом внутри трахеи.
- В этот момент выполните вторую визуализацию голосовых связок, чтобы подтвердить, что дистальный кончик провода остается прошедшим через освещенные голосовые связки и в трахею, и не находится в незажженном пищеводе.
- Держите проволоку за пределами рта изогнутыми щипцами в левой руке, стабилизированной на твердой поверхности, и осторожно выдвигайте катетер 20G с ленточными крыльями по проводу.
- Как только дистальный конец проволоки выйдет из заднего конца катетера 20G или эндотрахеальной трубки, удерживайте этот конец изогнутыми щипцами и плавно продвигайте катетер 20G в трахею.
- Осторожно извлеките проволоку из дистального конца катетера 20G с изогнутыми щипцами, не смещая размещение катетера.
- Кратко подключите катетер к вентилятору, прежде чем закрепить его, чтобы подтвердить правильное размещение в трахее, а не в пищеводе. Подтверждают расположение трахеи наблюдением за зависящими от искусственной вентиляции двусторонними движениями грудной стенки и отсутствием надувания желудка.
- Постинтубация
- Отсоедините катетер от вентилятора. Зафиксируйте крылья ленты (прикрепленные к катетеру) через нижнюю губу мыши с помощью викрильного шва 4-0, чтобы прочно закрепить эндотрахеальную трубку (ЭТТ) на мыши во время всех последующих процедур / манипуляций.
ПРИМЕЧАНИЕ: В качестве альтернативы, шелковая лента или другая лента может быть использована для крепления ETT, однако следует соблюдать осторожность, чтобы избежать смещения ETT во время перемещения животного от интубационных саней к хирургической поверхности. - Осторожно извлеките мышь из интубационных салазок. Кратковременно подключите катетер к вентилятору, установленному при приливном объеме 0,2-0,225 мл и частоте дыхания 120-150 вдохов в минуту, чтобы подтвердить правильное расположение трахеальной трубки, а затем отсоединитесь с мышью, самопроизвольно дышащей через оротрахеальную трубку.
- Не оставляйте животное без присмотра с этого момента до тех пор, пока оно не придет в достаточное сознание для поддержания грудинного покоя в конце процедуры.
- Отсоедините катетер от вентилятора. Зафиксируйте крылья ленты (прикрепленные к катетеру) через нижнюю губу мыши с помощью викрильного шва 4-0, чтобы прочно закрепить эндотрахеальную трубку (ЭТТ) на мыши во время всех последующих процедур / манипуляций.
2. Протокол хирургии ишемии легких и реперфузии (ИК)
- Обезболивание и подготовка хирургического участка
- Протрите брюшко мыши этаноловым тампоном и вводят бупренорфин (0,05-0,1 мг/кг) внутрибрюшинно.
- Сбрить волосы над левой областью грудной клетки до левой лопатки. Удалите лишние выбритые волосы с помощью спиртовых тампонов.
ПРИМЕЧАНИЕ: Этапы 2.1.1 и 2.1.2 могут быть также выполнены перед интубированием, если существует опасение смещения ЭТП при закреплении шелковой лентой. - Поместите мышь на согревающую подушку в левое боковое или 3/4 повернутое положение и подключите трахеальную трубку на вентиляторе с приливным объемом 0,2-0,225 мл (~8 мг/кг) и частотой дыхания 120-150 вдохов в минуту. Не используйте дополнительный кислород для этой процедуры.
- Нанесите смазку для глаз стерильным тампоном с ватным кончиком. Поверните мышь на 3/4 левой стороны вверх и обездвижите все четыре конечности и хвост лабораторной лентой.
- Продезинфицируйте выбритый участок кожи и окружающий мех повидоном-йодом и дождитесь высыхания раствора. Затем накройте операционное поле стерильной драпировкой или прозрачной пластиковой пленкой и создайте прямоугольное отверстие в драпировке или пластиковой пленке для хирургического поля.
- Хирургическая процедура
- Подтвердить соответствующий уровень анестезии (обеспечиваемый введением трибромэтанола и бупренорфина, как описано ранее) путем тестирования реакции на защемление пальцев ног.
- Используя пару острых ножниц и пару более крупных щипцов (узкие щипцы или аналогичные), сделайте поперечный разрез кожи на 2 см ниже нижнего угла лопатки в левой боковой грудной клетке. Используйте ножницы и более тонкую пару щипцов (дополнительные тонкие щипцы или аналогичные), чтобы разрезать мышечный слой и рассечь до ребер.
- Определите второе межреберное пространство и удерживайте второе ребро дополнительными тонкими щипцами. Потянув ребро вверх, используйте стерильное лезвие скальпеля No 11 или No 12 (изогнутое) (ручка не требуется), чтобы войти в плевральное пространство, разделив и разрезав межреберные мышцы 2-3-го пространства. Рассмотрите возможность приостановки вентиляции, чтобы уменьшить повреждение вершины левого легкого.
- Вставьте три стерилизованных втягивающих устройства. Используйте наименьшую/самую узкую втягивающую цефаладу вдоль ориентации ребер, втягивающую машину среднего размеравлево вдоль 2-го ребра и самую большую втягивающую машину вправо вдоль поверхности3-го ребра.
- Откройте грудную клетку с медленным и прогрессивным втягиванием с помощью эластичных втягивающих шнуров. Обнажите и идентифицируйте левую легочную артерию (ПА), отодвинув верхнюю часть левого легкого стерильным тампоном с ватным наконечником.
- Используйте микрощипцы, ультратонкие щипцы в правой руке и ПА или расширяющие сосуды щипцы в левой руке, чтобы мягко обнажить и создать поле, в котором видны левый ПА и бронх.
- Используя щипцы ПА, поднимите левый ПА и осторожно, но твердо потяните вверх и цефаладу, чтобы визуализировать прозрачный бронх внизу. Увеличьте увеличение на рассеченном микроскопе (см. список оборудования для получения более подробной информации) на этом этапе до максимума (2x).
ПРИМЕЧАНИЕ: Стерилизуйте все оборудование перед использованием. Кроме того, для поддержания стерильности в стерильное хирургическое поле должны входить только кончики хирургических инструментов. - Втягивая ПА подальше от бронха, осторожно пропустите закрытые ультратонкие щипцы через пространство между левым ПА и бронхом. Затем используйте эти щипцы, чтобы удерживать и тянуть 7-0 или 8-0 проленовый шов через пространство между левой легочной артерией (вверху) и бронхом (внизу).
- Окружите левый PA, связав скользящий узел, чтобы создать окклюзию в PA. Прерывание кровотока легко визуализируется под микроскопом. Это знаменует собой начало ишемического периода.
- Экстернализируйте свободный конец узла через другую точку входа в переднюю левую грудную клетку с помощью иглы 24G-28G и закрепите конец шва небольшим кусочком ленты для более легкой идентификации в дальнейшем.
- Повторно надувайте легкое, чтобы вытеснить как можно больше воздуха из грудной полости, используя клапан PEEP / трубку на вентиляторе грызунов. Затем закройте грудную клетку двумя прерванными 4-0 нейлоновыми швами.
- Закройте мышечный и подкожный слой бегущим 4-0 нейлоновым швом. Затем нанесите на разрез две-три капли местного бупивакаина (0,5%). Используйте нейлоновый шов 4-0, чтобы закрыть слой кожи бегущим швом.
- Послеоперационный уход
- Когда спонтанная вентиляция возобновится, отсоедините эндотрахеальную трубку от вентилятора и экстубируйте мышь.
- Поместите мышь на согревающую прокладку для поддержания температуры тела во время раннего восстановления после анестезии.
- Внимательно следите за мышью во время восстановления после общей анестезии. Осторожно потяните экстернализованный слипнот в конце ишемического периода (30 мин или 1 ч).
- Переместите мышь с согревающей подушки в клетку, как только она проявит признаки восстановления: самовосстановление и / или движение.
- После периода реперфузии (1 ч или 3 ч) усыпляют животное и собирают кровь путем пункции сердца и легочной ткани для дальнейшего анализа. В течение 1 ч реперфузии собирают плазму для ИФА, ткани для РНК и анализа белка; в течение 3 ч реперфузии дополнительно собирают ткани для гистологии.
Результаты
Воспаление, вызванное односторонним вентилируемым стерильным реперфузионным повреждением ишемии легких (ИК): После 1 ч ишемии мы наблюдали повышение уровня цитокинов в сыворотке и в легочной ткани как ИФА, так и qRT-PCR, которые достигли пика через 1 ч после реперфузии и быстро вернулись к исходному уровню в течение 12-24 ч после реперфузии13. Для образцов, собранных через 3 ч после реперфузии, мы наблюдали интенсивную инфильтрацию нейтрофилов в левой легочной ткани и отметили, что интенсивность воспаления зависела от штамма используемой мыши (рисунок 1). Примечательно, что воспаление, которое генерируется при отсутствии сосуществующего или последующего инфекционного процесса, постепенно разрешается и легкие возвращаются к своей нормальной архитектуре легких (по гистопатологии) с эффероцитозом или выходом нейтрофилов из поврежденных легких в течение 12-24 ч после реперфузии13. Следует отметить, что мы наблюдали легкое, но обнаруживаемое воспаление, которое было в значительной степени нейтрофильным и наблюдалось в неоперативном правом легком, которое, как мы предполагаем, связано с гиперперфузионным повреждением14.
Отбор образцов тканей для этой ИК-модели легких ничем не отличается от сбора для других ИК-моделей легких: кровь может быть собрана для получения плазмы с помощью сердечной пункции или канюляции IVC; легочная ткань может быть собрана для получения белка или РНК, а затем для дальнейшего анализа с помощью вестерн-блоттинга, ИФА или qPCR.
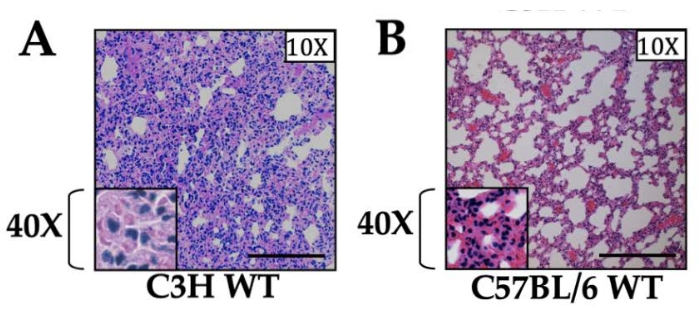
Рисунок 1: Гистология отделов легких у мышей дикого типа двух разных штаммов. (A) C3H и (B) C57BL/6 мыши. Оба штамма мышей получали 1 ч ишемии и 3 ч реперфузии, причем ткань показана при 10-кратном увеличении. 40-кратное увеличение показано во вставке. Нейтрофильная инфильтрация наблюдалась в обоих штаммах, причем штамм C3H демонстрировал заметно более высокие уровни воспаления по сравнению с C57BL/6, как сообщалось ранее12. Шкала составляет 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Сравнение преимуществ (синий текст) и недостатков (красный текст) трех наиболее часто используемых экспериментальных моделей ИК-повреждения легких (LIRI) мышей. Это сравнение подчеркивает выбор вентилируемого ИК легких (описанного в этой рукописи) в качестве идеальной модели для изучения чистого ИК легких. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
В этой рукописи подробно описываются этапы, связанные с выполнением ИК-модели вентилируемого легкого, разработанной Dodd-o et al.9. Эта модель помогла идентифицировать молекулярные пути, участвующие в генерации и разрешении воспаления из ИК легких в изоляции 14,15,16,17, ИК легких в сочетании с сосуществующей инфекцией18 и ИК легких по отношению к оси кишечник-легкие и вклад кишечного микробиома 13,18,19 . Хотя технически более сложная, текущая модель позволяет оценить ИК легких без сложных эффектов прерванной циклической инфляции легких и гипоксии. Он также минимизирует период механического вентиляционного воздействия, в отличие от модели перфузии ex vivo, которая сама по себе может привести к повреждению легких20.
Ограничения метода: В то время как трахея мыши достаточно сужена, чтобы положительное давление выдоха (PEEP) позволяло расширять легкие и обеспечивало плотное прилегание к ETT, измерения механики легких и контура потока могут быть невозможны при этой версии обратимой оротрахеальной интубации. Эти измерения физиологии легких могут потребовать трахеотомии, которая, в отличие от этого метода, несовместима с операцией на выживании легких. Обратимая оротрахеальная интубация хорошо переносится мышами, и даже при отсутствии паралитиков очень мало мышино-вентиляционной асинхронности при условии, что минутная вентиляция (MV = приливный объем x частота дыхания) достаточно высока, чтобы предотвратить естественный привод CO2 путем захвата дыхания (т. Е. Сразу за пределами апноического порога).
Существует несколько соображений, связанных с ишемией-реперфузией (ИК) этой процедуры. Во-первых, ИК-процедура должна выполняться с как можно меньшим физическим повреждением легких. Мы рекомендуем приостановить искусственную вентиляцию легких и позволить мыши дышать спонтанно при входе в грудную полость. Вентиляция с отрицательным давлением, наряду с захватом хирургом второго или третьего ребра и отрывом его от легкого при осторожном входе в грудную клетку лезвием скальпеля No 11, уменьшит вероятность повреждения легкого скальпелем. В качестве альтернативы, мы обнаружили, что использование изогнутого лезвия скальпеля No 12, расположенного так, чтобы кривая была обращена вверх, позволяет более осторожно входить в грудную полость, потенциально уменьшая повреждение подлежащей поверхности вершины левого легкого. Кроме того, соединение между левым ПА и бронхом менее надежно ближе к хилуму, что облегчает прохождение ультратонких щипцов между этими двумя структурами.
Следующим критическим шагом является изоляция левого ПА от бронха внизу, чтобы окружить ПА шовным галстуком. Важно, чтобы этот шаг был выполнен осторожно, чтобы избежать травмы вершины легких. Мы рекомендуем входить в грудную клетку как можно более цефаладным, чтобы свести к минимуму количество левого легкого, которое необходимо сместить или втянуть для доступа к ПА и бронхам. Любая часть легкого, которая получает тупую травму, должна быть исключена из оценки изолированного ИК-повреждения. Часто верхушка левого легкого иссекается при сборе легких для окончательного анализа стерильного ИК-повреждения легких. Травма верхушки легкого может быть визуализирована во время операции из-за наличия пункции кровоизлияния или кровавого обесцвечивания.
Между ПА и бронхом ниже существует соединительнотканный слой, который должен быть прорван, чтобы окружить артерию шовным галстуком. Изучение того, сколько напряжения допускается при захвате и вытягивании левого ПА вверх (т. Е. К грудной клетке и в сторону от бронха), используя незазубренный, не повреждающий сосуд, захватывающий плоские тонкие щипцы в левой руке, является важным первым шагом для освоения. Левый ПА может выдерживать удивительное количество напряжения и растяжения, когда он тянется вверх. Мы считаем полезным увеличить увеличение поля зрения до максимума и отрегулировать фокус так, чтобы потенциальное пространство (белая линия соединительной ткани, прилипающей ПА к бронху) можно было четко и резко визуализировать вместе с ультратонкими щипцами (удерживаемыми в правой руке). Чтобы поле оставалось в фокусе, важно стабилизировать левую руку на хирургической поверхности, вытягивая левый ПА вверх и прочь от бронха. Ультратонкие щипцы затем могут быть переданы в пространстве между двумя структурами. Закрытые наконечники должны проходить легко без какого-либо реального сопротивления, и после того, как они видны с другой стороны левого ПА, наконечники могут быть аккуратно открыты для дальнейшего создания пространства для прохождения шовного материала. Очень важно, чтобы это было выполнено с использованием полностью неповрежденных ультратонких щипцов, которые можно быстро определить, проведя стерильный спиртовой тампон через закрытые кончики, чтобы увидеть, рвутся ли наконечники на материал. Повреждения наконечников также можно определить, открывая и закрывая щипцы при максимальном увеличении хирургического микроскопа.
Легко обнаружить повреждение, которое происходит либо с левым ПА, либо с левым главным бронхом при попытке отделить их. Повреждение левого ПА приводит к затоплению поля зрения кровью и может привести к неспасительной операции, если повреждение создает дыру в самом ПА. Примечательно, что на ПА есть поверхностные микроскопические кровеносные сосуды, которые могут быть повреждены во время движения ультратонких щипцов и потенциально могут управляться путем размещения сухого стерильного тампона с ватным наконечником над полем, чтобы поглотить кровь, которая появляется. Если кровотечение останавливается, процедуру можно возобновить. Повреждение левого главного бронха всегда является ситуацией, которую невозможно спасти, поскольку не существует простого или быстрого способа восстановления повреждений дыхательных путей.
Этап отделения ПА от основного бронха может быть первоначально практикуем на мертвой мыши без давления времени или отвлечения сердечной деятельности и движения, которое она вызывает. Кроме того, застой крови в левом ПА позволяет легче визуализировать ее (толстый и пухлый сосуд), и все же она может быть подхвачена не травмирующими плоскими щипцами ПА. Способность обнаруживать повреждения в левом бронхе все еще возможна, так как вентиляция левого легкого может быть использована для оценки наличия неповрежденных проводящих дыхательных путей к левому легкому. Эта практическая ситуация также может быть использована для совершенствования создания slipknot.
Существует конечная продолжительность окклюзии, за пределами которой спонтанная реперфузия после удаления слипкота не гарантируется. В пилотных исследованиях это происходит где-то между 6 и 10 часами. Помимо этого, реперфузия происходит реже сразу после удаления скользящего узла. По мере продления ишемического периода реперфузия требует манипуляций с ПА после удаления скользящего узла с целью восстановления кровотока.
Следующие наблюдения были получены от пяти соавторов этой статьи, которые представляют их коллективный опыт в обучении, совершенствовании, устранении неполадок и улучшении этой процедуры в течение периода, когда они проводили эту хирургическую модель мыши, и были обобщены в пунктах ниже:
В среднем на освоение этой хирургической процедуры уходило 1-3 месяца. По оценкам одного процедуралиста, требуется около 50 операций, чтобы стать легкими с различными процедурами.
Показатель успешности в начале выполнения процедуры составил 20%-40%. После выполнения процедуры регулярно и с ознакомлением показатель успешности увеличился до 80%-90%.
Самой сложной частью операции было единодушное прохождение ультратонких щипцов между левым ПА и левым бронхом, а затем последующий захват шва монофиламентом щипцами и его прохождение между двумя структурами.
Ошибки при прохождении мононити между ПА и левым главным стволом бронха могут привести к неспасительной операции с катастрофическим кровотечением левого ПА или необратимой травмой левого главного бронха.
Максимальное количество операций, осуществимых за 1 день, оценивалось в 10 (примерно 35-45 мин / операция), в то время как идеальное число для процедураторского комфорта и хирургического успеха составляло пять или шесть.
Другие различные советы и предложения включают в себя:
Избегайте избытка кофеина перед началом хирургического дня, чтобы поддерживать устойчивое положение рук.
Увеличьте увеличение на микроскопе до максимума во время части процедуры, когда шов проходит между левым ПА и левым главным бронхом.
Используйте мягкие и постепенные /инкрементные движения при продвижении щипцов Дюмона, чтобы создать пространство между левым ПА и левым главным бронхом.
Стабилизируйте руки на хирургической поверхности при выполнении всех критических шагов.
Убедитесь, что частота дыхания на аппарате ИВЛ достаточно высока, чтобы избежать спонтанных вдохов, особенно во время ключевых / критических частей процедуры (прохождение шва между левым ПА и левым главным бронхом).
Тихая и спокойная обстановка для выполнения операций имеет важное значение, чтобы оставаться сосредоточенным и неотвлеченным.
На рисунке 2 эта модель сравнивается с альтернативными моделями ИК-повреждения легких. Эта модель реперфузии вентиляции легких предлагает преимущества минимизации ателектаза, гипоксии и искусственной вентиляции легких. Важно отметить, что в качестве операции по выживанию она совместима со вторыми моделями травм (например, экспериментальными моделями пневмонии) и анализом разрешения травмы.
В заключение мы описали операцию по выживанию, включающую создание реперфузионного повреждения ишемии легких, которая, по нашему мнению, может дать ценное представление о механизмах и клеточных путях, участвующих в чистом ИК-повреждении в легких.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Эта работа финансировалась департаментской поддержкой отделения анестезии и периоперационной помощи, Калифорнийского университета в Сан-Франциско и больницы общего профиля Сан-Франциско, а также наградой NIH R01 (ap): 1R01HL146753.
Материалы
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Fiber Optic Light Pipe | Cole-Parmer | UX-41720-65 | Fiberoptic light pipe |
| Fiber Optic Light Source | AmScope | SKU: CL-HL250-B | Light source for fiberoptic lights |
| Germinator 500 | Cell Point Scientific, Inc. | No.5-1450 | Bead Sterilizer |
| Heating Pad | AIMS | 14-370-223 | Alternative option |
| Lithium.Ion Grooming Kits(hair clipper) | WAHL home products | SKU 09854-600B | To remove mouse hair on surgical site |
| Microscope | Nikon | SMZ-10 | Other newer options available at the company website |
| MiniVent Ventilator | Havard Apparatus | Model 845 | Mouse ventilator |
| Ultrasonic Cleaner | Cole-Parmer | UX-08895-05 | Clean tools that been used in operation |
| Warming Pad | Kent Scientific | RT-0501 | To keep mouse warm while recovering from surgery |
| Weighing Scale | Cole-Parmer | UX-11003-41 | Weighing scale |
| Surgery Tools | |||
| 4-0 Silk Suture | Ethicon | 683G | For closing muscle layer |
| 7-0 Prolene Suture | Ethicon Industry | EP8734H | Using for making a slip knot of left pulmonary artery |
| Bard-Parker (11) Scalpel (Rib-Back Carbon Steel Surgical Blade, sterile, single use) | Aspen Surgical | 372611 | For entering thoracic cavity (option 1) |
| Bard-Parker (12) Scalpel | Aspen Surgical | 372612 | For entering thoracic cavity (option 2) |
| Extra Fine Graefe Forceps | FST | 11150-10 | Muscle/rib holding forceps |
| Magnetic Fixator Retraction System | FST | 1. Base Plate (Nos. 18200-03) 2. Fixators (Nos. 18200-01) 3. Retractors (Nos. 18200-05 through 18200-12) 4. Elastomer (Nos.18200-07) 5. Retractor(No.18200-08) | Small Animal Retraction System |
| Monoject Standard Hypodermic Needle | COVIDIEN | 05-561-20 | For medication delivery IP |
| Narrow Pattern Forceps | FST | 11002-12 | Skin level forceps |
| Needle holder/Needle driver | FST | 12565-14 | for holding needles |
| Needles | BD | 305110 | 26 gauge needle for externalizing slipknot (24 or 26 gauge needle okay too) |
| PA/Vessel Dilating forceps | FST | 00125-11 | To hold PA; non-damaging gripper |
| Scissors | FST | 14060-09 | Used for incision and cutting into the muscular layer durging surgery |
| Ultra Fine Dumont micro forceps | FST | 11295-10 (Dumont #5 forceps, Biology tip, tip dimension:0.05*0.02mm,11cm) | For passing through the space between the left pulmonary artery and bronchus |
| Reagents | |||
| 0.25% Bupivacaine | Hospira, Inc. | 0409-1159-02 | Topical analgesic used during surgical wound closure |
| Avertin (2,2,2-Tribromoethanol) | Sigma-Aldrich | T48402-25G | Anesthetic, using for anesthetize the mouse for IR surgery, the concentration used in IR surgery is 250-400 mg/kg. |
| Buprenorphine | Covetrus North America | 59122 | Analgesic: concentration used for surgery is 0.05-0.1 mg/kg |
| Eye Lubricant | BAUSCH+LOMB | Soothe Lubricant Eye Ointment | Relieves dryness of the eye |
| Povidone-Iodine 10% Solution | MEDLINE INDUSTRIES INC | SKU MDS093944H (2 FL OZ, topical antiseptic) | Topical liquid applied for an effective first aid antiseptic at beginning of surgery |
| Materials | |||
| Alcohol Swab | BD brand | BD 326895 | for sterilzing area of injection and surgery |
| Plastic film | KIRKLAND | Stretch-Tite premium | Alternative for covering the sterilized surgical field (more cost effective) |
| Rodent Surgical Drapes | Stoelting | 50981 | Sterile field or drape for surgical field |
| Sterile Cotton Tipped Application | Pwi-Wnaps | 703033 | used for applying eye lubricant |
| Top Sponges | Dukal Corporaton | Reorder # 5360 | Stopping bleeding from skin/muscle |
Ссылки
- Shen, H., Kreisel, D., Goldstein, D. R. Processes of sterile inflammation. Journal of Immunology. 191 (6), 2857-2863 (2013).
- Fiser, S. M., et al. Lung transplant reperfusion injury involves pulmonary macrophages and circulating leukocytes in a biphasic response. The Journal of Thoracic and Cardiovascular Surgery. 121 (6), 1069-1075 (2001).
- Lama, V. N., et al. Models of lung transplant research: A consensus statement from the National Heart, Lung, and Blood Institute workshop. JCI Insight. 2 (9), 93121 (2017).
- Miao, R., Liu, J., Wang, J. Overview of mouse pulmonary embolism models. Drug Discovery Today: Disease Models. 7 (3-4), 77-82 (2010).
- Mira, J. C., et al. Mouse injury model of polytrauma and shock. Methods in Molecular Biology. 1717, 1-15 (2018).
- Krupnick, A. S., et al. Orthotopic mouse lung transplantation as experimental methodology to study transplant and tumor biology. Nature Protocols. 4 (1), 86-93 (2009).
- Gielis, J. F., et al. A murine model of lung ischemia and reperfusion injury: Tricks of the trade. The Journal of Surgical Research. 194 (2), 659-666 (2015).
- Nelson, K., et al. Animal models of ex vivo lung perfusion as a platform for transplantation research. World Journal of Experimental Medicine. 4 (2), 7-15 (2014).
- Dodd-o, J. M., Hristopoulos, M. L., Faraday, N., Pearse, D. B. Effect of ischemia and reperfusion without airway occlusion on vascular barrier function in the in vivo mouse lung. Journal of Applied Physiology. 95 (5), 1971-1978 (2003).
- Lawrenz, M. B., Fodah, R. A., Gutierrez, M. G., Warawa, J. Intubation-mediated intratracheal (IMIT) instillation: a noninvasive, lung-specific delivery system. Journal of Visualized Experiments. (93), e52261 (2014).
- Rayamajhi, M., et al. Non-surgical intratracheal instillation of mice with analysis of lungs and lung draining lymph nodes by flow cytometry. Journal of Visualized Experiments. (51), e2702 (2011).
- Dodd-o, J. M., Hristopoulos, M. L., Welsh-Servinsky, L. E., Tankersley, C. G., Pearse, D. B. Strain-specific differences in sensitivity to ischemia-reperfusion lung injury in mice. Journal of Applied Physiology. 100 (5), 1590-1595 (2006).
- Prakash, A., et al. Lung ischemia reperfusion (IR) is a sterile inflammatory process influenced by commensal microbiota in mice. Shock. 44 (3), 272-279 (2015).
- Prakash, A., et al. Alveolar macrophages and toll-like receptor 4 mediate ventilated lung ischemia reperfusion injury in mice. Anesthesiology. 117 (4), 822-835 (2012).
- Dodd-o, J. M., et al. The role of natriuretic peptide receptor-A signaling in unilateral lung ischemia-reperfusion injury in the intact mouse. American Journal of Physiology. Lung Cellular and Molecular Physiology. 294 (4), 714-723 (2008).
- Prakash, A., Kianian, F., Tian, X., Maruyama, D. Ferroptosis mediates inflammation in lung ischemia-reperfusion (IR) sterile injury in mice. American Journal of Respiratory and Critical Care Medicine. 201, (2020).
- Tian, X., et al. NLRP3 inflammasome mediates dormant neutrophil recruitment following sterile lung injury and protects against subsequent bacterial pneumonia in mice. Frontiers in Immunology. 8, 1337 (2017).
- Tian, X., Hellman, J., Prakash, A. Elevated gut microbiome-derived propionate levels are associated with reduced sterile lung inflammation and bacterial immunity in mice. Frontiers in Microbiology. 10, 159 (2019).
- Liu, Q., Tian, X., Maruyama, D., Arjomandi, M., Prakash, A. Lung immune tone via gut-lung axis: Gut-derived LPS and short-chain fatty acids' immunometabolic regulation of lung IL-1β, FFAR2, and FFAR3 expression. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (1), 65-78 (2021).
- Dodd-o, J. M., et al. Interactive effects of mechanical ventilation and kidney health on lung function in an in vivo mouse model. American Journal of Physiology. Lung Cellular and Molecular Physiology. 296 (1), 3-11 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены