Method Article
Un modelo de ratón de intubación orotraqueal y cirugía de reperfusión de isquemia pulmonar ventilada
* Estos autores han contribuido por igual
En este artículo
Resumen
Un modelo quirúrgico de ratón para crear una lesión por isquemia de reperfusión (RI) del pulmón izquierdo mientras se mantiene la ventilación y se evita la hipoxia.
Resumen
La lesión por isquemia de reperfusión (RI) con frecuencia resulta de procesos que implican un período transitorio de flujo sanguíneo interrumpido. En el pulmón, la RI aislada permite el estudio experimental de este proceso específico con ventilación alveolar continua, evitando así los procesos perjudiciales compuestos de hipoxia y atelectasia. En el contexto clínico, la lesión por isquemia pulmonar por reperfusión (también conocida como IRI pulmonar o LIRI) es causada por numerosos procesos, que incluyen, entre otros, embolia pulmonar, traumatismo hemorrágico resucitado y trasplante pulmonar. Actualmente hay opciones de tratamiento efectivas limitadas para LIRI. A continuación, presentamos un modelo quirúrgico reversible de IR pulmonar que incluye la primera intubación orotraqueal seguida de isquemia pulmonar izquierda unilateral y reperfusión con ventilación alveolar preservada o intercambio gaseoso. Los ratones se someten a una toracotomía izquierda, a través de la cual la arteria pulmonar izquierda se expone, visualiza, aísla y comprime usando un nudo deslizante reversible. La incisión quirúrgica se cierra durante el período isquémico, y el animal es despertado y extubado. Con el ratón respirando espontáneamente, la reperfusión se establece liberando el nudo deslizante alrededor de la arteria pulmonar. Este modelo de supervivencia clínicamente relevante permite la evaluación de la lesión pulmonar IR, la fase de resolución, los efectos posteriores sobre la función pulmonar, así como los modelos de dos golpes que involucran neumonía experimental. Si bien técnicamente es un desafío, este modelo se puede dominar en el transcurso de unas pocas semanas o meses con una eventual tasa de supervivencia o éxito del 80% -90%.
Introducción
La lesión por isquemia reperfusión (RI) puede ocurrir cuando se restablece el flujo sanguíneo a un órgano o lecho de tejido después de un período de interrupción. En el pulmón, la RI puede ocurrir de forma aislada o en asociación con otros procesos perjudiciales como infección, hipoxia, atelectasia, volutrauma (por volúmenes corrientes altos durante la ventilación mecánica), barotrauma (altas presiones máximas o sostenidas durante la ventilación mecánica) o lesión por contusión pulmonar contundente (no penetrante) 1,2,3 . Sigue habiendo varias lagunas en el conocimiento acerca de los mecanismos de LIRI y el impacto de los procesos concurrentes (p.ej., infección) en los resultados de LIRI, y también las opciones de tratamiento para LIRI son limitadas. Se requiere un modelo in vivo de LIRI puro para identificar la fisiopatología de la lesión pulmonar IR de forma aislada y para estudiar su contribución a cualquier proceso de múltiples golpes del cual la lesión pulmonar sea un componente.
Los modelos de IR pulmonar murina se pueden utilizar para estudiar la fisiopatología específica del pulmón de múltiples procesos, incluido el trasplante pulmonar3, la embolia pulmonar4 y la lesión pulmonar después de un traumatismo hemorrágico con reanimación5. Los modelos utilizados actualmente incluyen trasplante quirúrgico de pulmón6, pinzamiento hiliar7, perfusión pulmonar ex vivo 8 y pulmón ventilado IR9. Aquí, proporcionamos un protocolo detallado para un modelo IR pulmonar ventilado murino de lesión pulmonar estéril. Hay múltiples beneficios de este enfoque (Figura 2), incluyendo que induce hipoxia mínima y atelectasia mínima, y es un modelo de cirugía de supervivencia que permite estudios a largo plazo.
Las razones para elegir este modelo de LIRI sobre otros modelos como el pinzamiento hiliar y los modelos de perfusión ex vivo son las siguientes: este modelo minimiza las contribuciones inflamatorias de la atelectasia, la ventilación mecánica y la hipoxia; preserva la ventilación cíclica; mantiene intacto el sistema inmunitario circulatorio in vivo que puede responder a la lesión IR; y, por último, como procedimiento de supervivencia, permite el análisis a más largo plazo de los mecanismos de generación de lesiones secundarias (modelos de 2 golpes) y la resolución de lesiones. En general, creemos que este modelo IR de pulmón ventilado proporciona la forma "más pura" de lesión IR que se puede estudiar experimentalmente.
Otras publicaciones han descrito el uso de la intubación orotraqueal de ratones para realizar inyecciones o instalaciones IT10,11, pero no como punto de partida para una cirugía de supervivencia como lo es en este modelo. La colocación de un tubo orotraqueal permite la realización de la cirugía pulmonar al permitir el colapso del pulmón operatorio. También permite la reinflación del pulmón al final del procedimiento, lo cual es crítico para el neumotórax y para la capacidad del ratón para volver a la ventilación espontánea al final de los procedimientos. Finalmente, la extracción del tubo orotraqueal asegurado es un procedimiento simple que, a diferencia de una traqueotomía invasiva, es compatible con una cirugía de supervivencia. Esto permite estudios de investigación a largo plazo centrados en la comprensión de la progresión y resolución de LIRI y trastornos asociados, así como la creación de modelos de lesiones crónicas.
Protocolo
Todos los procedimientos y pasos descritos a continuación fueron aprobados por el comité institucional de cuidado y uso de animales (IACUC) de la Universidad de California en San Francisco. Se puede utilizar cualquier cepa de ratón, aunque algunas cepas tienen una respuesta inflamatoria IR pulmonar más robusta en comparación con otras12. Los ratones que tienen aproximadamente 12-15 semanas de edad (30-40 g) o más toleran y sobreviven a la cirugía IR pulmonar mejor que los ratones más jóvenes. Tanto los ratones machos como las hembras se pueden usar para estas cirugías.
1. Protocolo de intubación del ratón
- Anestesia y preparación para la intubación
- Limpie el abdomen del ratón con un hisopo de etanol. Anestesiar al ratón con una inyección intraperitoneal de tribromoetanol (250-400 mg/kg). Evaluar la profundidad apropiada de la anestesia por la falta de reflejo de retirada del pedal. Coloque la pomada lubricante para los ojos ahora o más tarde (paso 2.1.4).
NOTA: Para este procedimiento, el tribromoetanol (y el etomidato como una opción alternativa) proporciona un plano anestésico estable sin afectar las condiciones hemodinámicas requeridas para esta cirugía. Este anestésico solo se usa una vez para evitar el riesgo de adherencias peritoneales. El isoflurano también podría usarse, pero no lo usamos aquí. El practicante es libre de usar cualquier receta anestésica que considere adecuada. - Coloque el ratón anestesiado en un soporte de intubación o soporte de plástico en posición supina, suspendido por sus incisivos superiores en suturas 4-0 en bucle (seda u otras) a través de dos anclajes de soporte.
- Para mantener al ratón inmovilizado durante el procedimiento de intubación, pegue con cinta adhesiva la parte inferior del tórax (o ambas extremidades superiores) a la plataforma.
- Coloque la luz flexible de fibra óptica suavemente sobre la tráquea del ratón, ligeramente por debajo de las cuerdas vocales. Ajuste el nivel de iluminación para que solo se vea un campo oscuro cuando se mira dentro de la orofaringe del ratón, excepto la luz roja que emana de debajo de las cuerdas vocales, demostrando el objetivo para la eventual colocación del tubo endotraqueal. Tenga en cuenta que los movimientos de las cuerdas vocales deben ser visibles a simple vista o, si es necesario, bajo aumento.
- Limpie el abdomen del ratón con un hisopo de etanol. Anestesiar al ratón con una inyección intraperitoneal de tribromoetanol (250-400 mg/kg). Evaluar la profundidad apropiada de la anestesia por la falta de reflejo de retirada del pedal. Coloque la pomada lubricante para los ojos ahora o más tarde (paso 2.1.4).
- Procedimiento de intubación
- Sostenga las pinzas con la mano dominante y úselas para agarrar suavemente y sacar la lengua de la cavidad oral.
- Abra la mandíbula inferior con fórceps sostenidos por la mano no dominante y luego empuje los fórceps hacia la laringe para levantar suavemente la epiglotis. En este momento, suelte la lengua de las pinzas.
- Busca las cuerdas vocales. Deben abrirse y cerrarse de acuerdo con cada respiración. Sosteniendo la cánula con el alambre guía precargado, inserte la punta del cable a través de las cuerdas vocales.
- Teniendo mucho cuidado de no mover el alambre sosteniendo una porción que está fuera de la cánula pero justo por encima de las cuerdas vocales, retire la cánula, dejando solo el cable en su lugar con su extremo distal dentro de la tráquea.
- En este punto, realice una segunda visualización de las cuerdas vocales para confirmar que la punta distal del alambre permanece pasada a través de las cuerdas vocales iluminadas y hacia la tráquea, y no está en el esófago no iluminado.
- Sostenga el alambre fuera de la boca con las pinzas curvas en la mano izquierda, estabilizado contra una superficie dura, y avance cuidadosamente el catéter 20G con alas de cinta sobre el cable.
- Una vez que el extremo distal del alambre emerja del extremo posterior del catéter 20G o tubo endotraqueal, sostenga ese extremo con los fórceps curvos y avance suavemente el catéter 20G hacia la tráquea.
- Retire con cuidado el cable del extremo distal del catéter 20G con las pinzas curvas sin desalojar la colocación del catéter.
- Conecte brevemente el catéter al ventilador antes de asegurarlo para confirmar la colocación adecuada en la tráquea y no en el esófago. Confirmar la colocación traqueal mediante la observación de movimientos bilaterales de la pared torácica dependientes de la ventilación mecánica y la ausencia de inflado del estómago.
- Post-intubación
- Desconecte el catéter del ventilador. Fije las alas de la cinta (unidas al catéter) a través del labio inferior del ratón con una sutura de vicryl 4-0 para asegurar firmemente el tubo endotraqueal (ETT) al ratón durante todos los procedimientos/manipulaciones posteriores.
NOTA: Alternativamente, se puede usar cinta de seda u otra cinta para asegurar el ETT, sin embargo, se debe tener cuidado para evitar el desplazamiento del ETT durante el movimiento del animal desde el trineo de intubación hasta la superficie quirúrgica. - Retire con cuidado el ratón del trineo de intubación. Conecte brevemente el catéter al ventilador configurado a un volumen tidal de 0.2-0.225 ml y una frecuencia respiratoria de 120-150 respiraciones por minuto para confirmar la colocación traqueal correcta del tubo orotraqueal y luego desconecte con el ratón respirando espontáneamente a través del tubo orotraqueal.
- No deje al animal desatendido a partir de este momento hasta que haya recuperado la conciencia suficiente para mantener la decúbito esternal al final del procedimiento.
- Desconecte el catéter del ventilador. Fije las alas de la cinta (unidas al catéter) a través del labio inferior del ratón con una sutura de vicryl 4-0 para asegurar firmemente el tubo endotraqueal (ETT) al ratón durante todos los procedimientos/manipulaciones posteriores.
2. Protocolo quirúrgico de isquemia pulmonar y reperfusión (RI)
- Analgesia y preparación del sitio quirúrgico
- Limpie el abdomen del ratón con un hisopo de etanol e inyecte buprenorfina (0.05-0.1 mg / kg) por vía intraperitoneal.
- Afeite el vello sobre el área izquierda del tórax hasta la escápula izquierda. Elimine el exceso de vello afeitado con hisopos con alcohol.
NOTA: Los pasos 2.1.1 y 2.1.2 también se pueden realizar antes de la intubación si existe preocupación por el desplazamiento del ETT cuando se asegura con cinta de seda. - Coloque el ratón en una almohadilla de calentamiento en una posición lateral izquierda o 3/4 girada y conecte el tubo traqueal en el ventilador con un volumen corriente de 0.2-0.225 ml (~ 8 mg / kg) y una frecuencia respiratoria de 120-150 respiraciones por minuto. No use oxígeno suplementario para este procedimiento.
- Aplique lubricante para los ojos con un hisopo estéril de punta de algodón. Gire el ratón a 3/4 del lado izquierdo hacia arriba e inmovilice las cuatro extremidades y la cola con cinta de laboratorio.
- Desinfecte el área de la piel afeitada y el pelaje circundante con povidona yodada y espere a que la solución se seque. Luego cubra el campo quirúrgico con una cortina estéril o una película de plástico transparente y cree una abertura rectangular en la cortina o película plástica para el campo quirúrgico.
- Procedimiento quirúrgico
- Confirme el nivel apropiado de anestesia (proporcionado por la administración de tribromoetanol y buprenorfina como se describió anteriormente) mediante la prueba de respuesta al pellizco del dedo del pie.
- Usando un par de tijeras afiladas y un par de pinzas más grandes (pinzas de patrón estrecho o similares), haga una incisión transversal de piel de 2 cm por debajo del ángulo inferior de la escápula en el tórax lateral izquierdo. Use las tijeras y un par más fino de fórceps (pinzas graefe extra finas o similares) para cortar la capa muscular y diseccionar hasta las costillas.
- Identifique el segundo espacio intercostal y sostenga la segunda costilla con las pinzas extra finas. Tirando de la costilla hacia arriba, use una hoja de bisturí estéril #11 o #12 (curva) (sin necesidad de mango) para ingresar al espacio pleural separando y cortando los músculos intercostales del espacio 2º-3º. Considere pausar la ventilación para reducir la lesión en el ápice pulmonar izquierdo.
- Inserte tres retractores esterilizados. Use la cefalada retractora más pequeña/más estrecha a lo largo de la orientación de las costillas, el retractor de tamaño mediano a la izquierda a lo largo de la 2ª costilla y el retractor más grande a la derecha a lo largo de la superficie de la3ª costilla.
- Abra el pecho con una retracción lenta y progresiva utilizando los cordones retractores elásticos. Exponga e identifique la arteria pulmonar izquierda (PA) alejando el ápice pulmonar izquierdo con un hisopo estéril de punta de algodón.
- Use los micro fórceps, los fórceps ultrafinos en la mano derecha y la PA o las pinzas dilatadoras de vasos en la mano izquierda, para exponer suavemente y crear el campo en el que la PA izquierda y el bronquio son visibles.
- Usando los fórceps de PA, levante el PA izquierdo y tire suavemente pero firmemente hacia arriba y cefálico para visualizar el bronquio transparente debajo. Aumente el aumento en el microscopio de disección (consulte la lista de equipos para obtener más detalles) en este punto hasta el máximo (2x).
NOTA: Esterilice todo el equipo antes de usarlo. Además, para mantener la esterilidad, solo las puntas de los instrumentos quirúrgicos deben ingresar al campo quirúrgico estéril. - Mientras retrae la PA lejos del bronquio, pase cuidadosamente las pinzas ultrafinas cerradas a través del espacio entre la PA izquierda y el bronquio. Luego, use estos fórceps para sostener y tirar de un 7-0 u 8-0 Sutura de Proleno a través del espacio entre la arteria pulmonar izquierda (arriba) y el bronquio (abajo).
- Rodee el PA izquierdo atando un nudo deslizante para crear una oclusión en el PA. La interrupción del flujo sanguíneo se visualiza fácilmente bajo el microscopio. Esto marca el inicio del período isquémico.
- Externalice el extremo libre del nudo a través de un punto de entrada diferente en el tórax izquierdo anterior con una aguja 24G-28G y asegure el extremo de la sutura con un pequeño trozo de cinta para facilitar la identificación más adelante.
- Vuelva a inflar el pulmón para expulsar la mayor cantidad de aire posible de la cavidad torácica utilizando una válvula / tubo PEEP en el ventilador para roedores. Luego, cierre la caja torácica con dos suturas de nylon 4-0 interrumpidas.
- Cierre el músculo y la capa subcutánea con una sutura de nylon 4-0. Luego aplique dos o tres gotas de bupivacaína tópica (0.5%) en la incisión. Use una sutura de nylon 4-0 para cerrar la capa de piel con una sutura para correr.
- Cuidados postoperatorios
- Cuando se haya reanudado la ventilación espontánea, desconecte el tubo endotraqueal del ventilador y extube al ratón.
- Coloque el ratón en la almohadilla de calentamiento para mantener la temperatura corporal durante la recuperación temprana posterior a la anestesia.
- Controle cuidadosamente al ratón mientras se recupera de la anestesia general. Tire del nudo deslizante exteriorizado suavemente al final del período isquémico (30 min o 1 h).
- Mueva el ratón de la almohadilla de calentamiento a una jaula una vez que haya mostrado signos de recuperación: autoenderezamiento y/o movimiento.
- Después del período de reperfusión (1 h o 3 h), sacrificar al animal y recolectar sangre por punción cardíaca y tejido pulmonar para su posterior análisis. Para 1 h de reperfusión, recolectar plasma para ELISA, tejido para ARN y análisis de proteínas; Para la reperfusión de 3 h, además recolectar tejido para histología.
Resultados
Inflamación generada por lesión unilateral ventilada estéril por isquemia pulmonar (RI): Después de 1 h de isquemia, observamos un aumento de los niveles de citoquinas en el suero y dentro del tejido pulmonar tanto por ELISA como por qRT-PCR que alcanzó su punto máximo a 1 h después de la reperfusión y regresó rápidamente a la línea de base dentro de las 12-24 h después de la reperfusión13. Para las muestras recogidas a las 3 h después de la reperfusión, observamos una intensa infiltración de neutrófilos dentro del tejido pulmonar izquierdo y observamos que la intensidad de la inflamación dependía de la cepa de ratón utilizada (Figura 1). En particular, la inflamación que se genera en ausencia de un proceso infeccioso coexistente o posterior se resuelve gradualmente y los pulmones vuelven a su arquitectura pulmonar normal (por histopatología) con eferocitosis o salida de neutrófilos de los pulmones lesionados dentro de las 12-24 h después de la reperfusión13. Cabe destacar que observamos una inflamación leve pero detectable, que fue en gran parte neutrofílica y también se observó en el pulmón derecho no quirúrgico, lo que hipotetizamos se debe a la lesión por hiperperfusión14.
La recolección de muestras de tejido para este modelo de IR pulmonar no es diferente de la de otros modelos de IR pulmonar: se puede recolectar sangre para la preparación de plasma mediante punción cardíaca o canulación IVC; El tejido pulmonar se puede recolectar para la preparación de proteínas o ARN y luego para su posterior análisis mediante Western blot, ELISA o qPCR.
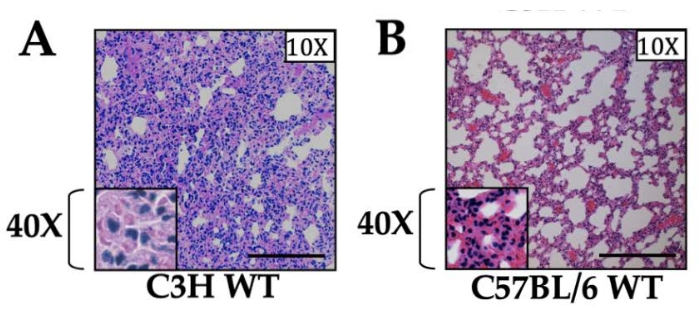
Figura 1: Histología de secciones pulmonares en ratones de tipo salvaje de dos cepas diferentes. (A) ratones C3H y (B) C57BL/6. Ambas cepas de ratones recibieron isquemia de 1 h y reperfusión de 3 h, y el tejido se muestra con un aumento de 10x. El aumento de 40x se muestra en el recuadro. Se observó infiltración neutrofílica en ambas cepas, con la cepa C3H mostrando niveles marcadamente mayores de inflamación en comparación con C57BL/6 como se informó anteriormente12. La barra de escala es de 200 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Comparación de ventajas (texto azul) y desventajas (texto rojo) de los tres modelos experimentales de lesión pulmonar IR (LIRI) de ratón más utilizados. Esta comparación destaca la elección de la RI pulmonar ventilada (descrita en este manuscrito) como el modelo ideal para estudiar la RI pulmonar pura. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este manuscrito detalla los pasos involucrados en la realización del modelo IR de pulmón ventilado desarrollado por Dodd-o et al.9. Este modelo ha ayudado a identificar vías moleculares implicadas en la generación y resolución de la inflamación de la RI pulmonar aislada 14,15,16,17, la RI pulmonar en combinación con la infección coexistente 18, y la RI pulmonar en relación con el eje intestino-pulmón y la contribución del microbioma intestinal13,18,19 . Aunque técnicamente es más desafiante, el modelo actual permite la evaluación de la RI pulmonar sin los efectos compuestos de la inflación pulmonar cíclica interrumpida y la hipoxia. También minimiza el período de exposición ventilatoria mecánica, a diferencia del modelo de perfusión ex vivo, que a su vez puede conducir a lesión pulmonar20.
Limitaciones del método: Si bien la tráquea del ratón es lo suficientemente estrecha como para que la presión espiratoria final positiva (PEEP) permita la expansión de los pulmones y proporcione un ajuste perfecto para la ETT, la mecánica pulmonar y las mediciones del asa de flujo y volumen pueden no ser posibles con esta versión de intubación orotraqueal reversible. Estas mediciones de fisiología pulmonar pueden requerir una traqueotomía, que, a diferencia de este método, es incompatible con una cirugía pulmonar de supervivencia. La intubación orotraqueal reversible es bien tolerada por los ratones, e incluso en ausencia de paralíticos hay muy poca asincronía ratón-ventilador siempre que la ventilación minuto (MV = volumen tidal x frecuencia respiratoria) sea lo suficientemente alta como para evitar que el impulso natural impulsado por elCO2 por la respiración se haga cargo (es decir, justo más allá del umbral apneico).
Hay varias consideraciones relacionadas con la porción de isquemia-reperfusión (RI) de este procedimiento. Primero, el procedimiento de RI debe realizarse con el menor trauma físico posible en el pulmón. Recomendamos pausar la ventilación mecánica y permitir que el ratón respire espontáneamente al entrar en la cavidad torácica. La ventilación con presión negativa, junto con el agarre del cirujano de la segunda o tercera costilla y alejarla del pulmón mientras ingresa cuidadosamente al pecho con una hoja de bisturí # 11, reducirá la posibilidad de lesionar el pulmón con el bisturí. Alternativamente, hemos encontrado que el uso de una hoja de bisturí curva # 12, colocada de manera que la curva mire hacia arriba, permite una entrada más cuidadosa en la cavidad torácica, lo que podría reducir la lesión en la superficie subyacente del ápice pulmonar izquierdo. Además, la conexión entre el PA izquierdo y el bronquio es menos segura más cerca del hilio, lo que facilita el paso de las pinzas ultrafinas entre estas dos estructuras aquí.
El siguiente paso crítico es aislar la PA izquierda del bronquio de abajo para rodear la PA con un lazo de sutura. Es esencial que este paso se realice con cuidado para evitar un traumatismo en el ápice pulmonar. Recomendamos ingresar a la caja torácica lo más cefálica posible para minimizar la cantidad de pulmón izquierdo que necesita ser desplazado o retraído para acceder a la AF y al bronquio. Cualquier parte del pulmón que sufra un traumatismo cerrado debe excluirse de la evaluación por lesión IR aislada. A menudo, el ápice del pulmón izquierdo se extirpa al recolectar los pulmones para el análisis final de la lesión pulmonar IR estéril. La lesión del ápice del pulmón se puede visualizar durante la cirugía debido a la presencia de puntos puncta de hemorragia o decoloración sanguinolenta.
Entre el PA y el bronquio de abajo existe una capa de tejido conectivo que debe romperse para rodear la arteria con el lazo de sutura. Aprender cuánta tensión se permite al agarrar y tirar de la PA izquierda hacia arriba (es decir, hacia la caja torácica y lejos del bronquio), usando el vaso no dentado y no dañino que agarra pinzas finas planas en la mano izquierda, es un primer paso importante para dominar. El PA izquierdo puede tolerar una sorprendente cantidad de tensión y estiramiento a medida que se tira hacia arriba. Nos resulta útil aumentar la ampliación del campo visual al máximo y ajustar el enfoque para que el espacio potencial (una línea blanca de tejido conectivo que adhiere el PA al bronquio) se pueda visualizar clara y nítidamente junto con las pinzas ultrafinas (sostenidas en la mano derecha). Para que el campo permanezca enfocado, es importante estabilizar la mano izquierda en la superficie quirúrgica mientras se tira de la PA izquierda hacia arriba y lejos del bronquio. Los fórceps ultrafinos se pueden pasar en el espacio entre las dos estructuras. Las puntas cerradas deben pasar fácilmente sin ninguna resistencia real, y una vez vistas en el otro lado del PA izquierdo, las puntas se pueden abrir suavemente para crear más espacio para el paso del material de sutura. Es fundamental que esto se realice utilizando pinzas ultrafinas completamente intactas, que se pueden determinar rápidamente tirando de un hisopo de alcohol estéril a través de las puntas cerradas para observar si las puntas rasgan el material. Las puntas dañadas también se pueden identificar abriendo y cerrando las pinzas con el máximo aumento del microscopio quirúrgico.
Es fácil detectar el daño que ocurre en el PA izquierdo o en el bronquio principal izquierdo al intentar separarlos. El daño a la PA izquierda resulta en la inundación del campo visual con sangre y puede resultar en una cirugía no recuperable si el daño crea un agujero dentro de la PA misma. En particular, hay vasos sanguíneos microscópicos superficiales en el PA que pueden lesionarse durante el movimiento de pinzas ultrafinas y potencialmente se pueden manejar colocando un hisopo de punta de algodón estéril seco sobre el campo para absorber la sangre que aparece. Si el sangrado se detiene, el procedimiento se puede reanudar. El daño al bronquio principal izquierdo es siempre una situación no recuperable, ya que no existe una forma simple o rápida de reparar el daño de las vías respiratorias.
El paso de separar el PA del bronquio subyacente se puede practicar inicialmente en un ratón muerto sin la presión del tiempo o la distracción de la actividad cardíaca y el movimiento que causa. Además, la estasis de sangre en la PA izquierda permite que se visualice más fácilmente (vaso grueso y regordete) y, sin embargo, aún pueda ser captada por las pinzas de PA planas no lesionantes. La capacidad de detectar daños en el bronquio izquierdo todavía es posible, ya que la ventilación del pulmón izquierdo se puede utilizar para evaluar la presencia de una vía aérea conductora intacta hacia el pulmón izquierdo. Esta situación de práctica también se puede utilizar para perfeccionar la creación del nudo deslizante.
Hay una duración finita de la oclusión, más allá de la cual no se garantiza la reperfusión espontánea después de la eliminación del nudo deslizante. En estudios piloto, esto ocurre en algún lugar entre 6 y 10 h. Más allá de esto, la reperfusión ocurre menos inmediatamente después de la eliminación del nudo deslizante. A medida que se extiende el período isquémico, la reperfusión requiere la manipulación del PA después de la eliminación del nudo deslizante para restablecer el flujo sanguíneo.
Las siguientes observaciones se han obtenido de cinco coautores de este artículo que representan su experiencia colectiva en el aprendizaje, perfeccionamiento, resolución de problemas y mejora de este procedimiento durante el período en que realizaron este modelo quirúrgico de ratón y se han resumido en los puntos siguientes:
En promedio, tomó de 1 a 3 meses dominar este procedimiento quirúrgico. Un procedurista estimó que se necesitan aproximadamente 50 cirugías para ser fácil con los diferentes procedimientos.
La tasa de éxito al inicio de la realización del procedimiento fue del 20% -40%. Después de realizar el procedimiento regularmente y con familiaridad, la tasa de éxito aumentó a 80% -90%.
La parte más difícil de la cirugía fue unánimemente el paso de los fórceps ultrafinos entre el PA izquierdo y el bronquio izquierdo, y luego la posterior captura del monofilamento de sutura con los fórceps y su paso entre las dos estructuras.
Los errores durante el paso del monofilamento entre el PA y el bronquio principal izquierdo pueden conducir a una cirugía insalvable con sangrado catastrófico del PA izquierdo o lesión irreversible en el bronquio principal izquierdo.
El número máximo de cirugías factibles en 1 solo día se estimó en 10 (aproximadamente 35-45 min/cirugía), mientras que el número ideal para la comodidad procesal y el éxito quirúrgico fue de cinco o seis.
Otros consejos y sugerencias misceláneos incluyen:
Evite el exceso de cafeína antes de comenzar el día quirúrgico para mantener la posición estable de la mano.
Aumente el aumento en el microscopio al máximo durante la porción del procedimiento cuando la sutura se pasa entre la PA izquierda y el bronquio principal izquierdo.
Use movimientos suaves y graduales/incrementales al avanzar los fórceps de Dumont para crear espacio entre la PA izquierda y el bronquio principal izquierdo.
Estabilice las manos en la superficie quirúrgica al realizar todos los pasos críticos.
Asegúrese de que la frecuencia respiratoria en el ventilador sea lo suficientemente alta como para evitar respiraciones espontáneas, especialmente durante las partes clave / críticas del procedimiento (sutura que pasa entre el PA izquierdo y el bronquio principal izquierdo).
Un ambiente tranquilo y sin interrupciones para realizar las cirugías es esencial para mantenerse concentrado y sin distracciones.
La figura 2 compara este modelo con modelos alternativos de lesión pulmonar IR. Este modelo de reperfusión de isquemia pulmonar ventilada ofrece las ventajas de minimizar la atelectasia, la hipoxia y la ventilación mecánica. Es importante destacar que, como cirugía de supervivencia, es compatible con modelos de segunda lesión (por ejemplo, modelos experimentales de neumonía) y el análisis de la resolución de la lesión.
En conclusión, hemos descrito una cirugía de supervivencia que implica la creación de una lesión por isquemia pulmonar por reperfusión que creemos que puede proporcionar información valiosa sobre los mecanismos y las vías celulares involucradas en la lesión IR pura en el pulmón.
Divulgaciones
Los autores declaran que no tienen intereses financieros contrapuestos.
Agradecimientos
Este trabajo fue financiado por el apoyo departamental del Departamento de Anestesia y Atención Perioperatoria, la Universidad de California en San Francisco y el Hospital General de San Francisco, así como por un premio NIH R01 (a AP): 1R01HL146753.
Materiales
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Fiber Optic Light Pipe | Cole-Parmer | UX-41720-65 | Fiberoptic light pipe |
| Fiber Optic Light Source | AmScope | SKU: CL-HL250-B | Light source for fiberoptic lights |
| Germinator 500 | Cell Point Scientific, Inc. | No.5-1450 | Bead Sterilizer |
| Heating Pad | AIMS | 14-370-223 | Alternative option |
| Lithium.Ion Grooming Kits(hair clipper) | WAHL home products | SKU 09854-600B | To remove mouse hair on surgical site |
| Microscope | Nikon | SMZ-10 | Other newer options available at the company website |
| MiniVent Ventilator | Havard Apparatus | Model 845 | Mouse ventilator |
| Ultrasonic Cleaner | Cole-Parmer | UX-08895-05 | Clean tools that been used in operation |
| Warming Pad | Kent Scientific | RT-0501 | To keep mouse warm while recovering from surgery |
| Weighing Scale | Cole-Parmer | UX-11003-41 | Weighing scale |
| Surgery Tools | |||
| 4-0 Silk Suture | Ethicon | 683G | For closing muscle layer |
| 7-0 Prolene Suture | Ethicon Industry | EP8734H | Using for making a slip knot of left pulmonary artery |
| Bard-Parker (11) Scalpel (Rib-Back Carbon Steel Surgical Blade, sterile, single use) | Aspen Surgical | 372611 | For entering thoracic cavity (option 1) |
| Bard-Parker (12) Scalpel | Aspen Surgical | 372612 | For entering thoracic cavity (option 2) |
| Extra Fine Graefe Forceps | FST | 11150-10 | Muscle/rib holding forceps |
| Magnetic Fixator Retraction System | FST | 1. Base Plate (Nos. 18200-03) 2. Fixators (Nos. 18200-01) 3. Retractors (Nos. 18200-05 through 18200-12) 4. Elastomer (Nos.18200-07) 5. Retractor(No.18200-08) | Small Animal Retraction System |
| Monoject Standard Hypodermic Needle | COVIDIEN | 05-561-20 | For medication delivery IP |
| Narrow Pattern Forceps | FST | 11002-12 | Skin level forceps |
| Needle holder/Needle driver | FST | 12565-14 | for holding needles |
| Needles | BD | 305110 | 26 gauge needle for externalizing slipknot (24 or 26 gauge needle okay too) |
| PA/Vessel Dilating forceps | FST | 00125-11 | To hold PA; non-damaging gripper |
| Scissors | FST | 14060-09 | Used for incision and cutting into the muscular layer durging surgery |
| Ultra Fine Dumont micro forceps | FST | 11295-10 (Dumont #5 forceps, Biology tip, tip dimension:0.05*0.02mm,11cm) | For passing through the space between the left pulmonary artery and bronchus |
| Reagents | |||
| 0.25% Bupivacaine | Hospira, Inc. | 0409-1159-02 | Topical analgesic used during surgical wound closure |
| Avertin (2,2,2-Tribromoethanol) | Sigma-Aldrich | T48402-25G | Anesthetic, using for anesthetize the mouse for IR surgery, the concentration used in IR surgery is 250-400 mg/kg. |
| Buprenorphine | Covetrus North America | 59122 | Analgesic: concentration used for surgery is 0.05-0.1 mg/kg |
| Eye Lubricant | BAUSCH+LOMB | Soothe Lubricant Eye Ointment | Relieves dryness of the eye |
| Povidone-Iodine 10% Solution | MEDLINE INDUSTRIES INC | SKU MDS093944H (2 FL OZ, topical antiseptic) | Topical liquid applied for an effective first aid antiseptic at beginning of surgery |
| Materials | |||
| Alcohol Swab | BD brand | BD 326895 | for sterilzing area of injection and surgery |
| Plastic film | KIRKLAND | Stretch-Tite premium | Alternative for covering the sterilized surgical field (more cost effective) |
| Rodent Surgical Drapes | Stoelting | 50981 | Sterile field or drape for surgical field |
| Sterile Cotton Tipped Application | Pwi-Wnaps | 703033 | used for applying eye lubricant |
| Top Sponges | Dukal Corporaton | Reorder # 5360 | Stopping bleeding from skin/muscle |
Referencias
- Shen, H., Kreisel, D., Goldstein, D. R. Processes of sterile inflammation. Journal of Immunology. 191 (6), 2857-2863 (2013).
- Fiser, S. M., et al. Lung transplant reperfusion injury involves pulmonary macrophages and circulating leukocytes in a biphasic response. The Journal of Thoracic and Cardiovascular Surgery. 121 (6), 1069-1075 (2001).
- Lama, V. N., et al. Models of lung transplant research: A consensus statement from the National Heart, Lung, and Blood Institute workshop. JCI Insight. 2 (9), 93121 (2017).
- Miao, R., Liu, J., Wang, J. Overview of mouse pulmonary embolism models. Drug Discovery Today: Disease Models. 7 (3-4), 77-82 (2010).
- Mira, J. C., et al. Mouse injury model of polytrauma and shock. Methods in Molecular Biology. 1717, 1-15 (2018).
- Krupnick, A. S., et al. Orthotopic mouse lung transplantation as experimental methodology to study transplant and tumor biology. Nature Protocols. 4 (1), 86-93 (2009).
- Gielis, J. F., et al. A murine model of lung ischemia and reperfusion injury: Tricks of the trade. The Journal of Surgical Research. 194 (2), 659-666 (2015).
- Nelson, K., et al. Animal models of ex vivo lung perfusion as a platform for transplantation research. World Journal of Experimental Medicine. 4 (2), 7-15 (2014).
- Dodd-o, J. M., Hristopoulos, M. L., Faraday, N., Pearse, D. B. Effect of ischemia and reperfusion without airway occlusion on vascular barrier function in the in vivo mouse lung. Journal of Applied Physiology. 95 (5), 1971-1978 (2003).
- Lawrenz, M. B., Fodah, R. A., Gutierrez, M. G., Warawa, J. Intubation-mediated intratracheal (IMIT) instillation: a noninvasive, lung-specific delivery system. Journal of Visualized Experiments. (93), e52261 (2014).
- Rayamajhi, M., et al. Non-surgical intratracheal instillation of mice with analysis of lungs and lung draining lymph nodes by flow cytometry. Journal of Visualized Experiments. (51), e2702 (2011).
- Dodd-o, J. M., Hristopoulos, M. L., Welsh-Servinsky, L. E., Tankersley, C. G., Pearse, D. B. Strain-specific differences in sensitivity to ischemia-reperfusion lung injury in mice. Journal of Applied Physiology. 100 (5), 1590-1595 (2006).
- Prakash, A., et al. Lung ischemia reperfusion (IR) is a sterile inflammatory process influenced by commensal microbiota in mice. Shock. 44 (3), 272-279 (2015).
- Prakash, A., et al. Alveolar macrophages and toll-like receptor 4 mediate ventilated lung ischemia reperfusion injury in mice. Anesthesiology. 117 (4), 822-835 (2012).
- Dodd-o, J. M., et al. The role of natriuretic peptide receptor-A signaling in unilateral lung ischemia-reperfusion injury in the intact mouse. American Journal of Physiology. Lung Cellular and Molecular Physiology. 294 (4), 714-723 (2008).
- Prakash, A., Kianian, F., Tian, X., Maruyama, D. Ferroptosis mediates inflammation in lung ischemia-reperfusion (IR) sterile injury in mice. American Journal of Respiratory and Critical Care Medicine. 201, (2020).
- Tian, X., et al. NLRP3 inflammasome mediates dormant neutrophil recruitment following sterile lung injury and protects against subsequent bacterial pneumonia in mice. Frontiers in Immunology. 8, 1337 (2017).
- Tian, X., Hellman, J., Prakash, A. Elevated gut microbiome-derived propionate levels are associated with reduced sterile lung inflammation and bacterial immunity in mice. Frontiers in Microbiology. 10, 159 (2019).
- Liu, Q., Tian, X., Maruyama, D., Arjomandi, M., Prakash, A. Lung immune tone via gut-lung axis: Gut-derived LPS and short-chain fatty acids' immunometabolic regulation of lung IL-1β, FFAR2, and FFAR3 expression. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (1), 65-78 (2021).
- Dodd-o, J. M., et al. Interactive effects of mechanical ventilation and kidney health on lung function in an in vivo mouse model. American Journal of Physiology. Lung Cellular and Molecular Physiology. 296 (1), 3-11 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados