Method Article
Ein Mausmodell der orotrachealen Intubation und der beatmeten Lungenischämie-Reperfusionschirurgie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Ein chirurgisches Mausmodell zur Erzeugung einer Reperfusionsverletzung der linken Lunge (IR) bei gleichzeitiger Aufrechterhaltung der Beatmung und Vermeidung von Hypoxie.
Zusammenfassung
Ischämie-Reperfusion (IR) -Verletzung resultiert häufig aus Prozessen, die eine vorübergehende Periode unterbrochenen Blutflusses beinhalten. In der Lunge ermöglicht die isolierte IR die experimentelle Untersuchung dieses spezifischen Prozesses mit fortgesetzter alveolärer Beatmung, wodurch die sich verstärkenden schädigenden Prozesse von Hypoxie und Atelektase vermieden werden. Im klinischen Kontext wird die Lungenischämie-Reperfusionsverletzung (auch bekannt als Lungen-IRI oder LIRI) durch zahlreiche Prozesse verursacht, einschließlich, aber nicht beschränkt auf Lungenembolie, wiederbelebtes hämorrhagisches Trauma und Lungentransplantation. Derzeit gibt es nur begrenzte wirksame Behandlungsmöglichkeiten für LIRI. Hier präsentieren wir ein reversibles chirurgisches Modell der Lungen-IR mit erster orotrachealer Intubation, gefolgt von einseitiger linker Lungenischämie und Reperfusion mit konservierter Alveolarventilation oder Gasaustausch. Mäuse durchlaufen eine linke Thorakotomie, durch die die linke Lungenarterie freigelegt, visualisiert, isoliert und mit einem reversiblen Slipknot komprimiert wird. Der chirurgische Schnitt wird dann während der ischämischen Periode geschlossen und das Tier wird geweckt und extubiert. Wenn die Maus spontan atmet, wird die Reperfusion hergestellt, indem der Slipknot um die Lungenarterie gelöst wird. Dieses klinisch relevante Überlebensmodell erlaubt die Bewertung von Lungen-IR-Verletzungen, der Auflösungsphase, nachgeschalteten Effekten auf die Lungenfunktion sowie Zwei-Treffer-Modellen mit experimenteller Pneumonie. Obwohl dieses Modell technisch anspruchsvoll ist, kann es im Laufe von einigen Wochen bis Monaten mit einer Überlebens- oder Erfolgsrate von 80% -90% gemeistert werden.
Einleitung
Ischämie-Reperfusion (IR) -Verletzung kann auftreten, wenn der Blutfluss zu einem Organ- oder Gewebebett nach einer gewissen Zeit der Unterbrechung wiederhergestellt wird. In der Lunge kann IR isoliert oder in Verbindung mit anderen schädlichen Prozessen wie Infektion, Hypoxie, Atelektase, Volutrauma (durch hohe Tidalvolumina während der mechanischen Beatmung), Barotrauma (hoher Spitzendruck oder anhaltender Druck während der mechanischen Beatmung) oder stumpfe (nicht penetrierende) Lungenprellung auftreten 1,2,3 . Es gibt noch einige Lücken in unserem Wissen über die Mechanismen von LIRI und die Auswirkungen gleichzeitiger Prozesse (z. B. Infektion) auf LIRI-Ergebnisse, und auch die Behandlungsmöglichkeiten für LIRI sind begrenzt. Ein In-vivo-Modell der reinen LIRI ist erforderlich, um die Pathophysiologie der Lungen-IR-Verletzung isoliert zu identifizieren und ihren Beitrag zu jedem Multi-Hit-Prozess zu untersuchen, bei dem eine Lungenverletzung eine Komponente ist.
Murine Lungen-IR-Modelle können verwendet werden, um die lungenspezifische Pathophysiologie mehrerer Prozesse zu untersuchen, einschließlich Lungentransplantation3, Lungenembolie4 und Lungenverletzung nach hämorrhagischem Trauma mit Reanimation5. Zu den derzeit verwendeten Modellen gehören chirurgische Lungentransplantation6, Hilarklemmung7, Ex-vivo-Lungenperfusion 8 und beatmete Lunge IR9. Hier stellen wir ein detailliertes Protokoll für ein murinventiliertes Lungen-IR-Modell einer sterilen Lungenverletzung zur Verfügung. Es gibt mehrere Vorteile dieses Ansatzes (Abbildung 2), einschließlich der Tatsache, dass er minimale Hypoxie und minimale Atelektase induziert, und es ist ein Überlebenschirurgiemodell, das Langzeitstudien ermöglicht.
Gründe, dieses Modell von LIRI gegenüber anderen Modellen wie dem Hilar-Klemm- und Ex-vivo-Perfusionsmodell zu wählen, sind die folgenden: Dieses Modell minimiert die entzündlichen Beiträge von Atelektase, mechanischer Beatmung und Hypoxie; es bewahrt die zyklische Belüftung; es erhält ein intaktes in vivo zirkulatorisches Immunsystem, das auf die IR-Verletzung reagieren kann; Und schließlich erlaubt es als Überlebensverfahren die längerfristige Analyse der Mechanismen der sekundären Verletzungsentstehung (2-Treffer-Modelle) und der Verletzungsauflösung. Insgesamt glauben wir, dass dieses beatmete Lungen-IR-Modell die "reinste" Form der IR-Verletzung bietet, die experimentell untersucht werden kann.
Andere Publikationen haben die Verwendung der orotrachealen Intubation von Mäusen zur Durchführung von IT-Injektionen oder -Installationenbeschrieben 10,11, aber nicht als Ausgangspunkt für eine Überlebensoperation wie in diesem Modell. Die Platzierung eines Orotrachealtubus ermöglicht die Durchführung einer Lungenoperation, indem der Kollaps der operativen Lunge ermöglicht wird. Es ermöglicht auch die erneute Inflation der Lunge am Ende des Eingriffs, was für den Pneumothorax und für die Fähigkeit der Maus, am Ende der Eingriffe zur Selbstbeatmung zurückzukehren, entscheidend ist. Schließlich ist die Entfernung des gesicherten Orotrachealtubus ein einfaches Verfahren, das im Gegensatz zu einer invasiven Tracheotomie mit einer Überlebensoperation kompatibel ist. Dies ermöglicht längerfristige Forschungsstudien, die sich auf das Verständnis des Verlaufs und der Auflösung von LIRI und damit verbundenen Erkrankungen sowie auf die Erstellung von Modellen für chronische Verletzungen konzentrieren.
Protokoll
Alle unten beschriebenen Verfahren und Schritte wurden vom Institutional Animal Care and Use Committee (IACUC) an der University of California San Francisco genehmigt. Jeder Mausstamm kann verwendet werden, obwohl einige Stämme im Vergleich zu anderen eine robustere Lungen-IR-Entzündungsreaktion haben12. Mäuse, die etwa 12-15 Wochen alt sind (30-40 g) oder älter, vertragen und überleben die Lungen-IR-Operation besser als jüngere Mäuse. Sowohl männliche als auch weibliche Mäuse können für diese Operationen verwendet werden.
1. Maus-Intubationsprotokoll
- Anästhesie und Vorbereitung auf die Intubation
- Wischen Sie den Bauch der Maus mit einem Ethanoltupfer ab. Betäuben Sie die Maus mit einer intraperitonealen Injektion von Tribromethanol (250-400 mg / kg). Beurteilen Sie die angemessene Tiefe der Anästhesie durch das Fehlen eines Pedalentzugsreflexes. Legen Sie die Augenschmiersalbe jetzt oder später (Schritt 2.1.4).
HINWEIS: Für dieses Verfahren bietet Tribromethanol (und Etomidate als alternative Option) eine stabile Anästhesieebene, ohne die für diese Operation erforderlichen hämodynamischen Bedingungen zu beeinflussen. Dieses Anästhetikum wird nur einmal verwendet, um das Risiko von Peritonealadhäsionen zu vermeiden. Isofluran könnte auch verwendet werden, aber wir verwenden es hier nicht. Dem Praktiker steht es frei, jedes Anästhesierezept zu verwenden, das er für richtig hält. - Legen Sie die betäubte Maus auf einen Intubationsständer oder eine Kunststoffstütze in Rückenlage, aufgehängt an ihren oberen Schneidezähnen an geschlungenen 4-0-Nähten (Seide oder andere) über zwei Stützanker.
- Um die Maus während des Intubationsvorgangs immobilisiert zu halten, kleben Sie den unteren Teil der Brust (oder beide oberen Extremitäten) locker auf die Plattform.
- Platzieren Sie das faseroptische flexible Licht sanft auf der Luftröhre der Maus, etwas unterhalb der Stimmbänder. Stellen Sie die Beleuchtungsstärke so ein, dass beim Blick in den Oropharynx der Maus nur ein dunkles Feld sichtbar ist, mit Ausnahme von rotem Licht, das von unterhalb der Stimmbänder ausgeht und das Ziel für die eventuelle Platzierung des Endotrachealtubus demonstriert. Beachten Sie, dass Stimmbandbewegungen mit bloßem Auge oder, falls erforderlich, unter Vergrößerung sichtbar sein sollten.
- Wischen Sie den Bauch der Maus mit einem Ethanoltupfer ab. Betäuben Sie die Maus mit einer intraperitonealen Injektion von Tribromethanol (250-400 mg / kg). Beurteilen Sie die angemessene Tiefe der Anästhesie durch das Fehlen eines Pedalentzugsreflexes. Legen Sie die Augenschmiersalbe jetzt oder später (Schritt 2.1.4).
- Intubationsverfahren
- Halten Sie die Pinzette mit der dominanten Hand und verwenden Sie sie, um die Zunge vorsichtig zu greifen und aus der Mundhöhle zu ziehen.
- Öffnen Sie den Unterkiefer mit einer Pinzette, die von der nicht dominanten Hand gehalten wird, und drücken Sie dann die Pinzette in den Kehlkopf, um die Epiglottis sanft anzuheben. Lösen Sie zu diesem Zeitpunkt die Zunge von der Pinzette.
- Suchen Sie nach den Stimmbändern. Sie sollten sich entsprechend jedem Atemzug öffnen und schließen. Halten Sie die Kanüle mit vorgespanntem Führungsdraht und führen Sie die Spitze des Drahtes durch die Stimmbänder ein.
- Achten Sie sehr darauf, den Draht nicht zu bewegen, indem Sie einen Teil davon halten, der sich außerhalb der Kanüle, aber knapp über den Stimmbändern befindet, ziehen Sie die Kanüle zurück und lassen Sie nur den Draht mit seinem distalen Ende in der Luftröhre.
- Führen Sie an dieser Stelle eine zweite Visualisierung der Stimmbänder durch, um zu bestätigen, dass die distale Spitze des Drahtes durch die beleuchteten Stimmbänder und in die Luftröhre geführt wird und sich nicht in der unbeleuchteten Speiseröhre befindet.
- Halten Sie den Draht außerhalb des Mundes mit der gebogenen Pinzette in der linken Hand, stabilisiert gegen eine harte Oberfläche, und schieben Sie den 20G-Katheter vorsichtig mit Bandflügeln über den Draht.
- Sobald das distale Ende des Drahtes aus dem hinteren Ende des 20G-Katheters oder Endotrachealtubus austritt, halten Sie dieses Ende mit der gekrümmten Pinzette und schieben Sie den 20G-Katheter sanft in die Luftröhre.
- Entfernen Sie den Draht vorsichtig vom distalen Ende des 20G-Katheters mit der gebogenen Pinzette, ohne die Platzierung des Katheters zu entfernen.
- Verbinden Sie den Katheter kurz mit dem Beatmungsgerät, bevor Sie ihn sichern, um die ordnungsgemäße Platzierung in der Luftröhre und nicht in der Speiseröhre zu bestätigen. Bestätigen Sie die Trachealplatzierung durch Beobachtung von mechanisch ventilationsabhängigen bilateralen Brustwandbewegungen und dem Fehlen einer Inflation des Magens.
- Post-Intubation
- Trennen Sie den Katheter vom Beatmungsgerät. Befestigen Sie die Bandflügel (am Katheter befestigt) durch die Unterlippe der Maus mit einer 4-0-Vicrylnaht, um den Endotrachealtubus (ETT) während aller nachfolgenden Eingriffe / Manipulationen fest an der Maus zu befestigen.
HINWEIS: Alternativ kann Seidenband oder anderes Klebeband verwendet werden, um das ETT zu sichern, es sollte jedoch darauf geachtet werden, dass sich das ETT während der Bewegung des Tieres vom Intubationsschlitten auf die chirurgische Oberfläche nicht löst. - Nehmen Sie die Maus vorsichtig aus dem Intubationsschlitten. Verbinden Sie den Katheter kurz mit dem Beatmungsgerät, das auf ein Tidalvolumen von 0,2-0,225 ml und eine Atemfrequenz von 120-150 Atemzügen pro Minute eingestellt ist, um die korrekte Trachealplatzierung des Orotrachealtubus zu bestätigen, und trennen Sie dann die Verbindung mit der Mausatmung spontan durch den Orotrachealtubus.
- Lassen Sie das Tier von diesem Zeitpunkt an nicht unbeaufsichtigt, bis es wieder ausreichend zu Bewusstsein gekommen ist, um am Ende des Eingriffs das sternale Liegen aufrechtzuerhalten.
- Trennen Sie den Katheter vom Beatmungsgerät. Befestigen Sie die Bandflügel (am Katheter befestigt) durch die Unterlippe der Maus mit einer 4-0-Vicrylnaht, um den Endotrachealtubus (ETT) während aller nachfolgenden Eingriffe / Manipulationen fest an der Maus zu befestigen.
2. Lungenischämie und Reperfusion (IR) Operationsprotokoll
- Analgesie und Vorbereitung der Operationsstelle
- Wischen Sie den Bauch der Maus mit einem Ethanoltupfer ab und injizieren Sie Buprenorphin (0,05-0,1 mg/kg) intraperitoneal.
- Rasieren Sie die Haare über den linken Thoraxbereich bis zum linken Schulterblatt. Entfernen Sie überschüssiges rasiertes Haar mit Alkoholtupfern.
HINWEIS: Die Schritte 2.1.1 und 2.1.2 können auch vor der Intubation durchgeführt werden, wenn Bedenken hinsichtlich der Entfernung des ETT bestehen, wenn es mit Seidenband gesichert ist. - Legen Sie die Maus auf ein Wärmekissen in einer linken seitlichen oder 3/4 gedrehten Position und verbinden Sie den Trachealschlauch am Beatmungsgerät mit einem Tidalvolumen von 0,2-0,225 ml (~ 8 mg / kg) und einer Atemfrequenz von 120-150 Atemzügen pro Minute. Verwenden Sie für dieses Verfahren keinen zusätzlichen Sauerstoff.
- Tragen Sie Augengleitmittel mit einem sterilen Wattestäbchen auf. Drehen Sie die Maus auf 3/4 linke Seite nach oben und immobilisieren Sie alle vier Gliedmaßen und den Schwanz mit Laborband.
- Desinfizieren Sie den rasierten Hautbereich und das umgebende Fell mit Povidon-Jod und warten Sie, bis die Lösung getrocknet ist. Decken Sie dann das Operationsfeld mit einem sterilen Vorhang oder einer durchsichtigen Kunststofffolie ab und erzeugen Sie eine rechteckige Öffnung im Vorhang oder der Kunststofffolie für das Operationsfeld.
- Chirurgischer Eingriff
- Bestätigen Sie das angemessene Maß an Anästhesie (bereitgestellt durch die Verabreichung von Tribromethanol und Buprenorphin, wie zuvor beschrieben), indem Sie das Ansprechen auf das Zehenklemmen testen.
- Machen Sie mit einer scharfen Schere und einer größeren Pinzette (Schmalmusterzange oder ähnliches) einen 2 cm langen Querschnitt der Haut unterhalb des unteren Winkels des Schulterblatts im linken lateralen Thorax. Verwenden Sie die Schere und eine feinere Pinzette (extra feine Graefe-Pinzette oder ähnliches), um in die Muskelschicht zu schneiden und bis zu den Rippen zu sezieren.
- Identifizieren Sie den zweiten Interkostalraum und halten Sie die zweite Rippe mit der extra feinen Pinzette. Ziehen Sie die Rippe nach oben, verwenden Sie eine sterile # 11 oder # 12 (gebogene) Skalpellklinge (kein Griff erforderlich), um in den Pleuraraum einzudringen, indem Sie die Interkostalmuskeln des 2. bis 3. Raums trennen und schneiden. Erwägen Sie, die Beatmung zu unterbrechen, um Verletzungen an der linken Lungenspitze zu reduzieren.
- Setzen Sie drei sterilisierte Retraktoren ein. Verwenden Sie den kleinsten / schmalsten Retraktorkopf entlang der Ausrichtung der Rippen, den mittelgroßen Retraktor links entlang der 2. Rippe und den größten Retraktor rechts entlang der Oberfläche der 3. Rippe.
- Öffnen Sie die Brust mit langsamem und fortschreitendem Retrakt mit den elastischen Retraktorschnüren. Belichten und identifizieren Sie die linke Lungenarterie (PA), indem Sie die linke Lungenspitze mit einem sterilen Wattestupfer wegbewegen.
- Verwenden Sie die Mikrozange, die ultrafeine Pinzette in der rechten Hand und die PA- oder gefäßerweiternde Pinzette in der linken Hand, um das Feld, in dem die linke PA und der Bronchus sichtbar sind, sanft freizulegen und zu erzeugen.
- Nehmen Sie mit der PA-Pinzette die linke PA auf und ziehen Sie sanft, aber fest nach oben und den Kopfschmerz, um den transparenten Bronchus darunter zu visualisieren. Erhöhen Sie die Vergrößerung am Dissektionsmikroskop (siehe Geräteliste für weitere Details) an dieser Stelle auf maximal (2x).
HINWEIS: Sterilisieren Sie alle Geräte vor Gebrauch. Um die Sterilität zu erhalten, sollten außerdem nur die Spitzen chirurgischer Instrumente in das sterile chirurgische Feld gelangen. - Während Sie die PA vom Bronchus wegziehen, führen Sie die geschlossene ultrafeine Pinzette vorsichtig durch den Raum zwischen der linken PA und dem Bronchus. Verwenden Sie dann diese Pinzette, um ein 7-0 oder 8-0 zu halten und zu ziehen Prolennaht durch den Raum zwischen der linken Lungenarterie (oben) und dem Bronchus (unten).
- Umkreisen Sie die linke PA, indem Sie einen Slipknot binden, um eine Okklusion in der PA zu erzeugen. Die Unterbrechung des Blutflusses wird leicht unter dem Mikroskop visualisiert. Dies markiert den Beginn der ischämischen Periode.
- Externalisieren Sie das freie Ende des Knotens durch einen anderen Eintrittspunkt im vorderen linken Thorax mit einer 24G-28G-Nadel und sichern Sie das Ende der Naht mit einem kleinen Stück Klebeband zur späteren leichteren Identifizierung.
- Blasen Sie die Lunge wieder auf, um so viel Luft wie möglich aus der Brusthöhle auszustoßen, indem Sie ein PEEP-Ventil / einen Schlauch am Nagetierbeatmungsgerät verwenden. Schließen Sie dann den Brustkorb mit zwei unterbrochenen 4-0-Nylonnähten.
- Schließen Sie den Muskel und die Unterhautschicht mit einer laufenden 4-0-Nylonnaht. Dann tragen Sie zwei oder drei Tropfen topisches Bupivacain (0,5%) auf den Einschnitt auf. Verwenden Sie eine 4-0-Nylonnaht, um die Hautschicht mit einer laufenden Naht zu schließen.
- Nachsorge
- Wenn die spontane Beatmung wieder aufgenommen wurde, trennen Sie den Endotrachealtubus vom Beatmungsgerät und extubieren Sie die Maus.
- Legen Sie die Maus auf das Wärmekissen, um die Körpertemperatur während der frühen Erholung nach der Anästhesie aufrechtzuerhalten.
- Überwachen Sie die Maus sorgfältig, während Sie sich von der Vollnarkose erholen. Ziehen Sie den externalisierten Slipknot vorsichtig am Ende der ischämischen Periode (30 min oder 1 h).
- Bewegen Sie die Maus vom Wärmekissen in einen Käfig, sobald sie Anzeichen einer Genesung gezeigt hat: Selbstaufrichten und / oder Bewegung.
- Nach der Reperfusionsperiode (1 h oder 3 h) das Tier einschläfern und Blut durch Herzpunktion und Lungengewebe zur weiteren Analyse sammeln. Für 1 h Reperfusion sammeln Sie Plasma für ELISA, Gewebe für RNA und Proteinanalyse; Für 3 h Reperfusion zusätzlich Gewebe für die Histologie sammeln.
Ergebnisse
Entzündung, die durch einseitig beatmete sterile Lungenischämie-Reperfusionsverletzung (IR) verursacht wurde: Nach 1 h Ischämie beobachteten wir erhöhte Zytokinspiegel im Serum und im Lungengewebe sowohl durch ELISA als auch durch qRT-PCR, die nach 1 h nach der Reperfusion ihren Höhepunkt erreichten und innerhalb von 12-24 h nach der Reperfusion schnell zum Ausgangswert zurückkehrten13. Für Proben, die 3 h nach der Reperfusion entnommen wurden, beobachteten wir eine intensive neutrophile Infiltration innerhalb des linken Lungengewebes und stellten fest, dass die Intensität der Entzündung vom verwendeten Mausstamm abhängig war (Abbildung 1). Bemerkenswerterweise löst sich die Entzündung, die in Abwesenheit eines koexistierenden oder nachfolgenden infektiösen Prozesses erzeugt wird, allmählich auf und die Lungen kehren zu ihrer normalen Lungenarchitektur (durch Histopathologie) mit Efferozytose oder Austritt von Neutrophilen aus den verletzten Lungen innerhalb von 12-24 h nach der Reperfusion zurück13. Bemerkenswert ist, dass wir eine leichte, aber nachweisbare Entzündung beobachteten, die weitgehend neutrophil war und auch in der nicht-operativen rechten Lunge beobachtet wurde, von der wir annehmen, dass sie auf eine Hyperperfusionsverletzung zurückzuführenist 14.
Die Entnahme von Gewebeproben für dieses Lungen-IR-Modell unterscheidet sich nicht von der für andere Lungen-IR-Modelle: Blut kann für die Plasmapräparation mittels Herzpunktion oder IVC-Kanülierung entnommen werden; Lungengewebe kann für die Protein- oder RNA-Vorbereitung und dann für die weitere Analyse mittels Western Blot, ELISA oder qPCR entnommen werden.
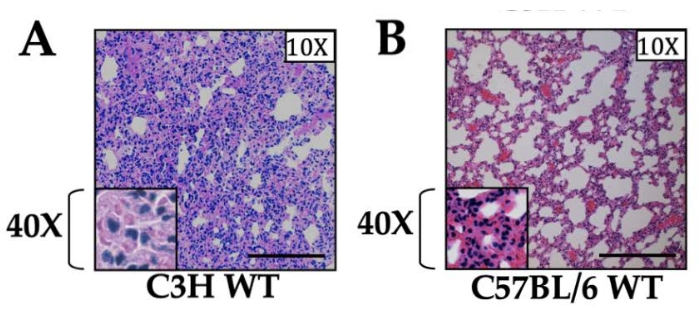
Abbildung 1: Histologie von Lungenschnitten in Wildtyp-Mäusen zweier verschiedener Stämme. (A) C3H- und (B) C57BL/6-Mäuse. Beide Mäusestämme erhielten 1 h Ischämie und 3 h Reperfusion, und das Gewebe wird bei 10-facher Vergrößerung gezeigt. Die 40-fache Vergrößerung ist im Einsatz dargestellt. Neutrophile Infiltration wurde in beiden Stämmen beobachtet, wobei der C3H-Stamm im Vergleich zu C57BL/6 deutlich höhere Entzündungswerte aufwies, wie zuvor berichtet12. Der Maßstabsbalken beträgt 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Vergleich der Vor- und Nachteile (roter Text) der drei am häufigsten verwendeten experimentellen Lungen-IR-Verletzungsmodelle (LIRI) der Maus. Dieser Vergleich unterstreicht die Wahl der beatmeten Lungen-IR (in diesem Manuskript beschrieben) als ideales Modell für die Untersuchung der reinen Lungen-IR. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Dieses Manuskript beschreibt die Schritte zur Durchführung des von Dodd-o et al.9 entwickelten belüfteten Lungen-IR-Modells. Dieses Modell hat dazu beigetragen, molekulare Signalwege zu identifizieren, die an der Entstehung und Auflösung von Entzündungen aus Lungen-IR in Isolation 14,15,16,17, Lungen-IR in Kombination mit kobestehender Infektion 18 und Lungen-IR in Bezug auf die Darm-Lungen-Achse und den Beitrag des Darmmikrobioms beteiligt sind13,18,19 . Obwohl technisch anspruchsvoller, ermöglicht das aktuelle Modell die Bewertung der Lungen-IR ohne die Compounding-Effekte einer unterbrochenen zyklischen Lungeninflation und Hypoxie. Es minimiert auch die Dauer der mechanischen Beatmungsexposition, im Gegensatz zum Ex-vivo-Perfusionsmodell, das selbst zu Lungenverletzungen führen kann20.
Einschränkungen der Methode: Während die Maustrachea so verjüngt ist, dass ein positiver exspiratorischer Enddruck (PEEP) eine Erweiterung der Lunge ermöglicht und eine passgenaue Passform für das ETT bietet, sind Lungenmechanik und Durchfluss-Volumen-Schleifenmessungen mit dieser Version der reversiblen orotrachealen Intubation möglicherweise nicht möglich. Diese lungenphysiologischen Messungen können eine Tracheotomie erfordern, die im Gegensatz zu dieser Methode mit einer Überlebenslungenoperation unvereinbar ist. Die reversible orotracheale Intubation wird von Mäusen gut vertragen, und selbst in Abwesenheit von Lähmungen gibt es sehr wenig Maus-Beatmungs-Asynchronie, vorausgesetzt, die Minutenbeatmung (MV = Tidalvolumen x Atemfrequenz) ist ausreichend hoch, um den natürlichen CO2-getriebenen Antrieb durch die Atemübernahme zu verhindern (d.h. knapp jenseits der Apnoeschwelle).
Es gibt mehrere Überlegungen im Zusammenhang mit dem Ischämie-Reperfusionsteil (IR) dieses Verfahrens. Erstens sollte das IR-Verfahren mit so wenig körperlichem Trauma für die Lunge wie möglich durchgeführt werden. Wir empfehlen, die mechanische Beatmung zu pausieren und die Maus beim Eintritt in die Brusthöhle spontan atmen zu lassen. Die Unterdruckbeatmung, zusammen mit dem Greifen der zweiten oder dritten Rippe durch den Chirurgen und das Wegziehen von der Lunge, während er vorsichtig mit einer # 11-Skalpellklinge in die Brust eindringt, verringert die Wahrscheinlichkeit, die Lunge mit dem Skalpell zu verletzen. Alternativ haben wir festgestellt, dass die Verwendung einer gekrümmten Skalpellklinge # 12, die so positioniert ist, dass die Kurve nach oben zeigt, einen vorsichtigeren Eintritt in die Brusthöhle ermöglicht, wodurch möglicherweise die Verletzung der darunter liegenden linken Lungenspitzenoberfläche reduziert wird. Darüber hinaus ist die Verbindung zwischen der linken PA und dem Bronchus näher am Hilum weniger sicher, was den Durchgang der ultrafeinen Pinzette zwischen diesen beiden Strukturen hier erleichtert.
Der nächste kritische Schritt besteht darin, die linke PA vom Bronchus darunter zu isolieren, um die PA mit einem Nahtband zu umschließen. Es ist wichtig, dass dieser Schritt sorgfältig durchgeführt wird, um ein Trauma der Lungenspitze zu vermeiden. Wir empfehlen, den Brustkorb als Kopfkrebs wie möglich zu betreten, um die Menge der linken Lunge zu minimieren, die verschoben oder zurückgezogen werden muss, um Zugang zu PA und Bronchus zu erhalten. Jeder Teil der Lunge, der ein stumpfes Trauma erleidet, muss von der Bewertung für isolierte IR-Verletzungen ausgeschlossen werden. Oft wird die Spitze der linken Lunge entfernt, wenn die Lunge zur endgültigen Analyse einer sterilen Lungen-IR-Verletzung entnommen wird. Eine Verletzung der Lungenspitze kann während der Operation aufgrund der Anwesenheit von Blutungen oder blutigen Verfärbungen visualisiert werden.
Zwischen der PA und dem darunter liegenden Bronchus befindet sich eine Bindegewebsschicht, die durchbrochen werden muss, um die Arterie mit der Nahtbinde zu umgeben. Zu lernen, wie viel Spannung erlaubt ist, während man die linke PA nach oben greift und zieht (d.h. in Richtung Brustkorb und weg vom Bronchus), wobei das nicht gezackte, nicht beschädigende Gefäß flache feine Pinzetten in der linken Hand greift, ist ein wichtiger erster Schritt, den es zu meistern gilt. Die linke PA kann überraschend viel Spannung und Dehnung tolerieren, wenn sie nach oben gezogen wird. Wir finden es hilfreich, die Vergrößerung des Gesichtsfeldes auf Maximum zu erhöhen und den Fokus so einzustellen, dass der potentielle Raum (eine weiße Linie des Bindegewebes, die die PA an den Bronchus haftet) zusammen mit der ultrafeinen Pinzette (in der rechten Hand gehalten) klar und scharf sichtbar gemacht werden kann. Damit das Feld im Fokus bleibt, ist es wichtig, die linke Hand auf der chirurgischen Oberfläche zu stabilisieren, während die linke PA nach oben und weg vom Bronchus gezogen wird. Die ultrafeine Pinzette kann dann im Raum zwischen den beiden Strukturen geführt werden. Die geschlossenen Spitzen sollten leicht ohne wirklichen Widerstand passieren, und sobald sie auf der anderen Seite der linken PA gesehen werden, können die Spitzen sanft geöffnet werden, um Platz für den Durchgang des Nahtmaterials zu schaffen. Entscheidend ist, dass dies mit völlig unbeschädigten ultrafeinen Pinzetten durchgeführt wird, die schnell festgestellt werden können, indem ein steriler Alkoholtupfer durch die geschlossenen Spitzen gezogen wird, um zu beobachten, ob die Spitzen am Material reißen. Schadensspitzen können auch durch Öffnen und Schließen der Pinzette unter maximaler Vergrößerung des Operationsmikroskops identifiziert werden.
Es ist leicht, Schäden zu erkennen, die entweder an der linken PA oder am linken Hauptbronchus auftreten, während versucht wird, sie zu trennen. Eine Beschädigung der linken PA führt zu einer Überflutung des Gesichtsfeldes mit Blut und kann zu einer nicht zu rettenden Operation führen, wenn der Schaden ein Loch in der PA selbst verursacht. Insbesondere gibt es mikroskopisch kleine Oberflächenblutgefäße auf der PA, die während der ultrafeinen Pinzettenbewegung verletzt werden können und möglicherweise durch Platzieren eines trockenen sterilen Wattestupfers über das Feld behandelt werden können, um das erscheinende Blut zu absorbieren. Wenn die Blutung aufhört, kann das Verfahren fortgesetzt werden. Eine Schädigung des linken Hauptbronchus ist immer eine nicht zu rettende Situation, da es keine einfache oder schnelle Möglichkeit gibt, Atemwegsschäden zu reparieren.
Der Schritt der Trennung der PA vom darunter liegenden Bronchus kann zunächst an einer toten Maus ohne Zeitdruck oder Ablenkung der Herzaktivität und der dadurch verursachten Bewegung geübt werden. Darüber hinaus ermöglicht die Blutstauung in der linken PA, dass sie leichter sichtbar gemacht werden kann (dickes und prdes Gefäß) und dennoch von der nicht verletzenden flachen PA-Pinzette aufgenommen werden kann. Die Fähigkeit, Schäden im linken Bronchus zu erkennen, ist immer noch möglich, da die Beatmung der linken Lunge verwendet werden kann, um das Vorhandensein eines intakten leitenden Atemwegs zur linken Lunge zu beurteilen. Diese Übungssituation kann auch genutzt werden, um die Entstehung des Slipknots zu perfektionieren.
Es gibt eine begrenzte Dauer der Okklusion, nach der eine spontane Reperfusion nach Entfernung des Slipknots nicht garantiert ist. In Pilotstudien tritt dies irgendwo zwischen 6 und 10 h auf. Darüber hinaus erfolgt die Reperfusion weniger unmittelbar nach dem Entfernen des Slipknots. Wenn sich die ischämische Periode verlängert, erfordert die Reperfusion eine Manipulation der PA nach der Entfernung von Slipknot, um den Blutfluss wiederherzustellen.
Diese folgenden Beobachtungen wurden von fünf Co-Autoren dieses Papiers erhalten, die ihre kollektive Erfahrung beim Lernen, Perfektionieren, Beheben und Verbessern dieses Verfahrens während des Zeitraums, in dem sie dieses Mausoperationsmodell durchführten, darstellen und in den folgenden Punkten zusammengefasst wurden:
Im Durchschnitt dauerte es 1-3 Monate, um diesen chirurgischen Eingriff zu meistern. Ein Verfahrensmediziner schätzte, dass es ungefähr 50 Operationen braucht, um mit den verschiedenen Verfahren einfach zu werden.
Die Erfolgsquote zu Beginn der Durchführung des Verfahrens betrug 20% -40%. Nach regelmäßiger und vertrauter Durchführung des Verfahrens stieg die Erfolgsrate auf 80%-90%.
Der schwierigste Teil der Operation war einstimmig das Passieren der ultrafeinen Pinzette zwischen der linken PA und dem linken Bronchus und dann das anschließende Einfangen des Nahtmonofilaments mit der Pinzette und dessen Übergang zwischen den beiden Strukturen.
Fehler beim Durchgang des Monofilaments zwischen PA und linkem Hauptstammbronchus können zu einer nicht zu rettenden Operation mit katastrophalen Blutungen der linken PA oder einer irreversiblen Verletzung des linken Hauptbronchus führen.
Die maximale Anzahl der an 1 einzigen Tag durchführbaren Operationen wurde auf 10 geschätzt (bei ca. 35-45 min/Operation), während die ideale Anzahl für prozeduralen Komfort und chirurgischen Erfolg fünf oder sechs betrug.
Weitere verschiedene Tipps und Vorschläge sind:
Vermeiden Sie überschüssiges Koffein, bevor Sie den chirurgischen Tag beginnen, um eine ruhige Handposition beizubehalten.
Erhöhen Sie die Vergrößerung des Mikroskops auf Maximum während des Teils des Eingriffs, wenn die Naht zwischen der linken PA und dem linken Hauptbronchus geführt wird.
Verwenden Sie sanfte und allmähliche / inkrementelle Bewegungen, wenn Sie die Dumont-Pinzette vorschieben, um Platz zwischen dem linken PA und dem linken Hauptbronchus zu schaffen.
Stabilisieren Sie die Hände auf der chirurgischen Oberfläche, wenn Sie alle kritischen Schritte ausführen.
Stellen Sie sicher, dass die Atemfrequenz am Beatmungsgerät hoch genug ist, um spontane Atemzüge zu vermeiden, insbesondere während der wichtigen/kritischen Teile des Verfahrens (Naht zwischen der linken PA und dem linken Hauptbronchus).
Eine ruhige und ungestörte Umgebung, um die Operationen durchzuführen, ist wichtig, um konzentriert und unabgelenkt zu bleiben.
Abbildung 2 vergleicht dieses Modell mit alternativen Modellen der Lungen-IR-Verletzung. Dieses Modell der reperfusion der beatmeten Lungenischämie bietet die Vorteile der Minimierung von Atelektase, Hypoxie und mechanischer Beatmung. Wichtig ist, dass es als Überlebenschirurgie mit Modellen für zweite Verletzungen (z. B. experimentelle Lungenentzündungsmodelle) und der Analyse der Auflösung von Verletzungen kompatibel ist.
Zusammenfassend haben wir eine Überlebensoperation beschrieben, bei der eine Lungenischämie-Reperfusionsverletzung entsteht, von der wir glauben, dass sie wertvolle Einblicke in die Mechanismen und zellulären Wege geben kann, die an einer reinen IR-Verletzung in der Lunge beteiligt sind.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Diese Arbeit wurde durch die Unterstützung der Abteilung für Anästhesie und perioperative Versorgung, der University of California San Francisco und des San Francisco General Hospital sowie durch einen NIH R01-Preis (an AP): 1R01HL146753 finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Fiber Optic Light Pipe | Cole-Parmer | UX-41720-65 | Fiberoptic light pipe |
| Fiber Optic Light Source | AmScope | SKU: CL-HL250-B | Light source for fiberoptic lights |
| Germinator 500 | Cell Point Scientific, Inc. | No.5-1450 | Bead Sterilizer |
| Heating Pad | AIMS | 14-370-223 | Alternative option |
| Lithium.Ion Grooming Kits(hair clipper) | WAHL home products | SKU 09854-600B | To remove mouse hair on surgical site |
| Microscope | Nikon | SMZ-10 | Other newer options available at the company website |
| MiniVent Ventilator | Havard Apparatus | Model 845 | Mouse ventilator |
| Ultrasonic Cleaner | Cole-Parmer | UX-08895-05 | Clean tools that been used in operation |
| Warming Pad | Kent Scientific | RT-0501 | To keep mouse warm while recovering from surgery |
| Weighing Scale | Cole-Parmer | UX-11003-41 | Weighing scale |
| Surgery Tools | |||
| 4-0 Silk Suture | Ethicon | 683G | For closing muscle layer |
| 7-0 Prolene Suture | Ethicon Industry | EP8734H | Using for making a slip knot of left pulmonary artery |
| Bard-Parker (11) Scalpel (Rib-Back Carbon Steel Surgical Blade, sterile, single use) | Aspen Surgical | 372611 | For entering thoracic cavity (option 1) |
| Bard-Parker (12) Scalpel | Aspen Surgical | 372612 | For entering thoracic cavity (option 2) |
| Extra Fine Graefe Forceps | FST | 11150-10 | Muscle/rib holding forceps |
| Magnetic Fixator Retraction System | FST | 1. Base Plate (Nos. 18200-03) 2. Fixators (Nos. 18200-01) 3. Retractors (Nos. 18200-05 through 18200-12) 4. Elastomer (Nos.18200-07) 5. Retractor(No.18200-08) | Small Animal Retraction System |
| Monoject Standard Hypodermic Needle | COVIDIEN | 05-561-20 | For medication delivery IP |
| Narrow Pattern Forceps | FST | 11002-12 | Skin level forceps |
| Needle holder/Needle driver | FST | 12565-14 | for holding needles |
| Needles | BD | 305110 | 26 gauge needle for externalizing slipknot (24 or 26 gauge needle okay too) |
| PA/Vessel Dilating forceps | FST | 00125-11 | To hold PA; non-damaging gripper |
| Scissors | FST | 14060-09 | Used for incision and cutting into the muscular layer durging surgery |
| Ultra Fine Dumont micro forceps | FST | 11295-10 (Dumont #5 forceps, Biology tip, tip dimension:0.05*0.02mm,11cm) | For passing through the space between the left pulmonary artery and bronchus |
| Reagents | |||
| 0.25% Bupivacaine | Hospira, Inc. | 0409-1159-02 | Topical analgesic used during surgical wound closure |
| Avertin (2,2,2-Tribromoethanol) | Sigma-Aldrich | T48402-25G | Anesthetic, using for anesthetize the mouse for IR surgery, the concentration used in IR surgery is 250-400 mg/kg. |
| Buprenorphine | Covetrus North America | 59122 | Analgesic: concentration used for surgery is 0.05-0.1 mg/kg |
| Eye Lubricant | BAUSCH+LOMB | Soothe Lubricant Eye Ointment | Relieves dryness of the eye |
| Povidone-Iodine 10% Solution | MEDLINE INDUSTRIES INC | SKU MDS093944H (2 FL OZ, topical antiseptic) | Topical liquid applied for an effective first aid antiseptic at beginning of surgery |
| Materials | |||
| Alcohol Swab | BD brand | BD 326895 | for sterilzing area of injection and surgery |
| Plastic film | KIRKLAND | Stretch-Tite premium | Alternative for covering the sterilized surgical field (more cost effective) |
| Rodent Surgical Drapes | Stoelting | 50981 | Sterile field or drape for surgical field |
| Sterile Cotton Tipped Application | Pwi-Wnaps | 703033 | used for applying eye lubricant |
| Top Sponges | Dukal Corporaton | Reorder # 5360 | Stopping bleeding from skin/muscle |
Referenzen
- Shen, H., Kreisel, D., Goldstein, D. R. Processes of sterile inflammation. Journal of Immunology. 191 (6), 2857-2863 (2013).
- Fiser, S. M., et al. Lung transplant reperfusion injury involves pulmonary macrophages and circulating leukocytes in a biphasic response. The Journal of Thoracic and Cardiovascular Surgery. 121 (6), 1069-1075 (2001).
- Lama, V. N., et al. Models of lung transplant research: A consensus statement from the National Heart, Lung, and Blood Institute workshop. JCI Insight. 2 (9), 93121 (2017).
- Miao, R., Liu, J., Wang, J. Overview of mouse pulmonary embolism models. Drug Discovery Today: Disease Models. 7 (3-4), 77-82 (2010).
- Mira, J. C., et al. Mouse injury model of polytrauma and shock. Methods in Molecular Biology. 1717, 1-15 (2018).
- Krupnick, A. S., et al. Orthotopic mouse lung transplantation as experimental methodology to study transplant and tumor biology. Nature Protocols. 4 (1), 86-93 (2009).
- Gielis, J. F., et al. A murine model of lung ischemia and reperfusion injury: Tricks of the trade. The Journal of Surgical Research. 194 (2), 659-666 (2015).
- Nelson, K., et al. Animal models of ex vivo lung perfusion as a platform for transplantation research. World Journal of Experimental Medicine. 4 (2), 7-15 (2014).
- Dodd-o, J. M., Hristopoulos, M. L., Faraday, N., Pearse, D. B. Effect of ischemia and reperfusion without airway occlusion on vascular barrier function in the in vivo mouse lung. Journal of Applied Physiology. 95 (5), 1971-1978 (2003).
- Lawrenz, M. B., Fodah, R. A., Gutierrez, M. G., Warawa, J. Intubation-mediated intratracheal (IMIT) instillation: a noninvasive, lung-specific delivery system. Journal of Visualized Experiments. (93), e52261 (2014).
- Rayamajhi, M., et al. Non-surgical intratracheal instillation of mice with analysis of lungs and lung draining lymph nodes by flow cytometry. Journal of Visualized Experiments. (51), e2702 (2011).
- Dodd-o, J. M., Hristopoulos, M. L., Welsh-Servinsky, L. E., Tankersley, C. G., Pearse, D. B. Strain-specific differences in sensitivity to ischemia-reperfusion lung injury in mice. Journal of Applied Physiology. 100 (5), 1590-1595 (2006).
- Prakash, A., et al. Lung ischemia reperfusion (IR) is a sterile inflammatory process influenced by commensal microbiota in mice. Shock. 44 (3), 272-279 (2015).
- Prakash, A., et al. Alveolar macrophages and toll-like receptor 4 mediate ventilated lung ischemia reperfusion injury in mice. Anesthesiology. 117 (4), 822-835 (2012).
- Dodd-o, J. M., et al. The role of natriuretic peptide receptor-A signaling in unilateral lung ischemia-reperfusion injury in the intact mouse. American Journal of Physiology. Lung Cellular and Molecular Physiology. 294 (4), 714-723 (2008).
- Prakash, A., Kianian, F., Tian, X., Maruyama, D. Ferroptosis mediates inflammation in lung ischemia-reperfusion (IR) sterile injury in mice. American Journal of Respiratory and Critical Care Medicine. 201, (2020).
- Tian, X., et al. NLRP3 inflammasome mediates dormant neutrophil recruitment following sterile lung injury and protects against subsequent bacterial pneumonia in mice. Frontiers in Immunology. 8, 1337 (2017).
- Tian, X., Hellman, J., Prakash, A. Elevated gut microbiome-derived propionate levels are associated with reduced sterile lung inflammation and bacterial immunity in mice. Frontiers in Microbiology. 10, 159 (2019).
- Liu, Q., Tian, X., Maruyama, D., Arjomandi, M., Prakash, A. Lung immune tone via gut-lung axis: Gut-derived LPS and short-chain fatty acids' immunometabolic regulation of lung IL-1β, FFAR2, and FFAR3 expression. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (1), 65-78 (2021).
- Dodd-o, J. M., et al. Interactive effects of mechanical ventilation and kidney health on lung function in an in vivo mouse model. American Journal of Physiology. Lung Cellular and Molecular Physiology. 296 (1), 3-11 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten