Method Article
Un modèle murin d’intubation orotrachéale et de chirurgie de reperfusion d’ischémie pulmonaire ventilée
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Un modèle chirurgical murin pour créer une lésion de reperfusion d’ischémie pulmonaire gauche (IR) tout en maintenant la ventilation et en évitant l’hypoxie.
Résumé
Les lésions d’ischémie par reperfusion (IR) résultent souvent de processus qui impliquent une période transitoire d’interruption du flux sanguin. Dans les poumons, l’IR isolée permet l’étude expérimentale de ce processus spécifique avec une ventilation alvéolaire continue, évitant ainsi les processus préjudiciables composés d’hypoxie et d’atélectasie. Dans le contexte clinique, la lésion de reperfusion de l’ischémie pulmonaire (également connue sous le nom d’IRI pulmonaire ou LIRI) est causée par de nombreux processus, y compris, mais sans s’y limiter, l’embolie pulmonaire, le traumatisme hémorragique réanimé et la transplantation pulmonaire. Il existe actuellement peu d’options de traitement efficaces pour le LIRI. Nous présentons ici un modèle chirurgical réversible d’IR pulmonaire impliquant d’abord une intubation orotrachéale suivie d’une ischémie unilatérale du poumon gauche et d’une reperfusion avec ventilation alvéolaire préservée ou échange gazeux. Les souris subissent une thoracotomie gauche, à travers laquelle l’artère pulmonaire gauche est exposée, visualisée, isolée et comprimée à l’aide d’un nœud glissant réversible. L’incision chirurgicale est ensuite fermée pendant la période ischémique, et l’animal est réveillé et extubé. Lorsque la souris respire spontanément, la reperfusion est établie en libérant le nœud glissant autour de l’artère pulmonaire. Ce modèle de survie cliniquement pertinent permet d’évaluer les lésions IR pulmonaires, la phase de résolution, les effets en aval sur la fonction pulmonaire, ainsi que des modèles à deux coups impliquant une pneumonie expérimentale. Bien que techniquement difficile, ce modèle peut être maîtrisé au cours de quelques semaines à quelques mois avec un taux de survie ou de réussite éventuel de 80% à 90%.
Introduction
Les lésions d’ischémie par reperfusion (IR) peuvent survenir lorsque le flux sanguin est rétabli dans un lit d’organe ou de tissu après une certaine période d’interruption. Dans les poumons, la RI peut survenir isolément ou en association avec d’autres processus nuisibles tels qu’une infection, une hypoxie, une atélectasie, un volutraumatisme (dû à des volumes courants élevés pendant la ventilation mécanique), un barotraumatisme (pression maximale élevée ou soutenue pendant la ventilation mécanique) ou une contusion pulmonaire contondante (non pénétrante) 1,2,3 . Il subsiste plusieurs lacunes dans nos connaissances sur les mécanismes de l’IRLI et l’impact des processus concomitants (p. ex. infection) sur les résultats de l’IRLI, et les options de traitement de l’IRLI sont limitées. Un modèle in vivo de LIRI pur est nécessaire pour identifier la physiopathologie des lésions IR pulmonaires de manière isolée et pour étudier sa contribution à tout processus multi-hit dont la lésion pulmonaire est une composante.
Les modèles IR pulmonaires murins peuvent être utilisés pour étudier la physiopathologie spécifique aux poumons de plusieurs processus, y compris la transplantation pulmonaire3, l’embolie pulmonaire4 et les lésions pulmonaires à la suite d’un traumatisme hémorragique avec réanimation5. Les modèles actuellement utilisés comprennent la transplantation pulmonairechirurgicale 6, le clampage hilaire7, la perfusion pulmonaire ex vivo 8 et l’IR9 pulmonaire ventilé. Ici, nous fournissons un protocole détaillé pour un modèle IR pulmonaire ventilé murin de lésion pulmonaire stérile. Les avantages de cette approche (Figure 2) sont multiples, notamment le fait qu’elle induit une hypoxie minimale et une atélectasie minimale, et qu’il s’agit d’un modèle de chirurgie de survie qui permet des études à long terme.
Les raisons de choisir ce modèle de LIRI par rapport à d’autres modèles tels que le clampage hilarant et les modèles de perfusion ex vivo sont les suivantes: ce modèle minimise les contributions inflammatoires de l’atélectasie, de la ventilation mécanique et de l’hypoxie; il préserve la ventilation cyclique; il maintient un système immunitaire circulatoire in vivo intact qui peut répondre à la lésion IR; Enfin, en tant que procédure de survie, elle permet l’analyse à plus long terme des mécanismes de génération de blessures secondaires (modèles à 2 coups) et de résolution des blessures. Dans l’ensemble, nous pensons que ce modèle d’IR pulmonaire ventilé fournit la forme « la plus pure » de lésion IR qui puisse être étudiée expérimentalement.
D’autres publications ont décrit l’utilisation de l’intubation orotrachéale de souris pour effectuer des injections ou des installations informatiques10,11, mais pas comme point de départ d’une chirurgie de survie comme c’est le cas dans ce modèle. La mise en place d’un tube orotrachéal permet la réalisation d’une chirurgie pulmonaire en permettant l’affaissement du poumon opératoire. Il permet également la réinflation du poumon à la fin de la procédure, ce qui est essentiel pour le pneumothorax et pour la capacité de la souris à revenir à la ventilation spontanée à la fin des procédures. Enfin, le retrait du tube orotrachéal sécurisé est une procédure simple qui, contrairement à une trachéotomie invasive, est compatible avec une chirurgie de survie. Cela permet de mener des études de recherche à plus long terme axées sur la compréhension de la progression et de la résolution de l’IRLI et des troubles associés, ainsi que sur la création de modèles de blessures chroniques.
Protocole
Toutes les procédures et étapes décrites ci-dessous ont été approuvées par le comité institutionnel de soin et d’utilisation des animaux (IACUC) de l’Université de Californie à San Francisco. N’importe quelle souche de souris peut être utilisée, bien que certaines souches aient une réponse inflammatoire IR pulmonaire plus robuste que d’autres12. Les souris âgées d’environ 12 à 15 semaines (30 à 40 g) ou plus tolèrent et survivent mieux à la chirurgie IR pulmonaire que les souris plus jeunes. Les souris mâles et femelles peuvent être utilisées pour ces chirurgies.
1. Protocole d’intubation de souris
- Anesthésie et préparation à l’intubation
- Essuyez l’abdomen de la souris avec un tampon à l’éthanol. Anesthésiez la souris avec une injection intrapéritonéale de tribromoéthanol (250-400 mg / kg). Évaluer la profondeur appropriée de l’anesthésie par l’absence de réflexe de retrait de la pédale. Placez la pommade lubrifiante pour les yeux maintenant ou plus tard (étape 2.1.4).
REMARQUE: Pour cette procédure, le tribromoéthanol (et l’étomidate comme option alternative) fournit un plan anesthésique stable sans affecter les conditions hémodynamiques requises pour cette chirurgie. Cet anesthésique n’est utilisé qu’une seule fois pour éviter le risque d’adhérences péritonéales. L’isoflurane pourrait également être utilisé, mais nous ne l’utilisons pas ici. Le praticien est libre d’utiliser la recette anesthésique qu’il juge appropriée. - Placer la souris anesthésiée sur un support d’intubation ou un support en plastique en décubitus dorsal, suspendu par ses incisives supérieures sur des sutures 4-0 bouclées (soie ou autre) sur deux ancrages de support.
- Pour maintenir la souris immobilisée pendant la procédure d’intubation, collez lâchement la partie inférieure de la poitrine (ou les deux membres supérieurs) à la plate-forme.
- Placez doucement la lumière flexible à fibre optique sur la trachée de la souris, légèrement en dessous des cordes vocales. Ajustez le niveau d’éclairage de sorte que seul un champ sombre soit visible lorsque vous regardez dans l’oropharynx de la souris, à l’exception de la lumière rouge émanant de sous les cordes vocales, démontrant la cible pour le placement éventuel du tube endotrachéal. Notez que les mouvements des cordes vocales doivent être visibles à l’œil nu ou, si nécessaire, sous grossissement.
- Essuyez l’abdomen de la souris avec un tampon à l’éthanol. Anesthésiez la souris avec une injection intrapéritonéale de tribromoéthanol (250-400 mg / kg). Évaluer la profondeur appropriée de l’anesthésie par l’absence de réflexe de retrait de la pédale. Placez la pommade lubrifiante pour les yeux maintenant ou plus tard (étape 2.1.4).
- Procédure d’intubation
- Tenez la pince à épiler avec la main dominante et utilisez-les pour saisir doucement et tirer la langue hors de la cavité buccale.
- Ouvrez la mâchoire inférieure à l’aide d’une pince tenue par la main non dominante, puis poussez la pince dans le larynx pour soulever doucement l’épiglotte. À ce stade, libérez la langue de la pince à épiler.
- Recherchez les cordes vocales. Ils doivent s’ouvrir et se fermer en fonction de chaque respiration. En tenant la canule avec le fil guide préchargé, insérez la pointe du fil à travers les cordes vocales.
- En faisant très attention à ne pas déplacer le fil en tenant une partie de celui-ci qui se trouve à l’extérieur de la canule mais juste au-dessus des cordes vocales, retirez la canule, en laissant juste le fil en place avec son extrémité distale dans la trachée.
- À ce stade, effectuez une deuxième visualisation des cordes vocales pour confirmer que l’extrémité distale du fil reste passée à travers les cordes vocales éclairées et dans la trachée, et n’est pas dans l’œsophage non éclairé.
- Tenez le fil à l’extérieur de la bouche avec la pince incurvée dans la main gauche, stabilisée contre une surface dure, et avancez délicatement le cathéter 20G avec des ailes de ruban adhésif sur le fil.
- Une fois que l’extrémité distale du fil émerge de l’extrémité arrière du cathéter 20G ou du tube endotrachéal, maintenez cette extrémité avec la pince incurvée et avancez doucement le cathéter 20G dans la trachée.
- Retirez délicatement le fil de l’extrémité distale du cathéter 20G avec les pinces incurvées sans déloger l’emplacement du cathéter.
- Connectez brièvement le cathéter au ventilateur avant de le fixer pour confirmer le placement approprié dans la trachée et non dans l’œsophage. Confirmer la mise en place trachéale par l’observation des mouvements bilatéraux de la paroi thoracique dépendants de la ventilation mécanique et de l’absence de gonflage de l’estomac.
- Post-intubation
- Débranchez le cathéter du ventilateur. Fixez les ailes du ruban adhésif (attachées au cathéter) à travers la lèvre inférieure de la souris à l’aide d’une suture en vicryle 4-0 pour fixer fermement le tube endotrachéal (ETT) à la souris pendant toutes les procédures / manipulations ultérieures.
REMARQUE: Alternativement, du ruban de soie ou un autre ruban peut être utilisé pour fixer l’ETT, mais il faut prendre soin d’éviter le déplacement de l’ETT pendant le déplacement de l’animal du traîneau d’intubation à la surface chirurgicale. - Retirez délicatement la souris du traîneau d’intubation. Connectez brièvement le cathéter au ventilateur réglé à un volume courant de 0,2 à 0,225 mL et à une fréquence respiratoire de 120 à 150 respirations par minute pour confirmer le placement trachéal correct du tube orotrachéal, puis déconnectez-vous de la souris qui respire spontanément par le tube orotrachéal.
- Ne laissez pas l’animal sans surveillance à partir de ce moment jusqu’à ce qu’il ait repris suffisamment conscience pour maintenir une position couchée sternale à la fin de la procédure.
- Débranchez le cathéter du ventilateur. Fixez les ailes du ruban adhésif (attachées au cathéter) à travers la lèvre inférieure de la souris à l’aide d’une suture en vicryle 4-0 pour fixer fermement le tube endotrachéal (ETT) à la souris pendant toutes les procédures / manipulations ultérieures.
2. Protocole chirurgical d’ischémie pulmonaire et de reperfusion (IR)
- Analgésie et préparation du site chirurgical
- Essuyez l’abdomen de la souris avec un tampon d’éthanol et injectez de la buprénorphine (0,05-0,1 mg / kg) par voie intrapéritonéale.
- Rasez les cheveux sur la région du thorax gauche jusqu’à l’omoplate gauche. Enlevez l’excès de poils rasés à l’aide de tampons imbibés d’alcool.
NOTE: Les étapes 2.1.1 et 2.1.2 peuvent également être effectuées avant l’intubation s’il y a un risque de déplacement de l’ETT lorsqu’il est fixé avec du ruban de soie. - Placez la souris sur un coussin chauffant en position latérale gauche ou tournée 3/4 et connectez le tube trachéal sur le ventilateur avec un volume courant de 0,2-0,225 mL (~ 8 mg / kg) et une fréquence respiratoire de 120-150 respirations par minute. N’utilisez pas d’oxygène supplémentaire pour cette procédure.
- Appliquez un lubrifiant pour les yeux avec un écouvillon stérile à pointe de coton. Tournez la souris sur le côté gauche 3/4 vers le haut et immobilisez les quatre membres et la queue avec du ruban de laboratoire.
- Désinfectez la zone de peau rasée et la fourrure environnante avec de la povidone iodée et attendez que la solution sèche. Ensuite, couvrez le champ chirurgical avec un champ stérile ou un film plastique transparent et créez une ouverture rectangulaire dans le champ ou le film plastique pour le champ chirurgical.
- Intervention chirurgicale
- Confirmer le niveau approprié d’anesthésie (fourni par l’administration de tribromoéthanol et de buprénorphine tel que décrit précédemment) en testant la réponse au pincement des orteils.
- À l’aide d’une paire de ciseaux tranchants et d’une paire de pinces plus grandes (pinces à motif étroit ou similaires), faites une incision cutanée transversale de 2 cm sous l’angle inférieur de l’omoplate dans le thorax latéral gauche. Utilisez les ciseaux et une paire de pinces plus fines (pinces graefe extra fines ou similaires) pour couper dans la couche musculaire et disséquer jusqu’aux côtes.
- Identifiez le deuxième espace intercostal et tenez la deuxième côte avec la pince extra fine. En tirant la côte vers le haut, utilisez une lame de scalpel #11 ou #12 (incurvée) stérile (aucune poignée nécessaire) pour entrer dans l’espace pleural en séparant et en coupant les muscles intercostaux du 2ème espace. Envisagez de suspendre la ventilation pour réduire les blessures à l’apex du poumon gauche.
- Insérez trois rétracteurs stérilisés. Utilisez le céphalade rétracteur le plus petit/le plus étroit le long de l’orientation des nervures, le rétracteur de taille moyenne à gauche le long de la 2e côte et le plus grand rétracteur à droite le long de la surface de la 3ecôte.
- Ouvrez la poitrine avec une rétraction lente et progressive à l’aide des cordons élastiques. Exposer et identifier l’artère pulmonaire gauche (AP) en éloignant l’apex du poumon gauche à l’aide d’un écouvillon stérile à pointe de coton.
- Utilisez les micro-pinces, les pinces ultrafines dans la main droite et les pinces PA ou dilatatrices vasculaires dans la main gauche, pour exposer doucement et créer le champ dans lequel le PA gauche et la bronche sont tous deux visibles.
- À l’aide de la pince PA, prenez la sonde gauche et tirez doucement mais fermement vers le haut et céphalade pour visualiser la bronche transparente ci-dessous. Augmenter le grossissement du microscope à dissection (voir la liste des équipements pour plus de détails) à ce stade au maximum (2x).
REMARQUE : Stérilisez tout l’équipement avant utilisation. De plus, pour maintenir la stérilité, seules les pointes des instruments chirurgicaux doivent entrer dans le champ chirurgical stérile. - Tout en rétractant le PA loin de la bronche, passez soigneusement la pince ultrafine fermée à travers l’espace entre le PA gauche et la bronche. Ensuite, utilisez ces forceps pour tenir et tirer un 7-0 ou 8-0 suture proléne à travers l’espace entre l’artère pulmonaire gauche (ci-dessus) et la bronche (ci-dessous).
- Encerclez le PA gauche en attachant un slipknot pour créer une occlusion dans le PA. L’interruption du flux sanguin est facilement visualisée au microscope. Cela marque le début de la période ischémique.
- Externalisez l’extrémité libre du nœud à travers un point d’entrée différent dans le thorax gauche antérieur à l’aide d’une aiguille 24G-28G et fixez l’extrémité de la suture avec un petit morceau de ruban adhésif pour une identification plus facile plus tard.
- Regonflez le poumon pour expulser autant d’air que possible de la cavité thoracique à l’aide d’une valve / tubulure PEEP sur le ventilateur pour rongeurs. Ensuite, fermez la cage thoracique avec deux sutures en nylon interrompues 4-0.
- Fermez la couche musculaire et sous-cutanée avec une suture en nylon 4-0. Ensuite, appliquez deux ou trois gouttes de bupivacaïne topique (0,5%) sur l’incision. Utilisez une suture en nylon 4-0 pour fermer la couche de peau avec une suture courante.
- Soins postopératoires
- Lorsque la ventilation spontanée a repris, débranchez le tube endotrachéal du ventilateur et extuberez la souris.
- Placez la souris sur le coussin chauffant pour maintenir la température corporelle pendant la récupération post-anesthésique précoce.
- Surveillez attentivement la souris pendant qu’elle se remet d’une anesthésie générale. Tirez doucement le nœud sillon extériorisé à la fin de la période ischémique (30 min ou 1 h).
- Déplacez la souris du coussin chauffant vers une cage une fois qu’elle a montré des signes de récupération : auto-redressement et/ou mouvement.
- Après la période de reperfusion (1 h ou 3 h), euthanasier l’animal et prélever du sang par ponction cardiaque et du tissu pulmonaire pour une analyse plus approfondie. Pour 1 h de reperfusion, prélever du plasma pour l’ELISA, du tissu pour l’ARN et l’analyse des protéines; Pour 3 h de reperfusion, prélever en outre du tissu pour l’histologie.
Résultats
Inflammation générée par une lésion unilatérale de reperfusion pulmonaire stérile (IR) : Après 1 h d’ischémie, nous avons observé une augmentation des taux de cytokines dans le sérum et dans le tissu pulmonaire par ELISA et qRT-PCR qui ont culminé à 1 h après la reperfusion et sont rapidement revenus à la ligne de base dans les 12-24 heures après la reperfusion13. Pour les échantillons prélevés 3 h après la reperfusion, nous avons observé une infiltration intense de neutrophiles dans le tissu pulmonaire gauche et noté que l’intensité de l’inflammation dépendait de la souche de souris utilisée (Figure 1). Notamment, l’inflammation qui est générée en l’absence d’un processus infectieux coexistant ou ultérieur disparaît progressivement et les poumons reviennent à leur architecture pulmonaire normale (par histopathologie) avec efférocytose ou sortie des neutrophiles des poumons blessés dans les 12-24 heures après la reperfusion13. Il convient de noter que nous avons observé une inflammation légère mais détectable, qui était en grande partie neutrophile et a également été observée dans le poumon droit non opératoire, ce qui, selon nous, est dû à une lésion d’hyperperfusion14.
Le prélèvement d’échantillons de tissus pour ce modèle d’IR pulmonaire n’est pas différent de celui des autres modèles d’IR pulmonaire : le sang peut être prélevé pour la préparation du plasma par ponction cardiaque ou canulation IVC ; Le tissu pulmonaire peut être prélevé pour la préparation de protéines ou d’ARN, puis pour une analyse plus approfondie par transfert Western, ELISA ou qPCR.
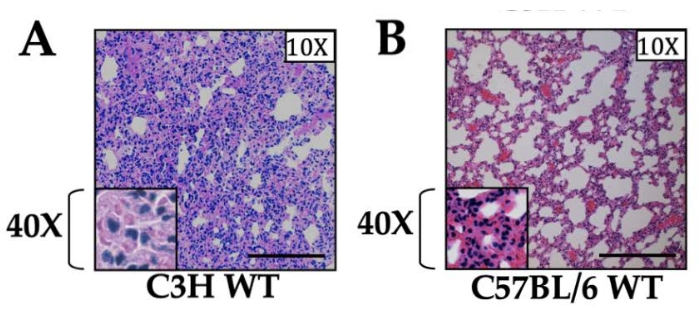
Figure 1 : Histologie des coupes pulmonaires chez des souris de type sauvage de deux souches différentes. (A) souris C3H et (B) C57BL/6. Les deux souches de souris ont reçu une ischémie de 1 h et une reperfusion de 3 h, et le tissu est montré à un grossissement de 10x. Le grossissement 40x est indiqué dans l’encart. Une infiltration neutrophile a été observée dans les deux souches, la souche C3H présentant des niveaux d’inflammation nettement plus élevés que C57BL/6, comme indiqué précédemment12. La barre d’échelle est de 200 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Comparaison des avantages (texte bleu) et des inconvénients (texte rouge) des trois modèles expérimentaux de lésions IR pulmonaires (LIRI) chez la souris les plus couramment utilisés. Cette comparaison met en évidence le choix de l’IR pulmonaire ventilée (décrite dans ce manuscrit) comme modèle idéal pour étudier l’IR pulmonaire pure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Ce manuscrit détaille les étapes impliquées dans la réalisation du modèle IR pulmonaire ventilé développé par Dodd-o et al.9. Ce modèle a permis d’identifier les voies moléculaires impliquées dans la génération et la résolution de l’inflammation à partir de l’IR pulmonaire en isolement 14,15,16,17, de l’IR pulmonaire en combinaison avec une infection coexistante 18 et de l’IR pulmonaire en relation avec l’axe intestin-poumon et la contribution du microbiome intestinal13,18,19 . Bien que techniquement plus difficile, le modèle actuel permet d’évaluer l’IR pulmonaire sans les effets cumulatifs de l’inflation pulmonaire cyclique interrompue et de l’hypoxie. Il minimise également la période d’exposition ventilatoire mécanique, contrairement au modèle de perfusion ex vivo, qui peut lui-même entraîner des lésions pulmonaires20.
Limites de la méthode: Bien que la trachée de souris soit suffisamment effilée pour que la pression expiratoire positive (PEP) permette l’expansion des poumons et fournisse un ajustement parfait pour l’ETT, la mécanique pulmonaire et les mesures de la boucle débit-volume peuvent ne pas être possibles avec cette version de l’intubation orotrachéale réversible. Ces mesures de physiologie pulmonaire peuvent nécessiter une trachéotomie, qui, contrairement à cette méthode, est incompatible avec une chirurgie pulmonaire de survie. L’intubation orotrachéale réversible est bien tolérée par les souris, et même en l’absence de paralytiques, il y a très peu d’asynchronie souris-ventilateur à condition que la ventilation minute (MV = volume courant x fréquence respiratoire) soit suffisamment élevée pour empêcher l’entraînement naturel du CO2 par le souffle (c’est-à-dire juste au-delà du seuil apnéique).
Il y a plusieurs considérations liées à la partie ischémie-reperfusion (IR) de cette procédure. Tout d’abord, la procédure IR doit être effectuée avec le moins de traumatisme physique possible au poumon. Nous recommandons de suspendre la ventilation mécanique et de permettre à la souris de respirer spontanément lorsqu’elle pénètre dans la cavité thoracique. La ventilation à pression négative, ainsi que la saisie par le chirurgien de la deuxième ou troisième côte et de l’éloigner du poumon tout en pénétrant soigneusement dans la poitrine avec une lame de scalpel #11, réduiront le risque de blessure au poumon avec le scalpel. Alternativement, nous avons constaté que l’utilisation d’une lame de scalpel incurvée #12, positionnée de manière à ce que la courbe soit orientée vers le haut, permet une entrée plus prudente dans la cavité thoracique, réduisant potentiellement les blessures à la surface sous-jacente de l’apex du poumon gauche. De plus, la connexion entre le PA gauche et la bronche est moins sûre plus près du hile, ce qui facilite ici le passage des pinces ultrafines entre ces deux structures.
La prochaine étape critique consiste à isoler le PA gauche de la bronche ci-dessous pour encercler le PA avec une attache de suture. Il est essentiel que cette étape soit accomplie avec soin pour éviter un traumatisme à l’apex pulmonaire. Nous recommandons d’entrer dans la cage thoracique aussi céphale que possible pour minimiser la quantité de poumon gauche qui doit être déplacée ou rétractée pour accéder à l’AP et aux bronches. Toute partie du poumon qui subit un traumatisme contondant doit être exclue de l’évaluation pour une blessure IR isolée. Souvent, l’apex du poumon gauche est excisé lors de la collecte des poumons pour l’analyse finale de la lésion IR pulmonaire stérile. Une lésion de l’apex du poumon peut être visualisée pendant la chirurgie en raison de la présence de puncta d’hémorragie ou de décoloration sanglante.
Entre le PA et la bronche ci-dessous existe une couche de tissu conjonctif qui doit être percée pour encercler l’artère avec le lien de suture. Apprendre combien de tension est permise lors de la saisie et de la traction de l’AP gauche vers le haut (c.-à-d. vers la cage thoracique et loin de la bronche), en utilisant le vaisseau non dentelé et non dommageable saisissant des pinces fines plates dans la main gauche, est une première étape importante à maîtriser. Le PA gauche peut tolérer une quantité surprenante de tension et s’étirer lorsqu’il est tiré vers le haut. Nous trouvons utile d’augmenter le grossissement du champ visuel au maximum et d’ajuster la mise au point afin que l’espace potentiel (une ligne blanche de tissu conjonctif adhérant le PA à la bronche) puisse être clairement et nettement visualisé avec la pince ultrafine (tenue dans la main droite). Pour que le champ reste concentré, il est important de stabiliser la main gauche sur la surface chirurgicale tout en tirant l’AP gauche vers le haut et loin de la bronche. Les pinces ultrafines peuvent ensuite être passées dans l’espace entre les deux structures. Les pointes fermées doivent passer facilement sans réelle résistance, et une fois vues de l’autre côté de la sonorisation gauche, les pointes peuvent être ouvertes doucement pour créer davantage d’espace pour le passage du matériau de suture. Il est essentiel que cela soit effectué à l’aide de pinces ultrafines complètement intactes, qui peuvent être rapidement déterminées en tirant un tampon d’alcool stérile à travers les embouts fermés pour observer si les pointes déchirent le matériau. Les pointes de dommages peuvent également être identifiées en ouvrant et en fermant les pinces sous grossissement maximal du microscope chirurgical.
Il est facile de détecter les dommages qui se produisent à la sonorisation gauche ou à la bronche principale gauche tout en essayant de les séparer. Les dommages à l’AP gauche entraînent une inondation du champ visuel avec du sang et peuvent entraîner une chirurgie non récupérable si les dommages créent un trou dans l’AP lui-même. Notamment, il y a des vaisseaux sanguins microscopiques de surface sur le PA qui peuvent se blesser pendant le mouvement des forceps ultrafins et peuvent potentiellement être gérés en plaçant un écouvillon sec stérile à pointe de coton sur le champ pour absorber le sang qui apparaît. Si le saignement cesse, la procédure peut être reprise. Les dommages à la bronche principale gauche sont toujours une situation irrécupérable puisqu’il n’existe aucun moyen simple ou rapide de réparer les dommages aux voies respiratoires.
L’étape de séparation de l’AP de la bronche sous-jacente peut être initialement pratiquée sur une souris morte sans la pression du temps ou la distraction de l’activité cardiaque et du mouvement qu’elle provoque. De plus, la stase du sang dans la sonorisation gauche permet de le visualiser plus facilement (vaisseau épais et dodu), tout en restant capable d’être capté par les pinces PA plates non blessantes. La capacité de détecter les dommages dans la bronche gauche est toujours possible, car la ventilation du poumon gauche peut être utilisée pour évaluer la présence d’une voie aérienne conductrice intacte vers le poumon gauche. Cette situation de pratique peut également être utilisée pour parfaire la création du slipknot.
Il existe une durée d’occlusion finie, au-delà de laquelle la reperfusion spontanée après retrait du slipknot n’est pas garantie. Dans les études pilotes, cela se produit quelque part entre 6 et 10 h. Au-delà de cela, la reperfusion se produit moins immédiatement après le retrait du nœud coulant. Au fur et à mesure que la période ischémique se prolonge, la reperfusion nécessite la manipulation de l’AP après l’élimination du nœud glissant afin de rétablir le flux sanguin.
Ces observations suivantes ont été obtenues de cinq co-auteurs de cet article qui représentent leur expérience collective dans l’apprentissage, le perfectionnement, le dépannage et l’amélioration de cette procédure au cours de la période où ils ont mené ce modèle chirurgical murin et ont été résumées dans les points ci-dessous:
En moyenne, il a fallu 1 à 3 mois pour maîtriser cette intervention chirurgicale. Un procéduraliste a estimé qu’il faut environ 50 chirurgies pour devenir facile avec les différentes procédures.
Le taux de réussite au début de l’exécution de la procédure était de 20% à 40%. Après avoir effectué la procédure régulièrement et avec familiarité, le taux de réussite est passé à 80%-90%.
La partie la plus difficile de la chirurgie a été unanimement le passage de la pince ultrafine entre la sonorisation gauche et la bronche gauche, puis la capture ultérieure du monofilament de suture avec la pince et son passage entre les deux structures.
Des erreurs lors du passage du monofilament entre l’AP et la bronche principale gauche peuvent entraîner une intervention chirurgicale irrécupérable avec saignement catastrophique de l’AP gauche ou une blessure irréversible à la bronche principale gauche.
Le nombre maximum de chirurgies réalisables en 1 seule journée a été estimé à 10 (à environ 35-45 minutes / chirurgie), tandis que le nombre idéal pour le confort procédural et le succès chirurgical était de cinq ou six.
Voici d’autres conseils et suggestions divers :
Évitez l’excès de caféine avant de commencer la journée chirurgicale pour maintenir une position stable de la main.
Augmenter le grossissement au microscope au maximum pendant la partie de la procédure lorsque la suture est passée entre la sonorisation gauche et la bronche principale gauche.
Utilisez des mouvements doux et graduels/progressifs lorsque vous avancez la pince Dumont pour créer un espace entre la sonorisation gauche et la bronche principale gauche.
Stabiliser les mains sur la surface chirurgicale lors de toutes les étapes critiques.
Assurez-vous que la fréquence respiratoire du ventilateur est suffisamment élevée pour éviter les respirations spontanées, en particulier pendant les parties clés / critiques de la procédure (suture passant entre la sonorisation gauche et la bronche principale gauche).
Un environnement calme et non perturbé pour effectuer les chirurgies est essentiel pour rester concentré et non distrait.
La figure 2 compare ce modèle à d’autres modèles de lésions IR pulmonaires. Ce modèle de reperfusion d’ischémie pulmonaire ventilée offre les avantages de minimiser l’atélectasie, l’hypoxie et la ventilation mécanique. Il est important de noter qu’en tant que chirurgie de survie, elle est compatible avec les modèles de deuxième blessure (par exemple, les modèles expérimentaux de pneumonie) et l’analyse de la résolution de la blessure.
En conclusion, nous avons décrit une chirurgie de survie impliquant la création d’une lésion de reperfusion d’ischémie pulmonaire qui, selon nous, peut fournir des informations précieuses sur les mécanismes et les voies cellulaires impliqués dans les lésions IR pures dans les poumons.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents.
Remerciements
Ce travail a été financé par le soutien du département d’anesthésie et de soins périopératoires de l’Université de Californie à San Francisco et de l’hôpital général de San Francisco, ainsi que par une bourse NIH R01 (à AP): 1R01HL146753.
matériels
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Fiber Optic Light Pipe | Cole-Parmer | UX-41720-65 | Fiberoptic light pipe |
| Fiber Optic Light Source | AmScope | SKU: CL-HL250-B | Light source for fiberoptic lights |
| Germinator 500 | Cell Point Scientific, Inc. | No.5-1450 | Bead Sterilizer |
| Heating Pad | AIMS | 14-370-223 | Alternative option |
| Lithium.Ion Grooming Kits(hair clipper) | WAHL home products | SKU 09854-600B | To remove mouse hair on surgical site |
| Microscope | Nikon | SMZ-10 | Other newer options available at the company website |
| MiniVent Ventilator | Havard Apparatus | Model 845 | Mouse ventilator |
| Ultrasonic Cleaner | Cole-Parmer | UX-08895-05 | Clean tools that been used in operation |
| Warming Pad | Kent Scientific | RT-0501 | To keep mouse warm while recovering from surgery |
| Weighing Scale | Cole-Parmer | UX-11003-41 | Weighing scale |
| Surgery Tools | |||
| 4-0 Silk Suture | Ethicon | 683G | For closing muscle layer |
| 7-0 Prolene Suture | Ethicon Industry | EP8734H | Using for making a slip knot of left pulmonary artery |
| Bard-Parker (11) Scalpel (Rib-Back Carbon Steel Surgical Blade, sterile, single use) | Aspen Surgical | 372611 | For entering thoracic cavity (option 1) |
| Bard-Parker (12) Scalpel | Aspen Surgical | 372612 | For entering thoracic cavity (option 2) |
| Extra Fine Graefe Forceps | FST | 11150-10 | Muscle/rib holding forceps |
| Magnetic Fixator Retraction System | FST | 1. Base Plate (Nos. 18200-03) 2. Fixators (Nos. 18200-01) 3. Retractors (Nos. 18200-05 through 18200-12) 4. Elastomer (Nos.18200-07) 5. Retractor(No.18200-08) | Small Animal Retraction System |
| Monoject Standard Hypodermic Needle | COVIDIEN | 05-561-20 | For medication delivery IP |
| Narrow Pattern Forceps | FST | 11002-12 | Skin level forceps |
| Needle holder/Needle driver | FST | 12565-14 | for holding needles |
| Needles | BD | 305110 | 26 gauge needle for externalizing slipknot (24 or 26 gauge needle okay too) |
| PA/Vessel Dilating forceps | FST | 00125-11 | To hold PA; non-damaging gripper |
| Scissors | FST | 14060-09 | Used for incision and cutting into the muscular layer durging surgery |
| Ultra Fine Dumont micro forceps | FST | 11295-10 (Dumont #5 forceps, Biology tip, tip dimension:0.05*0.02mm,11cm) | For passing through the space between the left pulmonary artery and bronchus |
| Reagents | |||
| 0.25% Bupivacaine | Hospira, Inc. | 0409-1159-02 | Topical analgesic used during surgical wound closure |
| Avertin (2,2,2-Tribromoethanol) | Sigma-Aldrich | T48402-25G | Anesthetic, using for anesthetize the mouse for IR surgery, the concentration used in IR surgery is 250-400 mg/kg. |
| Buprenorphine | Covetrus North America | 59122 | Analgesic: concentration used for surgery is 0.05-0.1 mg/kg |
| Eye Lubricant | BAUSCH+LOMB | Soothe Lubricant Eye Ointment | Relieves dryness of the eye |
| Povidone-Iodine 10% Solution | MEDLINE INDUSTRIES INC | SKU MDS093944H (2 FL OZ, topical antiseptic) | Topical liquid applied for an effective first aid antiseptic at beginning of surgery |
| Materials | |||
| Alcohol Swab | BD brand | BD 326895 | for sterilzing area of injection and surgery |
| Plastic film | KIRKLAND | Stretch-Tite premium | Alternative for covering the sterilized surgical field (more cost effective) |
| Rodent Surgical Drapes | Stoelting | 50981 | Sterile field or drape for surgical field |
| Sterile Cotton Tipped Application | Pwi-Wnaps | 703033 | used for applying eye lubricant |
| Top Sponges | Dukal Corporaton | Reorder # 5360 | Stopping bleeding from skin/muscle |
Références
- Shen, H., Kreisel, D., Goldstein, D. R. Processes of sterile inflammation. Journal of Immunology. 191 (6), 2857-2863 (2013).
- Fiser, S. M., et al. Lung transplant reperfusion injury involves pulmonary macrophages and circulating leukocytes in a biphasic response. The Journal of Thoracic and Cardiovascular Surgery. 121 (6), 1069-1075 (2001).
- Lama, V. N., et al. Models of lung transplant research: A consensus statement from the National Heart, Lung, and Blood Institute workshop. JCI Insight. 2 (9), 93121 (2017).
- Miao, R., Liu, J., Wang, J. Overview of mouse pulmonary embolism models. Drug Discovery Today: Disease Models. 7 (3-4), 77-82 (2010).
- Mira, J. C., et al. Mouse injury model of polytrauma and shock. Methods in Molecular Biology. 1717, 1-15 (2018).
- Krupnick, A. S., et al. Orthotopic mouse lung transplantation as experimental methodology to study transplant and tumor biology. Nature Protocols. 4 (1), 86-93 (2009).
- Gielis, J. F., et al. A murine model of lung ischemia and reperfusion injury: Tricks of the trade. The Journal of Surgical Research. 194 (2), 659-666 (2015).
- Nelson, K., et al. Animal models of ex vivo lung perfusion as a platform for transplantation research. World Journal of Experimental Medicine. 4 (2), 7-15 (2014).
- Dodd-o, J. M., Hristopoulos, M. L., Faraday, N., Pearse, D. B. Effect of ischemia and reperfusion without airway occlusion on vascular barrier function in the in vivo mouse lung. Journal of Applied Physiology. 95 (5), 1971-1978 (2003).
- Lawrenz, M. B., Fodah, R. A., Gutierrez, M. G., Warawa, J. Intubation-mediated intratracheal (IMIT) instillation: a noninvasive, lung-specific delivery system. Journal of Visualized Experiments. (93), e52261 (2014).
- Rayamajhi, M., et al. Non-surgical intratracheal instillation of mice with analysis of lungs and lung draining lymph nodes by flow cytometry. Journal of Visualized Experiments. (51), e2702 (2011).
- Dodd-o, J. M., Hristopoulos, M. L., Welsh-Servinsky, L. E., Tankersley, C. G., Pearse, D. B. Strain-specific differences in sensitivity to ischemia-reperfusion lung injury in mice. Journal of Applied Physiology. 100 (5), 1590-1595 (2006).
- Prakash, A., et al. Lung ischemia reperfusion (IR) is a sterile inflammatory process influenced by commensal microbiota in mice. Shock. 44 (3), 272-279 (2015).
- Prakash, A., et al. Alveolar macrophages and toll-like receptor 4 mediate ventilated lung ischemia reperfusion injury in mice. Anesthesiology. 117 (4), 822-835 (2012).
- Dodd-o, J. M., et al. The role of natriuretic peptide receptor-A signaling in unilateral lung ischemia-reperfusion injury in the intact mouse. American Journal of Physiology. Lung Cellular and Molecular Physiology. 294 (4), 714-723 (2008).
- Prakash, A., Kianian, F., Tian, X., Maruyama, D. Ferroptosis mediates inflammation in lung ischemia-reperfusion (IR) sterile injury in mice. American Journal of Respiratory and Critical Care Medicine. 201, (2020).
- Tian, X., et al. NLRP3 inflammasome mediates dormant neutrophil recruitment following sterile lung injury and protects against subsequent bacterial pneumonia in mice. Frontiers in Immunology. 8, 1337 (2017).
- Tian, X., Hellman, J., Prakash, A. Elevated gut microbiome-derived propionate levels are associated with reduced sterile lung inflammation and bacterial immunity in mice. Frontiers in Microbiology. 10, 159 (2019).
- Liu, Q., Tian, X., Maruyama, D., Arjomandi, M., Prakash, A. Lung immune tone via gut-lung axis: Gut-derived LPS and short-chain fatty acids' immunometabolic regulation of lung IL-1β, FFAR2, and FFAR3 expression. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (1), 65-78 (2021).
- Dodd-o, J. M., et al. Interactive effects of mechanical ventilation and kidney health on lung function in an in vivo mouse model. American Journal of Physiology. Lung Cellular and Molecular Physiology. 296 (1), 3-11 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon