Method Article
Orotracheal 삽관 및 환기 폐 허혈 재관류 수술의 마우스 모델
* 이 저자들은 동등하게 기여했습니다
요약
환기를 유지하고 저산소증을 피하면서 왼쪽 폐 허혈 재관류 (IR) 손상을 만드는 마우스 수술 모델.
초록
허혈 재관류 (IR) 손상은 종종 일시적인 혈류 중단을 포함하는 과정에서 발생합니다. 폐에서 격리 된 IR은 지속적인 폐포 환기와 함께이 특정 과정에 대한 실험적 연구를 허용하여 저산소증과 무기폐의 복잡한 해로운 과정을 피할 수 있습니다. 임상적 맥락에서 폐허혈 재관류 손상(폐 IRI 또는 LIRI라고도 함)은 폐색전증, 소생출혈성 외상 및 폐 이식을 포함하되 이에 국한되지 않는 수많은 과정에 의해 유발됩니다. 현재 LIRI에 대한 효과적인 치료 옵션은 제한적입니다. 여기에서는 첫 번째 구강 기관 삽관에 이어 편측성 좌측 폐 허혈 및 보존된 폐포 환기 또는 가스 교환을 통한 재관류를 포함하는 폐 IR의 가역적 수술 모델을 제시합니다. 마우스는 왼쪽 개흉술을 받는데,이를 통해 왼쪽 폐동맥이 노출되고, 시각화되고, 분리되고, 가역적 인 슬립 매듭을 사용하여 압축됩니다. 그런 다음 허혈성 기간 동안 수술 절개를 닫고 동물을 깨우고 발관합니다. 마우스가 자발적으로 호흡하면 폐동맥 주위의 슬립 매듭을 풀어 재관류가 이루어집니다. 이 임상적으로 관련된 생존 모델은 폐 IR 손상, 해결 단계, 폐 기능에 대한 다운스트림 효과 및 실험적 폐렴과 관련된 2-hit 모델의 평가를 허용합니다. 기술적으로 어렵지만 이 모델은 몇 주에서 몇 달에 걸쳐 마스터할 수 있으며 최종 생존율 또는 성공률은 80%-90%입니다.
서문
허혈 재관류 (IR) 손상은 일정 기간의 중단 후 혈류가 장기 또는 조직 베드로 회복 될 때 발생할 수 있습니다. 폐에서 IR은 감염, 저산소증, 무기폐, 부피 외상(기계적 환기 중 높은 일회 호흡량), 기압 외상(기계적 환기 중 높은 피크 또는 지속적인 압력) 또는 둔기(비관통) 폐 타박상 손상 1,2,3과 같은 다른 유해한 과정과 관련하여 단독으로 또는 발생할 수 있습니다. . LIRI의 메커니즘과 동시 프로세스(예: 감염)가 LIRI 결과에 미치는 영향에 대한 지식에는 몇 가지 격차가 남아 있으며 LIRI에 대한 치료 옵션도 제한적입니다. 순수한 LIRI의 생체 내 모델은 폐 IR 손상의 병태생리학을 단독으로 식별하고 폐 손상이 구성 요소인 다중 히트 과정에 대한 기여도를 연구하는 데 필요합니다.
쥐 폐 IR 모델은 폐 이식3, 폐색전증4 및 소생술을 동반한 출혈성 외상 후 폐 손상5을 포함한 여러 과정의 폐 특이적 병태생리학을 연구하는 데 사용할 수 있습니다. 현재 사용되는 모델에는 외과적 폐 이식6, 힐라 클램핑7, 체외 폐 관류8 및 환기 폐 IR9가 포함됩니다. 여기에서, 우리는 멸균 폐 손상의 뮤린 환기 폐 IR 모델에 대한 상세한 프로토콜을 제공한다. 이 접근법에는 최소 저산소증과 최소 무기폐를 유도하고 장기 연구를 허용하는 생존 수술 모델을 포함하여 여러 가지 이점이 있습니다 (그림 2).
힐라 클램핑 및 체외 관류 모델과 같은 다른 모델보다 LIRI 모델을 선택하는 이유는 다음과 같습니다. 이 모델은 무기폐, 기계적 환기 및 저산소증의 염증성 기여를 최소화합니다. 주기적 환기를 보존합니다. IR 손상에 반응할 수 있는 온전한 생체 내 순환 면역 체계를 유지하고; 마지막으로 생존 절차로서 2차 부상 생성(2히트 모델) 및 부상 해결 메커니즘에 대한 장기 분석이 가능합니다. 전반적으로, 우리는이 환기 된 폐 IR 모델이 실험적으로 연구 할 수있는 "가장 순수한"형태의 IR 손상을 제공한다고 믿습니다.
다른 간행물에서는 IT 주사 또는 설치10,11을 수행하기 위해 마우스의 구강 기관 삽관을 사용하는 것을 설명했지만이 모델에서와 같이 생존 수술의 출발점은 아닙니다. 구강 기관 튜브의 배치는 수술 폐의 붕괴를 허용함으로써 폐 수술의 수행을 허용합니다. 또한 절차가 끝날 때 폐의 재 팽창을 허용하는데, 이는 기흉과 절차가 끝날 때 마우스가 자발적인 환기로 돌아갈 수있는 능력에 중요합니다. 마지막으로, 고정 된 구강 기관 튜브의 제거는 침습적 기관 절개술과 달리 생존 수술과 호환되는 간단한 절차입니다. 이를 통해 LIRI 및 관련 장애의 진행 및 해결을 이해하고 만성 손상 모델을 만드는 데 중점을 둔 장기 연구 연구가 가능합니다.
프로토콜
아래에 설명 된 모든 절차와 단계는 캘리포니아 대학교 샌프란시스코의 기관 동물 관리 및 사용위원회 (IACUC)의 승인을 받았습니다. 모든 마우스 균주를 사용할 수 있지만 일부 균주는 다른 균주에 비해 더 강력한 폐 IR 염증 반응을 보입니다12. 약 12-15주령(30-40g) 이상인 마우스는 어린 마우스보다 폐 IR 수술을 더 잘 견디고 생존합니다. 수컷과 암컷 마우스 모두 이러한 수술에 사용할 수 있습니다.
1. 마우스 삽관 프로토콜
- 마취 및 삽관 준비
- 에탄올 면봉으로 마우스 복부를 닦으십시오. 트리 브로 모 에탄올 (250-400 mg / kg)의 복강 주사로 마우스를 마취하십시오. 페달 철수 반사의 부족으로 적절한 마취 깊이를 평가하십시오. 눈 윤활 연고를 지금 또는 나중에 두십시오 (2.1.4 단계).
참고: 이 절차의 경우 트리브로모에탄올(및 대체 옵션으로 에토미데이트)은 이 수술에 필요한 혈역학적 상태에 영향을 미치지 않으면서 안정적인 마취면을 제공합니다. 이 마취제는 복막 유착의 위험을 피하기 위해 한 번만 사용됩니다. 이소플루란도 사용할 수 있지만 여기서는 사용하지 않습니다. 의사는 적합하다고 생각하는 마취법을 자유롭게 사용할 수 있습니다. - 마취된 마우스를 삽관 스탠드 또는 플라스틱 지지대에 앙와위 자세로 놓고 두 개의 지지 앵커에 걸쳐 고리가 있는 4-0 봉합사(실크 또는 기타)에 위쪽 앞니에 매달아 놓습니다.
- 삽관 절차 중에 마우스를 고정한 상태로 유지하려면 가슴의 아래쪽(또는 양쪽 상지)을 플랫폼에 느슨하게 테이프로 붙입니다.
- 광섬유 유연한 빛을 성대 약간 아래의 마우스 기관에 부드럽게 놓습니다. 성대 아래에서 나오는 붉은 빛을 제외하고 마우스 구인두를 들여다 볼 때 어두운 필드 만 보이도록 조명 수준을 조정하여 기관 내 튜브의 최종 배치 대상을 보여줍니다. 성대의 움직임은 육안으로 또는 필요한 경우 확대하여 볼 수 있어야합니다.
- 에탄올 면봉으로 마우스 복부를 닦으십시오. 트리 브로 모 에탄올 (250-400 mg / kg)의 복강 주사로 마우스를 마취하십시오. 페달 철수 반사의 부족으로 적절한 마취 깊이를 평가하십시오. 눈 윤활 연고를 지금 또는 나중에 두십시오 (2.1.4 단계).
- 삽관 절차
- 지배적 인 손으로 핀셋을 잡고 부드럽게 잡고 구강 밖으로 혀를 빼내는 데 사용하십시오.
- 지배적이지 않은 손으로 잡은 집게를 사용하여 아래턱을 연 다음 집게를 후두로 밀어 후두개를 부드럽게 들어 올립니다. 이때 핀셋에서 혀를 풀어줍니다.
- 성대를 찾으십시오. 그들은 각 호흡에 따라 열리고 닫혀 야합니다. 가이드 와이어가 미리로드 된 캐뉼러를 잡고 성대를 통해 와이어 끝을 삽입합니다.
- 캐뉼라 바깥쪽이 아니라 성대 바로 위에 있는 와이어의 일부를 잡고 와이어를 움직이지 않도록 매우 조심하면서 캐뉼러를 빼내고 기관 내의 말단부가 있는 와이어만 제자리에 둡니다.
- 이 시점에서 성대의 두 번째 시각화를 수행하여 와이어 원위 팁이 조명 된 성대를 통과하여 기관으로 전달되고 조명이없는 식도에 있지 않은지 확인하십시오.
- 왼손에 구부러진 집게로 와이어를 입 밖으로 잡고 단단한 표면에 고정하고 테이프 날개로 20G 카테터를 와이어 위로 조심스럽게 전진시킵니다.
- 와이어의 말단부가 20G 카테터 또는 기관 내 튜브의 뒤쪽 끝에서 나오면 구부러진 집게로 그 끝을 잡고 20G 카테터를 기관으로 부드럽게 전진시킵니다.
- 카테터의 배치를 제거하지 않고 구부러진 집게로 20G 카테터의 말단부에서 와이어를 조심스럽게 제거합니다.
- 카테터를 고정하기 전에 인공 호흡기에 간단히 연결하여 식도가 아닌 기관에 적절한 배치를 확인하십시오. 기계적 환기에 의존하는 양측 흉벽 움직임과 위 팽창이없는 것을 관찰하여 기관 배치를 확인하십시오.
- 삽관 후
- 인공 호흡기에서 카테터를 분리하십시오. 4-0 vicryl 봉합사를 사용하여 마우스의 아랫입술을 통해 테이프 날개(카테터에 부착됨)를 고정하여 모든 후속 절차/조작 중에 기관 내 튜브(ETT)를 마우스에 단단히 고정합니다.
알림: 또는 실크 테이프 또는 기타 테이프를 사용하여 ETT를 고정할 수 있지만 삽관 썰매에서 수술 표면으로 동물을 이동하는 동안 ETT가 빠지지 않도록 주의해야 합니다. - 삽관 슬레드에서 마우스를 조심스럽게 제거하십시오. 카테터를 일회 호흡량 0.2-0.225 mL 및 분당 120-150 호흡의 호흡 속도로 설정된 인공 호흡기에 간단히 연결하여 구강 기관 튜브의 올바른 기관 배치를 확인한 다음 구강 기관 튜브를 통해 자발적으로 호흡하는 마우스와 연결을 끊습니다.
- 절차가 끝날 때 흉골 누운 자세를 유지하기에 충분한 의식을 회복 할 때까지이 시점부터 동물을 방치하지 마십시오.
- 인공 호흡기에서 카테터를 분리하십시오. 4-0 vicryl 봉합사를 사용하여 마우스의 아랫입술을 통해 테이프 날개(카테터에 부착됨)를 고정하여 모든 후속 절차/조작 중에 기관 내 튜브(ETT)를 마우스에 단단히 고정합니다.
2. 폐허혈 및 재관류(IR) 수술 프로토콜
- 진통 및 수술 부위 준비
- 에탄올 면봉으로 마우스 복부를 닦고 부 프레 노르 핀 (0.05-0.1 mg / kg)을 복강 내 주사합니다.
- 왼쪽 흉부 부위의 머리카락을 왼쪽 견갑골까지 면도하십시오. 알코올 면봉을 사용하여 과도하게 면도한 모발을 제거합니다.
참고: 2.1.1단계 및 2.1.2단계는 실크 테이프로 고정할 때 ETT가 이탈될 우려가 있는 경우 삽관 전에 수행할 수도 있습니다. - 마우스를 왼쪽 측면 또는 3/4 회전 위치의 온난화 패드에 놓고 인공호흡기의 기관 튜브를 0.2-0.225mL(~8mg/kg)의 일회 호흡량과 분당 120-150회의 호흡수로 연결합니다. 이 절차에는 보충 산소를 사용하지 마십시오.
- 멸균 면봉으로 눈 윤활제를 바르십시오. 마우스를 왼쪽으로 3/4 위로 돌리고 실험실 테이프로 네 팔다리와 꼬리를 모두 고정시킵니다.
- 면도 한 피부 부위와 주변 모피를 포비돈 요오드로 소독하고 용액이 마를 때까지 기다리십시오. 그런 다음 멸균 드레이프 또는 투명 플라스틱 필름으로 수술 부위를 덮고 수술 부위의 드레이프 또는 플라스틱 필름에 직사각형 개구부를 만듭니다.
- 수술
- 발가락 꼬집음에 대한 반응을 테스트하여 적절한 수준의 마취 (앞에서 설명한 트리브로 모 에탄올 및 부 프레 노르 핀 투여로 제공)를 확인하십시오.
- 한 쌍의 날카로운 가위와 한 쌍의 큰 집게 (좁은 패턴 집게 또는 이와 유사한 것)를 사용하여 왼쪽 측면 흉부의 견갑골의 열등한 각도 아래에서 2cm의 가로 피부 절개를하십시오. 가위와 더 미세한 집게 쌍 (초미세 그레이프 집게 또는 이와 유사한 것)을 사용하여 근육층을 자르고 갈비뼈까지 해부하십시오.
- 두 번째 늑간 공간을 식별하고 여분의 미세한 집게로 두 번째 갈비뼈를 잡습니다. 갈비뼈를 위로 당기고 멸균 #11 또는 #12(곡선) 메스 블레이드(손잡이 필요 없음)를 사용하여2-3번째 공간의 늑간근을 분리하고 절단하여 흉막 공간으로 들어갑니다. 왼쪽 폐 정점의 손상을 줄이기 위해 환기를 일시 중지하는 것을 고려하십시오.
- 3 개의 멸균 된 견인기를 삽입하십시오. 리브의 방향을 따라 가장 작은/가장 좁은 견인기 cephalad를 사용하고, 중간 크기 견인기는 2번째 리브를 따라 왼쪽으로, 가장 큰 견인기는 3번째 리브 의 표면을 따라 오른쪽에 사용합니다.
- 탄성 견인기 코드를 사용하여 느리고 점진적인 수축으로 가슴을여십시오. 멸균 면봉으로 왼쪽 폐 정점을 멀리 이동하여 왼쪽 폐동맥(PA)을 노출하고 식별합니다.
- 마이크로 집게, 오른손의 초미세 집게, 왼손의 PA 또는 혈관 확장 집게를 사용하여 왼쪽 PA와 기관지가 모두 보이는 필드를 부드럽게 노출하고 만듭니다.
- PA 집게를 사용하여 왼쪽 PA를 들어 올리고 부드럽지만 단단히 위쪽으로 당기고 두부를 당겨 아래의 투명한 기관지를 시각화합니다. 이 시점에서 해부 현미경의 배율(자세한 내용은 장비 목록 참조)을 최대(2x)로 늘립니다.
알림: 사용하기 전에 모든 장비를 소독하십시오. 또한 불임을 유지하려면 수술 도구의 끝 부분 만 멸균 수술 분야에 들어가야합니다. - PA를 기관지에서 멀어지게하면서 닫힌 초 미세 집게를 왼쪽 PA와 기관지 사이의 공간을 통해 조심스럽게 통과시킵니다. 그런 다음이 집게를 사용하여 7-0 또는 8-0을 잡고 당깁니다. 왼쪽 폐동맥 (위)과 기관지 (아래) 사이의 공간을 통한 Prolene 봉합사.
- 슬립 매듭을 묶어 왼쪽 PA를 둘러싸고 PA에 폐색을 만듭니다. 혈류 중단은 현미경으로 쉽게 시각화됩니다. 이것은 허혈성의 시작을 표시합니다.
- 24G-28G 바늘을 사용하여 전방 왼쪽 흉부의 다른 진입점을 통해 매듭의 자유 끝을 외부화하고 나중에 쉽게 식별할 수 있도록 작은 테이프로 봉합사의 끝을 고정합니다.
- 설치류 인공 호흡기의 PEEP 밸브 / 튜브를 사용하여 가능한 한 많은 공기를 흉강 밖으로 배출하도록 폐를 다시 팽창시킵니다. 그런 다음 두 개의 중단 된 4-0 나일론 봉합사로 흉곽을 닫습니다.
- 달리기 4-0 나일론 봉합사로 근육과 피하 층을 닫습니다. 그런 다음 국소 부피 바카 인 (0.5 %)을 절개 부위에 두세 방울 떨어 뜨립니다. 4-0 나일론 봉합사를 사용하여 흐르는 봉합사로 피부층을 닫습니다.
- 수술 후 관리
- 자발적 환기가 재개되면 인공 호흡기에서 기관 내 튜브를 분리하고 마우스를 발관하십시오.
- 마취 후 조기 회복 중에 체온을 유지하기 위해 마우스를 온난화 패드에 놓습니다.
- 전신 마취에서 회복하는 동안 마우스를주의 깊게 모니터링하십시오. 허혈성 기간(30분 또는 1시간)이 끝날 때 외부화된 슬립매듭을 부드럽게 당깁니다.
- 마우스를 보온화 패드에서 케이지로 옮기면 회복 징후가 보이면 (자기 교정 및 / 또는 움직임).
- 재관류 기간 (1 시간 또는 3 시간) 후, 동물을 안락사시키고 추가 분석을 위해 심장 천자 및 폐 조직으로 혈액을 수집합니다. 1 시간 재관류를 위해 ELISA를위한 혈장, RNA를위한 조직 및 단백질 분석을 위해 혈장을 수집하십시오. 3 시간 재관류의 경우 조직학을 위해 조직을 추가로 수집하십시오.
결과
일방적 환기 멸균 폐허혈 재관류(IR) 손상으로 생성된 염증: 허혈 1시간 후, ELISA 및 qRT-PCR 모두에 의해 혈청 및 폐 조직 내 사이토카인 수치가 증가한 것을 관찰했으며, 이는 재관류 후 1시간에 최고조에 달하고 재관류 후 12-24시간 이내에 기준선으로 빠르게 돌아왔습니다13. 재관류 후 3 시간에 수집 된 샘플의 경우, 우리는 왼쪽 폐 조직 내에서 강렬한 호중구 침윤을 관찰했으며 염증의 강도가 사용 된 마우스의 균주에 의존한다는 점에 주목했습니다 (그림 1). 특히, 공존 또는 후속 감염 과정이 없을 때 생성되는 염증은 점차적으로 해결되고 폐는 재관류 후 12-24 시간 내에 손상된 폐에서 호중구의 유출 또는 유출과 함께 정상적인 폐 구조 (조직 병리학에 의해)로 돌아갑니다13. 참고로, 우리는 경미하지만 감지 가능한 염증을 관찰했는데, 이는 대부분 호중구였으며 비수술적 오른쪽 폐에서도 관찰되었으며, 이는 과관류 손상14로 인한 것이라고 가정합니다.
이 폐 IR 모델에 대한 조직 샘플 수집은 다른 폐 IR 모델의 경우와 다르지 않습니다 : 심장 천자 또는 IVC 캐뉼러를 통해 혈장 준비를 위해 혈액을 수집 할 수 있습니다. 폐 조직은 단백질 또는 RNA 준비를 위해 수확한 다음 웨스턴 블롯, ELISA 또는 qPCR에 의한 추가 분석을 위해 수확할 수 있습니다.
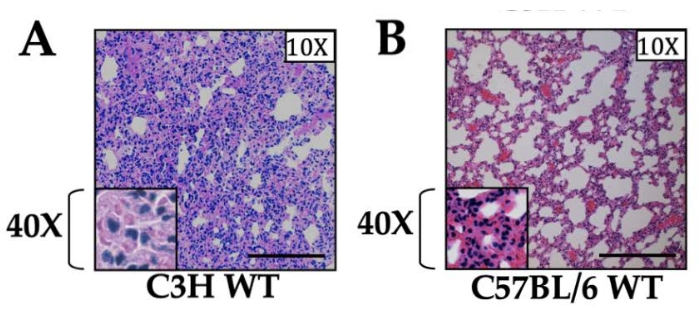
그림 1: 두 가지 다른 균주의 야생형 마우스에서 폐 절편의 조직학. (A) C3H 및 (B) C57BL/6 마우스. 마우스의 두 균주 모두 1 h 허혈 및 3 h 재관류를 받았고, 조직은 10x 배율로 나타내었다. 40x 배율이 삽입물에 표시됩니다. 호중구 침윤은 두 균주 모두에서 관찰되었으며, C3H 균주는 앞서 보고된 바와 같이 C57BL/6에 비해 현저히 더 높은 수준의 염증을 보였습니다. 스케일 바는 200 μm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 가장 일반적으로 사용되는 세 가지 마우스 실험적 폐 IR 손상(LIRI) 모델의 장점(파란색 텍스트)과 단점(빨간색 텍스트) 비교. 이 비교는 순수한 폐 IR을 연구하기위한 이상적인 모델로서 환기 된 폐 IR (이 원고에 설명 됨)의 선택을 강조합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 원고는 Dodd-o et al.9에 의해 개발 된 환기 된 폐 IR 모델을 수행하는 단계를 자세히 설명합니다. 이 모델은 분리 된 폐 IR 14,15,16,17, 공존하는 감염과 결합 된 폐 IR 18, 장-폐 축 및 장내 미생물 군집의 기여와 관련된 폐 IR에서 염증의 생성 및 해결에 관여하는 분자 경로를 식별하는 데 도움이되었습니다13,18,19 . 기술적으로 더 어렵지만 현재 모델은 중단된 주기적 폐 팽창 및 저산소증의 복합 효과 없이 폐 IR을 평가할 수 있습니다. 또한 그 자체로 폐 손상20을 유발할 수있는 생체 외 관류 모델과 달리 기계적 환기 노출 기간을 최소화합니다.
방법의 한계: 마우스 기관은 양단 호기압(PEEP)이 폐의 확장을 허용하고 ETT에 꼭 맞을 정도로 충분히 가늘어지지만, 이 버전의 가역적 구강 기관 삽관에서는 폐 역학 및 유량 루프 측정이 불가능할 수 있습니다. 이러한 폐 생리학 측정에는 기관 절개술이 필요할 수 있으며, 이 방법과 달리 생존 폐 수술과 양립할 수 없습니다. 가역적 구강 기관 삽관은 마우스에 의해 잘 견디며, 마비 환자가없는 경우에도 미세 환기 (MV = 일회 호흡량 x 호흡 속도)가 호흡에 의한 자연 CO2 구동 구동을 방지하기에 충분히 충분히 높다면 (즉, 무호흡 역치를 약간 초과).
이 절차의 허혈 재관류 (IR) 부분과 관련된 몇 가지 고려 사항이 있습니다. 첫째, IR 절차는 가능한 한 폐에 대한 신체적 외상을 최소화하면서 수행되어야합니다. 기계적 환기를 일시 중지하고 마우스가 흉강에 들어갈 때 자발적으로 숨을 쉴 수 있도록 하는 것이 좋습니다. 음압 환기는 외과의가 두 번째 또는 세 번째 갈비뼈를 잡고 #11 메스 블레이드로 가슴에 조심스럽게 들어가면서 폐에서 빼내는 것과 함께 메스로 폐를 손상시킬 가능성을 줄입니다. 또는 곡선이 위쪽을 향하도록 위치한 #12 곡선 메스 블레이드를 사용하면 흉강으로 더 조심스럽게 들어갈 수 있어 잠재적으로 기본 왼쪽 폐 정점 표면의 손상을 줄일 수 있음을 발견했습니다. 또한 왼쪽 PA와 기관지 사이의 연결은 hilum에 더 가깝게 덜 안전하므로이 두 구조 사이의 초 미세 집게가 더 쉽게 통과 할 수 있습니다.
다음 중요한 단계는 아래 기관지에서 왼쪽 PA를 분리하여 PA를 봉합사 묶음으로 둘러싸는 것입니다. 폐 정점에 대한 외상을 피하기 위해이 단계를 신중하게 수행하는 것이 중요합니다. PA와 기관지에 접근하기 위해 변위되거나 수축되어야하는 왼쪽 폐의 양을 최소화하기 위해 가능한 한 두개골로 흉곽에 들어가는 것이 좋습니다. 둔기 외상을 유지하는 폐의 모든 부분은 고립 된 IR 손상에 대한 평가에서 제외되어야합니다. 종종, 왼쪽 폐의 정점은 멸균 폐 IR 손상의 최종 분석을 위해 폐를 수집 할 때 절제됩니다. 폐 정점의 손상은 출혈이나 피 묻은 변색의 반점으로 인해 수술 중에 시각화 될 수 있습니다.
PA와 아래 기관지 사이에는 봉합사 넥타이로 동맥을 둘러싸기 위해 뚫려야하는 결합 조직 층이 있습니다. 왼손에 평평하고 가는 집게를 잡는 톱니가 없고 손상되지 않는 혈관을 사용하여 왼쪽 PA를 위쪽으로(즉, 흉곽 쪽으로 그리고 기관지에서 멀어짐) 잡고 당기는 동안 얼마나 많은 장력이 허용되는지 배우는 것은 마스터해야 할 중요한 첫 번째 단계입니다. 왼쪽 PA는 위쪽으로 당겨질 때 놀라운 양의 장력과 스트레칭을 견딜 수 있습니다. 우리는 시야의 배율을 최대로 높이고 초점을 조정하여 잠재적 공간 (PA를 기관지에 부착하는 결합 조직의 흰색 선)을 초 미세 집게 (오른손에 들고)와 함께 명확하고 선명하게 시각화 할 수 있도록하는 것이 도움이된다는 것을 알게되었습니다. 필드에 초점을 유지하려면 왼쪽 PA를 기관지에서 위로 당겨 멀리 당기면서 수술 표면에서 왼손을 안정시키는 것이 중요합니다. 그런 다음 초미세 집게를 두 구조 사이의 공간으로 통과시킬 수 있습니다. 닫힌 팁은 실제 저항 없이 쉽게 통과해야 하며, 왼쪽 PA의 반대쪽에서 보이면 팁을 부드럽게 열어 봉합사 재료가 통과할 공간을 더 만들 수 있습니다. 완전히 손상되지 않은 초미세 집게를 사용하여 이 작업을 수행하는 것이 중요하며, 이는 닫힌 팁을 통해 멸균 알코올 면봉을 당겨 팁이 재료에서 찢어지는지 관찰하여 신속하게 확인할 수 있습니다. 손상 팁은 수술 현미경의 최대 배율로 집게를 열고 닫음으로써 식별 할 수도 있습니다.
왼쪽 PA 또는 왼쪽 주 기관지를 분리하려고 시도하는 동안 발생하는 손상을 쉽게 감지 할 수 있습니다. 왼쪽 PA가 손상되면 시야에 혈액이 넘치며 손상으로 인해 PA 자체에 구멍이 생기면 구제 불가능한 수술이 발생할 수 있습니다. 특히, PA에는 초미세 집게 운동 중에 부상을 입을 수 있는 표면 미세한 혈관이 있으며 나타나는 혈액을 흡수하기 위해 필드 위에 마른 멸균 면봉을 배치하여 잠재적으로 관리할 수 있습니다. 출혈이 멈 추면 절차를 재개 할 수 있습니다. 왼쪽 주 기관지의 손상은기도 손상을 복구하는 간단하거나 빠른 방법이 없기 때문에 항상 구제 할 수없는 상황입니다.
밑에있는 기관지에서 PA를 분리하는 단계는 시간의 압박이나 심장 활동의 산만 함 및 그로 인한 움직임없이 죽은 마우스에서 초기에 연습 할 수 있습니다. 또한 왼쪽 PA의 혈액 정체는 더 쉽게 시각화 할 수 있지만 (두껍고 통통한 혈관) 손상되지 않은 평평한 PA 집게로 여전히 집어 올릴 수 있습니다. 왼쪽 폐의 환기가 왼쪽 폐에 손상되지 않은 전도성기도의 존재를 평가하는 데 사용될 수 있기 때문에 왼쪽 기관지의 손상을 감지하는 능력은 여전히 가능합니다. 이 연습 상황은 슬립 매듭의 생성을 완벽하게 만드는 데에도 사용할 수 있습니다.
폐색의 유한 기간이 있으며, 그 이상으로 슬립 매듭 제거 후 자발적인 재관류가 보장되지 않습니다. 파일럿 연구에서 이것은 6 시간에서 10 시간 사이에 발생합니다. 이 외에도 슬립 매듭을 제거한 직후에 재관류가 덜 발생합니다. 허혈성 기간이 연장됨에 따라 재관류는 혈류를 재설정하기 위해 슬립 매듭 제거 후 PA를 조작해야합니다.
다음 관찰은 이 논문의 5명의 공동 저자로부터 얻은 것으로, 이 마우스 수술 모델을 수행한 기간 동안 이 절차를 학습, 완성, 문제 해결 및 개선한 집단적 경험을 나타내며 아래 요점에 요약되어 있습니다.
평균적으로이 수술 절차를 마스터하는 데 1-3 개월이 걸렸습니다. 한 절차 전문가는 다른 절차로 용이해지기 위해 약 50번의 수술이 필요하다고 추정했습니다.
절차 수행 시작시 성공률은 20 % -40 %였습니다. 정기적으로 친숙하게 절차를 수행 한 후 성공률이 80 % -90 %로 증가했습니다.
수술의 가장 어려운 부분은 만장일치로 왼쪽 PA와 왼쪽 기관지 사이의 초 미세 집게를 통과시킨 다음 집게로 봉합사 모노 필라멘트를 포착하고 두 구조 사이를 통과하는 것이 었습니다.
PA와 왼쪽 주 줄기 기관지 사이의 모노 필라멘트 통과 중 실수는 왼쪽 PA의 치명적인 출혈 또는 왼쪽 주 기관지에 돌이킬 수없는 손상으로 구제 불가능한 수술로 이어질 수 있습니다.
1일 1회 가능한 최대 수술 횟수는 10건(수술 약 35-45분)으로 추정되는 반면, 시술적 편안함과 수술 성공에 이상적인 횟수는 5-6건이었습니다.
기타 팁과 제안은 다음과 같습니다.
안정적인 손 위치를 유지하기 위해 수술을 시작하기 전에 과도한 카페인을 피하십시오.
봉합사가 왼쪽 PA와 왼쪽 주 기관지 사이를 통과 할 때 절차 부분에서 현미경의 배율을 최대로 늘립니다.
Dumont 집게를 전진시킬 때 부드럽고 점진적/점진적인 움직임을 사용하여 왼쪽 PA와 왼쪽 주 기관지 사이에 공간을 만듭니다.
모든 중요한 단계를 수행할 때 수술 표면에 손을 고정하십시오.
인공 호흡기의 호흡 속도가 특히 절차의 핵심 / 중요한 부분 (왼쪽 PA와 왼쪽 주 기관지 사이를 통과하는 봉합사) 동안 자발적 호흡을 피할 수있을만큼 충분히 높은지 확인하십시오.
수술을 수행하기 위한 조용하고 방해받지 않는 환경은 집중력을 유지하고 산만하지 않게 유지하는 데 필수적입니다.
그림 2 는이 모델을 폐 IR 손상의 대체 모델과 비교합니다. 이 환기 폐 허혈 재관류 모델은 무기폐, 저산소증 및 기계적 환기를 최소화하는 이점을 제공합니다. 중요하게도, 생존 수술로서, 제2 상해 모델(예를 들어, 실험적 폐렴 모델) 및 상해의 해결의 분석과 양립할 수 있다.
결론적으로, 우리는 폐의 순수한 IR 손상과 관련된 메커니즘과 세포 경로에 대한 귀중한 통찰력을 제공할 수 있다고 믿는 폐 허혈 재관류 손상의 생성과 관련된 생존 수술을 설명했습니다.
공개
저자는 경쟁하는 재정적 이해 관계가 없다고 선언합니다.
감사의 말
이 작업은 마취 및 수술 전후 치료부, 캘리포니아 대학교 샌프란시스코 및 샌프란시스코 종합 병원의 부서 지원과 NIH R01 상(AP에): 1R01HL146753으로 자금을 지원받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Fiber Optic Light Pipe | Cole-Parmer | UX-41720-65 | Fiberoptic light pipe |
| Fiber Optic Light Source | AmScope | SKU: CL-HL250-B | Light source for fiberoptic lights |
| Germinator 500 | Cell Point Scientific, Inc. | No.5-1450 | Bead Sterilizer |
| Heating Pad | AIMS | 14-370-223 | Alternative option |
| Lithium.Ion Grooming Kits(hair clipper) | WAHL home products | SKU 09854-600B | To remove mouse hair on surgical site |
| Microscope | Nikon | SMZ-10 | Other newer options available at the company website |
| MiniVent Ventilator | Havard Apparatus | Model 845 | Mouse ventilator |
| Ultrasonic Cleaner | Cole-Parmer | UX-08895-05 | Clean tools that been used in operation |
| Warming Pad | Kent Scientific | RT-0501 | To keep mouse warm while recovering from surgery |
| Weighing Scale | Cole-Parmer | UX-11003-41 | Weighing scale |
| Surgery Tools | |||
| 4-0 Silk Suture | Ethicon | 683G | For closing muscle layer |
| 7-0 Prolene Suture | Ethicon Industry | EP8734H | Using for making a slip knot of left pulmonary artery |
| Bard-Parker (11) Scalpel (Rib-Back Carbon Steel Surgical Blade, sterile, single use) | Aspen Surgical | 372611 | For entering thoracic cavity (option 1) |
| Bard-Parker (12) Scalpel | Aspen Surgical | 372612 | For entering thoracic cavity (option 2) |
| Extra Fine Graefe Forceps | FST | 11150-10 | Muscle/rib holding forceps |
| Magnetic Fixator Retraction System | FST | 1. Base Plate (Nos. 18200-03) 2. Fixators (Nos. 18200-01) 3. Retractors (Nos. 18200-05 through 18200-12) 4. Elastomer (Nos.18200-07) 5. Retractor(No.18200-08) | Small Animal Retraction System |
| Monoject Standard Hypodermic Needle | COVIDIEN | 05-561-20 | For medication delivery IP |
| Narrow Pattern Forceps | FST | 11002-12 | Skin level forceps |
| Needle holder/Needle driver | FST | 12565-14 | for holding needles |
| Needles | BD | 305110 | 26 gauge needle for externalizing slipknot (24 or 26 gauge needle okay too) |
| PA/Vessel Dilating forceps | FST | 00125-11 | To hold PA; non-damaging gripper |
| Scissors | FST | 14060-09 | Used for incision and cutting into the muscular layer durging surgery |
| Ultra Fine Dumont micro forceps | FST | 11295-10 (Dumont #5 forceps, Biology tip, tip dimension:0.05*0.02mm,11cm) | For passing through the space between the left pulmonary artery and bronchus |
| Reagents | |||
| 0.25% Bupivacaine | Hospira, Inc. | 0409-1159-02 | Topical analgesic used during surgical wound closure |
| Avertin (2,2,2-Tribromoethanol) | Sigma-Aldrich | T48402-25G | Anesthetic, using for anesthetize the mouse for IR surgery, the concentration used in IR surgery is 250-400 mg/kg. |
| Buprenorphine | Covetrus North America | 59122 | Analgesic: concentration used for surgery is 0.05-0.1 mg/kg |
| Eye Lubricant | BAUSCH+LOMB | Soothe Lubricant Eye Ointment | Relieves dryness of the eye |
| Povidone-Iodine 10% Solution | MEDLINE INDUSTRIES INC | SKU MDS093944H (2 FL OZ, topical antiseptic) | Topical liquid applied for an effective first aid antiseptic at beginning of surgery |
| Materials | |||
| Alcohol Swab | BD brand | BD 326895 | for sterilzing area of injection and surgery |
| Plastic film | KIRKLAND | Stretch-Tite premium | Alternative for covering the sterilized surgical field (more cost effective) |
| Rodent Surgical Drapes | Stoelting | 50981 | Sterile field or drape for surgical field |
| Sterile Cotton Tipped Application | Pwi-Wnaps | 703033 | used for applying eye lubricant |
| Top Sponges | Dukal Corporaton | Reorder # 5360 | Stopping bleeding from skin/muscle |
참고문헌
- Shen, H., Kreisel, D., Goldstein, D. R. Processes of sterile inflammation. Journal of Immunology. 191 (6), 2857-2863 (2013).
- Fiser, S. M., et al. Lung transplant reperfusion injury involves pulmonary macrophages and circulating leukocytes in a biphasic response. The Journal of Thoracic and Cardiovascular Surgery. 121 (6), 1069-1075 (2001).
- Lama, V. N., et al. Models of lung transplant research: A consensus statement from the National Heart, Lung, and Blood Institute workshop. JCI Insight. 2 (9), 93121 (2017).
- Miao, R., Liu, J., Wang, J. Overview of mouse pulmonary embolism models. Drug Discovery Today: Disease Models. 7 (3-4), 77-82 (2010).
- Mira, J. C., et al. Mouse injury model of polytrauma and shock. Methods in Molecular Biology. 1717, 1-15 (2018).
- Krupnick, A. S., et al. Orthotopic mouse lung transplantation as experimental methodology to study transplant and tumor biology. Nature Protocols. 4 (1), 86-93 (2009).
- Gielis, J. F., et al. A murine model of lung ischemia and reperfusion injury: Tricks of the trade. The Journal of Surgical Research. 194 (2), 659-666 (2015).
- Nelson, K., et al. Animal models of ex vivo lung perfusion as a platform for transplantation research. World Journal of Experimental Medicine. 4 (2), 7-15 (2014).
- Dodd-o, J. M., Hristopoulos, M. L., Faraday, N., Pearse, D. B. Effect of ischemia and reperfusion without airway occlusion on vascular barrier function in the in vivo mouse lung. Journal of Applied Physiology. 95 (5), 1971-1978 (2003).
- Lawrenz, M. B., Fodah, R. A., Gutierrez, M. G., Warawa, J. Intubation-mediated intratracheal (IMIT) instillation: a noninvasive, lung-specific delivery system. Journal of Visualized Experiments. (93), e52261 (2014).
- Rayamajhi, M., et al. Non-surgical intratracheal instillation of mice with analysis of lungs and lung draining lymph nodes by flow cytometry. Journal of Visualized Experiments. (51), e2702 (2011).
- Dodd-o, J. M., Hristopoulos, M. L., Welsh-Servinsky, L. E., Tankersley, C. G., Pearse, D. B. Strain-specific differences in sensitivity to ischemia-reperfusion lung injury in mice. Journal of Applied Physiology. 100 (5), 1590-1595 (2006).
- Prakash, A., et al. Lung ischemia reperfusion (IR) is a sterile inflammatory process influenced by commensal microbiota in mice. Shock. 44 (3), 272-279 (2015).
- Prakash, A., et al. Alveolar macrophages and toll-like receptor 4 mediate ventilated lung ischemia reperfusion injury in mice. Anesthesiology. 117 (4), 822-835 (2012).
- Dodd-o, J. M., et al. The role of natriuretic peptide receptor-A signaling in unilateral lung ischemia-reperfusion injury in the intact mouse. American Journal of Physiology. Lung Cellular and Molecular Physiology. 294 (4), 714-723 (2008).
- Prakash, A., Kianian, F., Tian, X., Maruyama, D. Ferroptosis mediates inflammation in lung ischemia-reperfusion (IR) sterile injury in mice. American Journal of Respiratory and Critical Care Medicine. 201, (2020).
- Tian, X., et al. NLRP3 inflammasome mediates dormant neutrophil recruitment following sterile lung injury and protects against subsequent bacterial pneumonia in mice. Frontiers in Immunology. 8, 1337 (2017).
- Tian, X., Hellman, J., Prakash, A. Elevated gut microbiome-derived propionate levels are associated with reduced sterile lung inflammation and bacterial immunity in mice. Frontiers in Microbiology. 10, 159 (2019).
- Liu, Q., Tian, X., Maruyama, D., Arjomandi, M., Prakash, A. Lung immune tone via gut-lung axis: Gut-derived LPS and short-chain fatty acids' immunometabolic regulation of lung IL-1β, FFAR2, and FFAR3 expression. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (1), 65-78 (2021).
- Dodd-o, J. M., et al. Interactive effects of mechanical ventilation and kidney health on lung function in an in vivo mouse model. American Journal of Physiology. Lung Cellular and Molecular Physiology. 296 (1), 3-11 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유