Method Article
Um Modelo de Rato de Intubação Orotraqueal e Cirurgia de Reperfusão de Isquemia Pulmonar Ventilada
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Um modelo cirúrgico de camundongo para criar lesão de reperfusão (RI) de isquemia pulmonar esquerda, mantendo a ventilação e evitando a hipóxia.
Resumo
A lesão por isquemia reperfusão (RI) frequentemente resulta de processos que envolvem um período transitório de fluxo sanguíneo interrompido. No pulmão, a RI isolada permite o estudo experimental desse processo específico com ventilação alveolar continuada, evitando, assim, os processos agravantes prejudiciais de hipóxia e atelectasia. No contexto clínico, a lesão de reperfusão por isquemia pulmonar (também conhecida como IRI pulmonar ou LIRI) é causada por inúmeros processos, incluindo, entre outros, embolia pulmonar, trauma hemorrágico ressuscitado e transplante pulmonar. Atualmente, existem opções de tratamento eficazes limitadas para o LIRI. Aqui, apresentamos um modelo cirúrgico reversível de RI pulmonar envolvendo a primeira intubação orotraqueal seguida de isquemia pulmonar esquerda unilateral e reperfusão com ventilação alveolar preservada ou troca gasosa. Os camundongos são submetidos a uma toracotomia esquerda, através da qual a artéria pulmonar esquerda é exposta, visualizada, isolada e comprimida usando um nó escorregadio reversível. A incisão cirúrgica é então fechada durante o período isquêmico, e o animal é despertado e extubado . Com o rato respirando espontaneamente, a reperfusão é estabelecida liberando o nó deslizante ao redor da artéria pulmonar. Este modelo de sobrevida clinicamente relevante permite a avaliação da lesão da RI pulmonar, da fase de resolução, dos efeitos a jusante sobre a função pulmonar, bem como de modelos de dois acertos envolvendo pneumonia experimental. Embora tecnicamente desafiador, esse modelo pode ser dominado ao longo de algumas semanas a meses com uma eventual taxa de sobrevivência ou sucesso de 80% a 90%.
Introdução
A lesão por isquemia reperfusão (RI) pode ocorrer quando o fluxo sanguíneo é restaurado para um leito de órgão ou tecido após algum período de interrupção. No pulmão, a RI pode ocorrer isoladamente ou em associação com outros processos prejudiciais, como infecção, hipóxia, atelectasia, volutrauma (de volumes correntes elevados durante a ventilação mecânica), barotrauma (alto pico ou pressões sustentadas durante a ventilação mecânica) ou lesão por contusão pulmonar contusa contundente (não penetrante) 1,2,3 . Ainda existem várias lacunas em nosso conhecimento sobre os mecanismos do LIRI e o impacto dos processos simultâneos (por exemplo, infecção) nos desfechos do LIRI, e também as opções de tratamento para o LIRI são limitadas. Um modelo in vivo de LIRI puro é necessário para identificar a fisiopatologia da lesão da RI pulmonar isoladamente e para estudar sua contribuição para qualquer processo multi-hit do qual a lesão pulmonar seja um componente.
Modelos de RI pulmonar murina podem ser usados para estudar a fisiopatologia pulmonar específica de múltiplos processos, incluindo transplante pulmonar3, embolia pulmonar4 e lesão pulmonar após trauma hemorrágico com ressuscitação5. Os modelos atualmente utilizados incluem transplante pulmonar cirúrgico6, pinçamento hilar7, perfusão pulmonar ex vivo 8 e RI pulmonar ventilada9. Aqui, fornecemos um protocolo detalhado para um modelo de RI pulmonar ventilada murina de lesão pulmonar estéril. Existem múltiplos benefícios dessa abordagem (Figura 2), incluindo que ela induz hipóxia mínima e atelectasia mínima, e é um modelo de cirurgia de sobrevida que permite estudos de longo prazo.
As razões para escolher este modelo de LIRI em detrimento de outros modelos, como os modelos de pinçamento hilar e perfusão ex vivo , são as seguintes: este modelo minimiza as contribuições inflamatórias da atelectasia, ventilação mecânica e hipóxia; preserva a ventilação cíclica; mantém um sistema imunológico circulatório in vivo intacto que pode responder à lesão por RI; e, finalmente, como procedimento de sobrevida, permite a análise a longo prazo dos mecanismos de geração de lesão secundária (modelos 2-hit) e resolução da lesão. No geral, acreditamos que este modelo de IR pulmonar ventilado fornece a forma "mais pura" de lesão de IR que pode ser estudada experimentalmente.
Outras publicações descreveram o uso da intubação orotraqueal de camundongos para a realização de injeções ou instalações de TI10,11, mas não como ponto de partida para uma cirurgia de sobrevida como neste modelo. A colocação de um tubo orotraqueal permite a realização de cirurgia pulmonar, permitindo o colapso do pulmão operatório. Também permite a reinsuflação do pulmão no final do procedimento, o que é crítico para o pneumotórax e para a capacidade do rato de retornar à ventilação espontânea na conclusão dos procedimentos. Finalmente, a remoção do tubo orotraqueal seguro é um procedimento simples que, ao contrário de uma traqueostomia invasiva, é compatível com uma cirurgia de sobrevivência. Isso permite estudos de pesquisa de longo prazo focados na compreensão da progressão e resolução do LIRI e distúrbios associados, bem como a criação de modelos de lesões crônicas.
Protocolo
Todos os procedimentos e etapas descritos abaixo foram aprovados pelo comitê institucional de cuidados e uso de animais (IACUC) da Universidade da Califórnia em São Francisco. Qualquer cepa de camundongo pode ser usada, embora algumas cepas tenham uma resposta inflamatória IR pulmonar mais robusta em comparação comoutras 12. Ratos que são aproximadamente 12-15 semanas de idade (30-40 g) ou mais velhos toleram e sobrevivem à cirurgia de IR pulmonar melhor do que os ratos mais jovens. Camundongos machos e fêmeas podem ser usados para essas cirurgias.
1. Protocolo de Intubação do Rato
- Anestesia e preparação para intubação
- Limpe o abdômen do rato com um cotonete de etanol. Anestesiar o rato com uma injeção intraperitoneal de tribromoetanol (250-400 mg/kg). Avaliar a profundidade adequada da anestesia pela falta de reflexo de retirada do pedal. Coloque a pomada lubrificante para os olhos agora ou mais tarde (passo 2.1.4).
NOTA: Para este procedimento, o tribromoetanol (e o etomidato como opção alternativa) fornece um plano anestésico estável sem afetar as condições hemodinâmicas necessárias para esta cirurgia. Este anestésico é usado apenas uma vez para evitar o risco de aderências peritoneais. O isoflurano também pode ser usado, mas não o usamos aqui. O praticante é livre para usar qualquer receita anestésica que achar melhor. - Coloque o rato anestesiado em um suporte de intubação ou suporte de plástico em decúbito dorsal, suspenso por seus incisivos superiores em suturas 4-0 em loop (seda ou outra) em duas âncoras de suporte.
- Para manter o rato imobilizado durante o procedimento de intubação, tape frouxamente a parte inferior do tórax (ou ambos os membros superiores) na plataforma.
- Coloque a luz flexível de fibra óptica suavemente na traqueia do rato, ligeiramente abaixo das cordas vocais. Ajuste o nível de iluminação para que apenas um campo escuro seja visível ao olhar para a orofaringe do rato, exceto a luz vermelha que emana de baixo das cordas vocais, demonstrando o alvo para a eventual colocação do tubo endotraqueal. Observe que os movimentos das cordas vocais devem ser visíveis a olho nu ou, se necessário, sob ampliação.
- Limpe o abdômen do rato com um cotonete de etanol. Anestesiar o rato com uma injeção intraperitoneal de tribromoetanol (250-400 mg/kg). Avaliar a profundidade adequada da anestesia pela falta de reflexo de retirada do pedal. Coloque a pomada lubrificante para os olhos agora ou mais tarde (passo 2.1.4).
- Procedimento de intubação
- Segure as pinças com a mão dominante e use-as para segurar suavemente e tirar a língua da cavidade oral.
- Abra a mandíbula inferior usando fórceps segurado pela mão não dominante e, em seguida, empurre a pinça para a laringe para levantar suavemente a epiglote. Neste momento, solte a língua das pinças.
- Procure as cordas vocais. Eles devem abrir e fechar de acordo com cada respiração. Segurando a cânula com o fio-guia pré-carregado, insira a ponta do fio através das cordas vocais.
- Tendo muito cuidado para não mover o fio, segurando uma parte dele que está fora da cânula, mas logo acima das cordas vocais, retire a cânula, deixando apenas o fio no lugar com sua extremidade distal dentro da traqueia.
- Neste ponto, realize uma segunda visualização das cordas vocais para confirmar que a ponta distal do fio permanece passada através das cordas vocais iluminadas e na traqueia, e não está no esôfago não iluminado.
- Segure o fio fora da boca com a pinça curva na mão esquerda, estabilizada contra uma superfície dura, e avance cuidadosamente o cateter 20G com asas de fita sobre o fio.
- Uma vez que a extremidade distal do fio emerge da extremidade traseira do cateter 20G ou tubo endotraqueal, segure essa extremidade com a pinça curva e avance suavemente o cateter 20G para a traqueia.
- Retire cuidadosamente o fio da extremidade distal do cateter 20G com a pinça curva sem desalojar a colocação do cateter.
- Conecte brevemente o cateter ao ventilador antes de prendê-lo para confirmar a colocação adequada na traqueia e não no esôfago. Confirmar a colocação traqueal pela observação de movimentos bilaterais da parede torácica dependentes da ventilação mecânica e da ausência de insuflação do estômago.
- Pós-intubação
- Desconecte o cateter do ventilador. Fixe as asas da fita (presas ao cateter) através do lábio inferior do rato usando uma sutura de vicril 4-0 para fixar firmemente o tubo endotraqueal (TET) ao rato durante todos os procedimentos/manipulações subsequentes.
NOTA: Alternativamente, fita de seda ou outra fita pode ser usada para fixar o ETT, no entanto, deve-se tomar cuidado para evitar o deslocamento do ETT durante o movimento do animal do trenó de intubação para a superfície cirúrgica. - Remova cuidadosamente o rato do trenó de intubação. Conecte brevemente o cateter ao ventilador com um volume corrente de 0,2-0,225 mL e uma frequência respiratória de 120-150 respirações por minuto para confirmar a colocação traqueal correta do tubo orotraqueal e, em seguida, desconecte-se com o camundongo respirando espontaneamente através do tubo orotraqueal.
- Não deixe o animal desacompanhado a partir deste ponto em diante até que ele tenha recuperado a consciência suficiente para manter a decúbito esternal no final do procedimento.
- Desconecte o cateter do ventilador. Fixe as asas da fita (presas ao cateter) através do lábio inferior do rato usando uma sutura de vicril 4-0 para fixar firmemente o tubo endotraqueal (TET) ao rato durante todos os procedimentos/manipulações subsequentes.
2. Protocolo cirúrgico de isquemia e reperfusão pulmonar (RI)
- Analgesia e preparo do sítio cirúrgico
- Limpe o abdômen do rato com um cotonete de etanol e injete buprenorfina (0,05-0,1 mg/kg) por via intraperitoneal.
- Raspe o cabelo sobre a área do tórax esquerdo até a escápula esquerda. Remova o excesso de cabelo raspado usando cotonetes com álcool.
NOTA: As etapas 2.1.1 e 2.1.2 também podem ser executadas antes da intubação se houver preocupação com o deslocamento do ETT quando fixado com fita de seda. - Coloque o rato numa almofada de aquecimento numa posição lateral esquerda ou 3/4 virada e ligue o tubo traqueal no ventilador com um volume corrente de 0,2-0,225 ml (~8 mg/kg) e uma frequência respiratória de 120-150 respirações por minuto. Não use oxigênio suplementar para este procedimento.
- Aplique lubrificante ocular com um cotonete estéril de ponta de algodão. Vire o rato para 3/4 do lado esquerdo para cima e imobilize todos os quatro membros e a cauda com fita adesiva de laboratório.
- Desinfete a área da pele raspada e a pele circundante com iodopovidona e espere a solução secar. Em seguida, cubra o campo cirúrgico com uma cortina estéril ou filme plástico transparente e crie uma abertura retangular na cortina ou filme plástico para o campo cirúrgico.
- Procedimento cirúrgico
- Confirme o nível apropriado de anestesia (fornecido pela administração de tribromoetanol e buprenorfina, conforme descrito anteriormente) testando a resposta à beliscão do dedo do pé.
- Usando um par de tesouras afiadas e um par de pinças maiores (pinça de padrão estreito ou similar), faça uma incisão cutânea transversal de 2 cm abaixo do ângulo inferior da escápula no tórax lateral esquerdo. Use a tesoura e um par mais fino de fórceps (pinça de graefe extra fina ou similar) para cortar a camada muscular e dissecar até as costelas.
- Identifique o segundo espaço intercostal e segure a segunda costela com a pinça extra fina. Puxando a costela para cima, use uma lâmina de bisturi estéril #11 ou #12 (curva) (sem alça necessária) para entrar no espaço pleural, separando e cortando os músculos intercostais do2º-3º espaço. Considere pausar a ventilação para reduzir a lesão no ápice do pulmão esquerdo.
- Inserir três afastadores esterilizados. Use o retrator cefálico menor/mais estreito ao longo da orientação das costelas, o afastador de tamanho médio à esquerda ao longo da 2ª costela e o maior afastador à direita ao longo da superfície da3ª costela.
- Abra o tórax com retração lenta e progressiva usando os cabos elásticos do afastador. Expor e identificar a artéria pulmonar esquerda (AP) movendo o ápice do pulmão esquerdo para longe com um cotonete estéril de ponta de algodão.
- Use a pinça micro, pinça ultrafina na mão direita e PA ou pinça dilatadora do vaso na mão esquerda, para expor suavemente e criar o campo no qual a AP esquerda e o brônquio são visíveis.
- Usando a pinça PA, pegue a PA esquerda e puxe suavemente, mas firmemente para cima e cefálico para visualizar o brônquio transparente abaixo. Aumente a ampliação no microscópio de dissecção (consulte a lista de equipamentos para obter mais detalhes) neste ponto até o máximo (2x).
NOTA: Esterilize todos os equipamentos antes de usar. Além disso, para manter a esterilidade, apenas as pontas dos instrumentos cirúrgicos devem entrar no campo cirúrgico estéril. - Ao retrair o PA para longe do brônquio, passe cuidadosamente a pinça ultrafina fechada através do espaço entre o PA esquerdo e o brônquio. Em seguida, use essas pinças para segurar e puxar um 7-0 ou 8-0 sutura de proleno através do espaço entre a artéria pulmonar esquerda (acima) e brônquio (abaixo).
- Circunde o PA esquerdo amarrando um nó deslizante para criar uma oclusão no PA. A interrupção do fluxo sanguíneo é facilmente visualizada ao microscópio. Isso marca o início do período isquêmico.
- Exteriorizar a extremidade livre do nó através de um ponto de entrada diferente no tórax anterior esquerdo usando uma agulha 24G-28G e fixar a extremidade da sutura com um pequeno pedaço de fita adesiva para facilitar a identificação posterior.
- Reinflar o pulmão para expelir o máximo de ar possível para fora da cavidade torácica usando uma válvula PEEP / tubulação no ventilador do roedor. Em seguida, feche a caixa torácica com duas suturas de nylon 4-0 interrompidas.
- Feche o músculo e a camada subcutânea com uma sutura de nylon 4-0 corrida. Em seguida, aplique duas ou três gotas de bupivacaína tópica (0,5%) na incisão. Use uma sutura de nylon 4-0 para fechar a camada de pele com uma sutura em execução.
- Cuidados pós-operatórios
- Quando a ventilação espontânea for retomada, desconecte o tubo endotraqueal do ventilador e extube o rato.
- Coloque o rato na almofada de aquecimento para manter a temperatura corporal durante a recuperação pós-anestésica precoce.
- Monitore cuidadosamente o rato enquanto se recupera da anestesia geral. Puxe o nó externo suavemente no final do período isquêmico (30 min ou 1 h).
- Mova o rato da almofada de aquecimento para uma gaiola assim que tiver apresentado sinais de recuperação: auto-endireitamento e/ou movimento.
- Após o período de reperfusão (1 h ou 3 h), eutanasiar o animal e coletar sangue por punção cardíaca e tecido pulmonar para posterior análise. Para reperfusão de 1 h, coletar plasma para ELISA, tecido para RNA e análise de proteínas; para reperfusão de 3 h, coletar adicionalmente tecido para histologia.
Resultados
Inflamação gerada pela lesão unilateral de reperfusão de isquemia pulmonar estéril ventilada (RI): Após 1 h de isquemia, observamos níveis aumentados de citocinas no soro e no tecido pulmonar por ELISA e qRT-PCR que atingiram o pico em 1 h após a reperfusão e rapidamente retornaram à linha de base dentro de 12-24 h após a reperfusão13. Para as amostras coletadas às 3 h após a reperfusão, observamos intensa infiltração de neutrófilos no interior do tecido pulmonar esquerdo e observamos que a intensidade da inflamação foi dependente da cepa de camundongo utilizada (Figura 1). Notavelmente, a inflamação que é gerada na ausência de um processo infeccioso coexistente ou subsequente se resolve gradualmente e os pulmões retornam à sua arquitetura pulmonar normal (por histopatologia) com efererocitose ou saída de neutrófilos dos pulmões lesados dentro de 12-24 h após a reperfusão13. Vale ressaltar que observamos inflamação leve, mas detectável, que foi em grande parte neutrofílica e foi observada também no pulmão direito não operatório, que hipotetizamos ser decorrente de lesão de hiperperfusão14.
A coleta de amostras de tecido para este modelo de RI pulmonar não é diferente da de outros modelos de RI pulmonar: o sangue pode ser coletado para preparação plasmática por meio de punção cardíaca ou canulação de VCI; o tecido pulmonar pode ser colhido para preparação de proteína ou RNA e, em seguida, para análise mais aprofundada por western blot, ELISA ou qPCR.
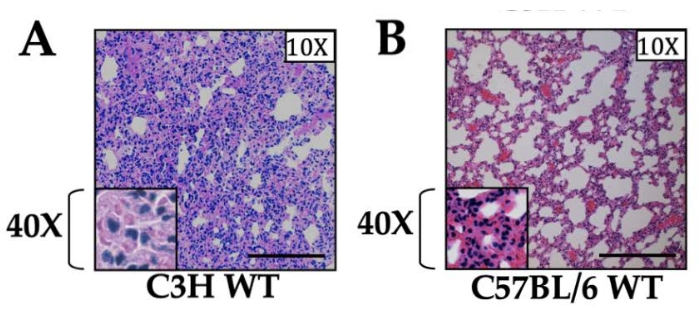
Figura 1: Histologia de cortes pulmonares em camundongos do tipo selvagem de duas cepas diferentes. (A) Camundongos C3H e (B) C57BL/6. Ambas as cepas de camundongos receberam isquemia de 1 h e reperfusão de 3 h, e o tecido é mostrado com ampliação de 10x. A ampliação de 40x é mostrada na inserção. A infiltração neutrofílica foi observada em ambas as cepas, com a cepa C3H mostrando níveis marcadamente maiores de inflamação em comparação com C57BL/6, conforme relatado anteriormente12. A barra de escala é de 200 μm. Clique aqui para ver uma versão maior desta figura.

Figura 2: Comparação das vantagens (texto azul) e desvantagens (texto vermelho) dos três modelos experimentais de lesão por IR pulmonar (LIRI) de camundongos mais utilizados. Esta comparação destaca a escolha da RI pulmonar ventilada (descrita neste manuscrito) como modelo ideal para o estudo da RI pulmonar pura. Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
Este manuscrito detalha as etapas envolvidas na realização do modelo de RI pulmonar ventilada desenvolvido por Dodd-o et al.9. Esse modelo ajudou a identificar as vias moleculares envolvidas na geração e resolução da inflamação da RI pulmonar isoladamente 14,15,16,17, da RI pulmonar em combinação com a infecção coexistente 18 e da RI pulmonar em relação ao eixo intestino-pulmão e à contribuição do microbioma intestinal13,18,19 . Embora tecnicamente mais desafiador, o modelo atual permite a avaliação da RI pulmonar sem os efeitos compostos da inflação pulmonar cíclica interrompida e da hipóxia. Também minimiza o período de exposição ventilatória mecânica, diferentemente do modelo de perfusão ex vivo, que por si só pode levar à lesão pulmonar20.
Limitações do método: Embora a traqueia do camundongo seja cônica o suficiente para que a pressão expiratória final positiva (PEEP) permita a expansão dos pulmões e forneça um ajuste confortável para o TET, a mecânica pulmonar e as medições da alça de fluxo-volume podem não ser possíveis com esta versão de intubação orotraqueal reversível. Essas medidas de fisiologia pulmonar podem exigir uma traqueostomia, que, ao contrário desse método, é incompatível com uma cirurgia pulmonar de sobrevivência. A intubação orotraqueal reversível é bem tolerada por camundongos e, mesmo na ausência de paralíticos, há muito pouca assincronia rato-ventilador, desde que a ventilação minuto (VM = volume corrente x frequência respiratória) seja suficientemente alta para impedir o impulso natural impulsionado pelo CO2 pelo respiro (ou seja, logo após o limiar apneico).
Existem várias considerações relacionadas à porção de isquemia-reperfusão (RI) desse procedimento. Primeiro, o procedimento de RI deve ser realizado com o mínimo de trauma físico possível no pulmão. Recomendamos pausar a ventilação mecânica e permitir que o rato respire espontaneamente ao entrar na cavidade torácica. A ventilação por pressão negativa, juntamente com o aperto do cirurgião da segunda ou terceira costela e puxá-la para longe do pulmão enquanto entra cuidadosamente no peito com uma lâmina de bisturi # 11, reduzirá a chance de ferir o pulmão com o bisturi. Alternativamente, descobrimos que o uso de uma lâmina de bisturi curva # 12, posicionada de modo que a curva esteja voltada para cima, permite uma entrada mais cuidadosa na cavidade torácica, potencialmente reduzindo a lesão na superfície subjacente do ápice pulmonar esquerdo. Além disso, a conexão entre o PA esquerdo e o brônquio é menos segura mais próxima do hilo, facilitando a passagem da pinça ultrafina entre essas duas estruturas.
O próximo passo crítico é isolar a AF esquerda do brônquio abaixo para circundar a AF com um laço de sutura. É essencial que esta etapa seja realizada com cuidado para evitar traumas no ápice pulmonar. Recomendamos entrar na gaiola torácica o mais cefálico possível para minimizar a quantidade de pulmão esquerdo que precisa ser deslocado ou retraído para acessar a AF e o brônquio. Qualquer parte do pulmão que sofra trauma contuso deve ser excluída da avaliação para lesão isolada por RI. Muitas vezes, o ápice do pulmão esquerdo é extirpado ao coletar os pulmões para análise final da lesão de IR pulmonar estéril. A lesão do ápice do pulmão pode ser visualizada durante a cirurgia devido à presença de puncta de hemorragia ou descoloração sangrenta.
Entre o PA e o brônquio abaixo existe uma camada de tecido conjuntivo que deve ser rompida para circundar a artéria com o laço de sutura. Aprender quanta tensão é permitida ao agarrar e puxar o PA esquerdo para cima (ou seja, em direção à gaiola torácica e longe do brônquio), usando o vaso não serrilhado e não prejudicial que agarra pinças finas planas na mão esquerda, é um primeiro passo importante para dominar. O PA esquerdo pode tolerar uma quantidade surpreendente de tensão e alongamento à medida que é puxado para cima. Achamos útil aumentar a ampliação do campo visual ao máximo e ajustar o foco para que o espaço potencial (uma linha branca de tecido conjuntivo aderindo o PA ao brônquio) possa ser visualizado de forma clara e nítida junto com a pinça ultrafina (mantida na mão direita). Para que o campo permaneça em foco, é importante estabilizar a mão esquerda na superfície cirúrgica enquanto puxa a AF esquerda para cima e para longe do brônquio. A pinça ultrafina pode então ser passada no espaço entre as duas estruturas. As pontas fechadas devem passar facilmente sem qualquer resistência real e, uma vez vistas do outro lado do PA esquerdo, as pontas podem ser abertas suavemente para criar ainda mais espaço para a passagem do material de sutura. É fundamental que isso seja realizado usando pinças ultrafinas completamente intactas, que podem ser rapidamente determinadas puxando um cotonete de álcool estéril através das pontas fechadas para observar se as pontas rasgam o material. As pontas de dano também podem ser identificadas abrindo e fechando a pinça sob ampliação máxima do microscópio cirúrgico.
É fácil detectar danos que ocorrem no PA esquerdo ou no brônquio principal esquerdo ao tentar separá-los. Danos ao PA esquerdo resultam em inundação do campo visual com sangue e podem resultar em uma cirurgia não recuperável se o dano criar um buraco dentro do próprio PA. Notavelmente, existem vasos sanguíneos microscópicos de superfície no PA que podem se machucar durante o movimento da pinça ultrafina e podem potencialmente ser gerenciados colocando um cotonete seco estéril sobre o campo para absorver o sangue que aparece. Se o sangramento parar, o procedimento pode ser retomado. O dano ao brônquio principal esquerdo é sempre uma situação não recuperável, uma vez que não há uma maneira simples ou rápida de reparar os danos nas vias aéreas.
A etapa de separar a AF do brônquio subjacente pode ser inicialmente praticada em um rato morto sem a pressão do tempo ou a distração da atividade cardíaca e do movimento que ela causa. Além disso, a estase do sangue na AP esquerda permite que ele seja mais facilmente visualizado (vaso espesso e rechonchudo) e, ainda assim, capaz de ser captado pela pinça plana da AP não inferida. A capacidade de detectar danos no brônquio esquerdo ainda é possível, uma vez que a ventilação do pulmão esquerdo pode ser usada para avaliar a presença de uma via aérea condutora intacta para o pulmão esquerdo. Essa situação de prática também pode ser usada para aperfeiçoar a criação do nó deslizante.
Há uma duração finita da oclusão, além da qual a reperfusão espontânea após a remoção do nó deslizante não é garantida. Em estudos-piloto, isso ocorre em algum lugar entre 6 e 10 h. Além disso, a reperfusão ocorre menos imediatamente após a remoção do nó deslizante. À medida que o período isquêmico se estende, a reperfusão requer manipulação do AF após a remoção do nó deslizante, a fim de restabelecer o fluxo sanguíneo.
Essas observações a seguir foram obtidas de cinco coautores deste artigo que representam sua experiência coletiva em aprender, aperfeiçoar, solucionar problemas e melhorar esse procedimento durante o período em que conduziram esse modelo cirúrgico de camundongo e foram resumidas nos pontos abaixo:
Em média, levou de 1 a 3 meses para dominar este procedimento cirúrgico. Um proceduralista estimou que são necessárias aproximadamente 50 cirurgias para se tornar fácil com os diferentes procedimentos.
A taxa de sucesso no início da realização do procedimento foi de 20% a 40%. Após a realização do procedimento regularmente e com familiaridade, a taxa de sucesso aumentou para 80%-90%.
A parte mais difícil da cirurgia foi unanimemente a passagem da pinça ultrafina entre o PA esquerdo e o brônquio esquerdo e, em seguida, a subsequente captura do monofilamento de sutura com a pinça e sua passagem entre as duas estruturas.
Erros durante a passagem do monofilamento entre o PA e o brônquio principal esquerdo podem levar a uma cirurgia irrecuperável com sangramento catastrófico do PA esquerdo ou lesão irreversível do brônquio principal esquerdo.
O número máximo de cirurgias viáveis em 1 único dia foi estimado em 10 (aproximadamente 35-45 min/cirurgia), enquanto o número ideal para conforto proceduralista e sucesso cirúrgico foi de cinco ou seis.
Outras dicas e sugestões diversas incluem:
Evite o excesso de cafeína antes de iniciar o dia cirúrgico para manter a posição constante da mão.
Aumente a ampliação no microscópio ao máximo durante a porção do procedimento, quando a sutura está sendo passada entre o PA esquerdo e o brônquio principal esquerdo.
Use movimentos suaves e graduais/incrementais ao avançar a pinça de Dumont para criar espaço entre a AF esquerda e o brônquio principal esquerdo.
Estabilize as mãos na superfície cirúrgica ao executar todas as etapas críticas.
Certifique-se de que a frequência respiratória no ventilador seja alta o suficiente para evitar respirações espontâneas, especialmente durante as porções chave/críticas do procedimento (passagem de sutura entre o PA esquerdo e o brônquio principal esquerdo).
Um ambiente tranquilo e tranquilo para realizar as cirurgias é essencial para manter o foco e a distração.
A Figura 2 compara esse modelo com modelos alternativos de lesão por RI pulmonar. Este modelo de reperfusão de isquemia pulmonar ventilada oferece as vantagens de minimizar atelectasias, hipóxia e ventilação mecânica. É importante ressaltar que, como uma cirurgia de sobrevida, é compatível com modelos de segunda lesão (por exemplo, modelos experimentais de pneumonia) e análise da resolução da lesão.
Em conclusão, descrevemos uma cirurgia de sobrevida envolvendo a criação de lesão de reperfusão de isquemia pulmonar que acreditamos poder fornecer informações valiosas sobre os mecanismos e vias celulares envolvidos na lesão de RI pura no pulmão.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Este trabalho foi financiado pelo apoio departamental do Departamento de Anestesia e Cuidados Perioperatórios, Universidade da Califórnia em São Francisco e San Francisco General Hospital, bem como por um prêmio NIH R01 (para AP): 1R01HL146753.
Materiais
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Fiber Optic Light Pipe | Cole-Parmer | UX-41720-65 | Fiberoptic light pipe |
| Fiber Optic Light Source | AmScope | SKU: CL-HL250-B | Light source for fiberoptic lights |
| Germinator 500 | Cell Point Scientific, Inc. | No.5-1450 | Bead Sterilizer |
| Heating Pad | AIMS | 14-370-223 | Alternative option |
| Lithium.Ion Grooming Kits(hair clipper) | WAHL home products | SKU 09854-600B | To remove mouse hair on surgical site |
| Microscope | Nikon | SMZ-10 | Other newer options available at the company website |
| MiniVent Ventilator | Havard Apparatus | Model 845 | Mouse ventilator |
| Ultrasonic Cleaner | Cole-Parmer | UX-08895-05 | Clean tools that been used in operation |
| Warming Pad | Kent Scientific | RT-0501 | To keep mouse warm while recovering from surgery |
| Weighing Scale | Cole-Parmer | UX-11003-41 | Weighing scale |
| Surgery Tools | |||
| 4-0 Silk Suture | Ethicon | 683G | For closing muscle layer |
| 7-0 Prolene Suture | Ethicon Industry | EP8734H | Using for making a slip knot of left pulmonary artery |
| Bard-Parker (11) Scalpel (Rib-Back Carbon Steel Surgical Blade, sterile, single use) | Aspen Surgical | 372611 | For entering thoracic cavity (option 1) |
| Bard-Parker (12) Scalpel | Aspen Surgical | 372612 | For entering thoracic cavity (option 2) |
| Extra Fine Graefe Forceps | FST | 11150-10 | Muscle/rib holding forceps |
| Magnetic Fixator Retraction System | FST | 1. Base Plate (Nos. 18200-03) 2. Fixators (Nos. 18200-01) 3. Retractors (Nos. 18200-05 through 18200-12) 4. Elastomer (Nos.18200-07) 5. Retractor(No.18200-08) | Small Animal Retraction System |
| Monoject Standard Hypodermic Needle | COVIDIEN | 05-561-20 | For medication delivery IP |
| Narrow Pattern Forceps | FST | 11002-12 | Skin level forceps |
| Needle holder/Needle driver | FST | 12565-14 | for holding needles |
| Needles | BD | 305110 | 26 gauge needle for externalizing slipknot (24 or 26 gauge needle okay too) |
| PA/Vessel Dilating forceps | FST | 00125-11 | To hold PA; non-damaging gripper |
| Scissors | FST | 14060-09 | Used for incision and cutting into the muscular layer durging surgery |
| Ultra Fine Dumont micro forceps | FST | 11295-10 (Dumont #5 forceps, Biology tip, tip dimension:0.05*0.02mm,11cm) | For passing through the space between the left pulmonary artery and bronchus |
| Reagents | |||
| 0.25% Bupivacaine | Hospira, Inc. | 0409-1159-02 | Topical analgesic used during surgical wound closure |
| Avertin (2,2,2-Tribromoethanol) | Sigma-Aldrich | T48402-25G | Anesthetic, using for anesthetize the mouse for IR surgery, the concentration used in IR surgery is 250-400 mg/kg. |
| Buprenorphine | Covetrus North America | 59122 | Analgesic: concentration used for surgery is 0.05-0.1 mg/kg |
| Eye Lubricant | BAUSCH+LOMB | Soothe Lubricant Eye Ointment | Relieves dryness of the eye |
| Povidone-Iodine 10% Solution | MEDLINE INDUSTRIES INC | SKU MDS093944H (2 FL OZ, topical antiseptic) | Topical liquid applied for an effective first aid antiseptic at beginning of surgery |
| Materials | |||
| Alcohol Swab | BD brand | BD 326895 | for sterilzing area of injection and surgery |
| Plastic film | KIRKLAND | Stretch-Tite premium | Alternative for covering the sterilized surgical field (more cost effective) |
| Rodent Surgical Drapes | Stoelting | 50981 | Sterile field or drape for surgical field |
| Sterile Cotton Tipped Application | Pwi-Wnaps | 703033 | used for applying eye lubricant |
| Top Sponges | Dukal Corporaton | Reorder # 5360 | Stopping bleeding from skin/muscle |
Referências
- Shen, H., Kreisel, D., Goldstein, D. R. Processes of sterile inflammation. Journal of Immunology. 191 (6), 2857-2863 (2013).
- Fiser, S. M., et al. Lung transplant reperfusion injury involves pulmonary macrophages and circulating leukocytes in a biphasic response. The Journal of Thoracic and Cardiovascular Surgery. 121 (6), 1069-1075 (2001).
- Lama, V. N., et al. Models of lung transplant research: A consensus statement from the National Heart, Lung, and Blood Institute workshop. JCI Insight. 2 (9), 93121 (2017).
- Miao, R., Liu, J., Wang, J. Overview of mouse pulmonary embolism models. Drug Discovery Today: Disease Models. 7 (3-4), 77-82 (2010).
- Mira, J. C., et al. Mouse injury model of polytrauma and shock. Methods in Molecular Biology. 1717, 1-15 (2018).
- Krupnick, A. S., et al. Orthotopic mouse lung transplantation as experimental methodology to study transplant and tumor biology. Nature Protocols. 4 (1), 86-93 (2009).
- Gielis, J. F., et al. A murine model of lung ischemia and reperfusion injury: Tricks of the trade. The Journal of Surgical Research. 194 (2), 659-666 (2015).
- Nelson, K., et al. Animal models of ex vivo lung perfusion as a platform for transplantation research. World Journal of Experimental Medicine. 4 (2), 7-15 (2014).
- Dodd-o, J. M., Hristopoulos, M. L., Faraday, N., Pearse, D. B. Effect of ischemia and reperfusion without airway occlusion on vascular barrier function in the in vivo mouse lung. Journal of Applied Physiology. 95 (5), 1971-1978 (2003).
- Lawrenz, M. B., Fodah, R. A., Gutierrez, M. G., Warawa, J. Intubation-mediated intratracheal (IMIT) instillation: a noninvasive, lung-specific delivery system. Journal of Visualized Experiments. (93), e52261 (2014).
- Rayamajhi, M., et al. Non-surgical intratracheal instillation of mice with analysis of lungs and lung draining lymph nodes by flow cytometry. Journal of Visualized Experiments. (51), e2702 (2011).
- Dodd-o, J. M., Hristopoulos, M. L., Welsh-Servinsky, L. E., Tankersley, C. G., Pearse, D. B. Strain-specific differences in sensitivity to ischemia-reperfusion lung injury in mice. Journal of Applied Physiology. 100 (5), 1590-1595 (2006).
- Prakash, A., et al. Lung ischemia reperfusion (IR) is a sterile inflammatory process influenced by commensal microbiota in mice. Shock. 44 (3), 272-279 (2015).
- Prakash, A., et al. Alveolar macrophages and toll-like receptor 4 mediate ventilated lung ischemia reperfusion injury in mice. Anesthesiology. 117 (4), 822-835 (2012).
- Dodd-o, J. M., et al. The role of natriuretic peptide receptor-A signaling in unilateral lung ischemia-reperfusion injury in the intact mouse. American Journal of Physiology. Lung Cellular and Molecular Physiology. 294 (4), 714-723 (2008).
- Prakash, A., Kianian, F., Tian, X., Maruyama, D. Ferroptosis mediates inflammation in lung ischemia-reperfusion (IR) sterile injury in mice. American Journal of Respiratory and Critical Care Medicine. 201, (2020).
- Tian, X., et al. NLRP3 inflammasome mediates dormant neutrophil recruitment following sterile lung injury and protects against subsequent bacterial pneumonia in mice. Frontiers in Immunology. 8, 1337 (2017).
- Tian, X., Hellman, J., Prakash, A. Elevated gut microbiome-derived propionate levels are associated with reduced sterile lung inflammation and bacterial immunity in mice. Frontiers in Microbiology. 10, 159 (2019).
- Liu, Q., Tian, X., Maruyama, D., Arjomandi, M., Prakash, A. Lung immune tone via gut-lung axis: Gut-derived LPS and short-chain fatty acids' immunometabolic regulation of lung IL-1β, FFAR2, and FFAR3 expression. American Journal of Physiology. Lung Cellular and Molecular Physiology. 321 (1), 65-78 (2021).
- Dodd-o, J. M., et al. Interactive effects of mechanical ventilation and kidney health on lung function in an in vivo mouse model. American Journal of Physiology. Lung Cellular and Molecular Physiology. 296 (1), 3-11 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados