Method Article
Построение циклических пептидов, проникающих в клетки, для усиленного проникновения через биологические барьеры
В этой статье
Резюме
Этот протокол описывает синтез циклических пептидов, проникающих в клетки, с ароматическими поперечными связями и оценку их проницаемости через биологические барьеры.
Аннотация
Рак был серьезной проблемой в глобальном здравоохранении. Однако сложное микроокружение опухоли обычно ограничивает доступ терапевтических средств к более глубоким опухолевым клеткам, что приводит к рецидиву опухоли. Чтобы преодолеть ограниченное проникновение биологических барьеров, были обнаружены проникающие в клетки пептиды (CPP) с отличной способностью транслокации мембраны и стали полезными молекулярными транспортерами для доставки различных грузов в клетки. Однако обычные линейные СРР обычно демонстрируют нарушенную протеолитическую стабильность, что ограничивает их проницаемость через биологические барьеры. Таким образом, разработка новых молекулярных транспортеров, которые могут проникать через биологические барьеры и проявлять повышенную протеолитическую стабильность, крайне желательна для повышения эффективности доставки лекарств в биомедицинских приложениях. Ранее мы синтезировали панель коротких циклических CPP с ароматическими сшивками, которые показали превосходную проницаемость в раковых клетках и тканях по сравнению с их линейными аналогами. Здесь описан краткий протокол синтеза флуоресцентно меченного циклического пептида полиаргинина R8 и его линейного аналога, а также ключевые этапы исследования их клеточной проницаемости.
Введение
За последние несколько десятилетий мы стали свидетелями быстрого прогресса в разработке пептидов, проникающих в клетки (СХТ) для доставки лекарств. СРТ широко используются в качестве молекулярных транспортеров для лечения ряда опасных для жизни заболеваний, включая неврологические расстройства1,2, болезни сердца3, диабет4, дерматоз5 и рак 6,7. Рак остается глобальным бременем здравоохранения, сопровождающимся высоким уровнем заболеваемости и смертности, несмотря на широкомасштабные исследовательские усилия8. Серьезным препятствием для лечения рака является ограниченный доступ терапевтических средств к более глубоким опухолевым клеткам из-за физиологических барьеров, таких как компактный внеклеточный матрикс (ECM), аномальная сосудистая сеть опухоли, множественные мембранные барьеры и высокое давление интерстициальной жидкости (IFP)9. Таким образом, разработка новых СРР с превосходной способностью доставлять грузы через биологические барьеры считается важной стратегией лечения рака10,11.
СРР можно разделить на катионные, амфипатические и гидрофобные СРР с точки зрения их физико-химических свойств12. Среди них положительно заряженный пептид ВИЧ-ТАТ и синтетический полиаргинин имеют большое значение в биомедицинских исследованиях и были тщательно изучены для облегчения внутриклеточной доставки лекарств13. Tunnemann et al. сообщили, что минимальная длина в восемь аргининов имеет важное значение для эффективного проникновения в клетки синтетических пептидов полиаргинина, основываясь на исследовании проницаемости клеток, проведенном с использованием пептидов от R3 до R1214. Однако эти CPP обычно имеют короткие периоды полураспада в плазме из-за их быстрого гидролиза in vivo. Кроме того, мало что известно об оптимизации химической структуры СРР для повышения их трансбарьерной способности, поскольку проникновение через несколько клеточных мембранзатруднено 15. Таким образом, разработка новых молекулярных транспортеров, способных проникать через биологические барьеры, крайне желательна для повышения эффективности доставки лекарств. В 2020 году Komin et al.16 обнаружили CPP, называемый пептидом CL, который содержит мотив спирали (RLLRLLR) и полиаргининовый хвост (R7) для пересечения эпителиального монослоя. Набор вариантов пептидов CL также был синтезирован путем изменения спирального рисунка. Это исследование может стать важным руководством для разработки новых CPP для доставки грузов через биологические барьеры. Кроме того, Dietrich et al. оптимизировали клеточную проницаемость пептида StAX, ингибируя сигнальный путь Wnt/β-катенина за счет увеличения общей гидрофобности пептидов17.
Конформационная рестрикция неструктурированных линейных пептидов циклизацией является эффективным способом повышения их протеолитической стабильности и проницаемости18,19,20. Структурное армирование повышает резистентность циклических пептидов к протеазе, делая их более стабильными in vivo по сравнению с их линейными аналогами. Кроме того, циклизация пептидов потенциально может маскировать полярную пептидную основу, способствуя внутримолекулярному образованию водородных связей, тем самым увеличивая мембранную проницаемость пептидов21. В последние два десятилетия хемослективные методы циклизации стали эффективными стратегиями построения циклических пептидов с различной архитектурой, таких как полностью углеводородные, лактамные, триазольные, м-ксилол, перфторарил и другие поперечные связи22,23. Биологический барьер, налагаемый сложным микроокружением опухоли, может снижать проникновение лекарств в солидные опухоли24. Ранее мы обнаружили, что циклические CPP проявляют превосходную устойчивость к ферментативному расщеплению по сравнению с их линейными аналогами20. Кроме того, общая гидрофобность пептидов имеет решающее значение для их повышенной проницаемостидля клеток 22. Основываясь на исследованиях, рассмотренных выше, можно предположить, что сочетание положительно заряженного паттерна, повышенной общей гидрофобности и повышенной стабильности протеолиза увеличивает проницаемость CPP через биологические барьеры. В недавнем исследовании мы идентифицировали два циклических CPP с ароматическими сшивками в положениях i и i + 7, которые демонстрируют улучшенную проницаемость в опухолевых клетках и тканях по сравнению с их линейными аналогами15. Здесь представлен краткий синтетический протокол синтеза флуоресцентно меченных циклических СРР и ключевые шаги по исследованию их проницаемости.
протокол
1. Подготовка оборудования
ПРИМЕЧАНИЕ: Выполняйте все процедуры в рабочем вытяжном шкафу с подходящими средствами индивидуальной защиты.
- Соберите ручной аппарат синтеза пептидов в вытяжном шкафу (рис. 1). Установите трехходовые запорные краны (см. Таблицу материалов) на вакуумный коллектор (см. Таблицу материалов) и подсоедините к азоту (N2). Обязательно закройте неиспользуемые впускные отверстия.
- Прикрепите полипропиленовую колонку объемом 10 мл (см. Таблицу материалов) к трехсторонним запорным кранам. Слейте реакционную смесь или растворители из полипропиленовой колонны с помощью резиновой колбы для пипетки или вакуума через ловушку для отходов.
2. Синтез меченного FITC линейного пептида R8 (FITC-R8) и меченного FITC сшитого пептида R8 (FITC-sR8-4)
ПРИМЕЧАНИЕ: Пептиды были синтезированы в соответствии со стандартным протоколом твердофазного пептидного синтеза (SPPS) на основе Fmoc (SPPS)25. На протяжении всего исследования использовалась смола 4-(2',4'-диметоксифеил-Fmoc-аминометил)-феноксиацетамидо-норлейцил-MBHA (смола MBHA с катком, см. Таблицу материалов).
ВНИМАНИЕ: N, N-диметилформамид (ДМФ), N, N-диизопропилэтиламин (DIPEA), морфолин и дихлорметан (DCM) бесцветны и повреждают при вдыхании или всасывании через кожу. Эфир чрезвычайно легко воспламеняется. 1,2-Этанедитиол (ЭДТ) является особенно пахучим веществом. Трифторуксусная кислота (TFA) обладает высокой коррозионной активностью, а ее кислотность в10-5 раз выше, чем у уксусной кислоты. Следовательно, со всеми реагентами и химическими веществами предполагается бороться с использованием защитных средств в вытяжном шкафу.
- Подготовьте смолу к синтезу пептидов.
- Рассчитайте массу смолы, необходимой для синтеза:Масса смолы (мг) = накипь (ммоль) / грузоподъемность смолы (ммоль/г) × 1,000 (мг/г)
ПРИМЕЧАНИЕ: Например, масса смолы амида MBHA (0,572 ммоль/г) для 0,2 ммоль = 0,2 ммоль/0,572 ммоль/г × 1000 мг/г = 350 мг. - Добавьте 4-5 мл ДМФА к необходимому количеству смолы и переведите в полипропиленовую колонну объемом 10 мл (этап 1.2) с мягким барботированием N2 в течение 30 мин, чтобы смола адекватно набухла, а затем слейте ДМФ.
- Добавьте 4-5 мл 50% морфолина/ДМФА (об./об.) в смолу, осторожно пузырите N 2 в течение 30 мин2 раза, чтобы удалить N-концевую группу Fmoc, а затем слейте смесь. После этого тщательно промойте смолу 3 раза, добавляя в колонку 4-5 мл ДМФА и каждый раз барботируя с N2 не менее 1 минуты. Продолжайте промывать смолу DCM (3x) и DMF (3x) таким же образом.
- Рассчитайте массу смолы, необходимой для синтеза:Масса смолы (мг) = накипь (ммоль) / грузоподъемность смолы (ммоль/г) × 1,000 (мг/г)
- Выполните аминокислотную связь, защищенную Fmoc, как описано ниже.
ПРИМЕЧАНИЕ: Соединение аргинина в ручном синтезе в масштабе 0,2 ммоль описано здесь в качестве примера.- Растворить Fmoc-Arg (Pbf)-OH (5 экв., 648,8 мг) и 2-(7-азобензотриазол)-N, N, N', N'-гексафторфосфат тетраметилурония (HATU, 4,9 экв., 372,6 мг) в 5 мл ДМФА в центрифужной пробирке.
- Добавьте DIPEA (10 экв., 348,4 мкл) для активации реакции связи, а затем перенесите реакционную смесь в полипропиленовую колонку объемом 10 мл со смолой (приготовленную на этапе 2.1.3). Затем аккуратно перемешайте смесь с пузырьками N 2 в течение1-2 часов.
- Повторите реакцию сцепления (этап 2.2.1 и этап 2.2.2) один раз.
- После завершения соединения слейте реакционную смесь и последовательно промойте смолу ДМФ, ДКМП и ДМФА по 3 раза каждый в течение не менее 1 минуты каждый раз.
- Выполните соединение каждой аминокислоты в последовательных этапах: добавьте 4-5 мл 50% морфолина/ДМФА (об./об.) в смолу, осторожно пузырите с N 2 в течение 30 мин 2x, чтобы удалить группу N α-Fmoc, затем промойте смолу (как показано на шаге 2.2.4) и приступайте к соединению следующей аминокислоты (как показано на шагах 2.2.1 и 2.2.2). Проведите несколько циклов этого этапа, чтобы добиться синтеза нужного пептида.
ПРИМЕЧАНИЕ: Этот процесс можно приостановить здесь. Конденсируйте смолу с метанолом и высушите смолу с непрерывным потоком N2. Закройте полипропиленовую колонну крышкой, а затем храните смолу при температуре 4 ° C в течение нескольких дней (или при -20 ° C для более длительного хранения). Набухают смолу 4-5 мл ДМФА в течение 0,5-1 ч перед началом нового синтеза. Если непосредственно переходить к следующему этапу, нет необходимости конденсировать смолу.
- Пометьте пептиды флуоресцеинизотиоцианатом (FITC), как описано ниже.
- Соедините бета-аланин в качестве спейсера для маркировки FITC, используя тот же процесс, который используется для связывания аминокислот на шаге 2.2.
- Выполняйте маркировку пептидов FITC на смоле, добавляя смесь FITC (5 экв.), DIPEA (10 экв.) и ДМФА в полипропиленовую колонку и реагируя в темноте в течение 8 ч.
- Для синтеза FITC-sR8-4 проводят циклизацию линейного пептида, как описано ниже.
- Добавьте смесь TFA/триизопропилсилана (TIS)/DCM (3/5/92, v/v/v) в полипропиленовую колонну в течение 2 мин, чтобы выборочно удалить защитную группу Cys (Trt), а затем слейте смесь. Повторяйте описанную выше процедуру до тех пор, пока желтоватый раствор не станет бесцветным, чтобы полностью удалить защитную группу TRT.
- Затем выполните последовательную промывку смолы ДМФА и ДКМП не менее 3 раз. После этого растворяют 4,4'-бис(бромметил)бифенил (2 экв.) в ДМФА с ДИПЭА (4 экв.), добавляют его в колонку и реагируют в течение 4 ч.
- Расщепляйте пептиды, как описано: После завершения синтеза пептидов промойте смолу 4-5 мл метанола два раза по 5 мин каждый и высушите ее непрерывным потокомN2. Обработайте смолу эффективным коктейлем для расщепления TFA/TIS/H 2 O (95/2,5/2,5, v/v/v) или TFA/TIS/EDT/H 2 O (92,5/2,5/2,5, v/v/v/v) для пептидов, содержащих цистеины, используя примерно 1 мл коктейля расщепления на 100 мг смолы. Обрабатывайте связанную с пептидом смолу в течение 2-3 ч, чтобы расщепить пептид, а затем осторожно удалите TFA струей N2.
- Чтобы получить сырые пептиды, добавляют 4-5 мл диэтилового эфира к расщепленному пептидному препарату для осаждения сырых пептидов и центрифугируют при 10 000 × г в течение 4 мин. Осторожно выбросьте надосадочную жидкость и высушите пептид на воздухе в течение 3 минут в эффективном вытяжном шкафу.
- Анализ пептидов: Растворите мелкомасштабный сырой пептид (отщепленный примерно из 10 мг смолы, связанной с пептидом) в 800 мкл ацетонитрила (ACN)/H2O (1/1, об./об.), а затем проанализируйте с помощью высокоэффективной жидкостной хроматографии с обратной фазой (RP-ВЭЖХ) и жидкостной хроматографии-масс-спектрометрии (LC-MS) (см. Таблицу материалов).
- Очистите пептиды с помощью RP-HPLC и LC-MS.
- Растворите 50 мг неочищенного пептидного продукта в 4 мл ACN/H2O (1/1, об./об.) и введите раствор в систему RP-HPLC, оснащенную колонкой C18 (4,6 мм x 150 мм, размер пор: 120 Å, размер частиц: 4 мкм; см. Таблицу материалов). Элютировать пептид с помощью подвижной фазы, содержащей 0,1% TFA/H2O (v/v) и ACN, с градиентом от 10% до 90% ACN в течение 30 мин. Обычные пептиды были обнаружены на длине волны 220 нм, а пептиды, меченные FITC, на длине волны 494 нм.
- Соберите фракции, соответствующие основному пептидному пику, идентифицированному РС, а затем лиофилизируйте желаемые пептидные фракции. Храните очищенный пептид при температуре -20 °C.
ПРИМЕЧАНИЕ: Найденные m/z очищенного FITC-R8 следующие: [M + 3 H]3+: 576,63; [М + 4 В] 4+: 432,72; [М + 5 Н] 5+: 346,39; [М + 6 Н] 6+: 288.85. Найденные m/z очищенного FITC-sR8-4 следующие: [M + 3 H]3+: 704,74; [М + 4 В] 4+: 528,77; [М + 5 Н] 5+: 423,34; [М + 6 Н] 6+: 352,91. Аналитические условия МС: прибор: ESI (смещение зонда: +4,5 кВ; детектор: 1,2 кВ); расход газа в небулайзере: 1,5 л/мин; изогнутая линия десольватации (CDL): −20 В; Температура CDL: 250 °C; температура блока: 400 °C; расход: 0,2 мл/мин; подвижная фаза: 50% H2O / 50% ACN.
3. Количественное определение пептидов, меченных FITC
- Растворите небольшое количество очищенного пептида в ДМСО в виде исходного раствора (например, 40 мкмоль/мл).
- Измерьте абсорбционную способность при 494 нм (A 494) 2 мкл исходного раствора в498 мкл 10 мМ фосфатного буферного физиологического раствора (1x PBS, pH 7,4) с помощью микротитровальной пластины (см. Таблицу материалов) с помощью мультитехнологического считывателя микропланшетов (см. Таблицу материалов). Коэффициент разбавления составляет 500 мкл / 2 мкл = 250, а длина пути микротитровальной пластины составляет 0,5 мм.
- Рассчитайте концентрацию исходного раствора по следующей формуле:
Концентрация (мМ) = коэффициент разбавленияA 494 × / 0,05 (см) / 77 000 (см-1· М−1) × 1 000 (мМ·М−1) - Отрегулируйте правильное разбавление таким образом, чтобы измеренное значение A494 находилось в диапазоне от 0,1 до 1,0.
ПРИМЕЧАНИЕ: Измерения следует повторить несколько раз, чтобы убедиться, что измеренная концентрация является точной. Коэффициент вымирания 77 000 см−1· M−1 возникает из группы FITC.
4. Стабильность пептидов в сыворотке крови крупного рогатого скота плода (FBS)
- Инкубируют пептид в концентрации 100 мкМ с 250 мкл 25% FBS/H2O (об./об.) при 37 °C. После инкубации в течение 0 ч, 1 ч, 2 ч и 4 ч возьмите 10 мкл аликвот, а затем добавьте 150 мкл 12% трихлоруксусной кислоты, растворенной в H2O / ACN (1/3, об. / об.), чтобы осаждать сывороточные белки.
- Центрифугируют образцы при 10 000 × г в течение 5 мин и анализируют надосадочную жидкость с помощью ВЭЖХ (как описано на шаге 2.8) для определения степени деградации пептида.
- Рассчитайте отношение площади пика через 1, 2 ч и 4 ч к площади через 0 ч, чтобы получить долю неразложившегося пептида в соответствующее время. В результате получается среднее значение трех параллельных выборок.
5. Клеточное поглощение пептидов
- Флуоресцентная микроскопическая визуализация
- Поместите круглое покровное стекло в 12-луночную тарелку. Затем равномерно инокулируют 1 x 105 клеток на покровные стекла и культивируют в течение ночи 2 мл среды. Удалите среду и промойте клетки 3 раза 1 мл PBS.
ПРИМЕЧАНИЕ: В этом исследовании клетки HeLa и клетки 4T1 культивировали в модифицированной среде Dulbecco Eagle Medium (DMEM, см. Таблицу материалов) с добавлением 10% FBS в увлажненном инкубаторе с температурой 37 °C, содержащем 5% CO2. - Инкубируют клетки с 1 мл 3 мкМ, меченных FITC пептидами, в ДМЭМ, не содержащем FBS, в течение 1 ч при 37 °C. После этого удалите пептидсодержащую среду и промойте клетки 3 раза 1 мл PBS.
- Окрашивают клетки 1 мл Hoechst 33258 в течение 15 мин. Наблюдайте интернализацию каждого пептида с помощью флуоресцентного микроскопа (см. Таблицу материалов) с одинаковой интенсивностью флуоресценции и временем экспозиции.
ПРИМЕЧАНИЕ: Для флуоресцентной микроскопии использовались следующие настройки. Цель: План-Апохромат: 63 x/1.40 Oil DIC M27; Канал 1 для FITC: фильтр возбуждения: 450-490 нм, эмиссионный фильтр: 500-550 нм, время экспозиции: 230 мс; Канал 2 для Hoechst 33258: фильтр возбуждения: 335-383 нм, эмиссионный фильтр: 420-470 нм, время экспозиции: 27 мс.
- Поместите круглое покровное стекло в 12-луночную тарелку. Затем равномерно инокулируют 1 x 105 клеток на покровные стекла и культивируют в течение ночи 2 мл среды. Удалите среду и промойте клетки 3 раза 1 мл PBS.
- Анализ проточной цитометрии
- Равномерно инокулируют 5 x 105 клеток HeLa в 12-луночные планшеты и культивируют в DMEM в течение 24 ч при 37 °C. После этого удалите среду и промойте клетки 3 раза 1 мл PBS.
- Инкубируют клетки с 1 мл 3 мкМ, меченных FITC пептидами, в ДМЭМ, не содержащем FBS, в течение 1 ч при 37 °C. Удалите пептидсодержащую среду, диссоциируйте клетки 0,25% (мас./об.) трипсина и 0,53 мМ ЭДТА в PBS в течение 5 мин, а затем соберите клетки центрифугированием при 306 × г в течение 4 мин. Промойте гранулы ячейки с помощью PBS.
- Инкубируйте клетки с 1 мл 0,05% (мас. / об.) трипанового синего в PBS в течение 3 мин, чтобы погасить флуоресценцию на поверхности, и проведите количественный анализ внутриклеточной флуоресценции с помощью проточного цитометра (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Настройки проточной цитометрии: возбуждение: 488 нм, эмиссия: 530 нм. Трипановый синий также может гасить флуоресценцию мертвых клеток и помогать различать живые и мертвые клетки во время анализа поглощения пептидов. - Обрабатывайте и анализируйте клетки 4T1 с помощью проточной цитометрии в соответствии с тем же протоколом, что и для клеток HeLa. Соберите 5 x 10,5 ячеек на образец и настройте три параллельных образца на группу.
6. Исследование межклеточного проникновения пептидов с использованием трансвелл-моделей
- Инокулируют 1 x 10 5 клеток HeLa в 2 мл DMEM в 12-луночную камеру с пластиной для культивирования тканей (см. Таблицу материалов) и инкубируют в течение 24 ч в увлажненном инкубаторе с температурой 37 °C, содержащем5%CO2. После этого удаляют среду и инкубируют клетки в камерах с 1 мл 10 мкМ FITC-R8 или FITC-sR8-4 (очищенного с помощью ВЭЖХ) в ДМЭМ без FBS в течение 1 часа.
- Удалите среду, содержащую пептиды, и промойте клетки 3 раза 1 мл PBS. Добавьте 1 мл свежего ДМЭМ, не содержащего FBS, в камеры, а затем совместно инкубируйте клетки HeLa в камере с вставленной пластинкой для культивирования тканей с клетками HeLa на круглых покровных стеклах внизу в течение 2 часов.
- Закрепите клетки HeLa на круглых покровных стеклах 2,5% глутаровым альдегидом в течение 15 минут, а затем покрасьте клетки DAPI в течение 15 минут. Затем понаблюдайте за клетками HeLa на покровных стеклах под флуоресцентным микроскопом. Обрабатывайте и анализируйте клетки 4T1, используя тот же протокол, что и для клеток HeLa.
Результаты
В этом протоколе была представлена синтетическая процедура для удержания линейного полиаргинина R8 в его циклической форме. СППС проводилась вручную с помощью простого аппарата (рис. 1). Подробный процесс синтеза СППС показан на рисунке 2. Короче говоря, смола достаточно набухла, после чего защитная группа N α-Fmoc была снята. Затем аминокислоту, защищеннуюN-α-Fmoc, закрепляли на смоле до завершения сборки пептида (этапы 1-4 на рисунке 2). Затем сырые пептиды отщепляли от смолы коктейлем расщепления (шаг 5 на рисунке 2). FITC использовался для маркировки пептидов для синтеза флуоресцентно меченных циклических CPP и отслеживания их проницаемости через биологические барьеры. Впоследствии тритил-защитные группы цистеинов селективно снимали защиту на смоле с последующей пептидной циклизацией с 4,4'-бис(бромметил)бифенильной сшивкой (рис. 3А). Спектры ВЭЖХ и МС FITC-R8 и FITC-sR8-4 показаны на рисунке 3B. Время удержания FITC-sR8-4 было значительно больше, чем у линейного аналога, что указывает на повышенную общую гидрофобность пептида после циклизации с гидрофобной сшивкой. Кроме того, как показано на рисунке 3C, циклический R8 оставался неповрежденным на 77,3% после инкубации с 25% FBS в течение 4 часов, в то время как его линейный аналог был в основном деградирован, что свидетельствует о повышенной протеолитической стабильности циклического пептида R8. В последующих клеточных исследованиях клетки, обработанные циклическим R8 с ароматической сшивкой, демонстрировали более высокую внутриклеточную флуоресценцию, чем клетки, обработанные его линейным аналогом, что было продемонстрировано флуоресцентной микроскопией живых клеток (рис. 4A). Аналогичные результаты были получены при анализе проточной цитометрии (рис. 4B). Для дальнейшего изучения того, обеспечивает ли циклический R8 усиленное проникновение от клетки к клетке, были использованы трансвелл-модели для моделирования барьерной проницаемости пептидов от одного клеточного слоя к другому. Циклический R8 явно демонстрировал более высокое трансбарьерное проникновение, чем линейный пептид R8, о чем свидетельствует значительное увеличение внутриклеточной флуоресценции (рис. 4C). Подводя итог, можно сказать, что циклический пептид R8 продемонстрировал превосходную проницаемость через биологические барьеры по сравнению со своим линейным аналогом.

Рисунок 1: Настройка оборудования для аппарата ручного синтеза пептидов. Полипропиленовая колонна объемом 10 мл устанавливается на вакуумном коллекторе с помощью трехходового запорного клапана. N2 используется для агитации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Общая процедура твердофазного пептидного синтеза Fmoc (SPPS). Аминокислота, защищенная N-α-Fmoc, прикреплена к смоле 4-(2',4'-диметоксифеил-Fmoc-аминометил)-феноксиацетамидо-норлейцил-MBHA (смола MBHA (смола MBHA (стадия 1) с последующим снятием защиты защитных групп N α-Fmoc аминокислот (стадия 2) и последующим связыванием аминокислот (стадия 3). Шаг 2 и шаг 3 повторяют несколько раз для синтеза желаемого пептида (шаг 4). После завершения синтеза добавляют коктейль расщепления, чтобы удалить защитные группы боковой цепи и отщепить нужный пептид от смолы (этап 5). Сокращения: ДМФА = N, N-диметилформамид; DCM = дихлорметан; HATU = 2-(7-азобензотриазол)-N, N, N', N'-гексафторфосфат тетраметилурония; ДИПЭА = N, N-диизопропилэтиламин; TFA = трифторуксусная кислота. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Синтез меченного FITC линейного пептида R8 (FITC-R8) и меченного FITC сшитого пептида R8 (FITC-sR8-4) с использованием твердофазного пептидного синтеза (SPPS). (A) Принципиальная схема синтеза FITC-R8 и FITC-sR8-4. (B) спектры ВЭЖХ и МС (вставка) FITC-R8 и FITC-sR8-4. (C) Стабильность FITC-R8 и FITC-sR8-4 в присутствии 25% FBS. Интактный пептид (%) относится к фракции неразложившегося пептида. Эта цифра была изменена по сравнению с Shi et al.15. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
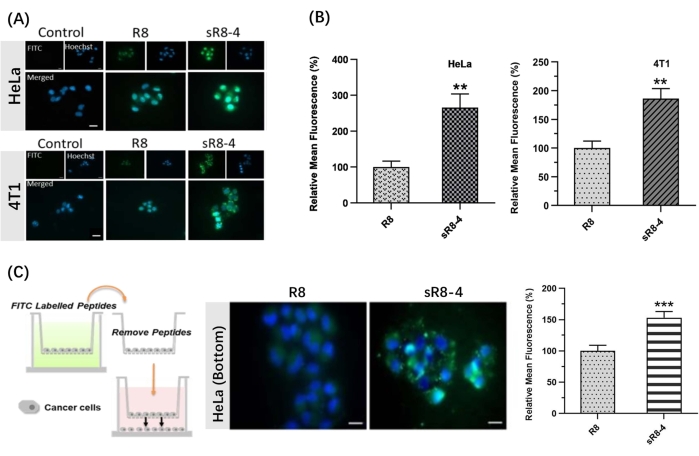
Рисунок 4: Проникновение меченного FITC линейного пептида R8 (FITC-R8) и меченного FITC сшитого пептида R8 (FITC-sR8-4). (A) Изображения флуоресцентной микроскопии живых клеток HeLa и клеток 4T1 после 1-часовой инкубации с 3 мкМ FITC-R8 и FITC-sR8-4. FITC (зеленый), Hoechst (синий). Масштабная линейка = 20 мкм. (B) Относительная средняя флуоресценция (по отношению к линейному пептиду R8), среднее значение ± с.д. и n = 3; (C) Межклеточное проникновение FITC-R8 и FITC-sR8-4 в трансвелл-модели с использованием клеток HeLa. Изображения флуоресцентной микроскопии живых клеток (масштабная линейка = 20 мкм) и относительная средняя флуоресценция (по отношению к линейному пептиду R8) означают ± s.d. и n = 3. ** P < 0,01, *** P < 0,001. Эта цифра была изменена по сравнению с Shi et al.15. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Химическая стабилизация пептидов путем включения конформационных ограничений оказалась эффективной стратегией повышения стабильности и клеточной проницаемости пептида26. В этом протоколе описана поэтапная процедура синтеза циклических СРР с ароматическими поперечными связями и оценки их проницаемости через биологические барьеры. По сравнению с гидрофильными лактамными или триазольными поперечными связями22,27 включение ароматических поперечных связей (используемых в этом исследовании) улучшает общую гидрофобность СРФ, тем самым значительно увеличивая их клеточную проницаемость. С другой стороны, пептидная циклизация может быть легко достигнута путем реакций замещения цистеинами, не требуя каких-либо металлических катализаторов. В этом протоколе циклизация СРР проводилась на смоле; Однако эффективность циклизации также зависит от конкретных последовательностей и длин пептидов из-за стерических эффектов, которые могут привести к образованию димерного побочного продукта28. В таком случае было бы полезно использовать смолу с меньшей грузоподъемностью. Кроме того, рекомендуется также циклизировать эти специфические пептиды в разбавленных концентрациях в фазе29 раствора.
В этом протоколе есть несколько критических моментов. Во-первых, коктейль расщепления TFA/TIS/EDT/H 2 O (92,5/2,5/2,5/2,5, v/v/v/v) используется для расщепления цистеинсодержащих пептидов для предотвращения окисления сульфгидрильной группы. Во-вторых, предлагается провести небольшое предварительное исследование для получения соответствующего условия расщепления. Оптимальное время, необходимое для отщепления пептидов от смолы, составляет 2-3 часа, при этом более длительное время расщепления (более 5 часов) приводит к образованию большего количества неопознанных побочных продуктов. Синтез пептидов можно контролировать с помощью LC-MS для оптимизации времени расщепления. В-третьих, маркировка FITC должна производиться в темноте, чтобы избежать гашения флуоресценции.
Кроме того, трипановый синий следует использовать для гашения флуоресценции на поверхности, поскольку анализ проточной цитометрии не может различить внутриклеточную или поверхностную флуоресценцию. Это поможет конкретно количественно определить пептид, интернализованный раковыми клетками27. Кроме того, поскольку катионные пептиды могут также вызывать неспецифический лизисмембраны 30, гемолитическая активность и жизнеспособность клеток также могут быть проведены для оценки токсичности циклических СХТ.
Циклические СРТ представляют собой одно из эффективных средств доставки лекарств для преодоления биологических барьеров. Однако мембранное взаимодействие и возмущение катионных СРР обычно приводят к потенциальной неспецифической цитотоксичности31. Дальнейшие усилия будут направлены на понимание детального механизма проникновения, который должен помочь в открытии следующего поколения циклических СРР для проникновения через биологические барьеры с минимальной цитотоксичностью. Эти высокоактивные и стабильные СХТ имеют большие перспективы для улучшения лечения важных опасных для жизни заболеваний.
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Эта работа поддерживается Фондом естественных наук Китая (21708031), Китайским фондом постдокторантуры (BX20180264, 2018M643519) и Фондами фундаментальных исследований центральных университетов (2682021ZTPY075).
Материалы
| Name | Company | Catalog Number | Comments |
| 1,2-ethanedithiol | Aladdin | K1722093 | stench |
| 2-(7-Azobenzotriazole)-N,N,N',N'-tetramethyluronium hexafluorophosphate (HATU) | HEOWNS | A-0443697 | |
| 4,4'-bis(bromomethyl)biphenyl | TCI | B1921 | |
| 4T1 cells | ATCC | 4T1 cells were cultured in DMEM medium supplemented with 10% FBS (Hyclone) in a 37 °C humidified incubator containing 5% CO2. | |
| Acetonitrile | Adamas | 1484971 | toxicity |
| Dichloromethane | Energy | W330229 | skin harmful |
| Diethyl ether | Aldrich | 673811 | flammable |
| Dimethyl sulfoxide | Beyotime | ST038 | skin harmful |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | ||
| Electrospray Ionization Mass Spectrometer | Waters | G2-S Tof | |
| Ethylene Diamine Tetraacetic Acid (EDTA) | BioFroxx | 1340 | |
| Fetal bovine serum (FBS) | HyClone | ||
| Flow cytometer | Beckman Coulter | CytoFLEX | |
| Fluorescein isothiocyanate isomer (FITC) | Energy | E0801812500 | |
| Fluorescent microscope | Carl Zeiss | Axio Observer 7 | |
| Fmoc-Arg(Pbf)-OH | HEOWNS | F-81070 | |
| Fmoc-Cys(Trt)-OH | GL Biochem | GLS201115-35202 | |
| Fmoc-βAla-OH | Adamas | 51341C | |
| HeLa cells | ATCC | HeLa cells were cultured in DMEM supplemented with 10% FBS (Hyclone) in a 37 °C humidified incubator containing 5% CO2. | |
| High-Performance Liquid Chromatography | Agilent | Agilent 1260 | |
| High-Performance Liquid Chromatography column | Agilent | Poroshell EC-C18 120, 4.6 × 150 mm (pore size 120 Å, particle size 4 μm) | |
| Lyophilizer | SP Scientific | Vir Tis | |
| Methanol | Aldrich | 9758 | toxicity |
| Microtiter plate | Thermo μdrop plate | N12391 | |
| Morpholine | HEOWNS | M99040 | irritant |
| Multi-technology microplate reader | Thermo | VARIOSKAN LUX | |
| N,N-Diisopropylethylamine | HEOWNS | E-81416 | irritant |
| N,N-Dimethyl formamide | Energy | B020051 | harmful to skin |
| Poly-Prep column | Bio-Rad | 7321010 | polypropylene chromatography columns |
| Rink Amide MBHA resin (0.572 mmol/g) | GL Biochem | GLS180301-49101 | |
| Three-way stopcocks | Bio-Rad | 7328107 | |
| Tissue culture plate insert | LABSELECT | 14211 | |
| Trifluoroacetic acid | HEOWNS | T63278 | corrosive |
| Triisopropylsilane | HEOWNS | T-0284475 | |
| Trypsin | BioFroxx | 1004 | |
| Vacuum manifold | Promega | A7231 |
Ссылки
- Zhang, L., et al. Brain-targeted dual site-selective functionalized poly(β-amino esters) delivery platform for nerve regeneration. Nano Letters. 21 (7), 3007-3015 (2021).
- Park, T. E., et al. Enhanced BBB permeability of osmotically active poly(mannitol-co-PEI) modified with rabies virus glycoprotein via selective stimulation of caveolar endocytosis for RNAi therapeutics in Alzheimer's disease. Biomaterials. 38, 61-71 (2015).
- Bian, J., et al. Effect of cell-based intercellular delivery of transcription factor GATA4 on ischemic cardiomyopathy. Circulation Research. 100 (11), 1626-1633 (2007).
- He, H., et al. The use of low molecular weight protamine chemical chimera to enhance monomeric insulin intestinal absorption. Biomaterials. 34 (31), 7733-7743 (2013).
- Kim, D., et al. A specific STAT3-binding peptide exerts antiproliferative effects and antitumor activity by inhibiting STAT3 phosphorylation and signaling. Cancer Research. 74 (8), 2144-2151 (2014).
- Yang, Y., et al. PEGylated liposomes with NGR ligand and heat-activable cell-penetrating peptide-doxorubicin conjugate for tumor-specific therapy. Biomaterials. 35 (14), 4368-4381 (2014).
- Wei, Y., et al. Intracellular paclitaxel delivery facilitated by a dual-functional CPP with a hydrophobic hairpin tail. ACS Applied Materials and Interfaces. 13 (4), 4853-4860 (2021).
- Vasan, N., Baselga, J., Hyman, D. M. A view on drug resistance in cancer. Nature. 575 (7782), 299-309 (2019).
- Cong, Y., et al. Microenvironment-induced in situ self-assembly of polymer-peptide conjugates that attack solid tumors deeply. Angewandte Chemie International Edition. 131 (14), 4680-4685 (2019).
- Blanco, E., Shen, H., Ferrari, M. Principles of nanoparticle design for overcoming biological barriers to drug delivery. Nature Biotechnology. 33 (9), 941-951 (2015).
- Tian, Y., Zhou, S. Advances in cell-penetrating peptides and their functionalization of polymeric nanoplatforms for drug delivery. Wiley Interdisciplinary Reviews. Nanomedicine and Nanobiotechnology. 13 (2), 1-12 (2021).
- Milletti, F. Cell-penetrating peptides: Classes, origin, and current landscape. Drug Discovery Today. 17 (15-16), 850-860 (2012).
- Turner, J. J., et al. Cell-penetrating peptide conjugates of peptide nucleic acids (PNA) as inhibitors of HIV-1 Tat-dependent trans-activation in cells. Nucleic Acids Research. 33 (21), 6837-6849 (2005).
- Tunnemann, G., et al. Live-cell analysis of cell penetration ability and toxicity of oligo-arginines. Journal of Peptide Science. 14 (4), 469-476 (2008).
- Shi, M., et al. Stapling of short cell-penetrating peptides for enhanced tumor cell-and-tissue dual-penetration. Chemical Communications. 58 (14), 2299-2302 (2022).
- Komin, A., et al. A peptide for transcellular cargo delivery: Structure-function relationship and mechanism of action. Journal of Controlled Release. 324, 633-643 (2020).
- Dietrich, L., et al. Cell permeable stapled peptide inhibitor of Wnt signaling that targets β-catenin protein-protein interactions. Cell Chemical Biology. 24 (8), 958-968 (2017).
- Tian, Y., et al. Stapling of unprotected helical peptides via photo-induced intramolecular thiol-yne hydrothiolation. Chemical Science. 7 (5), 3325-3330 (2016).
- De Araujo, A. D., et al. Comparative α-helicity of cyclic pentapeptides in water. Angewandte Chemie International Edition. 53 (27), 6965-6969 (2014).
- Chu, Q., et al. Towards understanding cell penetration by stapled peptides. Medicinal Chemistry Communications. 6 (1), 111-119 (2015).
- Bock, J. E., Gavenonis, J., Kritzer, J. A. Getting in shape: Controlling peptide bioactivity and bioavailability using conformational constraints. ACS Chemical Biology. 8 (3), 488-499 (2013).
- Tian, Y., et al. Effect of stapling architecture on physiochemical properties and cell permeability of stapled α-helical peptides: A comparative study. ChemBioChem. 18 (21), 2087-2093 (2017).
- White, C. J., Yudin, A. K. Contemporary strategies for peptide macrocyclization. Nature Chemistry. 3 (7), 509-524 (2011).
- Jain, R. K. Normalization of tumor vasculature: An emerging concept in antiangiogenic therapy. Science. 307 (5706), 58-62 (2005).
- Patgiri, A., Menzenski, M. Z., Mahon, A. B., Arora, P. S. Solid-phase synthesis of short α-helices stabilized by the hydrogen bond surrogate approach. Nature Protocols. 5 (11), 1857-1865 (2010).
- Baek, S., et al. Structure of the stapled p53 peptide bound to Mdm2. Journal of the American Chemical Society. 134 (1), 103-106 (2012).
- Traboulsi, H., et al. Macrocyclic cell penetrating peptides: A study of structure-penetration properties. Bioconjugate Chemistry. 26 (3), 405-411 (2015).
- Tian, Y., et al. A proline-derived transannular N-cap for nucleation of short α-helical peptides. Chemical Communications. 52 (59), 9275-9278 (2016).
- Muppidi, A., et al. Rational design of proteolytically stable, cell-permeable peptide-based selective Mcl-1 inhibitors. Journal of the American Chemical Society. 134 (36), 14734-14737 (2012).
- Wiradharma, N., et al. Synthetic cationic amphiphilic α-helical peptides as antimicrobial agents. Biomaterials. 32 (8), 2204-2212 (2011).
- Jones, A. T., Sayers, E. J. Cell entry of cell penetrating peptides: Tales of tails wagging dogs. Journal of Controlled Release. 161 (2), 582-591 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены