Method Article
生物学的障壁の浸透促進のための環状細胞透過性ペプチドの構築
要約
このプロトコルでは、芳香族架橋を有する環状細胞透過性ペプチドの合成と、生物学的障壁を越えたそれらの透過性の評価について説明します。
要約
がんは、グローバルヘルスにおける大きな課題となっています。しかし、複雑な腫瘍微小環境は一般に、より深い腫瘍細胞への治療薬のアクセスを制限し、腫瘍の再発につながります。生物学的障壁の限られた浸透を克服するために、優れた膜移行能力を有する細胞透過性ペプチド(CPP)が発見され、様々な貨物を細胞内に送達するための有用な分子輸送体として浮上している。ただし、従来の線形CPPは一般にタンパク質分解安定性の低下を示し、生物学的障壁を越えた透過性が制限されます。したがって、生物学的障壁を貫通し、タンパク質分解安定性を高めることができる新規分子トランスポーターの開発は、生物医学的用途における薬物送達効率を促進するために強く望まれています。我々は以前、芳香族架橋を有する短い環状CPPのパネルを合成し、それらの線状対応物と比較して癌細胞および組織において優れた透過性を示した。ここでは、蛍光標識された環状ポリアルギニンR8ペプチドおよびその直鎖状対応物の合成、ならびにそれらの細胞透過性を調べるための重要なステップについて、簡潔なプロトコルについて説明します。
概要
過去数十年の間に、薬物送達用の細胞透過性ペプチド(CPP)の開発が急速に進歩してきました。CPPは、神経疾患1,2、心臓病3、糖尿病4、皮膚病5、および癌6,7を含む、生命を脅かすさまざまな疾患の治療のための分子輸送体として広く使用されています。がんは、広範な研究努力にもかかわらず、高い罹患率と死亡率を伴う世界的な健康上の負担であり続けています8。がん治療の深刻な障害は、コンパクトな細胞外マトリックス(ECM)、異常な腫瘍血管系、複数の膜バリア、高い間質液圧(IFP)などの生理学的障壁のために、より深い腫瘍細胞への治療薬のアクセスが制限されていることです9。したがって、生物学的障壁を越えて貨物を輸送する優れた能力を備えた新しいCPPを開発することは、癌治療に不可欠な戦略と考えられています10,11。
CPPは、物理化学的特性の観点から、カチオン性、両親媒性、疎水性のCPPに分類できます12。これらの中で、正に帯電したHIV-TATペプチドおよび合成ポリアルギニンは、生物医学研究において非常に重要であり、細胞内薬物送達を促進するために広く研究されている13。Tunnemannらは、R3〜R12ペプチドを用いて実施された細胞透過性試験に基づいて、合成ポリアルギニンペプチドの効率的な細胞浸透には最小長8個のアルギニンが不可欠であると報告した14。しかしながら、これらのCPPは、 一般に、in vivoで急速に加水分解するため、血漿半減期が短い。さらに、複数の細胞膜を貫通することは困難であるため、CPPのトランスバリア能を高めるためのCPPの化学構造の最適化についてはほとんど知られていない15。従って、薬物送達効率を高めるために生物学的障壁を透過することができる新規分子トランスポーターの開発が強く望まれている。2020年、Kominら16 は、上皮単層を通過するためのらせんモチーフ(RLLRLLR)とポリアルギニンテール(R7)を含むCLペプチドと呼ばれるCPPを発見しました。CLペプチド変異体のセットも、らせんパターンを改変することによって合成した。この探査は、生物学的障壁を越えて貨物を輸送するための新しいCPPの開発のための重要なガイドとなる可能性があります。さらに、DietrichらはStAXペプチドの細胞透過性を最適化し、ペプチドの全体的な疎水性を高めることによってWnt/β-カテニンシグナル伝達経路を阻害した17。
環化による非構造化直鎖状ペプチドの立体構造制限は、それらのタンパク質分解安定性および透過性を増強する有効な方法である18、19、20。構造強化は、環状ペプチドのプロテアーゼ耐性を増加させ、それらの線状対応物と比較してそれらをin vivoでより安定にする。加えて、ペプチドの環化は、分子内水素結合を促進することによって極性ペプチド骨格を潜在的にマスクすることができ、したがってペプチド21の膜透過性を増加させる。過去20年間で、化学選択的環化法は、全炭化水素、ラクタム、トリアゾール、m-キシレン、パーフルオロアリール、およびその他の架橋など、異なる構造を持つ環状ペプチドを構築するための効果的な戦略になりました22,23。洗練された腫瘍微小環境によって課せられる生物学的障壁は、固形腫瘍への薬物の浸透を減少させる可能性がある24。我々は以前に、環状CPPがそれらの線形対応物よりも酵素消化に対して優れた耐性を示すことを発見した20。さらに、ペプチドの全体的な疎水性は、それらの増強された細胞透過性にとって重要である22。上記の研究に基づいて、正に荷電したパターン、全体的な疎水性の上昇、およびタンパク質分解安定性の向上の組み合わせは、生物学的障壁を越えたCPPの透過性を高めると仮定することができます。最近の研究では、位置iおよびi+7に芳香族架橋を有する2つの環状CPPが同定され、それらの線形対応物と比較して腫瘍細胞および組織における透過性が改善されている15。ここでは、蛍光標識された環状CPPを合成するための簡潔な合成プロトコルと、それらの透過性を調べるための重要なステップを示します。
プロトコル
1.機器の準備
注意: 適切な個人用保護具を備えた操作ヒュームフードですべての手順を実行してください。
- 手動ペプチド合成装置をヒュームフードに組み立てます(図1)。三方活栓(材料表を参照)を真空マニホールド(材料表を参照)に置き、窒素(N2)に接続します。未使用の入口には必ずキャップをしてください。
- 10 mLポリプロピレンカラム( 材料の表を参照)を3方向活栓に取り付けます。反応混合物または溶媒をゴム製ピペットバルブまたはスクラップ を介して 真空を使用してポリプロピレンカラムから排出します。
2. FITC標識直鎖状R8ペプチド(FITC-R8)およびFITC標識ステープルR8ペプチド(FITC-sR8-4)の合成
注:ペプチドは、標準的なFmocベースの固相ペプチド合成(SPPS)プロトコル25に従って合成されました。4-(2',4'-ジメトキシフェニル-Fmoc-アミノメチル)-フェノキシアセトアミド-ノルロイシル-MBHA樹脂(リンクアミドMBHA樹脂、 材料表を参照)を研究全体を通して使用しました。
注意: N、N-ジメチルホルムアミド(DMF)、N、N-ジイソプロピルエチルアミン(DIPEA)、モルホリン、およびジクロロメタン(DCM)はすべて無色であり、吸入または皮膚から吸収すると損傷します。エーテルは非常に可燃性です。1,2-エタンジチオール(EDT)は特に臭い物質です。トリフルオロ酢酸(TFA)は非常に腐食性が高く、その酸性度は酢酸の105 倍です。その結果、すべての試薬と化学物質は、ヒュームフード内の保護具を使用して処理されることになっています。
- ペプチド合成用の樹脂を準備します。
- 合成に必要な樹脂の質量を算出:樹脂の質量(mg)=スケール(ミリモル)/樹脂の負荷容量(ミリモル/g)×1,000(mg/g)
注:たとえば、0.2ミリモル= 0.2ミリモル/ 0.572ミリモル/ g×1,000ミリグラム/ g = 350ミリグラムの場合のリンクアミドMBHA樹脂(0.572ミリモル/ g)の質量。 - 必要量の樹脂に4〜5 mLのDMFを加え、10 mLのポリプロピレンカラムに移し(ステップ1.2)、30分間穏やかなN2 バブリングを行って樹脂を適切に膨潤させた後、DMFを排出します。
- 4〜5 mLの50%モルホリン/ DMF(v / v)を樹脂に加え、N2 を30分間2x穏やかに泡立ててN末端Fmoc基を除去してから、混合物を排出します。その後、4〜5 mLのDMFをカラムに加え、毎回少なくとも1分間N2 でバブリングすることにより、樹脂を3回完全に洗浄します。同じ方法でDCM(3x)とDMF(3x)でレジンを洗浄し続けます。
- 合成に必要な樹脂の質量を算出:樹脂の質量(mg)=スケール(ミリモル)/樹脂の負荷容量(ミリモル/g)×1,000(mg/g)
- 下記のようにFmoc保護アミノ酸カップリングを行う。
注:ここでは、0.2ミリモルスケールの手動合成におけるアルギニンのカップリングを例として説明します。- Fmoc-Arg (Pbf)-OH (5当量, 648.8 mg) および 2-(7-アゾベンゾトリアゾール)-N, N, N', N'-テトラメチルウロニウムヘキサフルオロホスフェート (HATU, 4.9当量, 372.6 mg) を 5 mL の DMF に溶解します。
- DIPEA(10当量、348.4 μL)を加えてカップリング反応を活性化し、反応混合物を樹脂(ステップ2.1.3で調製)を含む10 mLポリプロピレンカラムに移します。次いで、N2 バブリングしながら混合物を1〜2時間穏やかに撹拌する。
- カップリング反応(ステップ2.2.1とステップ2.2.2)を1回繰り返します。
- カップリング終了後、反応混合物を排出し、DMF、DCM、DMFをそれぞれ3回ずつ1分以上順次洗浄する。
- 各アミノ酸のカップリングを順序付けられたステップで実行します:4〜5 mLの50%モルホリン/ DMF(v / v)を樹脂に加え、N 2で30分間2x穏やかに泡立ててN α-Fmoc基を除去し、次に樹脂を洗浄し(ステップ2.2.4に示すように)、次のアミノ酸を結合します(ステップ2.2.1およびステップ2.2.2を参照)。このステップの数サイクルを進めて、目的のペプチドの合成を達成します。
注: このプロセスはここで一時停止できます。樹脂をメタノールで凝縮し、N2の連続流通で樹脂を乾燥させます。ポリプロピレンカラムに蓋をしてから、樹脂を4°Cで数日間(または-20°Cで長期間保存する場合)保管します。新しい合成を開始する前に、4〜5 mLのDMFで樹脂を0.5〜1時間膨潤させます。そのまま次のステップに進む場合は、樹脂を凝縮させる必要がない。
- 以下に説明するように、フルオレセインイソチオシアネート(FITC)でペプチドを標識します。
- ステップ2.2でアミノ酸カップリングに用いたのと同じプロセスを使用して、FITC標識用のスペーサーとしてベータアラニンを結合します。
- FITC(5当量)、DIPEA(10当量)、およびDMFの混合物をポリプロピレンカラムに加え、暗所で8時間反応させることにより、樹脂上のペプチドのFITC標識を実行します。
- FITC-sR8-4の合成については、後述するように直鎖状ペプチドの環化を行う。
- TFA /トリイソプロピルシラン(TIS)/ DCM(3/5/92、v / v / v)の混合物をポリプロピレンカラムに2分間追加して、Cys(Trt)保護基を選択的に除去してから、混合物を排出します。黄色がかった溶液が無色になるまで上記の手順を繰り返して、Trt保護基を完全に除去します。
- 続いて、DMFおよびDCMによる樹脂の逐次洗浄を少なくとも3回行う。その後、4,4'-ビス(ブロモメチル)ビフェニル(2当量)をDIPEA(4当量)を含むDMFに溶解し、カラムに加え、4時間反応させます。
- 説明されているようにペプチドを切断する:ペプチド合成の完了後、樹脂を4〜5mLのメタノールでそれぞれ5分間2回洗浄し、N2の連続フローで乾燥させます。樹脂100 mgあたり約1 mLの切断カクテルを使用して、効果的な切断カクテルTFA/TIS/H 2 O(95/2.5/2.5、v/v/v)、またはシステインを含むペプチドの場合はTFA/TIS/EDT/H 2 O(92.5/2.5/2.5、v/v/v/v)で樹脂を処理します。ペプチド結合樹脂を2〜3時間処理してペプチドを切断し、次いでN2の流れでTFAを注意深く除去します。
- 粗ペプチドを得るには、切断したペプチド調製物に4〜5 mLのジエチルエーテルを加えて粗ペプチドを沈殿させ、10,000 × g で4分間遠心分離します。上清を注意深く廃棄し、効果的なヒュームフードでペプチドを3分間風乾します。
- ペプチドの分析:少量の粗ペプチド(約10 mgのペプチド結合樹脂から切断)を800 μLのアセトニトリル(ACN)/H2O(1/1、v/v)に溶解し、逆相高速液体クロマトグラフィー(RP-HPLC)および液体クロマトグラフィー-質量分析(LC-MS)を使用して分析します( 材料表を参照)。
- RP-HPLCおよびLC-MSを用いてペプチドを精製します。
- 粗ペプチド産物50 mgを4 mLのACN/H2O(1/1、v/v)に溶解し、C18カラムを備えたRP-HPLCシステム(4.6 mm x 150 mm、孔径:120 Å、粒子径:4 μm、 材料表を参照)に溶液を注入します。0.1% TFA/H2O(v/v)およびACNを含む移動相を用いて、30分間にわたって10%から90%のACNの勾配でペプチドを溶出します。従来のペプチドは220 nmで、FITC標識ペプチドは494 nmで検出されました。
- MSで同定された主要ペプチドピークに対応する画分を収集し、次いで所望のペプチド画分を凍結乾燥する。精製ペプチドは-20°Cで保存してください。
注:精製されたFITC-R8の見つかったm / zは次のとおりです:[M + 3 H]3+:576.63;[M + 4 H]4+: 432.72;[M + 5 H]5+: 346.39;[M + 6 H]6+: 288.85.精製されたFITC-sR8-4の見つかったm / zは次のとおりです:[M + 3 H]3+:704.74;[M + 4 H]4+: 528.77;[M + 5 H]5+: 423.34;[M + 6 H]6+: 352.91.MS分析条件:機器:ESI(プローブバイアス:+4.5 kV、検出器:1.2 kV);ネブライザーガス流量:1.5リットル/分;曲線脱溶媒線 (CDL): −20 V;CDL温度:250°C;ブロック温度:400°C;流量:0.2ミリリットル/分;移動相:50%H2O/50%ACN。
3. FITC標識ペプチドの定量
- 少量の精製ペプチドをストック溶液としてDMSOに溶解します(例:40 μmol/mL)。
- マルチテクノロジーマイクロプレートリーダー(材料表を参照)を使用して、マイクロタイタープレート(1x PBS、pH 7.4)で498 μLの10 mMリン酸緩衝生理食塩水(1x PBS、pH 7.4)中の2 μLのストック溶液の494 nm(A494)での吸光度を測定します(材料の表を参照)。希釈係数は500 μL/2 μL = 250であり、マイクロタイタープレートの経路長は0.5 mmです。
- 次の式を使用して原液の濃度を計算します。
濃度 (mM) =A 494 ×希釈係数 / 0.05 (cm) / 77,000 (cm−1·M−1) × 1,000 (mM・M−1) - 測定されたA494 値が0.1から1.0の間になるように、適切な希釈に調整します。
注意: 測定された濃度が正確であることを確認するために、測定を数回繰り返す必要があります。吸光係数 77,000 cm−1·M−1 はFITC基から生じる。
4. ウシ胎児血清(FBS)中のペプチドの安定性
- ペプチドを100 μMの濃度で250 μLの25%FBS/H2O(v/v)とともに37°Cでインキュベートします。 0時間、1時間、2時間、および4時間インキュベートした後、10 μLのアリコートを取り、次にH2O/ACN(1/3、v / v)に溶解した12%トリクロロ酢酸150 μlを加えて血清タンパク質を沈殿させます。
- サンプルを10,000 × g で5分間遠心分離し、HPLCを使用して上清を分析し(ステップ2.8に記載)、ペプチド分解の程度を決定します。
- 1時間、2時間、4時間のピーク面積と0時間のピーク面積の比を計算し、対応する時間における未分解ペプチドの画分を求めます。結果は、3つの並列サンプルの平均です。
5. ペプチドの細胞内取り込み
- 蛍光顕微鏡イメージング
- 丸いカバーガラスを12ウェルプレートに入れます。その後、1 x 105 細胞をカバーガラスに均一に接種し、2 mLの培地で一晩培養します。培地を除去し、1 mLのPBSで細胞を3回洗浄します。
注:この研究では、HeLa細胞と4T1細胞を、5%CO2を含む37°C加湿インキュベーター内で10%FBSを添加したダルベッコ改変イーグル培地(DMEM、材料表を参照)で培養しました。 - 細胞を 1 mL の 3 μM FITC標識ペプチドとともにFBSフリーDMEM中で37°Cで1時間インキュベートします。 その後、ペプチド含有培地を取り出し、1 mLのPBSで細胞を3回洗浄します。
- 細胞を1 mLのHoechst 33258で15分間染色します。同じ蛍光強度と露光時間で蛍光顕微鏡( 材料の表を参照)を使用して各ペプチドのインターナリゼーションを観察します。
注:蛍光顕微鏡には以下の設定を使用しました。対物レンズ:プランアポクロマート:63 x / 1.40オイルDIC M27;FITC用チャンネル1:励起フィルター:450-490 nm、発光フィルター:500-550 nm、露光時間:230 ms;Hoechst 33258のチャンネル2:励起フィルター:335-383 nm、発光フィルター:420-470 nm、露光時間:27 ms。
- 丸いカバーガラスを12ウェルプレートに入れます。その後、1 x 105 細胞をカバーガラスに均一に接種し、2 mLの培地で一晩培養します。培地を除去し、1 mLのPBSで細胞を3回洗浄します。
- フローサイトメトリー解析
- 5 x 105 HeLa細胞を12ウェルプレートに均一に接種し、DMEM中で37°Cで24時間培養します。 その後、培地を除去し、1 mLのPBSで細胞を3回洗浄します。
- 細胞を 1 mL の 3 μM FITC標識ペプチドとともにFBSフリーDMEM中で37°Cで1時間インキュベートします。 ペプチド含有培地を除去し、細胞を0.25%(w/v)トリプシンおよび0.53 mM EDTAのPBS中で5分間解離させた後、306 × g で4分間遠心分離して細胞を回収します。セルペレットをPBSで洗浄する。
- 細胞を1 mLの0.05%(w/v)トリパンブルーのPBS中で3分間インキュベートして表面結合蛍光を消光し、フローサイトメーターを使用して細胞内蛍光の定量分析を実行します( 材料の表を参照)。
注:フローサイトメトリーの設定:励起:488 nm、発光:530 nm。トリパンブルーはまた、死細胞の蛍光を消光し、ペプチド取り込みの分析中に生細胞と死細胞を区別するのに役立ちます。 - HeLa細胞について説明したのと同じプロトコルに従ってフローサイトメトリーを使用して4T1細胞を処理およびアッセイします。サンプルごとに5 x 105 セルを収集し、グループごとに3つの並列サンプルを設定します。
6. トランスウェルモデルを用いたペプチドの細胞間浸透の探索
- 組織培養プレートインサート(材料の表を参照)を備えた12ウェルチャンバー内の2 mLのDMEMに1 x 10 5 HeLa細胞を接種し、5%CO2を含む37°C加湿インキュベーターで24時間インキュベートします。その後、培地を除去し、チャンバー内の細胞を1 mLの10 μM FITC-R8またはFITC-sR8-4(HPLCを使用して精製)とともにFBSフリーDMEMで1時間インキュベートします。
- ペプチドを含む培地を除去し、1 mLのPBSで細胞を3回洗浄します。1 mLの新鮮なFBSフリーDMEMをチャンバーに加え、組織培養プレートインサートとHeLa細胞を底部の丸いカバーガラスに2時間コインキュベートします。
- HeLa細胞を丸いカバーガラスに2.5%グルタルアルデヒドで15分間固定し、次にDAPIで細胞を15分間染色します。その後、カバーガラス上のHeLa細胞を蛍光顕微鏡で観察する。HeLa細胞に用いたものと同じプロトコルを使用して、4T1細胞を処理およびアッセイします。
結果
このプロトコルでは、直鎖状ポリアルギニンR8をその環状形態に拘束するための合成手順が提示された。SPPSは、簡単な装置を使用して手動で実施されました(図1)。SPPSの詳細な合成プロセスを図2に示します。簡単に説明すると、樹脂を十分に膨潤させ、続いてN α-Fmoc保護基を脱保護した。次いで、N個のα−Fmoc保護アミノ酸を、ペプチドアセンブリが完了するまで樹脂上に固着させた(図2のステップ1〜4)。次いで、切断カクテルによって粗ペプチドを樹脂から切断した(図2の工程5)。FITCを使用してペプチドを標識し、蛍光標識された環状CPPを合成し、生物学的障壁を越えた透過性を追跡しました。続いて、システインのトリチル保護基を樹脂上で選択的に脱保護し、続いて4,4'-ビス(ブロモメチル)ビフェニル架橋でペプチド環化を行いました(図3A)。FITC-R8およびFITC-sR8-4のHPLCおよびMSスペクトルを図3Bに示す。FITC-sR8-4の保持時間は、直鎖状アナログの保持時間よりも大幅に長く、疎水性架橋による環化後のペプチドの全体的な疎水性の向上を示しました。さらに、図3Cに示すように、環状R8は25%FBSで4時間インキュベートした後も77.3%の無傷のままでしたが、直鎖状R8はほとんど分解されており、環状R8ペプチドのタンパク質分解安定性が向上していることが示唆されています。その後の細胞ベースの研究では、芳香族架橋を有する環状R8で処理した細胞は、生細胞蛍光顕微鏡イメージングによって実証されるように、その線形対応物で処理された細胞よりも高い細胞内蛍光を示した(図4A)。同様の結果がフローサイトメトリー分析でも得られた(図4B)。環状R8が細胞間浸透の増強をもたらすかどうかをさらに調査するために、トランスウェルモデルを使用して、ある細胞層から別の細胞層へのペプチドのバリア透過性をシミュレートしました。環状R8は、細胞内蛍光の有意な増加によって示されるように、線状R8ペプチドよりも明らかに高いトランスバリア透過性を示した(図4C)。要約すると、環状R8ペプチドは、その線状対応物よりも生物学的障壁を越えて優れた透過性を示した。

図1:手動ペプチド合成装置の装置セットアップ。 10 mLのポリプロピレンカラムは、三方ストップバルブを使用して真空マニホールドに設置されます。N2 は攪拌に使用される。 この図の拡大版を表示するには、ここをクリックしてください。

図2:Fmoc固相ペプチド合成(SPPS)の一般的な手順。 N個のα-Fmoc保護アミノ酸を4-(2',4'-ジメトキシフェニル-Fmoc-アミノメチル)-フェノキシアセトアミド-ノルロイシル-MBHA樹脂(リンクアミドMBHA樹脂)に固定し(ステップ1)、続いてアミノ酸のN α-Fmoc保護基を脱保護し(ステップ2)、続いてアミノ酸カップリング(ステップ3)を行います。工程2と工程3を数回繰り返して、目的のペプチドを合成する(工程4)。合成の完了後、切断カクテルを添加して側鎖保護基を除去し、樹脂から所望のペプチドを切断する(ステップ5)。略語:DMF = N,N-ジメチルホルムアミド;DCM = ジクロロメタン;HATU = 2-(7-アゾベンゾトリアゾール)-N,N,N',N'-テトラメチルウロニウムヘキサフルオロホスフェート;DIPEA = N,N-ジイソプロピルエチルアミン;TFA = トリフルオロ酢酸。この図の拡大版を表示するには、ここをクリックしてください。

図3:固相ペプチド合成(SPPS)を用いたFITC標識直鎖状R8ペプチド(FITC-R8)およびFITC標識ステープルR8ペプチド(FITC-sR8-4)の合成。 (a)FITC-R8およびFITC-sR8-4の合成の模式図。(B)FITC-R8およびFITC-sR8-4のHPLCおよびMSスペクトル(挿入図)。(C)25%FBSの存在下でのFITC-R8およびFITC-sR8-4の安定性。インタクトペプチド(%)は、未分解ペプチドの画分を指す。この図はShiら15から修正されています。この図の拡大版を表示するには、ここをクリックしてください。
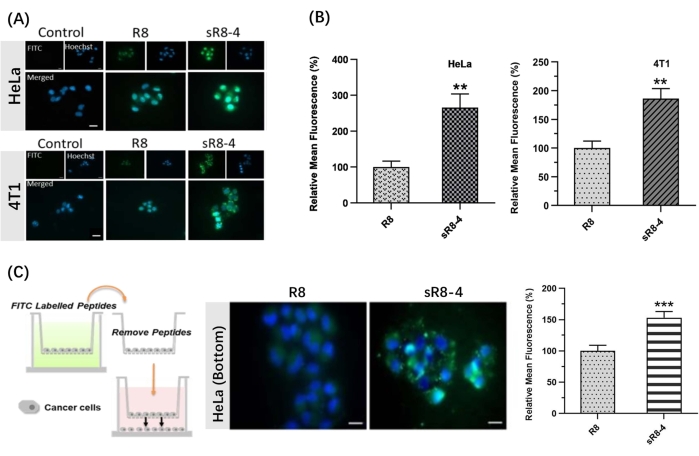
図4:FITC標識直鎖状R8ペプチド(FITC-R8)およびFITC標識ステープルR8ペプチド(FITC-sR8-4)の浸透。 (A)3 μM FITC-R8およびFITC-sR8-4との1時間インキュベーション後のHeLa細胞および4T1細胞の生細胞蛍光顕微鏡画像。FITC(緑)、ヘキスト(青)。スケールバー= 20μm。 (B)相対平均蛍光(直鎖状R8ペプチドに関して)、平均±s.d.、およびn = 3;(C)HeLa細胞を用いたトランスウェルモデルにおけるFITC-R8およびFITC-sR8-4の細胞間浸透。生細胞蛍光顕微鏡画像(スケールバー= 20 μm)、および相対平均蛍光(直鎖状R8ペプチドに関して)、平均± s.d.、およびn = 3。** P < 0.01, *** P < 0.001.この図はShiら15から修正されています。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
立体配座制約を組み込むことによるペプチドの化学的安定化は、ペプチド26の安定性および細胞透過性を改善するための有効な戦略であることが証明されている。このプロトコルでは、芳香族架橋を有する環状CPPの合成および生物学的障壁を越えたそれらの透過性の評価のための段階的な手順が説明されている。親水性ラクタムまたはトリアゾール架橋22,27と比較して、芳香族架橋(この研究で使用される)の組み込みは、CPPの全体的な疎水性を改善し、それによってそれらの細胞透過性を有意に増加させる。一方、ペプチド環化は、金属触媒を必要とせずにシステインとの置換反応によって容易に達成することができる。このプロトコルでは、CPPの環化は樹脂上で行われました。しかしながら、環化効率は、立体効果のためにペプチドの特定の配列および長さにも依存し、これは二量体副産物28の形成をもたらし得る。このような場合は、積載量の少ない樹脂を使用すると便利です。さらに、溶液相29でこれらの特定のペプチドを希薄濃度で環化することも推奨される。
このプロトコルにはいくつかの重要なポイントがあります。まず、切断カクテルTFA/TIS/EDT/H 2 O(92.5/2.5/2.5/2.5, v/v/v/v)をシステイン含有ペプチドの切断に使用し、スルフヒドリル基の酸化を防止する。第二に、適切な切断条件を得るために小規模な予備調査を行うことが提案されています。樹脂からペプチドを切断するのに必要な最適時間は2〜3時間であり、より長い切断時間(5時間以上)は、より多くの未同定副産物を生成する傾向があります。ペプチド合成をLC-MSでモニターして、切断時間を最適化することができます。第三に、FITC標識は、蛍光消光を避けるために暗闇の中で行う必要があります。
さらに、フローサイトメトリー分析では細胞内蛍光と表面結合蛍光を区別できないため、表面結合蛍光を消光するためにトリパンブルーを使用する必要があります。これは、癌細胞27によってインターナライズされたペプチドを特異的に定量するのに役立つであろう。さらに、カチオン性ペプチドも非特異的膜溶解30を引き起こす可能性があるため、溶血活性および細胞生存率も実施して、環状CPPの毒性を評価することができます。
サイクリックCPPは、生物学的障壁を克服するための効果的な薬物送達手段の1つを構成します。しかしながら、カチオン性CPPの膜相互作用および摂動は、一般に、潜在的な非特異的細胞毒性をもたらす31。さらなる努力は、細胞毒性を最小限に抑えて生物学的障壁を貫通する次世代の環状CPPの発見に役立つはずの詳細な浸透メカニズムの理解に費やされる予定です。これらの非常に活性が高く安定したCPPは、生命を脅かす重要な疾患の治療を改善するための大きな期待を寄せています。
開示事項
著者は開示するものは何もありません。
謝辞
この研究は、中国自然科学基金会(21708031)、中国ポスドク科学基金会(BX20180264、2018M643519)、および中央大学の基礎研究基金(2682021ZTPY075)の支援を受けています。
資料
| Name | Company | Catalog Number | Comments |
| 1,2-ethanedithiol | Aladdin | K1722093 | stench |
| 2-(7-Azobenzotriazole)-N,N,N',N'-tetramethyluronium hexafluorophosphate (HATU) | HEOWNS | A-0443697 | |
| 4,4'-bis(bromomethyl)biphenyl | TCI | B1921 | |
| 4T1 cells | ATCC | 4T1 cells were cultured in DMEM medium supplemented with 10% FBS (Hyclone) in a 37 °C humidified incubator containing 5% CO2. | |
| Acetonitrile | Adamas | 1484971 | toxicity |
| Dichloromethane | Energy | W330229 | skin harmful |
| Diethyl ether | Aldrich | 673811 | flammable |
| Dimethyl sulfoxide | Beyotime | ST038 | skin harmful |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | ||
| Electrospray Ionization Mass Spectrometer | Waters | G2-S Tof | |
| Ethylene Diamine Tetraacetic Acid (EDTA) | BioFroxx | 1340 | |
| Fetal bovine serum (FBS) | HyClone | ||
| Flow cytometer | Beckman Coulter | CytoFLEX | |
| Fluorescein isothiocyanate isomer (FITC) | Energy | E0801812500 | |
| Fluorescent microscope | Carl Zeiss | Axio Observer 7 | |
| Fmoc-Arg(Pbf)-OH | HEOWNS | F-81070 | |
| Fmoc-Cys(Trt)-OH | GL Biochem | GLS201115-35202 | |
| Fmoc-βAla-OH | Adamas | 51341C | |
| HeLa cells | ATCC | HeLa cells were cultured in DMEM supplemented with 10% FBS (Hyclone) in a 37 °C humidified incubator containing 5% CO2. | |
| High-Performance Liquid Chromatography | Agilent | Agilent 1260 | |
| High-Performance Liquid Chromatography column | Agilent | Poroshell EC-C18 120, 4.6 × 150 mm (pore size 120 Å, particle size 4 μm) | |
| Lyophilizer | SP Scientific | Vir Tis | |
| Methanol | Aldrich | 9758 | toxicity |
| Microtiter plate | Thermo μdrop plate | N12391 | |
| Morpholine | HEOWNS | M99040 | irritant |
| Multi-technology microplate reader | Thermo | VARIOSKAN LUX | |
| N,N-Diisopropylethylamine | HEOWNS | E-81416 | irritant |
| N,N-Dimethyl formamide | Energy | B020051 | harmful to skin |
| Poly-Prep column | Bio-Rad | 7321010 | polypropylene chromatography columns |
| Rink Amide MBHA resin (0.572 mmol/g) | GL Biochem | GLS180301-49101 | |
| Three-way stopcocks | Bio-Rad | 7328107 | |
| Tissue culture plate insert | LABSELECT | 14211 | |
| Trifluoroacetic acid | HEOWNS | T63278 | corrosive |
| Triisopropylsilane | HEOWNS | T-0284475 | |
| Trypsin | BioFroxx | 1004 | |
| Vacuum manifold | Promega | A7231 |
参考文献
- Zhang, L., et al. Brain-targeted dual site-selective functionalized poly(β-amino esters) delivery platform for nerve regeneration. Nano Letters. 21 (7), 3007-3015 (2021).
- Park, T. E., et al. Enhanced BBB permeability of osmotically active poly(mannitol-co-PEI) modified with rabies virus glycoprotein via selective stimulation of caveolar endocytosis for RNAi therapeutics in Alzheimer's disease. Biomaterials. 38, 61-71 (2015).
- Bian, J., et al. Effect of cell-based intercellular delivery of transcription factor GATA4 on ischemic cardiomyopathy. Circulation Research. 100 (11), 1626-1633 (2007).
- He, H., et al. The use of low molecular weight protamine chemical chimera to enhance monomeric insulin intestinal absorption. Biomaterials. 34 (31), 7733-7743 (2013).
- Kim, D., et al. A specific STAT3-binding peptide exerts antiproliferative effects and antitumor activity by inhibiting STAT3 phosphorylation and signaling. Cancer Research. 74 (8), 2144-2151 (2014).
- Yang, Y., et al. PEGylated liposomes with NGR ligand and heat-activable cell-penetrating peptide-doxorubicin conjugate for tumor-specific therapy. Biomaterials. 35 (14), 4368-4381 (2014).
- Wei, Y., et al. Intracellular paclitaxel delivery facilitated by a dual-functional CPP with a hydrophobic hairpin tail. ACS Applied Materials and Interfaces. 13 (4), 4853-4860 (2021).
- Vasan, N., Baselga, J., Hyman, D. M. A view on drug resistance in cancer. Nature. 575 (7782), 299-309 (2019).
- Cong, Y., et al. Microenvironment-induced in situ self-assembly of polymer-peptide conjugates that attack solid tumors deeply. Angewandte Chemie International Edition. 131 (14), 4680-4685 (2019).
- Blanco, E., Shen, H., Ferrari, M. Principles of nanoparticle design for overcoming biological barriers to drug delivery. Nature Biotechnology. 33 (9), 941-951 (2015).
- Tian, Y., Zhou, S. Advances in cell-penetrating peptides and their functionalization of polymeric nanoplatforms for drug delivery. Wiley Interdisciplinary Reviews. Nanomedicine and Nanobiotechnology. 13 (2), 1-12 (2021).
- Milletti, F. Cell-penetrating peptides: Classes, origin, and current landscape. Drug Discovery Today. 17 (15-16), 850-860 (2012).
- Turner, J. J., et al. Cell-penetrating peptide conjugates of peptide nucleic acids (PNA) as inhibitors of HIV-1 Tat-dependent trans-activation in cells. Nucleic Acids Research. 33 (21), 6837-6849 (2005).
- Tunnemann, G., et al. Live-cell analysis of cell penetration ability and toxicity of oligo-arginines. Journal of Peptide Science. 14 (4), 469-476 (2008).
- Shi, M., et al. Stapling of short cell-penetrating peptides for enhanced tumor cell-and-tissue dual-penetration. Chemical Communications. 58 (14), 2299-2302 (2022).
- Komin, A., et al. A peptide for transcellular cargo delivery: Structure-function relationship and mechanism of action. Journal of Controlled Release. 324, 633-643 (2020).
- Dietrich, L., et al. Cell permeable stapled peptide inhibitor of Wnt signaling that targets β-catenin protein-protein interactions. Cell Chemical Biology. 24 (8), 958-968 (2017).
- Tian, Y., et al. Stapling of unprotected helical peptides via photo-induced intramolecular thiol-yne hydrothiolation. Chemical Science. 7 (5), 3325-3330 (2016).
- De Araujo, A. D., et al. Comparative α-helicity of cyclic pentapeptides in water. Angewandte Chemie International Edition. 53 (27), 6965-6969 (2014).
- Chu, Q., et al. Towards understanding cell penetration by stapled peptides. Medicinal Chemistry Communications. 6 (1), 111-119 (2015).
- Bock, J. E., Gavenonis, J., Kritzer, J. A. Getting in shape: Controlling peptide bioactivity and bioavailability using conformational constraints. ACS Chemical Biology. 8 (3), 488-499 (2013).
- Tian, Y., et al. Effect of stapling architecture on physiochemical properties and cell permeability of stapled α-helical peptides: A comparative study. ChemBioChem. 18 (21), 2087-2093 (2017).
- White, C. J., Yudin, A. K. Contemporary strategies for peptide macrocyclization. Nature Chemistry. 3 (7), 509-524 (2011).
- Jain, R. K. Normalization of tumor vasculature: An emerging concept in antiangiogenic therapy. Science. 307 (5706), 58-62 (2005).
- Patgiri, A., Menzenski, M. Z., Mahon, A. B., Arora, P. S. Solid-phase synthesis of short α-helices stabilized by the hydrogen bond surrogate approach. Nature Protocols. 5 (11), 1857-1865 (2010).
- Baek, S., et al. Structure of the stapled p53 peptide bound to Mdm2. Journal of the American Chemical Society. 134 (1), 103-106 (2012).
- Traboulsi, H., et al. Macrocyclic cell penetrating peptides: A study of structure-penetration properties. Bioconjugate Chemistry. 26 (3), 405-411 (2015).
- Tian, Y., et al. A proline-derived transannular N-cap for nucleation of short α-helical peptides. Chemical Communications. 52 (59), 9275-9278 (2016).
- Muppidi, A., et al. Rational design of proteolytically stable, cell-permeable peptide-based selective Mcl-1 inhibitors. Journal of the American Chemical Society. 134 (36), 14734-14737 (2012).
- Wiradharma, N., et al. Synthetic cationic amphiphilic α-helical peptides as antimicrobial agents. Biomaterials. 32 (8), 2204-2212 (2011).
- Jones, A. T., Sayers, E. J. Cell entry of cell penetrating peptides: Tales of tails wagging dogs. Journal of Controlled Release. 161 (2), 582-591 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved