Method Article
Construcción de péptidos cíclicos penetrantes de células para mejorar la penetración de barreras biológicas
En este artículo
Resumen
Este protocolo describe la síntesis de péptidos cíclicos penetrantes de células con enlaces cruzados aromáticos y la evaluación de su permeabilidad a través de barreras biológicas.
Resumen
El cáncer ha sido un gran desafío en la salud mundial. Sin embargo, el complejo microambiente tumoral generalmente limita el acceso de la terapéutica a las células tumorales más profundas, lo que lleva a la recurrencia del tumor. Para conquistar la penetración limitada de las barreras biológicas, se han descubierto péptidos de penetración celular (CPP) con excelente capacidad de translocación de membrana y han surgido como transportadores moleculares útiles para entregar diversas cargas a las células. Sin embargo, las CPP lineales convencionales generalmente muestran una estabilidad proteolítica comprometida, lo que limita su permeabilidad a través de las barreras biológicas. Por lo tanto, el desarrollo de nuevos transportadores moleculares que puedan penetrar las barreras biológicas y exhibir una mayor estabilidad proteolítica es muy deseado para promover la eficiencia de la administración de fármacos en aplicaciones biomédicas. Hemos sintetizado previamente un panel de CPP cíclicos cortos con enlaces cruzados aromáticos, que exhibieron una permeabilidad superior en células y tejidos cancerosos en comparación con sus contrapartes lineales. Aquí, se describe un protocolo conciso para la síntesis del péptido cíclico de poliarginina R8 marcado con fluorescencia y su contraparte lineal, así como los pasos clave para investigar su permeabilidad celular.
Introducción
Las últimas décadas han sido testigos de rápidos avances en el desarrollo de péptidos de penetración celular (CPP) para la administración de fármacos. Los CPP se han utilizado ampliamente como transportadores moleculares para el tratamiento de una variedad de enfermedades potencialmente mortales, incluidos los trastornos neurológicos1,2, las enfermedades cardíacas3, la diabetes4, la dermatosis5 y el cáncer 6,7. El cáncer sigue siendo una carga sanitaria mundial acompañada de una alta tasa de morbilidad y mortalidad a pesar de los esfuerzos de investigación generalizados8. Un obstáculo serio para el tratamiento del cáncer es el acceso limitado de la terapéutica a las células tumorales más profundas debido a barreras fisiológicas como la matriz extracelular compacta (MEC), la vasculatura tumoral anormal, las barreras de membrana múltiple y la alta presión del líquido intersticial (IFP)9. Por lo tanto, el desarrollo de nuevos CPP con capacidad superior para entregar cargas a través de barreras biológicas se considera una estrategia esencial para el tratamiento del cáncer10,11.
Las CPP pueden clasificarse en CPP catiónicas, anfipáticas e hidrofóbicas en términos de sus propiedades fisicoquímicas12. Entre estos, el péptido VIH-TAT cargado positivamente y la poliarginina sintética son de considerable importancia en la investigación biomédica y han sido ampliamente estudiados para facilitar la administración intracelularde fármacos 13. Tunnemann et al. informaron que una longitud mínima de ocho argininas es esencial para la penetración celular eficiente de los péptidos sintéticos de poliarginina, basado en un estudio de permeabilidad celular realizado con péptidos R3 a R1214. Sin embargo, estos CPP generalmente tienen vidas medias plasmáticas cortas debido a su rápida hidrólisis in vivo. Además, se sabe poco sobre la optimización de la estructura química de los CPP para aumentar su capacidad de transbarrera, ya que es difícil penetrar múltiples membranas celulares15. Por lo tanto, el desarrollo de nuevos transportadores moleculares capaces de penetrar las barreras biológicas es muy deseado para mejorar la eficiencia de la administración de fármacos. En 2020, Komin et al.16 descubrieron un CPP llamado péptido CL, que contiene un motivo de hélice (RLLRLLR) y una cola de poliarginina (R7) para cruzar la monocapa epitelial. También se sintetizó un conjunto de variantes peptídicas CL alterando el patrón helicoidal. Esta exploración podría ser una guía importante para el desarrollo de nuevos CPP para la entrega de cargas a través de barreras biológicas. Además, Dietrich et al. optimizaron la permeabilidad celular del péptido StAX, inhibiendo la vía de señalización Wnt/β-catenina al aumentar la hidrofobicidad global de los péptidos17.
La restricción conformacional de péptidos lineales no estructurados por ciclación es una forma efectiva de mejorar su estabilidad proteolítica y permeabilidad18,19,20. El refuerzo estructural aumenta la resistencia a la proteasa de los péptidos cíclicos, haciéndolos más estables in vivo en comparación con sus contrapartes lineales. Además, la ciclación de péptidos puede potencialmente enmascarar la columna vertebral del péptido polar al promover el enlace de hidrógeno intramolecular, aumentando así la permeabilidad de la membrana de los péptidos21. En las últimas dos décadas, los métodos de ciclación quimioselectiva se han convertido en estrategias efectivas para la construcción de péptidos cíclicos con diferentes arquitecturas, como todo hidrocarburo, lactámico, triazol, m-xileno, perfluoroarilo y otros enlaces cruzados22,23. La barrera biológica impuesta por el sofisticado microambiente tumoral podría reducir la penetración de fármacos en tumores sólidos24. Hemos encontrado previamente que los CPP cíclicos mostraron una resistencia superior a la digestión enzimática sobre sus contrapartes lineales20. Además, la hidrofobicidad global de los péptidos es crítica para su mayor permeabilidad celular22. Sobre la base de los estudios discutidos anteriormente, se puede plantear la hipótesis de que la combinación de un patrón cargado positivamente, hidrofobicidad general elevada y estabilidad de proteólisis mejorada aumenta la permeabilidad de las CPP a través de las barreras biológicas. En un estudio reciente, identificamos dos CPP cíclicos con enlaces cruzados aromáticos en las posiciones i e i + 7 que exhiben una mejor permeabilidad en células y tejidos tumorales en comparación con sus contrapartes lineales15. Aquí, se presenta un protocolo sintético conciso para la síntesis de CPP cíclicos marcados con fluorescencia y los pasos clave para investigar su permeabilidad.
Protocolo
1. Preparación del equipo
NOTA: Realice todos los procedimientos en una campana extractora de humos de funcionamiento con el equipo de protección personal adecuado.
- Montar el aparato manual de síntesis de péptidos en la campana extractora (Figura 1). Coloque las llaves de paso de tres vías (consulte la Tabla de materiales) en el colector de vacío (consulte la Tabla de materiales) y conéctelas al nitrógeno (N2). Asegúrese de tapar las entradas no utilizadas.
- Coloque una columna de polipropileno de 10 ml (consulte la Tabla de materiales) en las llaves de paso de tres vías. Drene la mezcla de reacción o los disolventes de la columna de polipropileno utilizando una bombilla de pipeta de goma o un vacío a través de una trampa de residuos.
2. Síntesis del péptido R8 lineal marcado con FITC (FITC-R8) y el péptido R8 grapado marcado con FITC (FITC-sR8-4)
NOTA: Los péptidos se sintetizaron de acuerdo con un protocolo estándar de síntesis de péptidos en fase sólida (SPPS) basado en Fmoc25. La resina 4-(2',4'-Dimetoxipheyl-Fmoc-aminomethyl)-phenoxyacetamido-norleucyl-MBHA (resina MBHA de amida de pista, ver Tabla de materiales) se utilizó durante todo el estudio.
PRECAUCIÓN: N, N-dimetilformamida (DMF), N, N-diisopropiletilamina (DIPEA), morfolina y diclorometano (DCM) son incoloros y dañinos si se inhalan o absorben a través de la piel. El éter es extremadamente inflamable. El 1,2-Ethanedithiol (EDT) es una sustancia particularmente olorosa. El ácido trifluoroacético (TFA) es altamente corrosivo, y su acidez es 10a 5 veces mayor que la del ácido acético. En consecuencia, se supone que todos los reactivos y productos químicos deben tratarse utilizando equipos de protección en una campana extractora.
- Preparar la resina para la síntesis de péptidos.
- Calcular la masa de resina necesaria para la síntesis:Masa de resina (mg) = escala (mmol) / capacidad de carga de resina (mmol/g) × 1.000 (mg/g)
NOTA: Por ejemplo, la masa de resina MBHA amida de pista (0.572 mmol / g) para 0.2 mmol = 0.2 mmol / 0.572 mmol / g × 1,000 mg / g = 350 mg. - Agregue 4-5 ml de DMF a la cantidad requerida de resina y transfiérala a la columna de polipropileno de 10 ml (paso 1.2) con un burbujeo suave deN2 durante 30 minutos para hinchar la resina adecuadamente, y luego drene el DMF.
- Agregue 4-5 ml de morfolina/DMF al 50% (v/v) a la resina, burbujee suavementeN2 durante 30 min 2x para eliminar el grupo Fmoc N-terminal y luego drene la mezcla. Después, lave la resina a fondo 3 veces agregando 4-5 ml de DMF a la columna y burbujeando con N2 durante al menos 1 minuto cada vez. Continúe lavando la resina con DCM (3x) y DMF (3x) de la misma manera.
- Calcular la masa de resina necesaria para la síntesis:Masa de resina (mg) = escala (mmol) / capacidad de carga de resina (mmol/g) × 1.000 (mg/g)
- Realice el acoplamiento de aminoácidos protegido con Fmoc como se describe a continuación.
NOTA: El acoplamiento de arginina en una síntesis manual a escala de 0,2 mmol se describe aquí como ejemplo.- Disolver Fmoc-Arg (Pbf)-OH (5 equiv., 648.8 mg) y 2-(7-Azobenzotriazol)-N, N, N', N'-tetrametiluronio hexafluorofosfato (HATU, 4.9 equiv., 372.6 mg) en 5 mL de DMF en un tubo de centrífuga.
- Añadir DIPEA (10 equiv., 348,4 μL) para activar la reacción de acoplamiento y, a continuación, transferir la mezcla de reacción a la columna de polipropileno de 10 ml con resina (preparada en el paso 2.1.3). Luego, agite suavemente la mezcla con N 2 burbujeando durante1-2 h.
- Repita una vez la reacción de acoplamiento (paso 2.2.1 y paso 2.2.2).
- Después de completar el acoplamiento, drene la mezcla de reacción y lave la resina secuencialmente con DMF, DCM y DMF 3x cada uno durante al menos 1 minuto cada vez.
- Realice el acoplamiento de cada aminoácido en pasos ordenados: Agregue 4-5 ml de morfolina/DMF al 50% (v/v) a la resina, burbujee suavemente conN2 durante 30 min 2x para eliminar el grupo N α-Fmoc, luego lave la resina (como se muestra en el paso 2.2.4) y proceda a acoplar el siguiente aminoácido (como se muestra en los pasos 2.2.1 y 2.2.2). Proceda con varios ciclos de este paso para lograr la síntesis del péptido deseado.
NOTA: Este proceso se puede pausar aquí. Condensar la resina con metanol y secar la resina con un flujo continuo deN2. Tapa la columna de polipropileno y luego almacena la resina a 4 °C durante unos días (o a -20 °C para un almacenamiento más prolongado). Hinchar la resina con 4-5 mL de DMF durante 0,5-1 h antes de comenzar una nueva síntesis. Si se procede directamente al siguiente paso, no hay necesidad de condensar la resina.
- Marque los péptidos con isotiocianato de fluoresceína (FITC) como se describe a continuación.
- Acople la beta-alanina como espaciador para el etiquetado FITC utilizando el mismo proceso que se utiliza para el acoplamiento de aminoácidos en el paso 2.2.
- Realice el etiquetado FITC de péptidos en la resina agregando una mezcla de FITC (5 equiv.), DIPEA (10 equiv.) y DMF a la columna de polipropileno y reaccionando en la oscuridad durante 8 h.
- Para la síntesis de FITC-sR8-4, realice la ciclación del péptido lineal como se describe a continuación.
- Agregue una mezcla de TFA/triisopropilsilano (TIS)/DCM (3/5/92, v/v/v) a la columna de polipropileno durante 2 min para eliminar selectivamente el grupo protector Cys (Trt) y luego drene la mezcla. Repita el procedimiento anterior hasta que la solución amarillenta se vuelva incolora para eliminar completamente el grupo protector de Trt.
- Posteriormente, realizar lavados secuenciales de la resina con DMF y DCM al menos 3x. Después, disolver 4,4'-bis(bromometil)bifenilo (2 equiv.) en DMF con DIPEA (4 equiv.), añadirlo a la columna, y reaccionar durante 4 h.
- Dividir los péptidos como se describe: Después de completar la síntesis de péptidos, lave la resina con 4-5 ml de metanol dos veces durante 5 minutos cada una y séquela con un flujo continuo deN2. Trate la resina con un cóctel de escote eficaz TFA/TIS/H 2 O (95/2.5/2.5, v/v/v), o TFA/TIS/EDT/H 2 O (92.5/2.5/2.5/2.5, v/v/v/v) para péptidos que contengan cisteína, utilizando aproximadamente 1 ml de cóctel de escote por cada 100 mg de resina. Trate la resina unida a péptidos durante 2-3 h para escindir el péptido y luego retire el TFA cuidadosamente con una corriente de N2.
- Para obtener los péptidos crudos, agregue 4-5 ml de éter dietílico a la preparación de péptidos escindidos para precipitar los péptidos crudos y centrifugar a 10,000 × g durante 4 min. Deseche cuidadosamente el sobrenadante y seque al aire el péptido durante 3 minutos en una campana extractora eficaz.
- Análisis de los péptidos: Disolver un péptido crudo a pequeña escala (escindido a partir de aproximadamente 10 mg de resina unida a péptidos) en 800 μL de acetonitrilo (ACN)/H2O(1/1, v/v) y luego analizar mediante cromatografía líquida de alta resolución en fase inversa (RP-HPLC) y cromatografía líquida-espectrometría de masas (LC-MS) (ver Tabla de materiales).
- Purificar los péptidos usando RP-HPLC y LC-MS.
- Disolver 50 mg de producto peptídico crudo en 4 ml de ACN/H2O(1/1, v/v) e inyectar la solución en un sistema RP-HPLC equipado con una columna C18 (4,6 mm x 150 mm, tamaño de poro: 120 Å, tamaño de partícula: 4 μm; ver Tabla de materiales). Eluya el péptido utilizando una fase móvil que contenga 0,1% de TFA/H2O(v/v) y ACN, con un gradiente de 10% a 90% de ACN durante 30 min. Los péptidos convencionales se detectaron a 220 nm y los péptidos marcados con FITC a 494 nm.
- Recopile las fracciones correspondientes al pico peptídico principal identificado por MS y luego liofilice las fracciones peptídicas deseadas. Conservar el péptido purificado a -20 °C.
NOTA: Los m/z encontrados del FITC-R8 purificado son los siguientes: [M + 3 H]3+: 576.63; [M + 4 H] 4+: 432,72; [M + 5 H] 5+: 346,39; [M + 6 H] 6+: 288,85. Los m/z encontrados del FITC-sR8-4 purificado son los siguientes: [M + 3 H]3+: 704.74; [M + 4 H] 4+: 528,77; [M + 5 H] 5+: 423,34; [M + 6 H] 6+: 352,91. Condiciones analíticas MS: instrumento: ESI (sesgo de sonda: +4,5 kV; detector: 1,2 kV); flujo de gas nebulizador: 1,5 L/min; línea de desolvatación curva (CDL): −20 V; Temperatura CDL: 250 °C; temperatura del bloque: 400 °C; caudal: 0,2 mL/min; fase móvil: 50% H2O/50% ACN.
3. Cuantificación de los péptidos marcados con FITC
- Disuelva una pequeña cantidad de péptido purificado en DMSO como solución madre (por ejemplo, 40 μmol/ml).
- Mida la absorbancia a 494 nm (A 494) de 2 μL de la solución madre en498 μL de solución salina tamponada con fosfato de 10 mM (1x PBS, pH 7.4) con una placa de microtitulación (ver Tabla de materiales) utilizando un lector de microplacas multitecnología (ver Tabla de materiales). El factor de dilución es de 500 μL / 2 μL = 250, y la longitud de trayectoria de la placa de microtitulación es de 0,5 mm.
- Calcule la concentración de la solución madre utilizando la siguiente fórmula:
Concentración (mM) = A494 × factor de dilución / 0,05 (cm) / 77.000 (cm−1· M−1) × 1.000 (mM·M−1) - Ajuste a una dilución adecuada para que el valor A494 medido esté entre 0.1 y 1.0.
NOTA: Las mediciones deben repetirse varias veces para garantizar que la concentración medida sea precisa. El coeficiente de extinción de 77.000 cm−1· M−1 surge del grupo FIFC.
4. Estabilidad de péptidos en suero fetal bovino (FBS)
- Incubar el péptido a una concentración de 100 μM con 250 μL de FBS/H2O(v/v) al 25% a 37 °C. Después de incubar durante 0 h, 1 h, 2 h y 4 h, tomar 10 μL de alícuotas y luego agregar 150 μl de ácido tricloroacético al 12% disuelto enH2O/ACN (1/3, v/v) para precipitar las proteínas séricas.
- Centrifugar las muestras a 10.000 × g durante 5 min y analizar el sobrenadante utilizando HPLC (como se describe en el paso 2.8) para determinar el grado de degradación del péptido.
- Calcule la relación entre el área de pico a 1 h, 2 h y 4 h y la de 0 h para obtener la fracción de péptido no degradado en el momento correspondiente. El resultado es el promedio de tres muestras paralelas.
5. Captación celular de los péptidos
- Imágenes microscópicas de fluorescencia
- Coloque un cubreobjetos redondo en una placa de 12 pocillos. Luego, inocular 1 x 105 células uniformemente en cubreobjetos y cultivar durante la noche con 2 ml de medio. Retire el medio y lave las células 3 veces con 1 ml de PBS.
NOTA: En este estudio, las células HeLa y las células 4T1 se cultivaron en el medio Eagle Modificado de Dulbecco (DMEM, ver Tabla de materiales) suplementado con 10% de FBS en una incubadora humidificada a 37 °C que contenía 5% deCO2. - Incubar las células con 1 ml de péptidos marcados con FITC de 3 μM en DMEM libre de FBS durante 1 h a 37 °C. Después, retire el medio que contiene péptidos y lave las células 3 veces con 1 ml de PBS.
- Teñir las células con 1 mL de Hoechst 33258 durante 15 min. Observe la internalización de cada péptido utilizando un microscopio de fluorescencia (ver Tabla de materiales) con la misma intensidad de fluorescencia y tiempo de exposición.
NOTA: Se utilizaron los siguientes ajustes para la microscopía de fluorescencia. Objetivo: Plan-Apocromat: 63 x/1.40 Aceite DIC M27; Canal 1 para FITC: filtro de excitación: 450-490 nm, filtro de emisión: 500-550 nm, tiempo de exposición: 230 ms; Canal 2 para Hoechst 33258: filtro de excitación: 335-383 nm, filtro de emisión: 420-470 nm, tiempo de exposición: 27 ms.
- Coloque un cubreobjetos redondo en una placa de 12 pocillos. Luego, inocular 1 x 105 células uniformemente en cubreobjetos y cultivar durante la noche con 2 ml de medio. Retire el medio y lave las células 3 veces con 1 ml de PBS.
- Análisis de citometría de flujo
- Inocular 5 x 10células HeLa uniformemente en placas de 12 pocillos y cultivar en DMEM durante 24 h a 37 °C. Después, retire el medio y lave las células 3 veces con 1 ml de PBS.
- Incubar las células con 1 ml de péptidos marcados con FITC de 3 μM en DMEM libre de FBS durante 1 h a 37 °C. Retire el medio que contiene péptidos, disocie las células con tripsina al 0,25% (p/v) y EDTA a 0,53 mM en PBS durante 5 min, y luego recoja las células por centrifugación a 306 × g durante 4 min. Lave el pellet celular con PBS.
- Incubar las células con 1 ml de azul de tripano al 0,05% (p/v) en PBS durante 3 minutos para apagar la fluorescencia unida a la superficie, y realizar un análisis cuantitativo de la fluorescencia intracelular utilizando un citómetro de flujo (ver Tabla de materiales).
NOTA: Ajustes de citometría de flujo: excitación: 488 nm, emisión: 530 nm. El azul de tripano también puede apagar la fluorescencia de las células muertas y ayudar a distinguir las células vivas / muertas durante el análisis de la absorción de péptidos. - Tratar y evaluar las células 4T1 mediante citometría de flujo siguiendo el mismo protocolo descrito para las células HeLa. Recolectar 5 x 105 celdas por muestra y configurar tres muestras paralelas por grupo.
6. Exploración de la penetración de célula a célula de los péptidos utilizando modelos transwell
- Inocular 1 x 105 células HeLa en 2 ml de DMEM en una cámara de 12 pocillos con un inserto de placa de cultivo de tejidos (ver Tabla de materiales) e incubar durante 24 h en una incubadora humidificada a 37 °C que contiene 5% deCO2. Después, retire el medio e incube las células en las cámaras con 1 ml de 10 μM FITC-R8 o FITC-sR8-4 (purificado con HPLC) en DMEM libre de FBS durante 1 h.
- Retire el medio que contiene los péptidos y lave las células 3 veces con 1 ml de PBS. Agregue 1 ml de DMEM fresco libre de FBS a las cámaras y luego incube conjuntamente las células HeLa en la cámara con el inserto de placa de cultivo de tejidos con las células HeLa en los cubreobjetos redondos en la parte inferior durante 2 h.
- Fije las células HeLa en los cubreobjetos redondos con glutaraldehído al 2,5% durante 15 minutos y luego tiñe las células con DAPI durante 15 min. Luego, observe las células HeLa en los cubreobjetos bajo un microscopio de fluorescencia. Tratar y evaluar las células 4T1 utilizando el mismo protocolo que el utilizado para las células HeLa.
Resultados
En este protocolo, se presentó un procedimiento sintético para restringir la poliarginina lineal R8 en su forma cíclica. El SPPS se realizó manualmente utilizando un aparato simple (Figura 1). El proceso sintético detallado de SPPS se muestra en la Figura 2. Brevemente, la resina estaba suficientemente hinchada, seguida de la desprotección del grupo protector de N α-Mmoc. Luego, el aminoácido protegido con N α-Fmoc se ancló en la resina hasta completar el ensamblaje del péptido (pasos 1-4 en la Figura 2). Luego, los péptidos crudos fueron escindidos de la resina por el cóctel de escisión (paso 5 en la Figura 2). FITC se utilizó para etiquetar los péptidos para sintetizar CPP cíclicos marcados con fluorescencia y rastrear su permeabilidad a través de las barreras biológicas. Posteriormente, los grupos protectores de tritilo de cisteínas se desprotegieron selectivamente en la resina, seguido de la ciclación peptídica con reticulación de 4,4'-bis(bromometil)bifenilo (Figura 3A). Los espectros HPLC y MS de FITC-R8 y FITC-sR8-4 se muestran en la Figura 3B. El tiempo de retención de FITC-sR8-4 fue sustancialmente más largo que el del análogo lineal, lo que indica una mayor hidrofobicidad general del péptido después de la ciclación con la reticulación hidrófoba. Además, como se muestra en la Figura 3C, el R8 cíclico permaneció intacto en un 77,3% después de la incubación con FBS al 25% durante 4 h, mientras que su contraparte lineal se degradó en su mayoría, lo que sugiere una mayor estabilidad proteolítica del péptido R8 cíclico. En los estudios posteriores basados en células, las células tratadas con R8 cíclico con reticulación aromática exhibieron una mayor fluorescencia intracelular que las tratadas con su contraparte lineal, como lo demuestran las imágenes de microscopía de fluorescencia de células vivas (Figura 4A). Se obtuvieron resultados similares con el análisis de citometría de flujo (Figura 4B). Para investigar más a fondo si el R8 cíclico confiere una mayor penetración de célula a célula, se utilizaron modelos transwell para simular la permeabilidad de barrera de los péptidos de una capa celular a otra. El R8 cíclico mostró claramente una mayor penetración transbarrera que el péptido lineal R8, como lo indica un aumento significativo en la fluorescencia intracelular (Figura 4C). En resumen, el péptido cíclico R8 exhibió una permeabilidad superior a través de las barreras biológicas sobre su contraparte lineal.

Figura 1: Configuración del equipo para el aparato manual de síntesis de péptidos. Se instala una columna de polipropileno de 10 ml en el colector de vacío mediante una válvula de cierre de tres vías. N2 se utiliza para la agitación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Procedimiento general de síntesis de péptidos en fase sólida Fmoc (SPPS). Un aminoácido protegido con N α-Fmoc se ancla a la resina 4-(2',4'-Dimetoxipheyl-Fmoc-aminomethyl)-phenoxyacetamido-norleucyl-MBHA (resina MBHA de amida de pista) (paso 1), seguido de la desprotección de los grupos protectores de Nα-Fmoc de los aminoácidos (paso 2) y el acoplamiento posterior de aminoácidos (paso 3). El paso 2 y el paso 3 se repiten varias veces para sintetizar el péptido deseado (paso 4). Después de completar la síntesis, se agrega un cóctel de escisión para eliminar los grupos protectores de la cadena lateral y escindir el péptido deseado de la resina (paso 5). Abreviaturas: DMF = N, N-dimetilformamida; MCD = diclorometano; HATU = 2-(7-azobenzotriazol)-N, N, N', N'-tetrametiluronio hexafluorofosfato; DIPEA = N, N-diisopropiletilamina; TFA = ácido trifluoroacético. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Síntesis del péptido R8 lineal marcado con FITC (FITC-R8) y el péptido R8 grapado marcado con FITC (FITC-sR8-4) utilizando la síntesis de péptidos en fase sólida (SPPS). (A) Diagrama esquemático de la síntesis de FITC-R8 y FITC-sR8-4. (B) Espectros HPLC y MS (recuadro) de FITC-R8 y FITC-sR8-4. (C) Estabilidad de FITC-R8 y FITC-sR8-4 en presencia de 25% FBS. El péptido intacto (%) se refiere a la fracción de péptido no degradado. Esta figura ha sido modificada de Shi et al.15. Haga clic aquí para ver una versión más grande de esta figura.
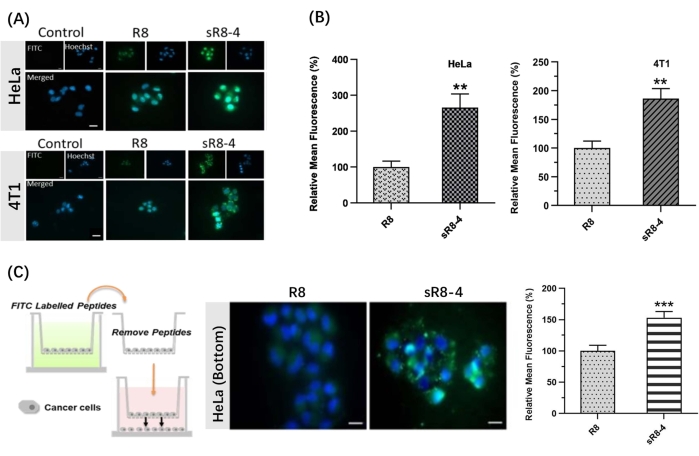
Figura 4: Penetración del péptido R8 lineal marcado con FITC (FITC-R8) y el péptido R8 grapado marcado con FITC (FITC-sR8-4). (A) Imágenes de microscopía de fluorescencia de células vivas de células HeLa y células 4T1 después de 1 h de incubación con 3 μM FITC-R8 y FITC-sR8-4. FITC (verde), Hoechst (azul). Barra de escala = 20 μm. (B) Fluorescencia media relativa (con respecto al péptido lineal R8), media ± s.d., y n = 3; (C) Penetración de célula a célula de FITC-R8 y FITC-sR8-4 en un modelo transwell utilizando células HeLa. Imágenes de microscopía de fluorescencia de células vivas (barra de escala = 20 μm) y fluorescencia media relativa (con respecto al péptido lineal R8), media ± s.d., y n = 3. ** P < 0,01, *** P < 0,001. Esta figura ha sido modificada de Shi et al.15. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La estabilización química de péptidos mediante la incorporación de restricciones conformacionales ha demostrado ser una estrategia eficaz para mejorar la estabilidad y permeabilidad celular del péptido26. En este protocolo, se describe un procedimiento paso a paso para la síntesis de CPP cíclicos con enlaces cruzados aromáticos y la evaluación de su permeabilidad a través de barreras biológicas. En comparación con los enlaces cruzados hidrofílicos lactámicos o triazoles22,27, la incorporación de enlaces cruzados aromáticos (utilizados en este estudio) mejora la hidrofobicidad general de los CPP, aumentando significativamente su permeabilidad celular. Por otro lado, la ciclación peptídica se puede lograr fácilmente a través de reacciones de sustitución con cisteínas sin requerir ningún catalizador metálico. En este protocolo, la ciclación de los CPPs se realizó sobre resina; Sin embargo, la eficiencia de ciclación también depende de las secuencias y longitudes específicas de los péptidos debido a los efectos estéricos, que pueden resultar en la formación de un subproducto dimérico28. En tal caso, sería útil usar una resina con una capacidad de carga menor. Además, también se recomienda ciclar estos péptidos específicos bajo concentraciones diluidas en la fasede solución 29.
Hay algunos puntos críticos en este protocolo. En primer lugar, el cóctel de escisión TFA/TIS/EDT/H 2 O (92.5/2.5/2.5/2.5, v/v/v/v) se utiliza para la escisión de péptidos que contienen cisteína para prevenir la oxidación del grupo sulfhidrilo. En segundo lugar, se sugiere realizar un estudio preliminar a pequeña escala para obtener la condición de escisión adecuada. El tiempo óptimo requerido para escindir los péptidos de la resina es de 2-3 h, con un tiempo de escisión más largo (más de 5 h) que tiende a producir más subproductos no identificados. La síntesis de péptidos podría ser monitoreada por LC-MS para optimizar el tiempo de escisión. En tercer lugar, el etiquetado de FITC debe hacerse en la oscuridad para evitar el enfriamiento de la fluorescencia.
Además, el azul de tripano debe usarse para apagar la fluorescencia ligada a la superficie, ya que el análisis de citometría de flujo no puede distinguir la fluorescencia intracelular o ligada a la superficie. Esto ayudará a cuantificar específicamente el péptido internalizado por las células cancerosas27. Además, como los péptidos catiónicos también pueden causar lisis de membrana no específica30, la actividad hemolítica y la viabilidad celular también podrían llevarse a cabo para evaluar la toxicidad de los CPP cíclicos.
Los CPP cíclicos constituyen uno de los vehículos eficaces de administración de fármacos para conquistar las barreras biológicas. Sin embargo, la interacción de la membrana y la perturbación de las CPP catiónicas generalmente conducen a una posible citotoxicidad no específica31. Se dedicarán más esfuerzos a comprender el mecanismo de penetración detallado, que debería ayudar al descubrimiento de la próxima generación de CPP cíclicos para penetrar las barreras biológicas con una citotoxicidad mínima. Estos CPP altamente activos y estables son muy prometedores para mejorar el tratamiento de enfermedades importantes que amenazan la vida.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo cuenta con el apoyo de la Fundación de Ciencias Naturales de China (21708031), la Fundación de Ciencias Postdoctorales de China (BX20180264, 2018M643519) y los Fondos de Investigación Fundamental para las Universidades Centrales (2682021ZTPY075).
Materiales
| Name | Company | Catalog Number | Comments |
| 1,2-ethanedithiol | Aladdin | K1722093 | stench |
| 2-(7-Azobenzotriazole)-N,N,N',N'-tetramethyluronium hexafluorophosphate (HATU) | HEOWNS | A-0443697 | |
| 4,4'-bis(bromomethyl)biphenyl | TCI | B1921 | |
| 4T1 cells | ATCC | 4T1 cells were cultured in DMEM medium supplemented with 10% FBS (Hyclone) in a 37 °C humidified incubator containing 5% CO2. | |
| Acetonitrile | Adamas | 1484971 | toxicity |
| Dichloromethane | Energy | W330229 | skin harmful |
| Diethyl ether | Aldrich | 673811 | flammable |
| Dimethyl sulfoxide | Beyotime | ST038 | skin harmful |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | ||
| Electrospray Ionization Mass Spectrometer | Waters | G2-S Tof | |
| Ethylene Diamine Tetraacetic Acid (EDTA) | BioFroxx | 1340 | |
| Fetal bovine serum (FBS) | HyClone | ||
| Flow cytometer | Beckman Coulter | CytoFLEX | |
| Fluorescein isothiocyanate isomer (FITC) | Energy | E0801812500 | |
| Fluorescent microscope | Carl Zeiss | Axio Observer 7 | |
| Fmoc-Arg(Pbf)-OH | HEOWNS | F-81070 | |
| Fmoc-Cys(Trt)-OH | GL Biochem | GLS201115-35202 | |
| Fmoc-βAla-OH | Adamas | 51341C | |
| HeLa cells | ATCC | HeLa cells were cultured in DMEM supplemented with 10% FBS (Hyclone) in a 37 °C humidified incubator containing 5% CO2. | |
| High-Performance Liquid Chromatography | Agilent | Agilent 1260 | |
| High-Performance Liquid Chromatography column | Agilent | Poroshell EC-C18 120, 4.6 × 150 mm (pore size 120 Å, particle size 4 μm) | |
| Lyophilizer | SP Scientific | Vir Tis | |
| Methanol | Aldrich | 9758 | toxicity |
| Microtiter plate | Thermo μdrop plate | N12391 | |
| Morpholine | HEOWNS | M99040 | irritant |
| Multi-technology microplate reader | Thermo | VARIOSKAN LUX | |
| N,N-Diisopropylethylamine | HEOWNS | E-81416 | irritant |
| N,N-Dimethyl formamide | Energy | B020051 | harmful to skin |
| Poly-Prep column | Bio-Rad | 7321010 | polypropylene chromatography columns |
| Rink Amide MBHA resin (0.572 mmol/g) | GL Biochem | GLS180301-49101 | |
| Three-way stopcocks | Bio-Rad | 7328107 | |
| Tissue culture plate insert | LABSELECT | 14211 | |
| Trifluoroacetic acid | HEOWNS | T63278 | corrosive |
| Triisopropylsilane | HEOWNS | T-0284475 | |
| Trypsin | BioFroxx | 1004 | |
| Vacuum manifold | Promega | A7231 |
Referencias
- Zhang, L., et al. Brain-targeted dual site-selective functionalized poly(β-amino esters) delivery platform for nerve regeneration. Nano Letters. 21 (7), 3007-3015 (2021).
- Park, T. E., et al. Enhanced BBB permeability of osmotically active poly(mannitol-co-PEI) modified with rabies virus glycoprotein via selective stimulation of caveolar endocytosis for RNAi therapeutics in Alzheimer's disease. Biomaterials. 38, 61-71 (2015).
- Bian, J., et al. Effect of cell-based intercellular delivery of transcription factor GATA4 on ischemic cardiomyopathy. Circulation Research. 100 (11), 1626-1633 (2007).
- He, H., et al. The use of low molecular weight protamine chemical chimera to enhance monomeric insulin intestinal absorption. Biomaterials. 34 (31), 7733-7743 (2013).
- Kim, D., et al. A specific STAT3-binding peptide exerts antiproliferative effects and antitumor activity by inhibiting STAT3 phosphorylation and signaling. Cancer Research. 74 (8), 2144-2151 (2014).
- Yang, Y., et al. PEGylated liposomes with NGR ligand and heat-activable cell-penetrating peptide-doxorubicin conjugate for tumor-specific therapy. Biomaterials. 35 (14), 4368-4381 (2014).
- Wei, Y., et al. Intracellular paclitaxel delivery facilitated by a dual-functional CPP with a hydrophobic hairpin tail. ACS Applied Materials and Interfaces. 13 (4), 4853-4860 (2021).
- Vasan, N., Baselga, J., Hyman, D. M. A view on drug resistance in cancer. Nature. 575 (7782), 299-309 (2019).
- Cong, Y., et al. Microenvironment-induced in situ self-assembly of polymer-peptide conjugates that attack solid tumors deeply. Angewandte Chemie International Edition. 131 (14), 4680-4685 (2019).
- Blanco, E., Shen, H., Ferrari, M. Principles of nanoparticle design for overcoming biological barriers to drug delivery. Nature Biotechnology. 33 (9), 941-951 (2015).
- Tian, Y., Zhou, S. Advances in cell-penetrating peptides and their functionalization of polymeric nanoplatforms for drug delivery. Wiley Interdisciplinary Reviews. Nanomedicine and Nanobiotechnology. 13 (2), 1-12 (2021).
- Milletti, F. Cell-penetrating peptides: Classes, origin, and current landscape. Drug Discovery Today. 17 (15-16), 850-860 (2012).
- Turner, J. J., et al. Cell-penetrating peptide conjugates of peptide nucleic acids (PNA) as inhibitors of HIV-1 Tat-dependent trans-activation in cells. Nucleic Acids Research. 33 (21), 6837-6849 (2005).
- Tunnemann, G., et al. Live-cell analysis of cell penetration ability and toxicity of oligo-arginines. Journal of Peptide Science. 14 (4), 469-476 (2008).
- Shi, M., et al. Stapling of short cell-penetrating peptides for enhanced tumor cell-and-tissue dual-penetration. Chemical Communications. 58 (14), 2299-2302 (2022).
- Komin, A., et al. A peptide for transcellular cargo delivery: Structure-function relationship and mechanism of action. Journal of Controlled Release. 324, 633-643 (2020).
- Dietrich, L., et al. Cell permeable stapled peptide inhibitor of Wnt signaling that targets β-catenin protein-protein interactions. Cell Chemical Biology. 24 (8), 958-968 (2017).
- Tian, Y., et al. Stapling of unprotected helical peptides via photo-induced intramolecular thiol-yne hydrothiolation. Chemical Science. 7 (5), 3325-3330 (2016).
- De Araujo, A. D., et al. Comparative α-helicity of cyclic pentapeptides in water. Angewandte Chemie International Edition. 53 (27), 6965-6969 (2014).
- Chu, Q., et al. Towards understanding cell penetration by stapled peptides. Medicinal Chemistry Communications. 6 (1), 111-119 (2015).
- Bock, J. E., Gavenonis, J., Kritzer, J. A. Getting in shape: Controlling peptide bioactivity and bioavailability using conformational constraints. ACS Chemical Biology. 8 (3), 488-499 (2013).
- Tian, Y., et al. Effect of stapling architecture on physiochemical properties and cell permeability of stapled α-helical peptides: A comparative study. ChemBioChem. 18 (21), 2087-2093 (2017).
- White, C. J., Yudin, A. K. Contemporary strategies for peptide macrocyclization. Nature Chemistry. 3 (7), 509-524 (2011).
- Jain, R. K. Normalization of tumor vasculature: An emerging concept in antiangiogenic therapy. Science. 307 (5706), 58-62 (2005).
- Patgiri, A., Menzenski, M. Z., Mahon, A. B., Arora, P. S. Solid-phase synthesis of short α-helices stabilized by the hydrogen bond surrogate approach. Nature Protocols. 5 (11), 1857-1865 (2010).
- Baek, S., et al. Structure of the stapled p53 peptide bound to Mdm2. Journal of the American Chemical Society. 134 (1), 103-106 (2012).
- Traboulsi, H., et al. Macrocyclic cell penetrating peptides: A study of structure-penetration properties. Bioconjugate Chemistry. 26 (3), 405-411 (2015).
- Tian, Y., et al. A proline-derived transannular N-cap for nucleation of short α-helical peptides. Chemical Communications. 52 (59), 9275-9278 (2016).
- Muppidi, A., et al. Rational design of proteolytically stable, cell-permeable peptide-based selective Mcl-1 inhibitors. Journal of the American Chemical Society. 134 (36), 14734-14737 (2012).
- Wiradharma, N., et al. Synthetic cationic amphiphilic α-helical peptides as antimicrobial agents. Biomaterials. 32 (8), 2204-2212 (2011).
- Jones, A. T., Sayers, E. J. Cell entry of cell penetrating peptides: Tales of tails wagging dogs. Journal of Controlled Release. 161 (2), 582-591 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados