Method Article
Konstruktion zyklischer zellpenetrierender Peptide zur verbesserten Durchdringung biologischer Barrieren
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Synthese von zyklischen zellpenetrierenden Peptiden mit aromatischen Querverbindungen und die Bewertung ihrer Permeabilität über biologische Barrieren hinweg.
Zusammenfassung
Krebs ist eine große Herausforderung für die globale Gesundheit. Die komplexe Mikroumgebung des Tumors schränkt jedoch im Allgemeinen den Zugang von Therapeutika zu tieferen Tumorzellen ein, was zu einem Tumorrezidiv führt. Um die begrenzte Durchdringung biologischer Barrieren zu überwinden, wurden zellpenetrierende Peptide (CPPs) mit ausgezeichneter Membrantranslokationsfähigkeit entdeckt und haben sich als nützliche molekulare Transporter für den Transport verschiedener Frachten in Zellen erwiesen. Konventionelle lineare CPPs weisen jedoch im Allgemeinen eine beeinträchtigte proteolytische Stabilität auf, was ihre Permeabilität über biologische Barrieren hinweg einschränkt. Daher ist die Entwicklung neuartiger molekularer Transporter, die biologische Barrieren durchdringen können und eine verbesserte proteolytische Stabilität aufweisen, sehr wünschenswert, um die Effizienz der Wirkstoffabgabe in biomedizinischen Anwendungen zu fördern. Wir haben zuvor eine Reihe von kurzen zyklischen CPPs mit aromatischen Vernetzungen synthetisiert, die im Vergleich zu ihren linearen Gegenstücken eine überlegene Permeabilität in Krebszellen und -geweben aufwiesen. In dieser Arbeit wird ein prägnantes Protokoll für die Synthese des fluoreszenzmarkierten zyklischen Polyarginin-R8-Peptids und seines linearen Gegenstücks sowie wichtige Schritte zur Untersuchung ihrer Zellpermeabilität beschrieben.
Einleitung
In den letzten Jahrzehnten gab es rasante Fortschritte bei der Entwicklung von zellpenetrierenden Peptiden (CPPs) für die Verabreichung von Medikamenten. CPPs werden häufig als molekulare Transporter zur Behandlung einer Reihe von lebensbedrohlichen Krankheiten eingesetzt, darunter neurologische Erkrankungen1,2, Herzerkrankungen3, Diabetes4, Dermatose5 und Krebs 6,7. Krebs ist nach wie vor eine globale Gesundheitsbelastung, die mit einer hohen Morbiditäts- und Mortalitätsrate einhergeht, trotz breit angelegter Forschungsbemühungen8. Ein ernsthaftes Hindernis für die Behandlung von Krebs ist der eingeschränkte Zugang von Therapeutika zu tieferen Tumorzellen aufgrund physiologischer Barrieren wie der kompakten extrazellulären Matrix (EZM), abnormen Tumorgefäßen, multiplen Membranbarrieren und hohem interstitiellen Flüssigkeitsdruck (IFP)9. Daher wird die Entwicklung neuartiger CPPs mit überlegener Fähigkeit, Ladungen über biologische Barrieren hinweg zu transportieren, als eine wesentliche Strategie für die Krebsbehandlung angesehen10,11.
CPPs können hinsichtlich ihrer physikalisch-chemischen Eigenschaften in kationische, amphipathische und hydrophobe CPPs eingeteilt werden12. Unter diesen sind das positiv geladene HIV-TAT-Peptid und das synthetische Polyarginin von erheblicher Bedeutung in der biomedizinischen Forschung und wurden ausgiebig untersucht, um die intrazelluläre Wirkstoffverabreichung zu erleichtern13. Tunnemann et al. berichteten, dass eine Mindestlänge von acht Argininen für eine effiziente Zellpenetration der synthetischen Polyarginin-Peptide unerlässlich ist, basierend auf einer Zellpermeabilitätsstudie, die mit R3- bis R12-Peptiden durchgeführt wurde14. Diese CPPs haben jedoch aufgrund ihrer schnellen Hydrolyse in vivo in der Regel kurze Plasmahalbwertszeiten. Darüber hinaus ist wenig über die Optimierung der chemischen Struktur von CPPs bekannt, um ihre Transbarrierefähigkeit zu erhöhen, da es schwierig ist, mehrere Zellmembranen zu durchdringen15. Daher ist die Entwicklung neuartiger molekularer Transporter, die in der Lage sind, biologische Barrieren zu durchdringen, dringend erwünscht, um die Effizienz der Wirkstoffabgabe zu verbessern. Im Jahr 2020 entdeckten Komin et al.16 ein CPP namens CL-Peptid, das ein Helix-Motiv (RLLRLLR) und einen Polyarginin-Schwanz (R7) zur Durchquerung der Epithel-Monoschicht enthält. Eine Reihe von CL-Peptidvarianten wurde ebenfalls synthetisiert, indem das helikale Muster verändert wurde. Diese Erkundung könnte ein wichtiger Leitfaden für die Entwicklung neuartiger CPPs für die Lieferung von Ladungen über biologische Barrieren hinweg sein. Darüber hinaus optimierten Dietrich et al. die Zellpermeabilität des StAX-Peptids, indem sie den Wnt/β-Catenin-Signalweg hemmten, indem sie die Gesamthydrophobie der Peptide erhöhten17.
Die Konformationsrestriktion von unstrukturierten linearen Peptiden durch Cyclisierung ist ein effektiver Weg, um ihre proteolytische Stabilität und Permeabilität zu verbessern18,19,20. Die strukturelle Verstärkung erhöht die Proteaseresistenz zyklischer Peptide und macht sie in vivo im Vergleich zu ihren linearen Gegenstücken stabiler. Darüber hinaus kann die Cyclisierung von Peptiden potenziell das polare Peptidrückgrat maskieren, indem sie intramolekulare Wasserstoffbrückenbindungen fördert und so die Membranpermeabilität der Peptide21 erhöht. In den letzten zwei Jahrzehnten haben sich chemoselektive Cyclisierungsmethoden zu effektiven Strategien für die Konstruktion zyklischer Peptide mit unterschiedlichen Architekturen entwickelt, wie z. B. reiner Kohlenwasserstoff, Lactam, Triazol, m-Xylol, Perfluoraryl und anderen Querverbindungen22,23. Die biologische Barriere, die durch die ausgeklügelte Tumormikroumgebung auferlegt wird, könnte das Eindringen von Medikamenten in solide Tumore verringern24. Wir haben bereits festgestellt, dass die zyklischen CPPs eine überlegene Resistenz gegen enzymatische Verdauung aufwiesen als ihre linearen Gegenstücke20. Darüber hinaus ist die Gesamthydrophobie der Peptide entscheidend für ihre verbesserte Zellpermeabilität22. Basierend auf den oben diskutierten Studien kann die Hypothese aufgestellt werden, dass die Kombination aus einem positiv geladenen Muster, einer erhöhten Gesamthydrophobie und einer verbesserten Proteolysestabilität die Permeabilität von CPPs über biologische Barrieren hinweg erhöht. In einer kürzlich durchgeführten Studie haben wir zwei zyklische CPPs mit aromatischen Vernetzungen an den Positionen i und i+7 identifiziert, die im Vergleich zu ihren linearen Gegenstücken eine verbesserte Permeabilität in Tumorzellen und -geweben aufweisen15. In dieser Arbeit werden ein prägnantes Syntheseprotokoll für die Synthese fluoreszenzmarkierter zyklischer CPPs und die wichtigsten Schritte zur Untersuchung ihrer Permeabilität vorgestellt.
Protokoll
1. Vorbereitung der Ausrüstung
Anmerkungen: Führen Sie alle Vorgänge in einem Betriebsabzug mit geeigneter persönlicher Schutzausrüstung durch.
- Montieren Sie die manuelle Peptidsynthesevorrichtung im Abzug (Abbildung 1). Setzen Sie die Dreiwegehähne (siehe Materialtabelle) auf den Vakuumverteiler (siehe Materialtabelle) und schließen Sie sie an den Stickstoff (N2) an. Stellen Sie sicher, dass Sie die ungenutzten Einlässe verschließen.
- Befestigen Sie eine 10-ml-Polypropylensäule (siehe Materialtabelle) an den Dreiwegehähnen. Lassen Sie das Reaktionsgemisch oder die Lösungsmittel mit einem Gummipipettenkolben oder einem Vakuum über einen Abfallabscheider aus der Polypropylensäule ab.
2. Synthese von FITC-markiertem linearem R8-Peptid (FITC-R8) und FITC-markiertem geklammertem R8-Peptid (FITC-sR8-4)
HINWEIS: Die Peptide wurden gemäß einem Standardprotokoll der Fmoc-basierten Festphasenpeptidsynthese (SPPS) synthetisiert25. Das 4-(2',4'-Dimethoxypheyl-Fmoc-aminomethyl)-phenoxyacetamido-norleucyl-MBHA-Harz (Rink-Amid-MBHA-Harz, siehe Materialtabelle) wurde während der gesamten Studie verwendet.
VORSICHT: N, N-Dimethylformamid (DMF), N, N-Diisopropylethylamin (DIPEA), Morpholin und Dichlormethan (DCM) sind alle farblos und schädlich, wenn sie eingeatmet oder über die Haut aufgenommen werden. Äther ist hochentzündlich. 1,2-Ethanedithiol (EDT) ist eine besonders geruchsintensive Substanz. Trifluoressigsäure (TFA) ist stark korrosiv und ihr Säuregehalt ist 10 bis5 Mal so hoch wie der von Essigsäure. Folglich sollten alle Reagenzien und Chemikalien mit Schutzausrüstung in einem Abzug behandelt werden.
- Bereiten Sie das Harz für die Peptidsynthese vor.
- Berechnen Sie die für die Synthese benötigte Harzmasse:Masse des Harzes (mg) = Zunder (mmol) / Harzbeladungskapazität (mmol/g) × 1.000 (mg/g)
HINWEIS: Zum Beispiel die Masse des Eisbahnamid-MBHA-Harzes (0,572 mmol/g) für 0,2 mmol = 0,2 mmol / 0,572 mmol/g × 1.000 mg/g = 350 mg. - Fügen Sie 4-5 ml DMF zur erforderlichen Menge Harz hinzu und geben Sie es in die 10-ml-Polypropylensäule (Schritt 1.2), wobei N2 30 Minuten lang sanft sprudelt, um das Harz ausreichend aufzuquellen, und lassen Sie dann das ZMS ab.
- Fügen Sie dem Harz 4-5 ml 50% Morpholin/DMF (v/v) hinzu, blasen Sie N2 30 Minuten lang 2x lang sanft auf, um die N-terminale Fmoc-Gruppe zu entfernen, und lassen Sie die Mischung dann abtropfen. Waschen Sie das Harz anschließend 3x gründlich, indem Sie 4-5 ml DMF in die Säule geben und jedes Mal mindestens 1 Minute lang mit N2 sprudeln. Waschen Sie das Harz weiterhin mit DCM (3x) und DMF (3x) auf die gleiche Weise.
- Berechnen Sie die für die Synthese benötigte Harzmasse:Masse des Harzes (mg) = Zunder (mmol) / Harzbeladungskapazität (mmol/g) × 1.000 (mg/g)
- Führen Sie die Fmoc-geschützte Aminosäurekopplung wie unten beschrieben durch.
HINWEIS: Die Kopplung von Arginin in einer manuellen Synthese im 0,2-mmol-Maßstab wird hier als Beispiel beschrieben.- Fmoc-Arg (Pbf)-OH (5-Äquiv., 648,8 mg) und 2-(7-Azobenzotriazol)-N, N, N', N'-Tetramethyluroniumhexafluorophosphat (HATU, 4,9 Äquivalent, 372,6 mg) in 5 ml DMF in einem Zentrifugenröhrchen lösen.
- Zur Aktivierung der Kupplungsreaktion wird DIPEA (entspricht 10, 348,4 μl) zugegeben und dann das Reaktionsgemisch mit Harz in die 10-ml-Polypropylensäule überführt (hergestellt in Schritt 2.1.3). Dann rühren Sie die Mischung vorsichtig mitN2-Sprudel für 1-2 h.
- Die Kupplungsreaktion (Schritt 2.2.1 und Schritt 2.2.2) einmal wiederholen.
- Nach Abschluss der Kopplung das Reaktionsgemisch abtropfen lassen und das Harz nacheinander mit DMF, DCM und DMF jeweils 3x für jeweils mindestens 1 min waschen.
- Führen Sie die Kopplung jeder Aminosäure in geordneten Schritten durch: Fügen Sie dem Harz 4-5 ml 50% Morpholin/DMF (v/v) hinzu, sprudeln Sie 30 Minuten lang 2x vorsichtig mitN2, um die N α-Fmoc-Gruppe zu entfernen, waschen Sie dann das Harz (wie in Schritt 2.2.4 gezeigt) und fahren Sie mit der Kopplung der nächsten Aminosäure fort (wie in Schritt 2.2.1 und Schritt 2.2.2 gezeigt). Fahren Sie mit mehreren Zyklen dieses Schritts fort, um die Synthese des gewünschten Peptids zu erreichen.
HINWEIS: Dieser Vorgang kann hier pausiert werden. Kondensieren Sie das Harz mit Methanol und trocknen Sie das Harz mit einem kontinuierlichen Fluss von N2. Verschließen Sie die Polypropylensäule und lagern Sie das Harz dann einige Tage bei 4 °C (oder bei −20 °C bei längerer Lagerung). Quellt das Harz mit 4-5 ml DMF für 0,5-1 h auf, bevor eine neue Synthese beginnt. Wenn Sie direkt mit dem nächsten Schritt fortfahren, ist es nicht erforderlich, das Harz zu kondensieren.
- Markieren Sie die Peptide wie unten beschrieben mit Fluoresceinisothiocyanat (FITC).
- Koppeln Sie das Beta-Alanin als Abstandshalter für die FITC-Markierung mit dem gleichen Verfahren wie bei der Aminosäurekopplung in Schritt 2.2.
- Führen Sie eine FITC-Markierung von Peptiden auf dem Harz durch, indem Sie eine Mischung aus FITC (5 Äquiv.), DIPEA (10 Äquiv.) und DMF in die Polypropylensäule geben und 8 Stunden lang im Dunkeln reagieren.
- Für die Synthese von FITC-sR8-4 wird die Cyclisierung des linearen Peptids wie unten beschrieben durchgeführt.
- Geben Sie eine Mischung aus TFA/Triisopropylsilan (TIS)/DCM (3/5/92, v/v/v) für 2 Minuten in die Polypropylensäule, um die Cys (Trt)-Schutzgruppe selektiv zu entfernen, und lassen Sie die Mischung dann ab. Wiederholen Sie den obigen Vorgang, bis die gelbliche Lösung farblos wird, um die Trt-Schutzgruppe vollständig zu entfernen.
- Führen Sie anschließend mindestens 3x sequentielle Waschvorgänge des Harzes mit DMF und DCM durch. Danach 4,4'-Bis(brommethyl)biphenyl (2 Äquiv.) in DMF mit DIPEA (4 Äquiv.) lösen, in die Säule geben und 4 h reagieren.
- Spalten Sie die Peptide wie beschrieben: Waschen Sie das Harz nach Abschluss der Peptidsynthese zweimal zweimal für 5 min mit 4-5 mL Methanol und trocknen Sie es mit einem kontinuierlichen Fluss von N2. Behandeln Sie das Harz mit einem wirksamen Spaltcocktail TFA/TIS/H 2 O (95/2,5/2,5, v/v/v) oder TFA/TIS/EDT/H 2 O (92,5/2,5/2,5/2,5, v/v/v/v) für Cysteinhaltige Peptide, wobei Sie etwa 1 ml Spaltcocktail pro 100 mg Harz verwenden. Behandeln Sie das peptidgebundene Harz 2-3 h lang, um das Peptid zu spalten, und entfernen Sie dann das TFA vorsichtig mit einem Strom vonN2.
- Um die rohen Peptide zu erhalten, werden 4-5 ml Diethylether in die gespaltene Peptidzubereitung gegeben, um die rohen Peptide auszufällen, und bei 10.000 × g für 4 min zentrifugiert. Entsorgen Sie den Überstand vorsichtig und lassen Sie das Peptid 3 Minuten lang in einem wirksamen Abzug an der Luft trocknen.
- Analyse der Peptide: Lösen Sie ein rohes Peptid in kleinem Maßstab (gespalten aus ca. 10 mg peptidgebundenem Harz) in 800 μl Acetonitril (ACN)/H2O (1/1, v/v) und analysieren Sie es anschließend mittels Umkehrphasen-Hochleistungsflüssigkeitschromatographie (RP-HPLC) und Flüssigkeitschromatographie-Massenspektrometrie (LC-MS) (siehe Materialtabelle).
- Aufreinigung der Peptide mittels RP-HPLC und LC-MS.
- Lösen Sie 50 mg Rohpeptidprodukt in 4 ml ACN/H2O(1/1, v/v) auf und injizieren Sie die Lösung in ein RP-HPLC-System, das mit einer C18-Säule ausgestattet ist (4,6 mm x 150 mm, Porengröße: 120 Å, Partikelgröße: 4 μm; siehe Materialtabelle). Das Peptid wird mit einer mobilen Phase eluiert, die 0,1 % TFA/H2O (v/v) und ACN enthält, mit einem Gradienten von 10 % bis 90 % ACN über 30 Minuten. Konventionelle Peptide wurden bei 220 nm und FITC-markierte Peptide bei 494 nm detektiert.
- Sammeln Sie die Fraktionen, die dem Hauptpeptidpeak entsprechen, wie er durch MS identifiziert wurde, und lyophilisieren Sie dann die gewünschten Peptidfraktionen. Lagern Sie das gereinigte Peptid bei −20 °C.
HINWEIS: Die gefundenen m/z des gereinigten FITC-R8 lauten wie folgt: [M + 3 H]3+: 576,63; [M + 4 H] 4+: 432,72; [M + 5 H] 5+: 346,39; [M + 6 H] 6+: 288,85. Die gefundenen m/z des gereinigten FITC-sR8-4 lauten wie folgt: [M + 3 H]3+: 704.74; [M + 4 H] 4+: 528,77; [M + 5 H] 5+: 423,34; [M + 6 H] 6+: 352,91. MS-Analysebedingungen: Instrument: ESI (Sondenvorspannung: +4,5 kV; Detektor: 1,2 kV); Gasdurchfluss des Verneblers: 1,5 l/min; gekrümmte Desolvationslinie (CDL): −20 V; CDL-Temperatur: 250 °C; Blocktemperatur: 400 °C; Flussrate: 0,2 ml/min; mobile Phase: 50 % H2O/50 % ACN.
3. Quantifizierung der FITC-markierten Peptide
- Lösen Sie eine kleine Menge des gereinigten Peptids in DMSO als Stammlösung (z. B. 40 μmol/ml).
- Messen Sie die Absorption bei 494 nm (A 494) von 2 μl der Stammlösung in498 μl 10 mM phosphatgepufferter Kochsalzlösung (1x PBS, pH 7,4) mit einer Mikrotiterplatte (siehe Materialtabelle) unter Verwendung eines Multitechnologie-Mikroplatten-Readers (siehe Materialtabelle). Der Verdünnungsfaktor beträgt 500 μL/ 2 μL = 250, und die Weglänge der Mikrotiterplatte beträgt 0,5 mm.
- Berechnen Sie die Konzentration der Stammlösung mit der folgenden Formel:
Konzentration (mM) = A494 × Verdünnungsfaktor / 0,05 (cm) / 77.000 (cm−1· M−1) × 1.000 (mM·M−1) - Stellen Sie eine angemessene Verdünnung ein, so dass der gemessene A494-Wert zwischen 0,1 und 1,0 liegt.
Anmerkungen: Die Messungen sollten mehrmals wiederholt werden, um sicherzustellen, dass die gemessene Konzentration genau ist. Der Extinktionskoeffizient von 77.000 cm−1· M−1 geht aus der FITC-Gruppe hervor.
4. Stabilität von Peptiden im fötalen Kälberserum (FBS)
- Inkubieren Sie das Peptid in einer Konzentration von 100 μM mit 250 μL 25% FBS/H2O(v/v) bei 37 °C. Nach einer Inkubationszeit von 0 h, 1 h, 2 h und 4 h werden 10 μl Aliquots entnommen und dann 150 μl 12%ige Trichloressigsäure, gelöst inH2O/ACN (1/3, v/v), hinzugefügt, um die Serumproteine auszufällen.
- Zentrifugieren Sie die Proben bei 10.000 × g für 5 min und analysieren Sie den Überstand mittels HPLC (wie in Schritt 2.8 beschrieben), um das Ausmaß des Peptidabbaus zu bestimmen.
- Berechnen Sie das Verhältnis der Peakfläche bei 1 h, 2 h und 4 h zu dem bei 0 h, um den Anteil des nicht abgebauten Peptids zum entsprechenden Zeitpunkt zu erhalten. Das Ergebnis ist der Durchschnitt von drei parallelen Stichproben.
5. Zelluläre Aufnahme der Peptide
- Fluoreszenzmikroskopische Bildgebung
- Legen Sie ein rundes Deckglas in eine 12-Well-Platte. Dann 1 x 105 Zellen gleichmäßig auf Deckgläser beimpfen und über Nacht mit 2 ml Medium kultivieren. Entfernen Sie das Medium und waschen Sie die Zellen 3x mit 1 ml PBS.
HINWEIS: In dieser Studie wurden HeLa-Zellen und 4T1-Zellen in Dulbeccos modifiziertem Eagle-Medium (DMEM, siehe Materialtabelle) kultiviert, das mit 10 % FBS in einem bei 37 °C befeuchteten Inkubator mit 5 % CO2 ergänzt wurde. - Inkubieren Sie die Zellen mit 1 ml 3 μM FITC-markierten Peptiden in FBS-freiem DMEM für 1 h bei 37 °C. Entfernen Sie anschließend das peptidhaltige Medium und waschen Sie die Zellen 3x mit 1 ml PBS.
- Die Zellen mit 1 ml Hoechst 33258 für 15 min anfärben. Beobachten Sie die Internalisierung jedes Peptids mit einem Fluoreszenzmikroskop (siehe Materialtabelle) mit der gleichen Fluoreszenzintensität und Belichtungszeit.
HINWEIS: Die folgenden Einstellungen wurden für die Fluoreszenzmikroskopie verwendet. Objektiv: Plan-Apochromat: 63 x/1,40 Öl DIC M27; Kanal 1 für FITC: Anregungsfilter: 450-490 nm, Emissionsfilter: 500-550 nm, Belichtungszeit: 230 ms; Kanal 2 für Hoechst 33258: Anregungsfilter: 335-383 nm, Emissionsfilter: 420-470 nm, Belichtungszeit: 27 ms.
- Legen Sie ein rundes Deckglas in eine 12-Well-Platte. Dann 1 x 105 Zellen gleichmäßig auf Deckgläser beimpfen und über Nacht mit 2 ml Medium kultivieren. Entfernen Sie das Medium und waschen Sie die Zellen 3x mit 1 ml PBS.
- Durchflusszytometrische Analyse
- 5 x 105 HeLa-Zellen gleichmäßig in 12-Well-Platten beimpfen und 24 h bei 37 °C in DMEM kultivieren. Entfernen Sie anschließend das Medium und waschen Sie die Zellen 3x mit 1 ml PBS.
- Inkubieren Sie die Zellen mit 1 ml 3 μM FITC-markierten Peptiden in FBS-freiem DMEM für 1 h bei 37 °C. Entfernen Sie das peptidhaltige Medium, dissoziieren Sie die Zellen mit 0,25 % (w/v) Trypsin und 0,53 mM EDTA in PBS für 5 min und sammeln Sie die Zellen dann durch Zentrifugation bei 306 × g für 4 min. Waschen Sie das Zellpellet mit PBS.
- Inkubieren Sie die Zellen mit 1 ml 0,05 % (w/v) Trypanblau in PBS für 3 Minuten, um die oberflächengebundene Fluoreszenz zu löschen, und führen Sie eine quantitative Analyse der intrazellulären Fluoreszenz mit einem Durchflusszytometer durch (siehe Materialtabelle).
HINWEIS: Durchflusszytometrie-Einstellungen: Anregung: 488 nm, Emission: 530 nm. Trypanblau kann auch die Fluoreszenz abgestorbener Zellen unterdrücken und bei der Analyse der Peptidaufnahme helfen, lebende und tote Zellen zu unterscheiden. - Behandlung und Analyse von 4T1-Zellen mittels Durchflusszytometrie nach dem gleichen Protokoll wie bei HeLa-Zellen. Sammeln Sie 5 x 105 Zellen pro Probe und stellen Sie drei parallele Proben pro Gruppe auf.
6. Untersuchung der Zell-zu-Zell-Penetration der Peptide mit Hilfe von Transwell-Modellen
- Inokulieren Sie 1 x 10 5 HeLa-Zellen in 2 ml DMEM in einer 12-Well-Kammer mit einem Gewebekulturplatteneinsatz (siehe Materialtabelle) und inkubieren Sie sie 24 h lang in einem bei 37 °C befeuchteten Inkubator mit5 % CO2. Anschließend wird das Medium entnommen und die Zellen in den Kammern mit 1 mL 10 μM FITC-R8 oder FITC-sR8-4 (mittels HPLC gereinigt) in FBS-freiem DMEM für 1 h inkubiert.
- Entfernen Sie das Medium, das die Peptide enthält, und waschen Sie die Zellen 3x mit 1 ml PBS. Geben Sie 1 ml frisches FBS-freies DMEM in die Kammern und inkubieren Sie dann die HeLa-Zellen in der Kammer mit der Gewebekulturplatte für 2 h mit den HeLa-Zellen auf den runden Deckgläsern am Boden.
- Fixieren Sie die HeLa-Zellen mit 2,5 % Glutaraldehyd für 15 min auf den runden Deckgläsern und färben Sie die Zellen dann 15 min lang mit DAPI an. Beobachten Sie dann die HeLa-Zellen auf den Deckgläsern unter einem Fluoreszenzmikroskop. Behandeln und untersuchen Sie 4T1-Zellen mit dem gleichen Protokoll wie HeLa-Zellen.
Ergebnisse
In diesem Protokoll wurde ein Syntheseverfahren vorgestellt, um das lineare Polyarginin R8 in seine cyclische Form zu bringen. Die SPPS wurde manuell mit einer einfachen Apparatur durchgeführt (Abbildung 1). Der detaillierte Syntheseprozess von SPPS ist in Abbildung 2 dargestellt. Kurzzeitig war das Harz ausreichend aufgequollen, gefolgt von der Entschützung der N α-Fmoc-Schutzgruppe. Anschließend wurde die N α-Fmoc-geschützte Aminosäure bis zum Abschluss der Peptid-Assemblierung auf dem Harz verankert (Schritte 1-4 in Abbildung 2). Anschließend wurden die rohen Peptide durch den Spaltcocktail vom Harz abgespalten (Schritt 5 in Abbildung 2). FITC wurde verwendet, um die Peptide zu markieren, um fluoreszenzmarkierte zyklische CPPs zu synthetisieren und ihre Permeabilität über biologische Barrieren hinweg zu verfolgen. Anschließend wurden die Trityl-Schutzgruppen der Cysteine selektiv auf dem Harz degeschützt, gefolgt von einer Peptidcyclisierung mit 4,4'-Bis(brommethyl)biphenyl-Quervernetzung (Abbildung 3A). Die HPLC- und MS-Spektren von FITC-R8 und FITC-sR8-4 sind in Abbildung 3B dargestellt. Die Retentionszeit von FITC-sR8-4 war wesentlich länger als die des linearen Analogons, was auf eine erhöhte Gesamthydrophobie des Peptids nach der Cyclisierung mit der hydrophoben Vernetzung hinweist. Wie in Abbildung 3C gezeigt, blieb das zyklische R8 nach Inkubation mit 25 % FBS für 4 h zu 77,3 % intakt, während sein lineares Gegenstück größtenteils abgebaut wurde, was auf eine verbesserte proteolytische Stabilität des zyklischen R8-Peptids hindeutet. In den anschließenden zellbasierten Studien zeigten Zellen, die mit zyklischem R8 mit aromatischer Vernetzung behandelt wurden, eine höhere intrazelluläre Fluoreszenz als Zellen, die mit seinem linearen Gegenstück behandelt wurden, wie die Bildgebung mit Lebendzellfluoreszenzmikroskopie zeigte (Abbildung 4A). Ähnliche Ergebnisse wurden mit der durchflusszytometrischen Analyse erzielt (Abbildung 4B). Um weiter zu untersuchen, ob zyklisches R8 eine verbesserte Zell-zu-Zell-Penetration verleiht, wurden Transwell-Modelle verwendet, um die Barrierepermeabilität der Peptide von einer Zellschicht zur anderen zu simulieren. Das zyklische R8 zeigte deutlich eine höhere Transbarriere-Penetration als das lineare R8-Peptid, was durch eine signifikante Zunahme der intrazellulären Fluoreszenz angezeigt wird (Abbildung 4C). Zusammenfassend lässt sich sagen, dass das zyklische R8-Peptid eine überlegene Permeabilität über biologische Barrieren hinweg aufwies als sein lineares Gegenstück.

Abbildung 1: Geräteaufbau für die manuelle Peptidsyntheseapparatur. Eine 10-ml-Polypropylen-Säule wird mit einem Dreiwege-Absperrventil auf dem Vakuumverteiler aufgebaut. N2 wird zum Rühren verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Allgemeiner Ablauf der Fmoc-Festphasenpeptidsynthese (SPPS). Eine N α-Fmoc-geschützte Aminosäure wird an dem 4-(2',4'-Dimethoxypheyl-Fmoc-aminomethyl)-phenoxyacetamido-norleucyl-MBHA-Harz (Rink-Amid-MBHA-Harz) verankert (Schritt 1), gefolgt von der Entschützung der Nα-Fmoc-Schutzgruppen der Aminosäuren (Schritt 2) und anschließender Aminosäurekopplung (Schritt 3). Schritt 2 und Schritt 3 werden mehrmals wiederholt, um das gewünschte Peptid zu synthetisieren (Schritt 4). Nach Abschluss der Synthese wird ein Spaltcocktail hinzugefügt, um die Seitenkettenschutzgruppen zu entfernen und das gewünschte Peptid aus dem Harz zu spalten (Schritt 5). Abkürzungen: DMF = N,N-Dimethylformamid; DCM = Dichlormethan; HATU = 2-(7-Azobenzotriazol)-N, N, N', N'-Tetramethyluroniumhexafluorophosphat; DIPEA = N,N-Diisopropylethylamin; TFA = Trifluoressigsäure. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Synthese von FITC-markiertem linearem R8-Peptid (FITC-R8) und FITC-markiertem geklammertem R8-Peptid (FITC-sR8-4) mittels Festphasen-Peptidsynthese (SPPS). (A) Schematische Darstellung der Synthese von FITC-R8 und FITC-sR8-4. (B) HPLC- und MS-Spektren (Einschub) von FITC-R8 und FITC-sR8-4. (C) Stabilität von FITC-R8 und FITC-sR8-4 in Gegenwart von 25 % FBS. Intaktes Peptid (%) bezieht sich auf den Anteil des nicht abgebauten Peptids. Diese Zahl wurde von Shi et al.15 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
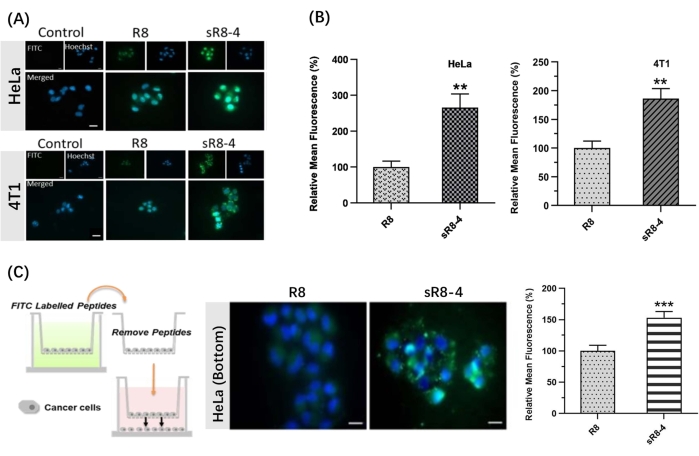
Abbildung 4: Penetration von FITC-markiertem linearem R8-Peptid (FITC-R8) und FITC-markiertem geklammertem R8-Peptid (FITC-sR8-4). (A) Lebendzell-Fluoreszenzmikroskopie-Aufnahmen von HeLa-Zellen und 4T1-Zellen nach 1-stündiger Inkubation mit 3 μM FITC-R8 und FITC-sR8-4. FITC (grün), Hoechst (blau). Maßstabsbalken = 20 μm. (B) Relative mittlere Fluoreszenz (in Bezug auf das lineare R8-Peptid), Mittelwert ± s.d. und n = 3; (C) Zell-zu-Zell-Penetration von FITC-R8 und FITC-sR8-4 in einem Transwell-Modell unter Verwendung von HeLa-Zellen. Lebendzell-Fluoreszenzmikroskopie-Bilder (Maßstabsbalken = 20 μm) und relative mittlere Fluoreszenz (in Bezug auf das lineare R8-Peptid), Mittelwert ± s.d. und n = 3. ** P < 0,01, *** P < 0,001. Diese Zahl wurde von Shi et al.15 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Die chemische Stabilisierung von Peptiden unter Einbeziehung von Konformationsbeschränkungen hat sich als effektive Strategie zur Verbesserung der Stabilität und Zellpermeabilität des Peptids26 erwiesen. In diesem Protokoll wird ein schrittweises Vorgehen für die Synthese zyklischer CPPs mit aromatischen Querverbindungen und die Bewertung ihrer Permeabilität über biologische Barrieren hinweg beschrieben. Im Vergleich zu den hydrophilen Lactam- oder Triazol-Quervernetzungen22,27 verbessert der Einbau aromatischer Quervernetzungen (die in dieser Studie verwendet wurden) die Gesamthydrophobie der CPPs, wodurch ihre Zellpermeabilität signifikant erhöht wird. Andererseits kann die Peptidcyclisierung leicht durch Substitutionsreaktionen mit Cysteinen erreicht werden, ohne dass Metallkatalysatoren erforderlich sind. In diesem Protokoll wurde die Cyclisierung der CPPs auf Harz durchgeführt; Die Cyclisierungseffizienz hängt jedoch auch von den spezifischen Sequenzen und Längen der Peptide aufgrund sterischer Effekte ab, die zur Bildung eines dimeren Nebenprodukts führen können28. In einem solchen Fall wäre die Verwendung eines Harzes mit geringerer Belastbarkeit hilfreich. Darüber hinaus wird auch empfohlen, diese spezifischen Peptide unter verdünnten Konzentrationen in der Lösungsphase29 zu cyclisieren.
Es gibt einige kritische Punkte in diesem Protokoll. Zunächst wird der Spaltcocktail TFA/TIS/EDT/H2 O (92,5/2,5/2,5/2,5, v/v/v/v) zur Spaltung von Cystein-haltigen Peptiden verwendet, um eine Oxidation der Sulfhydrylgruppe zu verhindern. Zweitens wird empfohlen, eine kleine Vorstudie durchzuführen, um die geeignete Spaltbedingung zu erhalten. Die optimale Zeit, die benötigt wird, um die Peptide aus dem Harz zu spalten, beträgt 2-3 Stunden, wobei eine längere Spaltzeit (mehr als 5 Stunden) dazu neigt, mehr nicht identifizierte Nebenprodukte zu produzieren. Die Peptidsynthese konnte mittels LC-MS überwacht werden, um die Spaltzeit zu optimieren. Drittens sollte die FITC-Markierung im Dunkeln erfolgen, um eine Fluoreszenzlöschung zu vermeiden.
Darüber hinaus sollte Trypanblau verwendet werden, um die oberflächengebundene Fluoreszenz zu löschen, da die Durchflusszytometrie intrazelluläre oder oberflächengebundene Fluoreszenz nicht unterscheiden kann. Dies wird dazu beitragen, das von den Krebszellen internalisierte Peptid spezifisch zu quantifizieren27. Da kationische Peptide auch eine unspezifische Membranlyse verursachen können30, könnten außerdem hämolytische Aktivität und Zellviabilität durchgeführt werden, um die Toxizität der zyklischen CPPs zu bewerten.
Zyklische CPPs stellen eines der effektivsten Vehikel zur Überwindung biologischer Barrieren dar. Die Membraninteraktion und die Störung kationischer CPPs führen jedoch im Allgemeinen zu einer potentiellen unspezifischen Zytotoxizität31. Weitere Anstrengungen werden unternommen, um den detaillierten Penetrationsmechanismus zu verstehen, der die Entdeckung der nächsten Generation zyklischer CPPs unterstützen sollte, um biologische Barrieren mit minimaler Zytotoxizität zu durchdringen. Diese hochaktiven und stabilen CPPs sind vielversprechend für die Verbesserung der Behandlung wichtiger lebensbedrohlicher Krankheiten.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wird von der Natural Science Foundation of China (21708031), der China Postdoctoral Science Foundation (BX20180264, 2018M643519) und den Fundamental Research Funds for the Central Universities (2682021ZTPY075) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1,2-ethanedithiol | Aladdin | K1722093 | stench |
| 2-(7-Azobenzotriazole)-N,N,N',N'-tetramethyluronium hexafluorophosphate (HATU) | HEOWNS | A-0443697 | |
| 4,4'-bis(bromomethyl)biphenyl | TCI | B1921 | |
| 4T1 cells | ATCC | 4T1 cells were cultured in DMEM medium supplemented with 10% FBS (Hyclone) in a 37 °C humidified incubator containing 5% CO2. | |
| Acetonitrile | Adamas | 1484971 | toxicity |
| Dichloromethane | Energy | W330229 | skin harmful |
| Diethyl ether | Aldrich | 673811 | flammable |
| Dimethyl sulfoxide | Beyotime | ST038 | skin harmful |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | ||
| Electrospray Ionization Mass Spectrometer | Waters | G2-S Tof | |
| Ethylene Diamine Tetraacetic Acid (EDTA) | BioFroxx | 1340 | |
| Fetal bovine serum (FBS) | HyClone | ||
| Flow cytometer | Beckman Coulter | CytoFLEX | |
| Fluorescein isothiocyanate isomer (FITC) | Energy | E0801812500 | |
| Fluorescent microscope | Carl Zeiss | Axio Observer 7 | |
| Fmoc-Arg(Pbf)-OH | HEOWNS | F-81070 | |
| Fmoc-Cys(Trt)-OH | GL Biochem | GLS201115-35202 | |
| Fmoc-βAla-OH | Adamas | 51341C | |
| HeLa cells | ATCC | HeLa cells were cultured in DMEM supplemented with 10% FBS (Hyclone) in a 37 °C humidified incubator containing 5% CO2. | |
| High-Performance Liquid Chromatography | Agilent | Agilent 1260 | |
| High-Performance Liquid Chromatography column | Agilent | Poroshell EC-C18 120, 4.6 × 150 mm (pore size 120 Å, particle size 4 μm) | |
| Lyophilizer | SP Scientific | Vir Tis | |
| Methanol | Aldrich | 9758 | toxicity |
| Microtiter plate | Thermo μdrop plate | N12391 | |
| Morpholine | HEOWNS | M99040 | irritant |
| Multi-technology microplate reader | Thermo | VARIOSKAN LUX | |
| N,N-Diisopropylethylamine | HEOWNS | E-81416 | irritant |
| N,N-Dimethyl formamide | Energy | B020051 | harmful to skin |
| Poly-Prep column | Bio-Rad | 7321010 | polypropylene chromatography columns |
| Rink Amide MBHA resin (0.572 mmol/g) | GL Biochem | GLS180301-49101 | |
| Three-way stopcocks | Bio-Rad | 7328107 | |
| Tissue culture plate insert | LABSELECT | 14211 | |
| Trifluoroacetic acid | HEOWNS | T63278 | corrosive |
| Triisopropylsilane | HEOWNS | T-0284475 | |
| Trypsin | BioFroxx | 1004 | |
| Vacuum manifold | Promega | A7231 |
Referenzen
- Zhang, L., et al. Brain-targeted dual site-selective functionalized poly(β-amino esters) delivery platform for nerve regeneration. Nano Letters. 21 (7), 3007-3015 (2021).
- Park, T. E., et al. Enhanced BBB permeability of osmotically active poly(mannitol-co-PEI) modified with rabies virus glycoprotein via selective stimulation of caveolar endocytosis for RNAi therapeutics in Alzheimer's disease. Biomaterials. 38, 61-71 (2015).
- Bian, J., et al. Effect of cell-based intercellular delivery of transcription factor GATA4 on ischemic cardiomyopathy. Circulation Research. 100 (11), 1626-1633 (2007).
- He, H., et al. The use of low molecular weight protamine chemical chimera to enhance monomeric insulin intestinal absorption. Biomaterials. 34 (31), 7733-7743 (2013).
- Kim, D., et al. A specific STAT3-binding peptide exerts antiproliferative effects and antitumor activity by inhibiting STAT3 phosphorylation and signaling. Cancer Research. 74 (8), 2144-2151 (2014).
- Yang, Y., et al. PEGylated liposomes with NGR ligand and heat-activable cell-penetrating peptide-doxorubicin conjugate for tumor-specific therapy. Biomaterials. 35 (14), 4368-4381 (2014).
- Wei, Y., et al. Intracellular paclitaxel delivery facilitated by a dual-functional CPP with a hydrophobic hairpin tail. ACS Applied Materials and Interfaces. 13 (4), 4853-4860 (2021).
- Vasan, N., Baselga, J., Hyman, D. M. A view on drug resistance in cancer. Nature. 575 (7782), 299-309 (2019).
- Cong, Y., et al. Microenvironment-induced in situ self-assembly of polymer-peptide conjugates that attack solid tumors deeply. Angewandte Chemie International Edition. 131 (14), 4680-4685 (2019).
- Blanco, E., Shen, H., Ferrari, M. Principles of nanoparticle design for overcoming biological barriers to drug delivery. Nature Biotechnology. 33 (9), 941-951 (2015).
- Tian, Y., Zhou, S. Advances in cell-penetrating peptides and their functionalization of polymeric nanoplatforms for drug delivery. Wiley Interdisciplinary Reviews. Nanomedicine and Nanobiotechnology. 13 (2), 1-12 (2021).
- Milletti, F. Cell-penetrating peptides: Classes, origin, and current landscape. Drug Discovery Today. 17 (15-16), 850-860 (2012).
- Turner, J. J., et al. Cell-penetrating peptide conjugates of peptide nucleic acids (PNA) as inhibitors of HIV-1 Tat-dependent trans-activation in cells. Nucleic Acids Research. 33 (21), 6837-6849 (2005).
- Tunnemann, G., et al. Live-cell analysis of cell penetration ability and toxicity of oligo-arginines. Journal of Peptide Science. 14 (4), 469-476 (2008).
- Shi, M., et al. Stapling of short cell-penetrating peptides for enhanced tumor cell-and-tissue dual-penetration. Chemical Communications. 58 (14), 2299-2302 (2022).
- Komin, A., et al. A peptide for transcellular cargo delivery: Structure-function relationship and mechanism of action. Journal of Controlled Release. 324, 633-643 (2020).
- Dietrich, L., et al. Cell permeable stapled peptide inhibitor of Wnt signaling that targets β-catenin protein-protein interactions. Cell Chemical Biology. 24 (8), 958-968 (2017).
- Tian, Y., et al. Stapling of unprotected helical peptides via photo-induced intramolecular thiol-yne hydrothiolation. Chemical Science. 7 (5), 3325-3330 (2016).
- De Araujo, A. D., et al. Comparative α-helicity of cyclic pentapeptides in water. Angewandte Chemie International Edition. 53 (27), 6965-6969 (2014).
- Chu, Q., et al. Towards understanding cell penetration by stapled peptides. Medicinal Chemistry Communications. 6 (1), 111-119 (2015).
- Bock, J. E., Gavenonis, J., Kritzer, J. A. Getting in shape: Controlling peptide bioactivity and bioavailability using conformational constraints. ACS Chemical Biology. 8 (3), 488-499 (2013).
- Tian, Y., et al. Effect of stapling architecture on physiochemical properties and cell permeability of stapled α-helical peptides: A comparative study. ChemBioChem. 18 (21), 2087-2093 (2017).
- White, C. J., Yudin, A. K. Contemporary strategies for peptide macrocyclization. Nature Chemistry. 3 (7), 509-524 (2011).
- Jain, R. K. Normalization of tumor vasculature: An emerging concept in antiangiogenic therapy. Science. 307 (5706), 58-62 (2005).
- Patgiri, A., Menzenski, M. Z., Mahon, A. B., Arora, P. S. Solid-phase synthesis of short α-helices stabilized by the hydrogen bond surrogate approach. Nature Protocols. 5 (11), 1857-1865 (2010).
- Baek, S., et al. Structure of the stapled p53 peptide bound to Mdm2. Journal of the American Chemical Society. 134 (1), 103-106 (2012).
- Traboulsi, H., et al. Macrocyclic cell penetrating peptides: A study of structure-penetration properties. Bioconjugate Chemistry. 26 (3), 405-411 (2015).
- Tian, Y., et al. A proline-derived transannular N-cap for nucleation of short α-helical peptides. Chemical Communications. 52 (59), 9275-9278 (2016).
- Muppidi, A., et al. Rational design of proteolytically stable, cell-permeable peptide-based selective Mcl-1 inhibitors. Journal of the American Chemical Society. 134 (36), 14734-14737 (2012).
- Wiradharma, N., et al. Synthetic cationic amphiphilic α-helical peptides as antimicrobial agents. Biomaterials. 32 (8), 2204-2212 (2011).
- Jones, A. T., Sayers, E. J. Cell entry of cell penetrating peptides: Tales of tails wagging dogs. Journal of Controlled Release. 161 (2), 582-591 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten