Method Article
Costruzione di peptidi ciclici che penetrano nelle cellule per una maggiore penetrazione delle barriere biologiche
In questo articolo
Riepilogo
Questo protocollo descrive la sintesi di peptidi ciclici penetranti nelle cellule con legami incrociati aromatici e la valutazione della loro permeabilità attraverso le barriere biologiche.
Abstract
Il cancro è stato una grande sfida per la salute globale. Tuttavia, il complesso microambiente tumorale generalmente limita l'accesso delle terapie alle cellule tumorali più profonde, portando alla recidiva del tumore. Per superare la limitata penetrazione delle barriere biologiche, sono stati scoperti peptidi che penetrano le cellule (CPP) con un'eccellente capacità di traslocazione della membrana e sono emersi come utili trasportatori molecolari per trasportare vari carichi nelle cellule. Tuttavia, le CPP lineari convenzionali mostrano generalmente una stabilità proteolitica compromessa, che limita la loro permeabilità attraverso le barriere biologiche. Pertanto, lo sviluppo di nuovi trasportatori molecolari in grado di penetrare le barriere biologiche e mostrare una maggiore stabilità proteolitica è altamente desiderato per promuovere l'efficienza della somministrazione di farmaci nelle applicazioni biomediche. Abbiamo precedentemente sintetizzato un pannello di CPP ciclici corti con reticoli aromatici, che hanno mostrato una permeabilità superiore nelle cellule tumorali e nei tessuti rispetto alle loro controparti lineari. Qui, viene descritto un protocollo conciso per la sintesi del peptide poliarginina R8 ciclico marcato fluorescentmente e della sua controparte lineare, nonché i passaggi chiave per studiare la loro permeabilità cellulare.
Introduzione
Gli ultimi decenni hanno assistito a rapidi progressi nello sviluppo di peptidi che penetrano nelle cellule (CPP) per la somministrazione di farmaci. I CPP sono stati ampiamente utilizzati come trasportatori molecolari per il trattamento di una serie di malattie potenzialmente letali, tra cui disturbi neurologici1,2, malattie cardiache3, diabete4, dermatosi5 e cancro 6,7. Il cancro rimane un onere sanitario globale accompagnato da un alto tasso di morbilità e mortalità nonostante i diffusi sforzi di ricerca8. Un serio ostacolo al trattamento del cancro è l'accesso limitato delle terapie alle cellule tumorali più profonde a causa di barriere fisiologiche come la matrice extracellulare compatta (ECM), la vascolarizzazione tumorale anormale, le barriere multimembrana e l'alta pressione del liquido interstiziale (IFP)9. Pertanto, lo sviluppo di nuovi CPP con una capacità superiore di consegnare carichi attraverso le barriere biologiche è considerato una strategia essenziale per il trattamento del cancro10,11.
I CPP possono essere classificati in CPP cationici, anfipatici e idrofobici in termini di proprietà fisico-chimiche12. Tra questi, il peptide HIV-TAT caricato positivamente e la poliarginina sintetica sono di notevole importanza nella ricerca biomedica e sono stati ampiamente studiati per facilitare la somministrazione intracellulare di farmaci13. Tunnemann et al. hanno riferito che una lunghezza minima di otto arginine è essenziale per un'efficiente penetrazione cellulare dei peptidi sintetici di poliarginina, sulla base di uno studio di permeabilità cellulare condotto utilizzando i peptidi da R3 a R1214. Tuttavia, questi CPP hanno generalmente brevi emivite plasmatiche a causa della loro rapida idrolisi in vivo. Inoltre, si sa poco per quanto riguarda l'ottimizzazione della struttura chimica dei CPP per aumentare la loro capacità di trans-barriera in quanto è difficile penetrare più membrane cellulari15. Pertanto, lo sviluppo di nuovi trasportatori molecolari in grado di penetrare le barriere biologiche è fortemente desiderato per migliorare l'efficienza della somministrazione dei farmaci. Nel 2020, Komin et al.16 hanno scoperto un CPP chiamato peptide CL, che contiene un motivo elicoidale (RLLRLLR) e una coda di poliarginina (R7) per attraversare il monostrato epiteliale. Una serie di varianti peptidiche CL sono state anche sintetizzate alterando il modello elicoidale. Questa esplorazione potrebbe essere una guida significativa per lo sviluppo di nuovi CPP per la consegna di carichi attraverso barriere biologiche. Inoltre, Dietrich et al. hanno ottimizzato la permeabilità cellulare del peptide StAX, inibendo la via di segnalazione Wnt / β-catenina aumentando l'idrofobicità complessiva dei peptidi17.
La restrizione conformazionale di peptidi lineari non strutturati mediante ciclizzazione è un modo efficace per migliorare la loro stabilità proteolitica e permeabilità18,19,20. Il rinforzo strutturale aumenta la resistenza alla proteasi dei peptidi ciclici, rendendoli più stabili in vivo rispetto alle loro controparti lineari. Inoltre, la ciclizzazione dei peptidi può potenzialmente mascherare la spina dorsale del peptide polare promuovendo il legame idrogeno intramolecolare, aumentando così la permeabilità della membrana dei peptidi21. Negli ultimi due decenni, i metodi di ciclizzazione chemioselettiva sono diventati strategie efficaci per la costruzione di peptidi ciclici con architetture diverse, come tutto idrocarburi, lattamici, triazolo, m-xilene, perfluoroarile e altri legami incrociati22,23. La barriera biologica imposta dal sofisticato microambiente tumorale potrebbe ridurre la penetrazione dei farmaci nei tumori solidi24. Abbiamo precedentemente scoperto che i CPP ciclici mostravano una resistenza superiore alla digestione enzimatica rispetto alle loro controparti lineari20. Inoltre, l'idrofobicità complessiva dei peptidi è fondamentale per la loro maggiore permeabilità cellulare22. Sulla base degli studi discussi sopra, la combinazione di un modello caricato positivamente, elevata idrofobicità complessiva e maggiore stabilità della proteolisi può essere ipotizzata per aumentare la permeabilità dei CPP attraverso le barriere biologiche. In uno studio recente, abbiamo identificato due CPP ciclici con legami incrociati aromatici nelle posizioni i e i + 7 che mostrano una migliore permeabilità nelle cellule e nei tessuti tumorali rispetto alle loro controparti lineari15. Qui viene presentato un protocollo sintetico conciso per la sintesi di CPP ciclici marcati con fluorescenza e i passaggi chiave per studiarne la permeabilità.
Protocollo
1. Preparazione dell'attrezzatura
NOTA: Eseguire tutte le procedure in una cappa aspirante funzionante con idonei dispositivi di protezione individuale.
- Assemblare l'apparato manuale di sintesi dei peptidi nella cappa aspirante (Figura 1). Posizionare i rubinetti di arresto a tre vie (vedi tabella dei materiali) sul collettore a vuoto (vedere tabella dei materiali) e collegarli all'azoto (N2). Assicurati di tappare le prese inutilizzate.
- Fissare una colonna in polipropilene da 10 mL (vedere la tabella dei materiali) sui rubinetti di arresto a tre vie. Scaricare la miscela di reazione o i solventi dalla colonna di polipropilene utilizzando una lampadina per pipette di gomma o un vuoto tramite una trappola per rifiuti.
2. Sintesi del peptide lineare R8 marcato con FITC (FITC-R8) e del peptide R8 graffato marcato con fitc (FITC-sR8-4)
NOTA: I peptidi sono stati sintetizzati secondo un protocollo standard di sintesi peptidica in fase solida (SPPS) basato su Fmoc25. La resina 4-(2',4'-Dimethoxypheyl-Fmoc-aminomethyl)-phenoxyacetamido-norleucyl-MBHA (resina MBHA ammidica da pista, vedi Tabella dei materiali) è stata utilizzata durante lo studio.
ATTENZIONE: N, N-dimetilformammide (DMF), N, N-diisopropiletilamina (DIPEA), morfolina e diclorometano (DCM) sono tutti incolori e sono dannosi se inalati o assorbiti attraverso la pelle. L'etere è estremamente infiammabile. L'1,2-Etanditiolo (EDT) è una sostanza particolarmente odorosa. L'acido trifluoroacetico (TFA) è altamente corrosivo e la sua acidità è 105 volte quella dell'acido acetico. Di conseguenza, tutti i reagenti e le sostanze chimiche dovrebbero essere trattati utilizzando dispositivi di protezione in una cappa aspirante.
- Preparare la resina per la sintesi peptidica.
- Calcola la massa di resina necessaria per la sintesi:Massa di resina (mg) = scala (mmol) / capacità di carico della resina (mmol / g) × 1.000 (mg / g)
NOTA: Ad esempio, la massa di resina MBHA ammidica (0,572 mmol / g) per 0,2 mmol = 0,2 mmol / 0,572 mmol / g × 1.000 mg / g = 350 mg. - Aggiungere 4-5 ml di DMF alla quantità necessaria di resina e trasferire nella colonna di polipropilene da 10 mL (fase 1.2) con un delicato gorgogliamento di N2 per 30 minuti per gonfiare adeguatamente la resina, quindi drenare il DMF.
- Aggiungere 4-5 ml di morfolina/DMF (v/v) al 50% alla resina, bollire delicatamente N2 per 30 minuti 2x per rimuovere il gruppo Fmoc N-terminale, quindi scolare la miscela. Successivamente, lavare accuratamente la resina 3 volte aggiungendo 4-5 ml di DMF alla colonna e gorgogliando con N2 per almeno 1 minuto ogni volta. Continuare a lavare la resina con DCM (3x) e DMF (3x) allo stesso modo.
- Calcola la massa di resina necessaria per la sintesi:Massa di resina (mg) = scala (mmol) / capacità di carico della resina (mmol / g) × 1.000 (mg / g)
- Eseguire l'accoppiamento aminoacidico protetto da Fmoc come descritto di seguito.
NOTA: L'accoppiamento dell'arginina in una sintesi manuale su scala 0,2 mmol è descritto qui come esempio.- Sciogliere Fmoc-Arg (Pbf)-OH (5 equiv., 648,8 mg) e 2-(7-azobenzotriazolo)-N, N, N', N'-tetrametiluronio esafluorofosfato (HATU, 4,9 equiv., 372,6 mg) in 5 mL di DMF in una provetta da centrifuga.
- Aggiungere DIPEA (10 equiv., 348,4 μL) per attivare la reazione di accoppiamento, quindi trasferire la miscela di reazione alla colonna di polipropilene da 10 mL con resina (preparata al punto 2.1.3). Quindi, agitare delicatamente la miscela con N 2 gorgogliando per1-2 ore.
- Ripetere una volta la reazione di accoppiamento (punto 2.2.1 e passaggio 2.2.2).
- Dopo il completamento dell'accoppiamento, scaricare la miscela di reazione e lavare la resina in sequenza con DMF, DCM e DMF 3 volte ciascuno per almeno 1 minuto ogni volta.
- Eseguire l'accoppiamento di ciascun amminoacido in fasi ordinate: aggiungere 4-5 ml di morfolina/DMF al 50% (v/v) alla resina, bollire delicatamente con N 2 per 30 minuti 2x per rimuovere il gruppo N α-Fmoc, quindi lavare la resina (come mostrato al punto 2.2.4) e procedere all'accoppiamento dell'amminoacido successivo (come mostrato nei punti 2.2.1 e 2.2.2). Procedere con diversi cicli di questo passaggio per ottenere la sintesi del peptide desiderato.
NOTA: questo processo può essere sospeso qui. Condensare la resina con metanolo e asciugare la resina con un flusso continuo di N2. Tappare la colonna di polipropilene e conservare la resina a 4 °C per alcuni giorni (o a -20 °C per una conservazione più lunga). Gonfiare la resina con 4-5 ml di DMF per 0,5-1 h prima di iniziare una nuova sintesi. Se si procede direttamente al passaggio successivo, non è necessario condensare la resina.
- Etichettare i peptidi con isotiocianato di fluoresceina (FITC) come descritto di seguito.
- Accoppiare la beta-alanina come distanziatore per l'etichettatura FITC utilizzando lo stesso processo utilizzato per l'accoppiamento degli aminoacidi nel passaggio 2.2.
- Eseguire la marcatura FITC dei peptidi sulla resina aggiungendo una miscela di FITC (5 equiv.), DIPEA (10 equiv.) e DMF alla colonna di polipropilene e reagendo al buio per 8 ore.
- Per la sintesi di FITC-sR8-4, eseguire la ciclizzazione del peptide lineare come descritto di seguito.
- Aggiungere una miscela di TFA/triisopropilsilano (TIS)/DCM (3/5/92, v/v/v) alla colonna di polipropilene per 2 minuti per rimuovere selettivamente il gruppo protettivo Cys (Trt), quindi scolare la miscela. Ripetere la procedura precedente fino a quando la soluzione giallastra diventa incolore per rimuovere completamente il gruppo protettivo trt.
- Successivamente, eseguire lavaggi sequenziali della resina con DMF e DCM almeno 3x. Successivamente, sciogliere 4,4'-bis(bromometil)bifenile (2 equiv.) in DMF con DIPEA (4 equiv.), aggiungerlo alla colonna e reagire per 4 ore.
- Fendere i peptidi come descritto: Dopo il completamento della sintesi peptidica, lavare la resina con 4-5 ml di metanolo due volte per 5 minuti ciascuno e asciugarla con un flusso continuo di N2. Trattare la resina con un efficace cocktail di scissione TFA/TIS/H 2 O (95/2.5/2.5, v/v/v), o TFA/TIS/EDT/H 2 O (92.5/2.5/2.5/2.5, v/v/v/v) per peptidi contenenti cisteine, utilizzando circa 1 mL di cocktail di scissione per 100 mg di resina. Trattare la resina legata al peptide per 2-3 ore per scindere il peptide e quindi rimuovere accuratamente il TFA con un flusso di N2.
- Per ottenere i peptidi grezzi, aggiungere 4-5 ml di etere etilico alla preparazione del peptide scisso per precipitare i peptidi grezzi e centrifugare a 10.000 × g per 4 minuti. Scartare con attenzione il surnatante e asciugare all'aria il peptide per 3 minuti in una cappa aspirante efficace.
- Analisi dei peptidi: sciogliere un peptide grezzo su piccola scala (scisso da circa 10 mg di resina legata al peptide) in 800 μL di acetonitrile (ACN)/H2O (1/1, v/v) e quindi analizzare utilizzando cromatografia liquida ad alte prestazioni a fase inversa (RP-HPLC) e cromatografia liquida-spettrometria di massa (LC-MS) (vedi Tabella dei materiali).
- Purificare i peptidi utilizzando RP-HPLC e LC-MS.
- Sciogliere 50 mg di prodotto peptidico grezzo in 4 mL di ACN/H2O (1/1, v/v) e iniettare la soluzione in un sistema RP-HPLC dotato di una colonna C18 (4,6 mm x 150 mm, dimensione dei pori: 120 Å, dimensione delle particelle: 4 μm; vedere Tabella dei materiali). Eluire il peptide utilizzando una fase mobile contenente lo 0,1% di TFA/H2O (v/v) e ACN, con un gradiente dal 10% al 90% di ACN nell'arco di 30 minuti. I peptidi convenzionali sono stati rilevati a 220 nm e i peptidi marcati con FITC a 494 nm.
- Raccogliere le frazioni corrispondenti al picco peptidico principale identificato dalla SM e quindi liofilizzare le frazioni peptidiche desiderate. Conservare il peptide purificato a -20 °C.
NOTA: I m/z trovati del FITC-R8 purificato sono i seguenti: [M + 3 H]3+: 576.63; [M + 4 H] 4+: 432,72; [M + 5 H] 5+: 346,39; [M + 6 H] 6+: 288,85. I m/z trovati del FITC-sR8-4 purificato sono i seguenti: [M + 3 H]3+: 704.74; [M + 4 H] 4+: 528,77; [M + 5 H] 5+: 423,34; [M + 6 H] 6+: 352,91. Condizioni analitiche MS: strumento: ESI (polarizzazione della sonda: +4,5 kV; rivelatore: 1,2 kV); flusso gas nebulizzatore: 1,5 L/min; linea di desolvatazione curva (CDL): -20 V; Temperatura CDL: 250 °C; temperatura blocco: 400 °C; portata: 0,2 ml/min; fase mobile: 50% H2O/50% ACN.
3. Quantificazione dei peptidi marcati con FITC
- Sciogliere una piccola quantità di peptide purificato in DMSO come soluzione madre (ad esempio, 40 μmol / ml).
- Misurare l'assorbanza a 494 nm (A 494) di 2 μL della soluzione madre in498 μL di soluzione salina tamponata fosfato 10 mM (1x PBS, pH 7,4) con una piastra di microtitolazione (vedere Tabella dei materiali) utilizzando un lettore di micropiastre multitecnologia (vedere Tabella dei materiali). Il fattore di diluizione è 500 μL/ 2 μL = 250 e la lunghezza del percorso della piastra di microtitolazione è di 0,5 mm.
- Calcolare la concentrazione della soluzione madre utilizzando la seguente formula:
Concentrazione (mM) = A494 × fattore di diluizione / 0,05 (cm) / 77.000 (cm−1· M−1) × 1.000 (mM·M−1) - Regolare una diluizione corretta in modo che il valore A494 misurato sia compreso tra 0,1 e 1,0.
NOTA: le misurazioni devono essere ripetute più volte per garantire che la concentrazione misurata sia accurata. Il coefficiente di estinzione di 77.000 cm−1· M−1 deriva dal gruppo FITC.
4. Stabilità dei peptidi nel siero fetale bovino (FBS)
- Incubare il peptide ad una concentrazione di 100 μM con 250 μL di FBS/H2O (v/v) al 25% a 37 °C. Dopo l'incubazione per 0 ore, 1 ora, 2 ore e 4 ore, prendere 10 μL di aliquote e quindi aggiungere 150 μl di acido tricloroacetico al 12% sciolto in H2O/ACN (1/3, v/v) per precipitare le proteine sieriche.
- Centrifugare i campioni a 10.000 × g per 5 minuti e analizzare il surnatante utilizzando HPLC (come descritto nella fase 2.8) per determinare l'entità della degradazione del peptide.
- Calcolare il rapporto tra l'area di picco a 1 h, 2 h e 4 h e quella a 0 h per ottenere la frazione di peptide non degradato al momento corrispondente. Il risultato è la media di tre campioni paralleli.
5. Assorbimento cellulare dei peptidi
- Imaging microscopico a fluorescenza
- Posizionare un coprislip rotondo in una piastra a 12 pozzetti. Quindi, inoculare 1 x 105 cellule uniformemente su vetrini di copertura e coltura durante la notte con 2 ml di terreno. Rimuovere il mezzo e lavare le celle 3 volte con 1 mL di PBS.
NOTA: In questo studio, le cellule HeLa e le cellule 4T1 sono state coltivate nel Modified Eagle Medium (DMEM, vedi Tabella dei materiali) di Dulbecco integrato con il 10% di FBS in un incubatore umidificato a 37 °C contenente il 5% di CO2. - Incubare le cellule con 1 mL di peptidi marcati con FITC da 3 μM in DMEM privo di FBS per 1 ora a 37 °C. Successivamente, rimuovere il mezzo contenente peptidi e lavare le cellule 3 volte con 1 mL di PBS.
- Colorare le cellule con 1 mL di Hoechst 33258 per 15 min. Osservare l'internalizzazione di ciascun peptide utilizzando un microscopio a fluorescenza (vedi Tabella dei materiali) con la stessa intensità di fluorescenza e tempo di esposizione.
NOTA: per la microscopia a fluorescenza sono state utilizzate le seguenti impostazioni. Obiettivo: Plan-Apochromat: 63 x/1.40 Oil DIC M27; Canale 1 per FITC: filtro di eccitazione: 450-490 nm, filtro di emissione: 500-550 nm, tempo di esposizione: 230 ms; Canale 2 per Hoechst 33258: filtro di eccitazione: 335-383 nm, filtro di emissione: 420-470 nm, tempo di esposizione: 27 ms.
- Posizionare un coprislip rotondo in una piastra a 12 pozzetti. Quindi, inoculare 1 x 105 cellule uniformemente su vetrini di copertura e coltura durante la notte con 2 ml di terreno. Rimuovere il mezzo e lavare le celle 3 volte con 1 mL di PBS.
- Analisi citometrica a flusso
- Inoculare uniformemente 5 x 10cellule HeLa 5 x 10 in piastre a 12 pozzetti e coltura in DMEM per 24 ore a 37 °C. Successivamente, rimuovere il mezzo e lavare le celle 3x con 1 mL di PBS.
- Incubare le cellule con 1 mL di peptidi marcati con FITC da 3 μM in DMEM privo di FBS per 1 ora a 37 °C. Rimuovere il mezzo contenente peptidi, dissociare le cellule con tripsina allo 0,25% (p/v) e 0,53 mM di EDTA in PBS per 5 minuti, quindi raccogliere le cellule mediante centrifugazione a 306 × g per 4 minuti. Lavare il pellet cellulare con PBS.
- Incubare le cellule con 1 mL di blu tripano allo 0,05% (p/v) in PBS per 3 minuti per estinguere la fluorescenza legata alla superficie ed eseguire l'analisi quantitativa della fluorescenza intracellulare utilizzando un citometro a flusso (vedere Tabella dei materiali).
NOTA: Impostazioni della citometria a flusso: eccitazione: 488 nm, emissione: 530 nm. Il blu di Trypan può anche estinguere la fluorescenza delle cellule morte e aiutare a distinguere le cellule vive / morte durante l'analisi dell'assorbimento del peptide. - Trattare e dosare le cellule 4T1 utilizzando la citometria a flusso seguendo lo stesso protocollo descritto per le cellule HeLa. Raccogliere 5 x 105 celle per campione e impostare tre campioni paralleli per gruppo.
6. Esplorazione della penetrazione cellula-cellula dei peptidi utilizzando modelli transwell
- Inoculare 1 x 10 5 cellule HeLa in 2 mL di DMEM in una camera a 12 pozzetti con un inserto in piastra di coltura tissutale (vedi Tabella dei materiali) e incubare per 24 ore in un incubatore umidificato a 37 °C contenente il5% di CO2. Successivamente, rimuovere il mezzo e incubare le cellule nelle camere con 1 mL di 10 μM FITC-R8 o FITC-sR8-4 (purificato con HPLC) in DMEM privo di FBS per 1 ora.
- Rimuovere il mezzo contenente i peptidi e lavare le cellule 3 volte con 1 mL di PBS. Aggiungere 1 mL di DMEM fresco privo di FBS alle camere e quindi co-incubare le cellule HeLa nella camera con l'inserto della piastra di coltura tissutale con le cellule HeLa sui vetrini rotondi sul fondo per 2 ore.
- Fissare le cellule HeLa sui coprivetrini rotondi con glutaraldeide al 2,5% per 15 minuti e quindi colorare le cellule con DAPI per 15 minuti. Quindi, osservare le cellule HeLa sui vetrini sotto un microscopio a fluorescenza. Trattare e dosare le cellule 4T1 utilizzando lo stesso protocollo utilizzato per le cellule HeLa.
Risultati
In questo protocollo, è stata presentata una procedura sintetica per vincolare la poliarginina lineare R8 nella sua forma ciclica. L'SPPS è stato condotto manualmente utilizzando un semplice apparato (Figura 1). Il processo sintetico dettagliato di SPPS è mostrato nella Figura 2. In breve, la resina è stata sufficientemente gonfiata, seguita dalla deprotezione del gruppo protettivo N α-Fmoc. Quindi, l'amminoacido protetto da N α-Fmoc è stato ancorato sulla resina fino al completamento dell'assemblaggio peptidico (passaggi 1-4 in Figura 2). Quindi, i peptidi grezzi sono stati scissi dalla resina dal cocktail di scissione (fase 5 nella Figura 2). FITC è stato utilizzato per etichettare i peptidi per sintetizzare CPP ciclici marcati con fluorescenza e tracciare la loro permeabilità attraverso le barriere biologiche. Successivamente, i gruppi di cisteina che proteggono il tritile sono stati selettivamente deprotetti sulla resina, seguiti dalla ciclizzazione del peptide con reticolo 4,4'-bis(bromometil)bifenile (Figura 3A). Gli spettri HPLC e MS di FITC-R8 e FITC-sR8-4 sono mostrati nella Figura 3B. Il tempo di ritenzione di FITC-sR8-4 era sostanzialmente più lungo di quello dell'analogo lineare, indicando una maggiore idrofobicità complessiva del peptide dopo la ciclizzazione con il reticolo idrofobico. Inoltre, come mostrato nella Figura 3C, l'R8 ciclico è rimasto intatto al 77,3% dopo l'incubazione con il 25% di FBS per 4 ore, mentre la sua controparte lineare è stata per lo più degradata, suggerendo una maggiore stabilità proteolitica del peptide ciclico R8. Nei successivi studi basati su cellule, le cellule trattate con R8 ciclico con reticolazione aromatica hanno mostrato una fluorescenza intracellulare più elevata rispetto a quelle trattate con la sua controparte lineare, come dimostrato dall'imaging al microscopio a fluorescenza di cellule vive (Figura 4A). Risultati simili sono stati ottenuti con l'analisi della citometria a flusso (Figura 4B). Per indagare ulteriormente se l'R8 ciclico conferisce una maggiore penetrazione da cellula a cellula, sono stati utilizzati modelli transwell per simulare la permeabilità barriera dei peptidi da uno strato cellulare all'altro. L'R8 ciclico ha chiaramente mostrato una maggiore penetrazione trans-barriera rispetto al peptide lineare R8, come indicato da un significativo aumento della fluorescenza intracellulare (Figura 4C). Per riassumere, il peptide ciclico R8 ha mostrato una permeabilità superiore attraverso le barriere biologiche rispetto alla sua controparte lineare.

Figura 1: Configurazione dell'apparecchiatura per l'apparato manuale di sintesi dei peptidi. Una colonna in polipropilene da 10 mL viene installata sul collettore del vuoto utilizzando una valvola di arresto a tre vie. N2 è usato per l'agitazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Procedura generale di sintesi peptidica in fase solida Fmoc (SPPS). Un amminoacido protetto da N α-Fmoc è ancorato alla resina 4-(2',4'-Dimethoxypheyl-Fmoc-aminomethyl)-phenoxyacetamido-norleucyl-MBHA (rink amide MBHA resin) (fase 1), seguita dalla deprotezione dei gruppi protettivi Nα-Fmoc degli amminoacidi (fase 2) e dal successivo accoppiamento amminoacidico (fase 3). Il passo 2 e il passo 3 vengono ripetuti più volte per sintetizzare il peptide desiderato (fase 4). Dopo il completamento della sintesi, viene aggiunto un cocktail di scissione per rimuovere i gruppi protettivi della catena laterale e scindere il peptide desiderato dalla resina (fase 5). Abbreviazioni: DMF = N, N-dimetilformammide; DCM = diclorometano; HATU = 2-(7-azobenzotriazolo)-N, N, N', N'-tetrametiluronio esafluorofosfato; DIPEA = N, N-diisopropiletilammina; TFA = acido trifluoroacetico. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3: Sintesi del peptide lineare R8 marcato con FITC (FITC-R8) e del peptide R8 graffato marcato con fitc (FITC-sR8-4) utilizzando la sintesi peptidica in fase solida (SPPS). (A) Schema della sintesi di FITC-R8 e FITC-sR8-4. (B) Spettri HPLC e MS (inserto) di FITC-R8 e FITC-sR8-4. (C) Stabilità di FITC-R8 e FITC-sR8-4 in presenza del 25% di FBS. Il peptide intatto (%) si riferisce alla frazione di peptide non degradato. Questa cifra è stata modificata da Shi et al.15. Fare clic qui per visualizzare una versione ingrandita di questa figura.
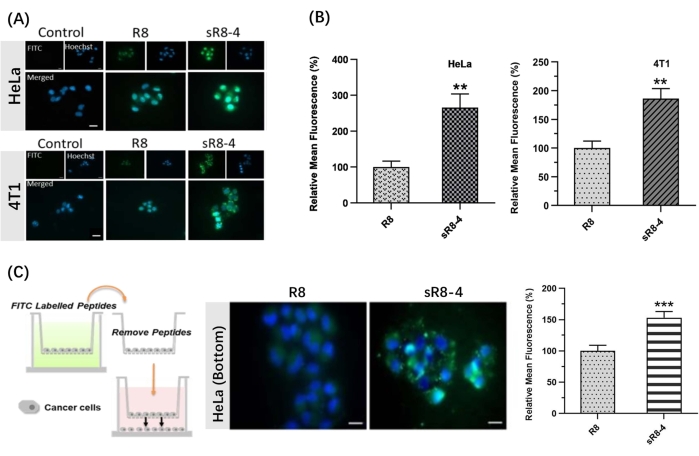
Figura 4: Penetrazione del peptide lineare R8 marcato con FITC (FITC-R8) e del peptide R8 graffato marcato con FITC (FITC-sR8-4). (A) Immagini al microscopio a fluorescenza di cellule HeLa e cellule 4T1 dopo 1 ora di incubazione con 3 μM FITC-R8 e FITC-sR8-4. FITC (verde), Hoechst (blu). Barra della scala = 20 μm. (B) Fluorescenza media relativa (rispetto al peptide lineare R8), media ± s.d. e n = 3; (C) Penetrazione cellula-cellula di FITC-R8 e FITC-sR8-4 in un modello transwell utilizzando celle HeLa. Immagini al microscopio a fluorescenza di cellule vive (barra di scala = 20 μm) e fluorescenza media relativa (rispetto al peptide lineare R8), media ± s.d. e n = 3. ** P < 0,01, *** P < 0,001. Questa cifra è stata modificata da Shi et al.15. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
La stabilizzazione chimica dei peptidi incorporando vincoli conformazionali si è dimostrata una strategia efficace per migliorare la stabilità e la permeabilità cellulare del peptide26. In questo protocollo, viene descritta una procedura passo-passo per la sintesi di CPP ciclici con legami incrociati aromatici e la valutazione della loro permeabilità attraverso barriere biologiche. Rispetto ai legami incrociati idrofili lattamici o triazolici22,27, l'incorporazione di legami incrociati aromatici (utilizzati in questo studio) migliora l'idrofobicità complessiva dei CPP, aumentando così significativamente la loro permeabilità cellulare. D'altra parte, la ciclizzazione dei peptidi può essere facilmente raggiunta attraverso reazioni di sostituzione con cisteine senza richiedere alcun catalizzatore metallico. In questo protocollo, la ciclizzazione dei CPP è stata condotta su resina; Tuttavia, l'efficienza di ciclizzazione dipende anche dalle sequenze e dalle lunghezze specifiche dei peptidi a causa degli effetti sterici, che possono provocare la formazione di un sottoprodotto dimerico28. In tal caso, sarebbe utile utilizzare una resina con una capacità di carico inferiore. Inoltre, si raccomanda anche di ciclizzare questi peptidi specifici in concentrazioni diluite nella fase di soluzione29.
Ci sono alcuni punti critici in questo protocollo. In primo luogo, il cocktail di scissione TFA / TIS / EDT / H 2 O (92.5/ 2.5 / 2.5 / 2.5, v / v / v / v) viene utilizzato per la scissione dei peptidi contenenti cisteina per prevenire l'ossidazione del gruppo sulfidrilico. In secondo luogo, si consiglia di eseguire uno studio preliminare su piccola scala per ottenere la condizione di scissione appropriata. Il tempo ottimale necessario per scindere i peptidi dalla resina è di 2-3 ore, con un tempo di scissione più lungo (più di 5 ore) tendente a produrre più sottoprodotti non identificati. La sintesi del peptide potrebbe essere monitorata da LC-MS per ottimizzare il tempo di scissione. In terzo luogo, l'etichettatura FITC dovrebbe essere eseguita al buio per evitare la tempra a fluorescenza.
Inoltre, il blu di tripano deve essere utilizzato per estinguere la fluorescenza legata alla superficie poiché l'analisi della citometria a flusso non può distinguere la fluorescenza intracellulare o legata alla superficie. Ciò contribuirà a quantificare specificamente il peptide internalizzato dalle cellule tumorali27. Inoltre, poiché i peptidi cationici possono anche causare la lisi30 non specifica della membrana, l'attività emolitica e la vitalità cellulare potrebbero anche essere condotte per valutare la tossicità delle CPP cicliche.
I CPP ciclici costituiscono uno dei veicoli efficaci per la somministrazione di farmaci per superare le barriere biologiche. Tuttavia, l'interazione di membrana e la perturbazione delle CPP cationiche portano generalmente a potenziali citotossicità non specifiche31. Ulteriori sforzi saranno dedicati alla comprensione del meccanismo di penetrazione dettagliato, che dovrebbe aiutare la scoperta della prossima generazione di CPP ciclici per penetrare le barriere biologiche con una citotossicità minima. Questi CPP altamente attivi e stabili sono molto promettenti per migliorare il trattamento di importanti malattie potenzialmente letali.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è supportato dalla Natural Science Foundation of China (21708031), dalla China Postdoctoral Science Foundation (BX20180264, 2018M643519) e dai fondi di ricerca fondamentale per le università centrali (2682021ZTPY075).
Materiali
| Name | Company | Catalog Number | Comments |
| 1,2-ethanedithiol | Aladdin | K1722093 | stench |
| 2-(7-Azobenzotriazole)-N,N,N',N'-tetramethyluronium hexafluorophosphate (HATU) | HEOWNS | A-0443697 | |
| 4,4'-bis(bromomethyl)biphenyl | TCI | B1921 | |
| 4T1 cells | ATCC | 4T1 cells were cultured in DMEM medium supplemented with 10% FBS (Hyclone) in a 37 °C humidified incubator containing 5% CO2. | |
| Acetonitrile | Adamas | 1484971 | toxicity |
| Dichloromethane | Energy | W330229 | skin harmful |
| Diethyl ether | Aldrich | 673811 | flammable |
| Dimethyl sulfoxide | Beyotime | ST038 | skin harmful |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | ||
| Electrospray Ionization Mass Spectrometer | Waters | G2-S Tof | |
| Ethylene Diamine Tetraacetic Acid (EDTA) | BioFroxx | 1340 | |
| Fetal bovine serum (FBS) | HyClone | ||
| Flow cytometer | Beckman Coulter | CytoFLEX | |
| Fluorescein isothiocyanate isomer (FITC) | Energy | E0801812500 | |
| Fluorescent microscope | Carl Zeiss | Axio Observer 7 | |
| Fmoc-Arg(Pbf)-OH | HEOWNS | F-81070 | |
| Fmoc-Cys(Trt)-OH | GL Biochem | GLS201115-35202 | |
| Fmoc-βAla-OH | Adamas | 51341C | |
| HeLa cells | ATCC | HeLa cells were cultured in DMEM supplemented with 10% FBS (Hyclone) in a 37 °C humidified incubator containing 5% CO2. | |
| High-Performance Liquid Chromatography | Agilent | Agilent 1260 | |
| High-Performance Liquid Chromatography column | Agilent | Poroshell EC-C18 120, 4.6 × 150 mm (pore size 120 Å, particle size 4 μm) | |
| Lyophilizer | SP Scientific | Vir Tis | |
| Methanol | Aldrich | 9758 | toxicity |
| Microtiter plate | Thermo μdrop plate | N12391 | |
| Morpholine | HEOWNS | M99040 | irritant |
| Multi-technology microplate reader | Thermo | VARIOSKAN LUX | |
| N,N-Diisopropylethylamine | HEOWNS | E-81416 | irritant |
| N,N-Dimethyl formamide | Energy | B020051 | harmful to skin |
| Poly-Prep column | Bio-Rad | 7321010 | polypropylene chromatography columns |
| Rink Amide MBHA resin (0.572 mmol/g) | GL Biochem | GLS180301-49101 | |
| Three-way stopcocks | Bio-Rad | 7328107 | |
| Tissue culture plate insert | LABSELECT | 14211 | |
| Trifluoroacetic acid | HEOWNS | T63278 | corrosive |
| Triisopropylsilane | HEOWNS | T-0284475 | |
| Trypsin | BioFroxx | 1004 | |
| Vacuum manifold | Promega | A7231 |
Riferimenti
- Zhang, L., et al. Brain-targeted dual site-selective functionalized poly(β-amino esters) delivery platform for nerve regeneration. Nano Letters. 21 (7), 3007-3015 (2021).
- Park, T. E., et al. Enhanced BBB permeability of osmotically active poly(mannitol-co-PEI) modified with rabies virus glycoprotein via selective stimulation of caveolar endocytosis for RNAi therapeutics in Alzheimer's disease. Biomaterials. 38, 61-71 (2015).
- Bian, J., et al. Effect of cell-based intercellular delivery of transcription factor GATA4 on ischemic cardiomyopathy. Circulation Research. 100 (11), 1626-1633 (2007).
- He, H., et al. The use of low molecular weight protamine chemical chimera to enhance monomeric insulin intestinal absorption. Biomaterials. 34 (31), 7733-7743 (2013).
- Kim, D., et al. A specific STAT3-binding peptide exerts antiproliferative effects and antitumor activity by inhibiting STAT3 phosphorylation and signaling. Cancer Research. 74 (8), 2144-2151 (2014).
- Yang, Y., et al. PEGylated liposomes with NGR ligand and heat-activable cell-penetrating peptide-doxorubicin conjugate for tumor-specific therapy. Biomaterials. 35 (14), 4368-4381 (2014).
- Wei, Y., et al. Intracellular paclitaxel delivery facilitated by a dual-functional CPP with a hydrophobic hairpin tail. ACS Applied Materials and Interfaces. 13 (4), 4853-4860 (2021).
- Vasan, N., Baselga, J., Hyman, D. M. A view on drug resistance in cancer. Nature. 575 (7782), 299-309 (2019).
- Cong, Y., et al. Microenvironment-induced in situ self-assembly of polymer-peptide conjugates that attack solid tumors deeply. Angewandte Chemie International Edition. 131 (14), 4680-4685 (2019).
- Blanco, E., Shen, H., Ferrari, M. Principles of nanoparticle design for overcoming biological barriers to drug delivery. Nature Biotechnology. 33 (9), 941-951 (2015).
- Tian, Y., Zhou, S. Advances in cell-penetrating peptides and their functionalization of polymeric nanoplatforms for drug delivery. Wiley Interdisciplinary Reviews. Nanomedicine and Nanobiotechnology. 13 (2), 1-12 (2021).
- Milletti, F. Cell-penetrating peptides: Classes, origin, and current landscape. Drug Discovery Today. 17 (15-16), 850-860 (2012).
- Turner, J. J., et al. Cell-penetrating peptide conjugates of peptide nucleic acids (PNA) as inhibitors of HIV-1 Tat-dependent trans-activation in cells. Nucleic Acids Research. 33 (21), 6837-6849 (2005).
- Tunnemann, G., et al. Live-cell analysis of cell penetration ability and toxicity of oligo-arginines. Journal of Peptide Science. 14 (4), 469-476 (2008).
- Shi, M., et al. Stapling of short cell-penetrating peptides for enhanced tumor cell-and-tissue dual-penetration. Chemical Communications. 58 (14), 2299-2302 (2022).
- Komin, A., et al. A peptide for transcellular cargo delivery: Structure-function relationship and mechanism of action. Journal of Controlled Release. 324, 633-643 (2020).
- Dietrich, L., et al. Cell permeable stapled peptide inhibitor of Wnt signaling that targets β-catenin protein-protein interactions. Cell Chemical Biology. 24 (8), 958-968 (2017).
- Tian, Y., et al. Stapling of unprotected helical peptides via photo-induced intramolecular thiol-yne hydrothiolation. Chemical Science. 7 (5), 3325-3330 (2016).
- De Araujo, A. D., et al. Comparative α-helicity of cyclic pentapeptides in water. Angewandte Chemie International Edition. 53 (27), 6965-6969 (2014).
- Chu, Q., et al. Towards understanding cell penetration by stapled peptides. Medicinal Chemistry Communications. 6 (1), 111-119 (2015).
- Bock, J. E., Gavenonis, J., Kritzer, J. A. Getting in shape: Controlling peptide bioactivity and bioavailability using conformational constraints. ACS Chemical Biology. 8 (3), 488-499 (2013).
- Tian, Y., et al. Effect of stapling architecture on physiochemical properties and cell permeability of stapled α-helical peptides: A comparative study. ChemBioChem. 18 (21), 2087-2093 (2017).
- White, C. J., Yudin, A. K. Contemporary strategies for peptide macrocyclization. Nature Chemistry. 3 (7), 509-524 (2011).
- Jain, R. K. Normalization of tumor vasculature: An emerging concept in antiangiogenic therapy. Science. 307 (5706), 58-62 (2005).
- Patgiri, A., Menzenski, M. Z., Mahon, A. B., Arora, P. S. Solid-phase synthesis of short α-helices stabilized by the hydrogen bond surrogate approach. Nature Protocols. 5 (11), 1857-1865 (2010).
- Baek, S., et al. Structure of the stapled p53 peptide bound to Mdm2. Journal of the American Chemical Society. 134 (1), 103-106 (2012).
- Traboulsi, H., et al. Macrocyclic cell penetrating peptides: A study of structure-penetration properties. Bioconjugate Chemistry. 26 (3), 405-411 (2015).
- Tian, Y., et al. A proline-derived transannular N-cap for nucleation of short α-helical peptides. Chemical Communications. 52 (59), 9275-9278 (2016).
- Muppidi, A., et al. Rational design of proteolytically stable, cell-permeable peptide-based selective Mcl-1 inhibitors. Journal of the American Chemical Society. 134 (36), 14734-14737 (2012).
- Wiradharma, N., et al. Synthetic cationic amphiphilic α-helical peptides as antimicrobial agents. Biomaterials. 32 (8), 2204-2212 (2011).
- Jones, A. T., Sayers, E. J. Cell entry of cell penetrating peptides: Tales of tails wagging dogs. Journal of Controlled Release. 161 (2), 582-591 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon