Method Article
Construção de Peptídeos Cíclicos Penetrantes em Células para Maior Penetração de Barreiras Biológicas
Neste Artigo
Resumo
Este protocolo descreve a síntese de peptídeos cíclicos penetrantes em células com ligações cruzadas aromáticas e a avaliação de sua permeabilidade através de barreiras biológicas.
Resumo
O câncer tem sido um grande desafio na saúde global. No entanto, o complexo microambiente tumoral geralmente limita o acesso da terapêutica a células tumorais mais profundas, levando à recorrência tumoral. Para vencer a penetração limitada de barreiras biológicas, peptídeos penetrantes de células (CPPs) foram descobertos com excelente capacidade de translocação de membrana e emergiram como transportadores moleculares úteis para entregar várias cargas nas células. No entanto, as PPCs lineares convencionais geralmente apresentam estabilidade proteolítica comprometida, o que limita sua permeabilidade através de barreiras biológicas. Assim, o desenvolvimento de novos transportadores moleculares que possam penetrar em barreiras biológicas e exibir maior estabilidade proteolítica é altamente desejado para promover a eficiência na liberação de fármacos em aplicações biomédicas. Nós sintetizamos previamente um painel de CPPs cíclicos curtos com ligações cruzadas aromáticas, que exibiram permeabilidade superior em células e tecidos cancerosos em comparação com seus homólogos lineares. Aqui, um protocolo conciso é descrito para a síntese do peptídeo R8 cíclico de poliarginina fluorescentemente marcado e sua contraparte linear, bem como os principais passos para investigar sua permeabilidade celular.
Introdução
As últimas décadas testemunharam rápidos avanços no desenvolvimento de peptídeos penetrantes em células (CPPs) para liberação de fármacos. As PPCs têm sido amplamente utilizadas como transportadores moleculares para o tratamento de uma série de doenças potencialmente fatais, incluindo distúrbios neurológicos1,2, doenças cardíacas3, diabetes4, dermatoses5 e câncer 6,7. O câncer continua sendo um fardo de saúde global acompanhado por uma alta taxa de morbidade e mortalidade, apesar dos amplos esforços de pesquisa8. Um sério obstáculo ao tratamento do câncer é o acesso limitado da terapêutica a células tumorais mais profundas devido a barreiras fisiológicas, como matriz extracelular compacta (MEC), vasculatura tumoral anormal, múltiplas barreiras de membrana e alta pressão do fluido intersticial (IFP)9. Assim, o desenvolvimento de novas PPCs com capacidade superior de entregar cargas através de barreiras biológicas é considerado uma estratégia essencial para o tratamento do câncer10,11.
As PPCs podem ser classificadas em catiônicas, anfipáticas e hidrofóbicas em termos de suas propriedades físico-químicas12. Dentre estes, o peptídeo HIV-TAT carregado positivamente e a poliarginina sintética são de considerável importância na pesquisa biomédica e têm sido extensivamente estudados para facilitar a liberação intracelular de fármacos13. Tunnemann e col. relataram que um comprimento mínimo de oito argininas é essencial para a penetração celular eficiente dos peptídeos sintéticos de poliarginina, com base em um estudo de permeabilidade celular realizado usando peptídeos R3 aR12 14. No entanto, essas PPCs geralmente têm meias-vidas plasmáticas curtas devido à sua rápida hidrólise in vivo. Além disso, pouco se sabe sobre a otimização da estrutura química das PPCs para aumentar sua capacidade de transbarreira, uma vez que é um desafio penetrar em múltiplas membranas celulares15. Assim, o desenvolvimento de novos transportadores moleculares capazes de penetrar barreiras biológicas é fortemente desejado para aumentar a eficiência da liberação de fármacos. Em 2020, Komin et al.16 descobriram um CPP chamado peptídeo CL, que contém um motivo de hélice (RLLRLLR) e uma cauda de poliarginina (R7) para cruzar a monocamada epitelial. Um conjunto de variantes peptídicas CL também foram sintetizadas alterando o padrão helicoidal. Esta exploração pode ser um guia significativo para o desenvolvimento de novos CPPs para a entrega de cargas através de barreiras biológicas. Além disso, Dietrich e col. otimizaram a permeabilidade celular do peptídeo StAX, inibindo a via de sinalização Wnt/β-catenina por aumentar a hidrofobicidade global dos peptídeos17.
A restrição conformacional de peptídeos lineares não estruturados por ciclização é uma maneira eficaz de aumentar sua estabilidade proteolítica e permeablidade18,19,20. O reforço estrutural aumenta a resistência às proteases dos peptídeos cíclicos, tornando-os mais estáveis in vivo em comparação com seus equivalentes lineares. Além disso, a ciclização de peptídeos pode potencialmente mascarar a espinha dorsal do peptídeo polar por promover a ligação intramolecular de hidrogênio, aumentando assim a permeabilidade da membrana dos peptídeos21. Nas últimas duas décadas, métodos quimiosseletivos de ciclização tornaram-se estratégias eficazes para a construção de peptídeos cíclicos com diferentes arquiteturas, como hidrocarbonetos, lactâmicos, triazóis, m-xileno, perfluoroaril e outras ligações cruzadas22,23. A barreira biológica imposta pelo sofisticado microambiente tumoral poderia reduzir a penetração de fármacos em tumoressólidos24. Verificamos anteriormente que as PPCs cíclicas apresentaram resistência superior à digestão enzimática em relação às suas contrapartes lineares20. Além disso, a hidrofobicidade global dos peptídeos é crítica para sua maior permeabilidade celular22. Com base nos estudos discutidos acima, a combinação de um padrão carregado positivamente, hidrofobicidade global elevada e maior estabilidade da proteólise pode ser hipotetizada para aumentar a permeabilidade das PPCs através de barreiras biológicas. Em um estudo recente, identificamos duas CPPs cíclicas com ligações cruzadas aromáticas nas posições i e i+7 que exibem melhor permeabilidade em células e tecidos tumorais em comparação com suas contrapartes lineares15. Aqui, um protocolo sintético conciso para a síntese de CPPs cíclicas marcadas fluorescentemente e os principais passos para investigar sua permeabilidade são apresentados.
Protocolo
1. Preparação do equipamento
OBS: Realizar todos os procedimentos em exaustor de operação com equipamentos de proteção individual adequados.
- Montar o aparelho manual de síntese de peptídeos na capela de fumaça (Figura 1). Coloque as torneiras de três vias (ver Tabela de Materiais) no coletor de vácuo (ver Tabela de Materiais) e conecte-as ao nitrogênio (N2). Certifique-se de tampar as entradas não utilizadas.
- Fixe uma coluna de polipropileno de 10 ml (ver Tabela de Materiais) nas torneiras de três vias. Escorra a mistura de reacção ou solventes da coluna de polipropileno utilizando um bulbo de pipeta de borracha ou um vácuo através de uma armadilha de resíduos.
2. Síntese do peptídeo R8 linear marcado com FITC (FITC-R8) e do peptídeo R8 grampeado marcado com FITC (FITC-sR8-4)
NOTA: Os peptídeos foram sintetizados de acordo com um protocolo padrão de síntese de peptídeos em fase sólida (SPPS) baseado em Fmoc25. A resina 4-(2',4'-Dimetoxifeil-Fmoc-aminometil)-fenoxiacetamido-norleucil-MBHA (resina de MBHA de amida de rinque, ver Tabela de Materiais) foi usada durante todo o estudo.
CUIDADO: N, N-dimetilformamida (DMF), N, N-diisopropiletilamina (DIPEA), morfolina e diclorometano (DCM) são todos incolores e são prejudiciais se inalados ou absorvidos através da pele. O éter é extremamente inflamável. O 1,2-etaniol (EDT) é uma substância particularmente odorífera. O ácido trifluoroacético (TFA) é altamente corrosivo, e sua acidez é de 10 a5 vezes a do ácido acético. Consequentemente, todos os reagentes e produtos químicos devem ser tratados com o uso de equipamentos de proteção em uma capela de fumaça.
- Preparar a resina para síntese de peptídeos.
- Calcular a massa de resina necessária para a síntese:Massa de resina (mg) = escala (mmol) / capacidade de carga de resina (mmol/g) × 1.000 (mg/g)
NOTA: Por exemplo, a massa da resina MBHA de amida de rinque (0,572 mmol/g) para 0,2 mmol = 0,2 mmol / 0,572 mmol/g × 1.000 mg/g = 350 mg. - Adicionar 4-5 mL de DMF à quantidade necessária de resina e transferir para a coluna de polipropileno de 10 mL (passo 1.2) com borbulhamento suave de N2 por 30 min para inchar adequadamente a resina e, em seguida, drenar o DMF.
- Adicionar 4-5 mL de morfolina/DMF a 50% (v/v) à resina, borbulhar suavemente N2 por 30 min 2x para remover o grupo Fmoc N-terminal e, em seguida, drenar a mistura. Em seguida, lave bem a resina 3x adicionando 4-5 mL de DMF à coluna e borbulhando com N2 por pelo menos 1 min de cada vez. Continue a lavar a resina com DCM (3x) e DMF (3x) da mesma forma.
- Calcular a massa de resina necessária para a síntese:Massa de resina (mg) = escala (mmol) / capacidade de carga de resina (mmol/g) × 1.000 (mg/g)
- Execute o acoplamento de aminoácidos protegido por Fmoc conforme descrito abaixo.
NOTA: O acoplamento de arginina em uma síntese manual em escala de 0,2 mmol é descrito aqui como um exemplo.- Dissolver Fmoc-Arg (Pbf)-OH (5 equiv., 648,8 mg) e 2-(7-azobenzotriazol)-N, N, N', N'-tetrametilurônio hexafluorofosfato (HATU, 4,9 equiv., 372,6 mg) em 5 mL de DMF em um tubo de centrífuga.
- Adicionar DIPEA (10 equiv., 348,4 μL) para activar a reacção de acoplamento e, em seguida, transferir a mistura reactiva para a coluna de polipropileno de 10 ml com resina (preparada no passo 2.1.3). Em seguida, agite suavemente a mistura com N 2 borbulhando por1-2 h.
- Repetir a reacção de engate (passo 2.2.1 e passo 2.2.2) uma vez.
- Após a conclusão do acoplamento, drene a mistura de reação e lave a resina sequencialmente com DMF, DCM e DMF 3x cada por pelo menos 1 min cada vez.
- Realizar o acoplamento de cada aminoácido em etapas ordenadas: Adicionar 4-5 mL de morfolina/DMF a 50% (v/v) à resina, borbulhar suavemente com N 2 por 30 min 2x para remover o grupo N α-Fmoc, depois lavar a resina (como mostrado na etapa 2.2.4) e proceder ao acoplamento do próximo aminoácido (conforme mostrado nas etapas 2.2.1 e 2.2.2). Prossiga com vários ciclos desta etapa para alcançar a síntese do peptídeo desejado.
NOTA: Este processo pode ser pausado aqui. Condensar a resina com metanol e secar a resina com um fluxo contínuo de N2. Tampe a coluna de polipropileno e, em seguida, armazene a resina a 4 °C por alguns dias (ou a -20 °C para armazenamento mais longo). Inchar a resina com 4-5 mL de DMF por 0,5-1 h antes de iniciar uma nova síntese. Se avançar diretamente para a próxima etapa, não há necessidade de condensar a resina.
- Rotular os peptídeos com isotiocianato de fluoresceína (FITC) conforme descrito abaixo.
- Acoplar a beta-alanina como espaçador para marcação FITC usando o mesmo processo usado para acoplamento de aminoácidos na etapa 2.2.
- Realizar a marcação FITC de peptídeos na resina adicionando uma mistura de FITC (5 equiv.), DIPEA (10 equiv.) e DMF à coluna de polipropileno e reagindo no escuro por 8 h.
- Para a síntese do FITC-sR8-4, realizar a ciclização do peptídeo linear conforme descrito abaixo.
- Adicionar uma mistura de TFA/triisopropilsilano (TIS)/DCM (3/5/92, v/v/v) à coluna de polipropileno durante 2 minutos para remover selectivamente o grupo protector Cys (Trt) e, em seguida, drenar a mistura. Repita o procedimento acima até que a solução amarelada se torne incolor para remover completamente o grupo protetor Trt.
- Em seguida, realizar lavagens sequenciais da resina com DMF e DCM pelo menos 3x. Em seguida, dissolver 4,4'-bis(bromometil)bifenil (2 equiv.) em DMF com DIPEA (4 equiv.), adicioná-lo à coluna e reagir por 4 h.
- Clivar os peptídeos conforme descrito: Após a conclusão da síntese peptídica, lavar a resina com 4-5 mL de metanol duas vezes por 5 min cada e secá-la com um fluxo contínuo de N2. Trate a resina com um coquetel de clivagem eficaz TFA/TIS/H 2 O (95/2,5/2,5, v/v/v), ou TFA/TIS/EDT/H 2 O (92,5/2,5/2,5/2,5, v/v/v/v) para peptídeos contendo cisteínas, usando aproximadamente 1 mL de coquetel de clivagem para cada 100 mg de resina. Trate a resina ligada ao peptídeo por 2-3 h para clivar o peptídeo e, em seguida, remover o TFA cuidadosamente com uma corrente de N2.
- Para obter os peptídeos brutos, adicione 4-5 mL de éter dietílico à preparação peptídica clivada para precipitar os peptídeos brutos e centrifugar a 10.000 × g por 4 min. Descarte cuidadosamente o sobrenadante e seque o peptídeo ao ar por 3 minutos em uma exaustora eficaz.
- Análise dos peptídeos: Dissolver um peptídeo bruto em pequena escala (clivado de aproximadamente 10 mg de resina ligada a peptídeos) em 800 μL de acetonitrila (ACN)/H2O (1/1, v/v) e, em seguida, analisar usando cromatografia líquida de alta eficiência de fase reversa (RP-HPLC) e cromatografia líquida-espectrometria de massas (LC-MS) (ver Tabela de Materiais).
- Purificar os peptídeos usando RP-HPLC e LC-MS.
- Dissolver 50 mg de produto peptídico bruto em 4 ml de ACN/H2O (1/1, v/v) e injetar a solução num sistema RP-HPLC equipado com uma coluna C18 (4,6 mm x 150 mm, tamanho dos poros: 120 Å, tamanho da partícula: 4 μm; ver Tabela de Materiais). Eluir o peptídeo usando uma fase móvel contendo 0,1% TFA/H2O (v/v) e ACN, com um gradiente de 10% a 90% ACN ao longo de 30 min. Peptídeos convencionais foram detectados a 220 nm e peptídeos marcados com FITC a 494 nm.
- Coletar as frações correspondentes ao pico peptídico principal identificado por MS e, em seguida, liofilizar as frações peptídicas desejadas. Conservar o péptido purificado a -20 °C.
NOTA: Os m/z encontrados do FITC-R8 purificado são os seguintes: [M + 3 H]3+: 576,63; [M + 4 H] 4+: 432,72; [M + 5 H] 5+: 346,39; [M + 6 H] 6+: 288,85. Os m/z encontrados do FITC-sR8-4 purificado são os seguintes: [M + 3 H]3+: 704,74; [M + 4 H] 4+: 528,77; [M + 5 H] 5+: 423,34; [M + 6 H] 6+: 352,91. Condições analíticas de EM: instrumento: ESI (viés de sonda: +4,5 kV; detector: 1,2 kV); fluxo de gás do nebulizador: 1,5 L/min; linha de desolvação curva (CDL): −20 V; Temperatura CDL: 250 °C; temperatura do bloco: 400 °C; vazão: 0,2 mL/min; fase móvel: 50% H2O/50% ACN.
3. Quantificação dos peptídeos marcados com FITC
- Dissolva uma pequena quantidade de peptídeo purificado em DMSO como solução estoque (por exemplo, 40 μmol/mL).
- Medir a absorbância a 494 nm (A 494) de 2 μL da solução-mãe em498 μL de solução salina tamponada com fosfato 10 mM (1x PBS, pH 7,4) com uma placa de microtitulação (ver Tabela de Materiais) utilizando um leitor de microplacas multitecnologia (ver Tabela de Materiais). O fator de diluição é de 500 μL/ 2 μL = 250, e o comprimento do caminho da placa de microtitulação é de 0,5 mm.
- Calcular a concentração da solução-mãe utilizando a seguinte fórmula:
Concentração (mM) = A494 × fator de diluição / 0,05 (cm) / 77.000 (cm−1· M−1) × 1.000 (mM·M−1) - Ajustar a uma diluição adequada de modo a que o valor A494 medido se situe entre 0,1 e 1,0.
NOTA: As medições devem ser repetidas várias vezes para garantir que a concentração medida é precisa. O coeficiente de extinção de 77.000 cm−1· M−1 surge do grupo FITC.
4. Estabilidade de peptídeos no soro fetal bovino (SFB)
- Incubar o peptídeo a uma concentração de 100 μM com 250 μL de 25% FBS/H2O (v/v) a 37 °C. Depois de incubar por 0 h, 1 h, 2 h e 4 h, tomar alíquotas de 10 μL e, em seguida, adicionar 150 μl de ácido tricloroacético a 12% dissolvido em H2O/ACN (1/3, v/v) para precipitar as proteínas séricas.
- Centrifugar as amostras a 10.000 × g durante 5 minutos e analisar o sobrenadante utilizando HPLC (conforme descrito no passo 2.8) para determinar a extensão da degradação do péptide.
- Calcular a razão entre a área do pico em 1 h, 2 h e 4 h e aquela em 0 h para obter a fração de peptídeo não degradado no tempo correspondente. O resultado é a média de três amostras paralelas.
5. Captação celular dos peptídeos
- Imagem microscópica de fluorescência
- Coloque uma tampa redonda em uma placa de 12 poços. Em seguida, inocular 1 x 105 células uniformemente nas lamínulas e cultivar durante a noite com 2 mL de meio. Retire o meio e lave as células 3x com 1 mL de PBS.
NOTA: Neste estudo, células HeLa e células 4T1 foram cultivadas em meio de águia modificado de Dulbecco (DMEM, ver Tabela de Materiais) suplementado com 10% de FBS em uma incubadora umidificada a 37 °C contendo 5% de CO2. - Incubar as células com 1 mL de peptídeos marcados com FITC 3 μM em DMEM livre de FBS por 1 h a 37 °C. Em seguida, remova o meio contendo peptídeo e lave as células 3x com 1 mL de PBS.
- Manchar as células com 1 mL de Hoechst 33258 por 15 min. Observe a internalização de cada peptídeo usando um microscópio de fluorescência (ver Tabela de Materiais) com a mesma intensidade de fluorescência e tempo de exposição.
NOTA: As seguintes configurações foram usadas para microscopia de fluorescência. Objetivo: Plano-Apócroma: 63 x/1,40 óleo DIC M27; Canal 1 para FITC: filtro de excitação: 450-490 nm, filtro de emissão: 500-550 nm, tempo de exposição: 230 ms; Canal 2 para Hoechst 33258: filtro de excitação: 335-383 nm, filtro de emissão: 420-470 nm, tempo de exposição: 27 ms.
- Coloque uma tampa redonda em uma placa de 12 poços. Em seguida, inocular 1 x 105 células uniformemente nas lamínulas e cultivar durante a noite com 2 mL de meio. Retire o meio e lave as células 3x com 1 mL de PBS.
- Análise por citometria de fluxo
- Inocular 5 x 105 células HeLa uniformemente em placas de 12 poços e cultura em DMEM por 24 h a 37 °C. Em seguida, retire o meio e lave as células 3x com 1 mL de PBS.
- Incubar as células com 1 mL de peptídeos marcados com FITC 3 μM em DMEM livre de FBS por 1 h a 37 °C. Remover o meio contendo peptídeo, dissociar as células com tripsina 0,25% (p/v) e EDTA 0,53 mM em PBS por 5 min e, em seguida, coletar as células por centrifugação a 306 × g por 4 min. Lave o pellet de células com PBS.
- Incubar as células com 1 mL de azul de tripano a 0,05% (p/v) em PBS por 3 min para extinguir a fluorescência ligada à superfície e realizar análise quantitativa da fluorescência intracelular usando um citômetro de fluxo (ver Tabela de Materiais).
NOTA: Configurações de citometria de fluxo: excitação: 488 nm, emissão: 530 nm. O azul de tripano também pode extinguir a fluorescência de células mortas e ajudar a distinguir células vivas / mortas durante a análise da captação de peptídeos. - Tratar e testar células 4T1 usando citometria de fluxo seguindo o mesmo protocolo descrito para células HeLa. Coletar 5 x 105 células por amostra e configurar três amostras paralelas por grupo.
6. Exploração da penetração célula-célula dos peptídeos utilizando modelos transwell
- Inocular 1 x 105 células HeLa em 2 mL de DMEM em uma câmara de 12 poços com uma inserção de placa de cultura de tecidos (ver Tabela de Materiais) e incubar por 24 h em uma incubadora umidificada a 37 °C contendo 5% de CO2. Em seguida, remover o meio e incubar as células nas câmaras com 1 mL de FITC-R8 10 μM ou FITC-sR8-4 (purificado por HPLC) em DMEM livre de FBS por 1 h.
- Retire o meio que contém os peptídeos e lave as células 3x com 1 mL de PBS. Adicionar 1 mL de DMEM fresco livre de FBS às câmaras e, em seguida, co-incubar as células HeLa na câmara com a placa de cultura de tecidos inserida com as células HeLa nas lamínulas redondas na parte inferior por 2 h.
- Fixar as células HeLa nas lamínulas redondas com glutaraldeído a 2,5% durante 15 min e, em seguida, corar as células com DAPI durante 15 min. Em seguida, observe as células HeLa nas lamínulas sob um microscópio de fluorescência. Tratar e testar células 4T1 usando o mesmo protocolo usado para células HeLa.
Resultados
Neste protocolo, um procedimento sintético para restringir a poliarginina linear R8 em sua forma cíclica foi apresentado. A SPPS foi realizada manualmente, utilizando-se aparelho simples (Figura 1). O processo sintético detalhado da SPPS é mostrado na Figura 2. Resumidamente, a resina estava suficientemente inchada, seguida pela desproteção do grupo protetor N α-Fmoc. Em seguida, o aminoácido N α-Fmoc protegido foi ancorado na resina até a conclusão da montagem do peptídeo (passos 1-4 na Figura 2). Em seguida, os peptídeos brutos foram clivados da resina pelo coquetel de clivagem (passo 5 na Figura 2). O FITC foi usado para marcar os peptídeos para sintetizar CPPs cíclicos marcados fluorescentemente e rastrear sua permeabilidade através de barreiras biológicas. Posteriormente, os grupos tritilprotetores das cisteínas foram seletivamente desprotegidos na resina, seguindo-se a ciclização peptídica com ligação cruzada de 4,4'-bis(bromometil)bifenil (Figura 3A). Os espectros de HPLC e MS do FITC-R8 e FITC-sR8-4 são mostrados na Figura 3B. O tempo de retenção do FITC-sR8-4 foi substancialmente maior do que o do análogo linear, indicando maior hidrofobicidade global do peptídeo após a ciclização com a reticulação hidrofóbica. Além disso, como mostrado na Figura 3C, o R8 cíclico permaneceu 77,3% intacto após a incubação com 25% de SFB por 4 h, enquanto sua contraparte linear foi degradada em sua maioria, sugerindo maior estabilidade proteolítica do peptídeo R8 cíclico. Nos estudos subsequentes baseados em células, as células tratadas com R8 cíclico com ligações cruzadas aromáticas exibiram maior fluorescência intracelular do que aquelas tratadas com sua contraparte linear, como demonstrado por imagens de microscopia de fluorescência de células vivas (Figura 4A). Resultados semelhantes foram obtidos com a análise por citometria de fluxo (Figura 4B). Para investigar melhor se o R8 cíclico confere maior penetração célula-a-célula, modelos transwell foram usados para simular a permeabilidade de barreira dos peptídeos de uma camada celular para outra. O R8 cíclico exibiu claramente maior penetração transbarreira do que o peptídeo linear R8, como indicado por um aumento significativo na fluorescência intracelular (Figura 4C). Em resumo, o peptídeo R8 cíclico exibiu permeabilidade superior através de barreiras biológicas sobre sua contraparte linear.

Figura 1: Configuração do equipamento para o aparelho manual de síntese de peptídeos. Uma coluna de polipropileno de 10 mL é montada no coletor de vácuo usando uma válvula de parada de três vias. N2 é usado para agitação. Clique aqui para ver uma versão maior desta figura.

Figura 2: Procedimento geral da síntese de peptídeos de fase sólida (SPPS) Fmoc. Um aminoácido protegido por N α-Fmoc é ancorado à resina 4-(2',4'-Dimetoxifoil-Fmoc-aminometil)-fenoxiacetamido-norleucil-MBHA (resina de amida de rinque MBHA) (etapa 1), seguida de desproteção dos grupos protetores Nα-Fmoc dos aminoácidos (etapa 2) e subsequente acoplamento de aminoácidos (etapa 3). O passo 2 e o passo 3 são repetidos várias vezes para sintetizar o peptídeo desejado (passo 4). Após a conclusão da síntese, um coquetel de clivagem é adicionado para remover os grupos protetores da cadeia lateral e clivar o peptídeo desejado da resina (passo 5). Abreviações: DMF = N, N-dimetilformamida; DCM = diclorometano; HATU = 2-(7-azobenzotriazol)-N, N, N', N'-tetrametilurônio hexafluorofosfato; DIPEA = N, N-diisopropiletilamina; TFA = ácido trifluoroacético. Clique aqui para ver uma versão maior desta figura.

Figura 3: Síntese do peptídeo R8 linear marcado com FITC (FITC-R8) e do peptídeo R8 grampeado marcado com FITC (FITC-sR8-4) usando síntese de peptídeo de fase sólida (SPPS). (A) Diagrama esquemático da síntese de FITC-R8 e FITC-sR8-4. (B) Espectros de HPLC e MS (inset) do FITC-R8 e do FITC-sR8-4. (C) Estabilidade do FITC-R8 e do FITC-sR8-4 na presença de SFB a 25%. Peptídeo intacto (%) refere-se à fração de peptídeo não degradado. Esse valor foi modificado de Shi et al.15. Clique aqui para ver uma versão maior desta figura.
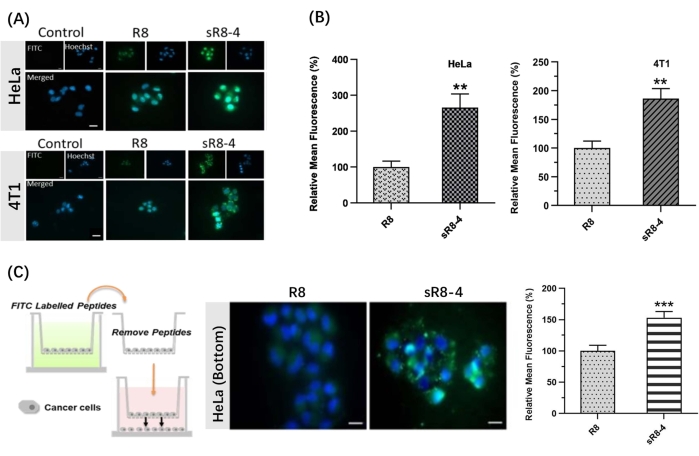
Figura 4: Penetração do peptídeo R8 linear marcado com FITC (FITC-R8) e do peptídeo R8 grampeado marcado com FITC (FITC-sR8-4). (A) Imagens de microscopia de fluorescência de células vivas de células HeLa e células 4T1 após 1 h de incubação com 3 μM de FITC-R8 e FITC-sR8-4. FITC (verde), Hoechst (azul). Barra de escala = 20 μm. (B) Fluorescência média relativa (em relação ao peptídeo linear R8), média ± d.p. e n = 3; (C) Penetração célula-célula de FITC-R8 e FITC-sR8-4 em um modelo transwell usando células HeLa. Imagens de microscopia de fluorescência de células vivas (barra de escala = 20 μm) e fluorescência média relativa (em relação ao peptídeo linear R8), média ± d.s. e n = 3. ** P < 0,01, *** P < 0,001. Esse valor foi modificado de Shi et al.15. Clique aqui para ver uma versão maior desta figura.
Discussão
A estabilização química de peptídeos pela incorporação de restrições conformacionais tem se mostrado uma estratégia eficaz para melhorar a estabilidade e a permeabilidade celular do peptídeo26. Neste protocolo, um procedimento passo-a-passo é descrito para a síntese de CPPs cíclicas com ligações cruzadas aromáticas e a avaliação de sua permeabilidade através de barreiras biológicas. Comparada às ligações cruzadas hidrofílicas lactâmicas ou triazólicas22,27, a incorporação de ligações cruzadas aromáticas (utilizadas neste estudo) melhora a hidrofobicidade global das PPCs, aumentando significativamente sua permeabilidade celular. Por outro lado, a ciclização de peptídeos pode ser facilmente obtida através de reações de substituição por cisteínas sem a necessidade de catalisadores metálicos. Nesse protocolo, a ciclização dos PPCs foi realizada em resina; entretanto, a eficiência da ciclização também depende das sequências e comprimentos específicos dos peptídeos devido aos efeitos estéricos, que podem resultar na formação de um subprodutodimérico28. Nesse caso, o uso de uma resina com menor capacidade de carga seria útil. Além disso, recomenda-se também a ciclização desses peptídeos específicos em concentrações diluídas na fase29 da solução.
Há alguns pontos críticos nesse protocolo. Primeiro, o coquetel de clivagem TFA/TIS/EDT/H 2 O (92,5/2,5/2,5/2,5, v/v/v/v) é usado para a clivagem de peptídeos contendo cisteína para prevenir a oxidação do grupo sulfidrila. Em segundo lugar, sugere-se a realização de um estudo preliminar em pequena escala para obter a condição de clivagem apropriada. O tempo ideal necessário para clivar os peptídeos da resina é de 2-3 h, com um tempo de clivagem mais longo (mais de 5 h) tendendo a produzir mais subprodutos não identificados. A síntese peptídica pode ser monitorada por LC-MS para otimizar o tempo de clivagem. Em terceiro lugar, a marcação FITC deve ser feita no escuro para evitar a extinção da fluorescência.
Além disso, o azul de tripano deve ser usado para extinguir a fluorescência ligada à superfície, pois a análise por citometria de fluxo não pode distinguir fluorescência intracelular ou superficial. Isso ajudará a quantificar especificamente o peptídeo internalizado pelas células cancerosas27. Além disso, como peptídeos catiônicos também podem causar lise inespecífica de membrana30, a atividade hemolítica e a viabilidade celular também poderiam ser conduzidas para avaliar a toxicidade das PPCs cíclicas.
Os CPPs cíclicos constituem um dos veículos eficazes de liberação de fármacos para vencer barreiras biológicas. No entanto, a interação da membrana e a perturbação das PPCs catiônicas geralmente levam a potencial citotoxicidade inespecífica31. Esforços adicionais serão dedicados à compreensão do mecanismo detalhado de penetração, o que deve ajudar a descoberta da próxima geração de CPPs cíclicos para penetrar barreiras biológicas com o mínimo de citotoxicidade. Essas PPCs altamente ativas e estáveis são uma grande promessa para melhorar o tratamento de doenças importantes que ameaçam a vida.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho é apoiado pela Natural Science Foundation of China (21708031), China Postdoctoral Science Foundation (BX20180264, 2018M643519) e pelos Fundos de Pesquisa Fundamental para as Universidades Centrais (2682021ZTPY075).
Materiais
| Name | Company | Catalog Number | Comments |
| 1,2-ethanedithiol | Aladdin | K1722093 | stench |
| 2-(7-Azobenzotriazole)-N,N,N',N'-tetramethyluronium hexafluorophosphate (HATU) | HEOWNS | A-0443697 | |
| 4,4'-bis(bromomethyl)biphenyl | TCI | B1921 | |
| 4T1 cells | ATCC | 4T1 cells were cultured in DMEM medium supplemented with 10% FBS (Hyclone) in a 37 °C humidified incubator containing 5% CO2. | |
| Acetonitrile | Adamas | 1484971 | toxicity |
| Dichloromethane | Energy | W330229 | skin harmful |
| Diethyl ether | Aldrich | 673811 | flammable |
| Dimethyl sulfoxide | Beyotime | ST038 | skin harmful |
| Dulbecco’s Modified Eagle Medium (DMEM) | Gibco | ||
| Electrospray Ionization Mass Spectrometer | Waters | G2-S Tof | |
| Ethylene Diamine Tetraacetic Acid (EDTA) | BioFroxx | 1340 | |
| Fetal bovine serum (FBS) | HyClone | ||
| Flow cytometer | Beckman Coulter | CytoFLEX | |
| Fluorescein isothiocyanate isomer (FITC) | Energy | E0801812500 | |
| Fluorescent microscope | Carl Zeiss | Axio Observer 7 | |
| Fmoc-Arg(Pbf)-OH | HEOWNS | F-81070 | |
| Fmoc-Cys(Trt)-OH | GL Biochem | GLS201115-35202 | |
| Fmoc-βAla-OH | Adamas | 51341C | |
| HeLa cells | ATCC | HeLa cells were cultured in DMEM supplemented with 10% FBS (Hyclone) in a 37 °C humidified incubator containing 5% CO2. | |
| High-Performance Liquid Chromatography | Agilent | Agilent 1260 | |
| High-Performance Liquid Chromatography column | Agilent | Poroshell EC-C18 120, 4.6 × 150 mm (pore size 120 Å, particle size 4 μm) | |
| Lyophilizer | SP Scientific | Vir Tis | |
| Methanol | Aldrich | 9758 | toxicity |
| Microtiter plate | Thermo μdrop plate | N12391 | |
| Morpholine | HEOWNS | M99040 | irritant |
| Multi-technology microplate reader | Thermo | VARIOSKAN LUX | |
| N,N-Diisopropylethylamine | HEOWNS | E-81416 | irritant |
| N,N-Dimethyl formamide | Energy | B020051 | harmful to skin |
| Poly-Prep column | Bio-Rad | 7321010 | polypropylene chromatography columns |
| Rink Amide MBHA resin (0.572 mmol/g) | GL Biochem | GLS180301-49101 | |
| Three-way stopcocks | Bio-Rad | 7328107 | |
| Tissue culture plate insert | LABSELECT | 14211 | |
| Trifluoroacetic acid | HEOWNS | T63278 | corrosive |
| Triisopropylsilane | HEOWNS | T-0284475 | |
| Trypsin | BioFroxx | 1004 | |
| Vacuum manifold | Promega | A7231 |
Referências
- Zhang, L., et al. Brain-targeted dual site-selective functionalized poly(β-amino esters) delivery platform for nerve regeneration. Nano Letters. 21 (7), 3007-3015 (2021).
- Park, T. E., et al. Enhanced BBB permeability of osmotically active poly(mannitol-co-PEI) modified with rabies virus glycoprotein via selective stimulation of caveolar endocytosis for RNAi therapeutics in Alzheimer's disease. Biomaterials. 38, 61-71 (2015).
- Bian, J., et al. Effect of cell-based intercellular delivery of transcription factor GATA4 on ischemic cardiomyopathy. Circulation Research. 100 (11), 1626-1633 (2007).
- He, H., et al. The use of low molecular weight protamine chemical chimera to enhance monomeric insulin intestinal absorption. Biomaterials. 34 (31), 7733-7743 (2013).
- Kim, D., et al. A specific STAT3-binding peptide exerts antiproliferative effects and antitumor activity by inhibiting STAT3 phosphorylation and signaling. Cancer Research. 74 (8), 2144-2151 (2014).
- Yang, Y., et al. PEGylated liposomes with NGR ligand and heat-activable cell-penetrating peptide-doxorubicin conjugate for tumor-specific therapy. Biomaterials. 35 (14), 4368-4381 (2014).
- Wei, Y., et al. Intracellular paclitaxel delivery facilitated by a dual-functional CPP with a hydrophobic hairpin tail. ACS Applied Materials and Interfaces. 13 (4), 4853-4860 (2021).
- Vasan, N., Baselga, J., Hyman, D. M. A view on drug resistance in cancer. Nature. 575 (7782), 299-309 (2019).
- Cong, Y., et al. Microenvironment-induced in situ self-assembly of polymer-peptide conjugates that attack solid tumors deeply. Angewandte Chemie International Edition. 131 (14), 4680-4685 (2019).
- Blanco, E., Shen, H., Ferrari, M. Principles of nanoparticle design for overcoming biological barriers to drug delivery. Nature Biotechnology. 33 (9), 941-951 (2015).
- Tian, Y., Zhou, S. Advances in cell-penetrating peptides and their functionalization of polymeric nanoplatforms for drug delivery. Wiley Interdisciplinary Reviews. Nanomedicine and Nanobiotechnology. 13 (2), 1-12 (2021).
- Milletti, F. Cell-penetrating peptides: Classes, origin, and current landscape. Drug Discovery Today. 17 (15-16), 850-860 (2012).
- Turner, J. J., et al. Cell-penetrating peptide conjugates of peptide nucleic acids (PNA) as inhibitors of HIV-1 Tat-dependent trans-activation in cells. Nucleic Acids Research. 33 (21), 6837-6849 (2005).
- Tunnemann, G., et al. Live-cell analysis of cell penetration ability and toxicity of oligo-arginines. Journal of Peptide Science. 14 (4), 469-476 (2008).
- Shi, M., et al. Stapling of short cell-penetrating peptides for enhanced tumor cell-and-tissue dual-penetration. Chemical Communications. 58 (14), 2299-2302 (2022).
- Komin, A., et al. A peptide for transcellular cargo delivery: Structure-function relationship and mechanism of action. Journal of Controlled Release. 324, 633-643 (2020).
- Dietrich, L., et al. Cell permeable stapled peptide inhibitor of Wnt signaling that targets β-catenin protein-protein interactions. Cell Chemical Biology. 24 (8), 958-968 (2017).
- Tian, Y., et al. Stapling of unprotected helical peptides via photo-induced intramolecular thiol-yne hydrothiolation. Chemical Science. 7 (5), 3325-3330 (2016).
- De Araujo, A. D., et al. Comparative α-helicity of cyclic pentapeptides in water. Angewandte Chemie International Edition. 53 (27), 6965-6969 (2014).
- Chu, Q., et al. Towards understanding cell penetration by stapled peptides. Medicinal Chemistry Communications. 6 (1), 111-119 (2015).
- Bock, J. E., Gavenonis, J., Kritzer, J. A. Getting in shape: Controlling peptide bioactivity and bioavailability using conformational constraints. ACS Chemical Biology. 8 (3), 488-499 (2013).
- Tian, Y., et al. Effect of stapling architecture on physiochemical properties and cell permeability of stapled α-helical peptides: A comparative study. ChemBioChem. 18 (21), 2087-2093 (2017).
- White, C. J., Yudin, A. K. Contemporary strategies for peptide macrocyclization. Nature Chemistry. 3 (7), 509-524 (2011).
- Jain, R. K. Normalization of tumor vasculature: An emerging concept in antiangiogenic therapy. Science. 307 (5706), 58-62 (2005).
- Patgiri, A., Menzenski, M. Z., Mahon, A. B., Arora, P. S. Solid-phase synthesis of short α-helices stabilized by the hydrogen bond surrogate approach. Nature Protocols. 5 (11), 1857-1865 (2010).
- Baek, S., et al. Structure of the stapled p53 peptide bound to Mdm2. Journal of the American Chemical Society. 134 (1), 103-106 (2012).
- Traboulsi, H., et al. Macrocyclic cell penetrating peptides: A study of structure-penetration properties. Bioconjugate Chemistry. 26 (3), 405-411 (2015).
- Tian, Y., et al. A proline-derived transannular N-cap for nucleation of short α-helical peptides. Chemical Communications. 52 (59), 9275-9278 (2016).
- Muppidi, A., et al. Rational design of proteolytically stable, cell-permeable peptide-based selective Mcl-1 inhibitors. Journal of the American Chemical Society. 134 (36), 14734-14737 (2012).
- Wiradharma, N., et al. Synthetic cationic amphiphilic α-helical peptides as antimicrobial agents. Biomaterials. 32 (8), 2204-2212 (2011).
- Jones, A. T., Sayers, E. J. Cell entry of cell penetrating peptides: Tales of tails wagging dogs. Journal of Controlled Release. 161 (2), 582-591 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados