Method Article
Мышечная модель повреждения брюшины, вызванного хлоргексидином глюконатом
* Эти авторы внесли равный вклад
В этой статье
Резюме
Настоящий протокол устанавливает модель перитонеального фиброза, индуцированного хлоргексидином глюконатом (КГ), у мышей с помощью перитонеального диализа (ПД). Текущая модель проста и удобна в использовании по сравнению с другими моделями PD на животных.
Аннотация
Перитонеальный фиброз является важным осложнением перитонеального диализа (БП). Для исследования и решения этой проблемы требуется соответствующая животная модель БП. Настоящий протокол устанавливает модель перитонеального фиброза, индуцированную хлоргексидином глюконатом (ХГ), которая имитирует состояние пациента с БП. Перитонеальный фиброз был индуцирован внутрибрюшинной инъекцией 0,1% КГ в 15% этаноле в течение 3 недель (вводили через день), в общей сложности девять раз у самцов мышей C57BL / 6. Затем на 22-й день были проведены перитонеальные функциональные пробы. После того, как мыши были принесены в жертву, была собрана париетальная брюшина брюшной стенки и висцеральная брюшина печени. Они были толще и более фиброзными при микроскопическом анализе после трихромного окрашивания Массона. Скорость ультрафильтрации снизилась, а массовый транспорт глюкозы указал на индуцированное ХГ увеличение проницаемости брюшины. Созданная таким образом модель БП может быть применена для улучшения технологии БП, эффективности диализа и продления выживаемости пациентов.
Введение
Перитонеальный диализ (ПД) является одним из видов заместительной почечной терапии. Однако у ПД есть проблемы, которые невозможно решить. Например, длительное лечение БП может вызвать повреждение брюшины, что в конечном итоге приведет к неудаче ультрафильтрации и прекращению лечения 1,2,3,4,5,6. Перитонеальный фиброз является одним из самых серьезных осложнений 7,8. Перитонеальный фиброз характеризуется отложением и накоплением внеклеточного матрикса в интерстиции, а также неоангиогенезом и васкулопатией брюшины 9,10.
Основными причинами этих перитонеальных изменений являются рецидивирующий перитонит и небиосовместимость диализата, которые являются гиперосмотическими, с высоким содержанием глюкозы, низким рН и накоплением продуктов распада глюкозы11,12. Таким образом, подходящие экспериментальные модели на животных могут помочь исследователям лучше изучить физиологические и патологические изменения брюшины во время терапии БП. Таким образом, создание модели БП животных важно для улучшения технологии БП и эффективности диализа, а также для продления выживаемости пациентов. Это исследование было направлено на создание модели БП у мышей путем внутрибрюшинной (внутривенной) инъекции хлоргексидина глюконата (КГ), как описано ранее13,14. Эта модель мыши PD проста, удобна в использовании и осуществима по сравнению с другими моделями PD животных.
протокол
Все эксперименты на мышах были одобрены Центром лабораторных животных больницы E-DA / Университета I-Shou и проводились в соответствии с «Руководством по уходу и использованию лабораторных животных» (NRC, США 2011 г.). Для настоящего исследования использовали самцов мышей C57BL/6 в возрасте 7-8 недель.
1. Химическая подготовка
- Приготовьте химический раздражитель, разбавив 0,1% хлоргексидина глюконата (CG, см. Таблицу материалов) в 15% этаноле.
2. Лечение животных
- Назначьте трех мышей в качестве контрольной группы. Выполняйте внутрибрюшинную инъекцию (в/) 1 мл/кг 0,9% физиологического раствора (НС) через день в течение 3 недель, всего девять раз.
- Назначьте трех мышей в группу перитонеального фиброза. Индуцировать перитонеальный фиброз с помощью хлоргексидина глюконата (ХГ) путем внутримышечного введения 0,1% ХГ в 15% этаноле (этап 1.1) в дозе 12,5 мкл / г массы тела. Выполняйте это через день в течение 3 недель, всего девять раз.
3. Тесты функции брюшины (модифицированный тест перитонеального равновесия)
- Приготовьте диализирующий раствор, содержащий 4,25% глюкозы. Возьмите 0,5 мл образца диализата с помощью шприца, а затем проверьте концентрацию глюкозы в образце диализата.
ПРИМЕЧАНИЕ: Концентрация глюкозы определяется по методу гексокиназы/G6PD. Образцы диализата были подвергнуты анализу Glu 2 L-типа и исследованы с помощью биохимического анализатора (см. Таблицу материалов). Это начальная концентрация глюкозы диализата. - Обезболивают мышей внутримышечным введением Золетила и Ксилазина (приготовленных в соотношении 1:2 по объему, см. Таблицу материалов) в дозе 20 мкл/20 гв. Кроме того, используйте ветеринарную мазь на глаза, чтобы предотвратить сухость под наркозом.
- Проводят внутривенную инстилляцию диализирующего раствора (2 мл/20 г массы тела).
- Через 30 минут оцените и проверьте глубину анестезии при отсутствии рефлекса защемления пальцев ног. Затем выполните вертикальный разрез по средней линии брюшной полости (под мечевидным отростком), затем откройте брюшную полость мышей и соберите внутрибрюшинную жидкость с помощью шприца (определяемого как «объем 1»). Затем измерьте вес чистого и сухого хлопка и поместите вату в брюшную полость мышей, чтобы поглотить остаточную внутрибрюшинную жидкость. Наконец, снова измерьте вес хлопка.
ПРИМЕЧАНИЕ: Прибавка в весе хлопка равна весу остаточной внутрибрюшинной жидкости. Затем преобразуйте в полученный объем (удельный вес: 1 г/см3; определяется как «объем 2»). Окончательный объем диализата составляет том 1 плюс том 2. - Используйте 0,5 мл образца диализата (конечный диализат) для измерения концентрации глюкозы. Это конечная концентрация глюкозы диализата.
- Рассчитайте чистую ультрафильтрацию по формуле15:
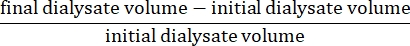
- Рассчитайте проницаемость брюшины по следующей формуле15:

4. Тканевая подготовка мышц брюшной стенки и печени и гистологический анализ
- Принесите мышей в жертву с помощью пункции сердца (флеботомии)3,16.
- Разрез брюшной стенки (1 см х 1 см) и тотальная гепатэктомия. Зафиксируйте брюшную стенку и ткани печени мышей на ночь в 10% нейтральном буферном формалине.
- Подготовьте парафиновые срезы мышц брюшной стенки и печени толщиной 3 мкм и проведите гистологический анализ в соответствии с ранее опубликованным отчетом17.
- Оцените париетальную брюшину брюшной стенки и висцеральную брюшину поверхности печени мышей с помощью морфометрии18.
- Выполняйте статистический анализ с помощью программного обеспечения для статистики и построения графиков (см. Таблицу материалов). Выразите все данные как среднее ± SD и проанализируйте статистическую значимость с помощью t-критерия19. Определите значения с P < 0,05 как значимые результаты.
Результаты
На рисунке 1A, B париетальная брюшина брюшной стенки была заметно толще и более фиброзной при трихромном окрашиванииМассона 17, что указывает на то, что в группе, подвергшейся воздействию ХГ, перитонеальный фиброз более тяжелый, чем в контрольной группе с физиологическим раствором (NS). На рисунке 2A, B висцеральная брюшина поверхности печени также была заметно толще и более фиброзной, что доказывает, что в группе, подвергшейся воздействию ХГ, перитонеальный фиброз более тяжелый, чем в контрольной группе с физиологическим раствором (NS). На рисунке 3А скорость ультрафильтрации снизилась в группе ХГ, а транспорт массы глюкозы показал, что перитонеальная проницаемость увеличилась в группе, индуцированной ХГ (рис. 3В).

Рисунок 1: Фиброз париетальной брюшины брюшной стенки на мышиной модели перитонеального диализа (ПД). (A) В группе, подвергшейся воздействию ХГ, перитонеальный фиброз является более тяжелым, чем в контрольной группе (НС) при трихромном окрашивании Массона. В) количественные данные по подпункту (А), представленные в виде среднего ± стандартного отклонения, n ≥ 3; P < 0,01. Для (A) масштабная линейка = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
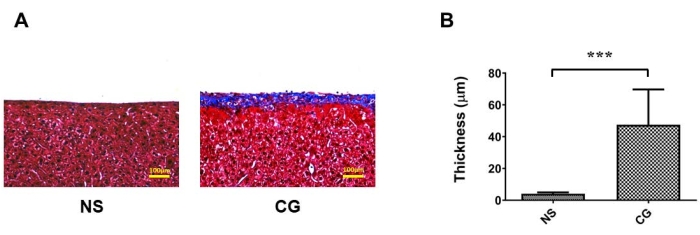
Рисунок 2: Фиброз висцеральной брюшины поверхностей печени на мышиной модели перитонеального диализа (ПД). (A) Для группы, подвергшейся воздействию ХГ, перитонеальный фиброз является более тяжелым, чем в контрольной группе (NS) при трихромном окрашивании Массона. В) количественные данные по подпункту (А), представленные в виде среднего ± стандартного отклонения, n ≥ 3; P < 0,005. Для (A) масштабная линейка = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
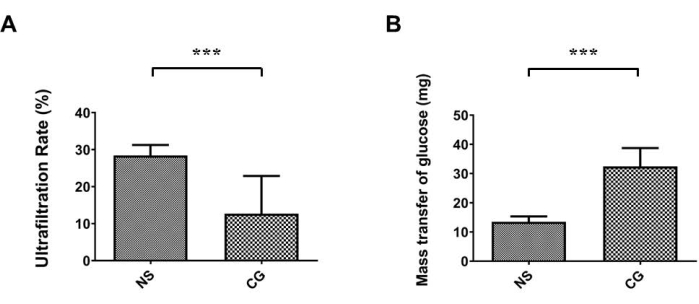
Рисунок 3: Ухудшение функции брюшины в мышиной модели БП. (A) В группе, подвергшейся воздействию хлоргексидина глюконата (CG), скорость ультрафильтрации была значительно ниже, чем в контрольной группе физиологического раствора (NS). (B) Массовый транспорт глюкозы также указывал на то, что CG-индуцировал увеличение перитонеальной проницаемости. Данные представлены в виде среднего ± стандартного отклонения, n ≥ 3; P < 0,005. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
В этом исследовании модель БП мыши представлена внутримышной инъекцией ХГ, и результаты показали перитонеальный фиброз и функциональное ухудшение в этой модели, которая имитировала состояние пациента с БП.
В протоколе есть несколько важных шагов. Во-первых, для выполнения внутривенной инъекции CG или NS кожа брюшной стенки мыши должна быть подобрана с помощью щипцов, чтобы предотвратить индуцированное пункцией внутрибрюшинное повреждение органов. Во-вторых, при сборе брюшины брюшной стенки для гистологического анализа следует избегать области, поврежденной внутривенными инъекциями.
Среди нескольких экспериментальных моделей перитонеального фиброза на животных наиболее распространенной является модель CG из-за ее простоты использования и адаптируемости. Suga et al.20 были первыми, кто сообщил о модели перитонеального фиброза крыс, индуцированной CG, в 1995 году. Внутривенные инъекции 0,1% КГ и 15% этанола, растворенного в 2 мл физиологического раствора, применяли ежедневно в течение 26 дней. IshiI et al.21 использовали мышей C57BL / 6 и вводили 0,3 мл 0,1% CG с 15% этанолом, растворенным в физиологическом растворе, внутримышечно в течение 56 дней, где у мышей был индуцирован экспериментальный склерозирующий инкапсулирующий перитонит. Nishino et al.22 использовали крыс Wistar, которые получали внутримышечно инъекции 0,1% CG в день в 15% этаноле, растворенном в 2 мл физиологического раствора в течение 28 дней. Mishima et al.23 использовали аналогичный метод для индукции перитонеального фиброза у крыс Sprague-Dawley (SD) в том же году. Kushiyama et al.24 использовали крыс SD и вводили 0,1% CG в 15% этаноле, растворенном в физиологическом растворе (1,5 мл / 100 г массы тела) внутримышечно три раза в неделю в течение 21 дня. Nishino et al.25 использовали мышей ежедневно, вводя инъекцию 0,1% CG в 15% этанол внутрибрюшинно, растворенный в 0,2 мл физиологического раствора в течение 7 дней и 15 дней. Lua et al.26 использовали тамоксифен, эмульгированный в кунжутном масле в концентрации 12,5 мг/мл, растворенный в этаноле, и внутривенно вводили мышам в дозе 100 мг/г массы тела в течение 3-дневного интервала. Через 2 недели мышам вводили 0,1% КГ в 15% физиологическом растворе с этанолом / фосфатом (1,5 мл / 100 г) через день, в общей сложности 10 доз. Yoh et al.14 использовали крыс SD и вводили 1,5 мл / 100 г массы тела 0,1% CG в 15 % этаноле, растворенном в физиологическом растворе, инъекции три раза в неделю в течение 21 дня. Yoh et al. использовали 10-недельных мышей и вводили 0,1% CG (0,01 мл / г массы тела) в инъекциях 15% этанола три раза в неделю в течение 21 дня. В том же году lo et al.13 также использовали аналогичный метод.
Данная модель имеет некоторые ограничения. Во-первых, в этой модели на животных CG использовалась в качестве химического стимулятора для индукции функционального ухудшения из-за перитонеального фиброза вместо диализата. CG является химическим раздражителем, и его повторное введение может привести к дегенерации мезотелиальных клеток и воспалительным реакциям, вызывая тем самым чрезмерный фиброз. Наблюдалось воспаление и неоваскуляризация, и эти результаты были аналогичны тем, которые наблюдались у пациентов с БП. Хотя инъекции CG приводят к значительному утолщению брюшины, предыдущее исследование показало, что отложение фибрина было относительно слабее27. Во-вторых, у мышей, использованных в настоящем исследовании, не было заболеваний почек; Следовательно, влияние уремических токсинов на брюшину оценить не удалось. В-третьих, мы не оценивали воспаление, ангиогенез и отложение внеклеточного матрикса в брюшине. Однако, согласно предыдущему исследованию13, та же животная модель уже показала, что количество как F4/80-положительных клеток, так и CD31-положительных сосудов увеличивается после воздействия ХГ. Поэтому необходимо отметить, что результаты, полученные на этой животной модели, не могут в полной мере отражать состояние БП у пациентов с перитонеальным диализом. У пациентов с БП механизм повреждения брюшины сложен и может следовать различным схемам.
Несмотря на все эти ограничения, настоящая модель проста, удобна в использовании и осуществима по сравнению с другими моделями БП на животных, согласно предыдущим исследованиям 3,13,14,16,18,25. Этот метод представляет собой модель перитонеального фиброза, связанную с БП, которая может быть применена к полевым исследованиям БП.
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Мы искренне благодарим Шин-Хан Ценга за критическое обсуждение и частичное выполнение исследования. Это исследование было поддержано EDAHP110003 и NCKUEDA110002 из Исследовательского фонда больницы E-DA и Национального университета Ченг Кунг, Тайвань.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.9% Normal Saline | Y F CHEMICAL CORP., New Taipei City, Taiwan | - | |
| 10% neutral buffered formalin | Taiwan Burnett International Co., Ltd., Taipei City, Taiwan | 00002A | |
| Automatic biochemical analyzer | Hitachi Ltd., Tokyo, Japan | Labospect Series 008 | for determining glucose concentration |
| Chlorhexidine digluconate solution, 20% in H2O | Sigma-Aldrich, MO, USA | C9394 | diluted to 0.1% with 15% ethanol for injection |
| Ethanol | Avantor Performance Materials, LLC, PA, USA | BAKR8006-05 | diluted to 15% with normal saline for working concentration |
| Glucose (Dianeal) | Baxter International, Inc., IL, USA | FNB9896 | Commercial dialysis solution (4.25%) |
| GraphPad Prism 8.0 | GraphPad Software, Inc., CA, US | ||
| L-type Glu 2 assay | FUJIFILM Wako, Japan | 461-32403 | |
| Xylazine 20 | Juily Pharmaceutical Co., Ltd., New Taipei City, Taiwan | - | |
| Zoletil 50 | Virbac Laboratories, Carros, France | - |
Ссылки
- Han, S. H., et al. Improving outcome of CAPD: twenty-five years' experience in a single Korean center. Peritoneal Dialysis International. 27 (4), 432-440 (2007).
- Kawaguchi, Y., Hasegawa, T., Nakayama, M., Kubo, H., Shigematu, T. Issues affecting the longevity of the continuous peritoneal dialysis therapy. Kidney International Supplements. 62, 105-107 (1997).
- Lee, Y. C., et al. Vitamin D can ameliorate chlorhexidine gluconate-induced peritoneal fibrosis and functional deterioration through the inhibition of epithelial-to-mesenchymal transition of mesothelial cells. BioMed Research International. 2015, 595030 (2015).
- Nakamoto, H., Kawaguchi, Y., Suzuki, H. Is technique survival on peritoneal dialysis better in Japan. Peritoneal Dialysis International. 26 (2), 136-143 (2006).
- Schaefer, F., Klaus, G., Muller-Wiefel, D. E., Mehls, O. Current practice of peritoneal dialysis in children: results of a longitudinal survey. Mid European Pediatric Peritoneal Dialysis Study Group (MEPPS). Peritoneal Dialysis International. 19, 445-449 (1999).
- Woodrow, G., Turney, J. H., Brownjohn, A. M. Technique failure in peritoneal dialysis and its impact on patient survival. Peritoneal Dialysis International. 17 (4), 360-364 (1997).
- Schmidt, D. W., Flessner, M. F. Pathogenesis and treatment of encapsulating peritoneal sclerosis: basic and translational research. Peritoneal Dialysis International. 28, 10-15 (2008).
- Augustine, T., Brown, P. W., Davies, S. D., Summers, A. M., Wilkie, M. E. Encapsulating peritoneal sclerosis: clinical significance and implications. Nephron Clinical Practice. 111 (2), 149-154 (2009).
- Di Paolo, N., Nicolai, G. A., Garosi, G. The peritoneum: from histological studies to mesothelial transplant through animal experimentation. Peritoneal Dialysis International. 28, 5-9 (2008).
- Fusshoeller, A. Histomorphological and functional changes of the peritoneal membrane during long-term peritoneal dialysis. Pediatric Nephrology. 23 (1), 19-25 (2008).
- Goffin, E. Peritoneal membrane structural and functional changes during peritoneal dialysis. Seminars in Dialysis. 21 (3), 258-265 (2008).
- Ito, T., Yorioka, N. Peritoneal damage by peritoneal dialysis solutions. Clinical and Experimental Nephrology. 12 (4), 243-249 (2008).
- Io, K., et al. SAHA suppresses peritoneal fibrosis in mice. Peritoneal Dialysis International. 35 (3), 246-258 (2015).
- Yoh, K., Ojima, M., Takahashi, S. Th2-biased GATA-3 transgenic mice developed severe experimental peritoneal fibrosis compared with Th1-biased T-bet and Th17-biased RORgammat transgenic mice. Experimental Animals. 64 (4), 353-362 (2015).
- Karl, Z. J. T., et al. Peritoneal Equilibration Test. Peritoneal Dialysis International. 7 (3), 138-148 (1987).
- Lee, Y. C., et al. The clinical implication of vitamin D nanomedicine for peritoneal dialysis-related peritoneal damage. International Journal of Nanomedicine. 14, 9665-9675 (2019).
- Goldner, J. A. Modification of the masson trichrome technique for routine laboratory purposes. The American Journal of Pathology. 14 (2), 237-243 (1938).
- Cheng, F. Y., et al. Novel application of magnetite nanoparticle-mediated vitamin D3 delivery for peritoneal dialysis-related peritoneal damage. International Journal of Nanomedicine. 16, 2137-2146 (2021).
- Ross, A., Willson, V. L. . Basic and Advanced Statistical Tests: Writing Results Sections and Creating Tables and Figures. , 13-16 (2017).
- Suga, H., et al. Preventive effect of pirfenidone against experimental sclerosing peritonitis in rats. Experimental and Toxicologic Pathology. 47 (4), 287-291 (1995).
- Ishii, Y., et al. An experimental sclerosing encapsulating peritonitis model in mice. Nephrology Dialysis Transplantation. 16 (6), 1262-1266 (2001).
- Nishino, T., et al. Antisense oligonucleotides against collagen-binding stress protein HSP47 suppress peritoneal fibrosis in rats. Kidney International. 64 (3), 887-896 (2003).
- Mishima, Y., et al. Enhanced expression of heat shock protein 47 in rat model of peritoneal fibrosis. Peritoneal Dialysis International. 23 (1), 14-22 (2003).
- Kushiyama, T., et al. Effects of liposome-encapsulated clodronate on chlorhexidine gluconate-induced peritoneal fibrosis in rats. Nephrology Dialysis Transplantation. 26 (10), 3143-3154 (2011).
- Nishino, T., et al. Involvement of lymphocyte infiltration in the progression of mouse peritoneal fibrosis model. Renal Failure. 34 (6), 760-766 (2012).
- Lua, I., Li, Y., Pappoe, L. S., Asahina, K. Myofibroblastic conversion and regeneration of mesothelial cells in peritoneal and liver fibrosis. The American Journal of Pathology. 185 (12), 3258-3273 (2015).
- Kitamura, M., et al. Epigallocatechin gallate suppresses peritoneal fibrosis in mice. Chemico-Biological Interactions. 195 (1), 95-104 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены