Method Article
Un modèle de souris de dommages péritonéaux induits par le gluconate de chlorhexidine
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le présent protocole établit un modèle murin de dialyse péritonéale () de fibrose péritonéale induite par le gluconate de chlorhexidine (CG). Le modèle actuel est simple et facile à utiliser par rapport aux autres modèles animaux de DP.
Résumé
La fibrose péritonéale est une complication importante de la dialyse péritonéale (MP). Pour étudier et résoudre ce problème, un modèle animal approprié de MP est nécessaire. Le présent protocole établit un modèle de fibrose péritonéale induite par le gluconate de chlorhexidine (CG) qui imite l’état d’un patient atteint de la MP. La fibrose péritonéale a été induite par injection intrapéritonéale de 0,1% de CG dans de l’éthanol à 15% pendant 3 semaines (administrée tous les deux jours), pour un total de neuf fois chez des souris mâles C57BL/6. Des tests fonctionnels péritonéaux ont ensuite été effectués le jour 22. Après le sacrifice des souris, le péritoine pariétal de la paroi abdominale et le péritoine viscéral du foie ont été récoltés. Ils étaient plus épais et plus fibrotiques lorsqu’ils étaient analysés au microscope après la coloration trichrome de Masson. Le taux d’ultrafiltration a diminué et le transport de masse de glucose a indiqué une augmentation de la perméabilité péritonéale induite par CG. Le modèle de MP ainsi établi peut avoir des applications dans l’amélioration de la technologie de la MP, l’efficacité de la dialyse et la prolongation de la survie des patients.
Introduction
La dialyse péritonéale (DP) est un type de thérapie de remplacement rénal. Cependant, la MP a des problèmes qui ne peuvent pas être résolus. Par exemple, le traitement à long terme de la MP peut causer des dommages péritonéaux, entraînant éventuellement un échec de l’ultrafiltration et l’arrêt du traitement 1,2,3,4,5,6. La fibrose péritonéale est l’une des complications les plus graves 7,8. La fibrose péritonéale est caractérisée par le dépôt et l’accumulation de matrice extracellulaire dans l’interstitium, ainsi que par la néo-angiogenèse et la vasculopathie du péritoine 9,10.
Les principales causes de ces changements péritonéaux sont la péritonite récurrente et la non-biocompatibilité du dialysat, qui sont hyperosmotiques, hyperglycémiques, faible pH et accumulation de produits de dégradation du glucose11,12. Par conséquent, des modèles expérimentaux animaux appropriés peuvent aider les chercheurs à mieux étudier les changements physiologiques et pathologiques du péritoine pendant le traitement par MP. Par conséquent, l’établissement d’un modèle animal de MP est important pour améliorer la technologie de la MP et l’efficacité de la dialyse et prolonger la survie des patients. Cette étude visait à générer un modèle murin par injection intrapéritonéale (i.p.) de gluconate de chlorhexidine (CG), comme décrit précédemment13,14. Ce modèle de souris est simple, facile à utiliser et réalisable par rapport aux autres modèles animaux.
Protocole
Toutes les expériences sur les souris ont été approuvées par le Centre des animaux de laboratoire de l’hôpital E-DA / Université I-Shou et ont été traitées conformément au « Guide for the Care and Use of Laboratory Animals » (NRC, États-Unis 2011). Des souris mâles C57BL/6, âgées de 7 à 8 semaines, ont été utilisées pour la présente étude.
1. Préparation chimique
- Préparer l’irritant chimique en diluant le gluconate de chlorhexidine à 0,1 % (CG, voir le tableau des matières) dans de l’éthanol à 15 %.
2. Traitement des animaux
- Assignez trois souris comme groupe témoin. Effectuer une injection intrapéritonéale (i.p.) de 1 mL/kg de solution saline normale à 0,9 % tous les deux jours pendant 3 semaines, pour un total de neuf fois.
- Assignez trois souris au groupe de fibrose péritonéale. Induire une fibrose péritonéale à l’aide de gluconate de chlorhexidine (CG) en administrant des injections i.p. de 0,1% de CG dans de l’éthanol à 15% (étape 1.1) à une dose de 12,5 μL / g de poids corporel. Effectuez cela tous les deux jours pendant 3 semaines, pour un total de neuf fois.
3. Tests de la fonction péritonéale (test d’équilibre péritonéal modifié)
- Préparez une solution de dialyse contenant 4,25% de glucose. Prélever 0,5 mL d’échantillon de dialysat avec une seringue, puis vérifier la concentration de glucose dans l’échantillon de dialysat.
NOTE: La concentration de glucose est déterminée selon la méthode hexokinase/G6PD. Les échantillons de dialysat ont été consultés pour le test Glu 2 de type L et étudiés à l’aide d’un analyseur biochimique (voir le tableau des matériaux). Il s’agit de la concentration initiale de glucose du dialysat. - Anesthésier les souris par injection intramusculaire de Zoletil et de Xylazine (préparées dans un rapport de 1:2 en volume, voir le tableau des matières) à une dose de 20 μL/20 gw. De plus, utilisez une pommade vétérinaire sur les yeux pour prévenir la sécheresse sous anesthésie.
- Effectuer l’instillation intraveineuse de la solution de dialyse (2 mL/20 g de poids corporel).
- Après 30 min, évaluer et vérifier la profondeur de l’anesthésie avec absence de réflexe de pincement des orteils. Ensuite, effectuez une incision verticale dans la ligne médiane de l’abdomen (sous le processus xiphoïde), puis ouvrez l’abdomen des souris et recueillez le liquide intrapéritonéal avec une seringue (définie comme « volume 1 »). Ensuite, mesurez le poids d’un coton propre et sec et mettez le coton dans la cavité abdominale des souris pour absorber le liquide intrapéritonéal résiduel. Enfin, mesurez à nouveau le poids du coton.
NOTE: Le gain de poids du coton est égal au poids du liquide intrapéritonéal résiduel. Ensuite, convertissez au volume obtenu (densité : 1 g/cm3 ; défini comme « volume 2 »). Le volume final du dialysat est le volume 1 plus le volume 2. - Utilisez 0,5 mL d’échantillon de dialysat (dialysat final) pour mesurer la concentration de glucose. Il s’agit de la concentration finale de glucose du dialysat.
- Calculer l’ultrafiltration nette à l’aide de la formule15 :
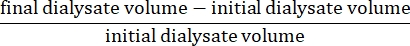
- Calculer la perméabilité péritonéale à l’aide de la formule15 suivante :

4. Préparation tissulaire du muscle de la paroi abdominale et du foie et analyse histologique
- Sacrifier les souris par ponction cardiaque (phlébotomie)3,16.
- Couper la paroi abdominale (1 cm x 1 cm) et hépatectomie totale. Fixez la paroi abdominale et les tissus hépatiques des souris pendant la nuit dans du formol tamponné neutre à 10%.
- Préparer des sections de paraffine de 3 μm d’épaisseur du muscle et du foie de la paroi abdominale et effectuer une analyse histologique à la suite du rapport17 publié précédemment.
- Évaluer le péritoine pariétal de la paroi abdominale et le péritoine viscéral des surfaces hépatiques des souris à l’aide de la morphométrie18.
- Effectuer des analyses statistiques à l’aide de statistiques et de logiciels graphiques (voir le tableau des matériaux). Exprimer toutes les données sous forme de moyenne ± écart-type et analyser la signification statistique à l’aide d’un test t19. Définissez des valeurs avec P < 0,05 comme résultats significatifs.
Résultats
Dans la figure 1A,B, le péritoine pariétal de la paroi abdominale était nettement plus épais et plus fibrotique sous la coloration trichrome de Masson17, ce qui indique que dans le groupe exposé à CG, la fibrose péritonéale est plus grave que dans le groupe témoin saline (NS). Dans la figure 2A,B, le péritoine viscéral des surfaces hépatiques était également nettement plus épais et plus fibrotique, prouvant ainsi que dans le groupe exposé à la CG, la fibrose péritonéale est plus sévère que dans le groupe témoin saline (NS). Dans la figure 3A, le taux d’ultrafiltration a diminué dans le groupe CG, et le transport de masse de glucose a indiqué que la perméabilité péritonéale a augmenté dans le groupe induit par CG (Figure 3B).

Figure 1 : Fibrose du péritoine pariétal de la paroi abdominale dans un modèle murin de dialyse péritonéale (MP). (A) Pour le groupe exposé à la CG, la fibrose péritonéale est plus sévère que dans le groupe témoin (NS) sous coloration trichrome de Masson. (B) Données quantifiées de (A) représenté par la moyenne ±écart type, n ≥ 3; P < 0,01. Pour (A), barre d’échelle = 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
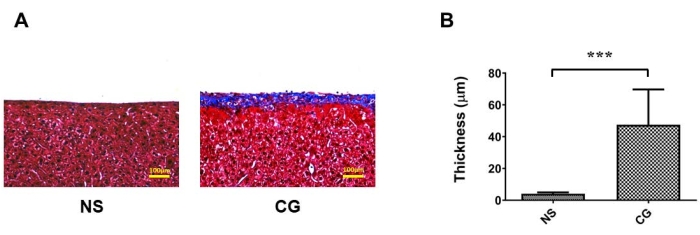
Figure 2 : Fibrose du péritoine viscéral des surfaces hépatiques dans un modèle murin de dialyse péritonéale (MP). (A) Pour le groupe exposé à la CG, la fibrose péritonéale est plus sévère que dans le groupe témoin (NS) sous coloration trichrome de Masson. (B) Données quantifiées de (A) représenté par la moyenne ±écart type, n ≥ 3; P < 0,005. Pour (A), barre d’échelle = 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
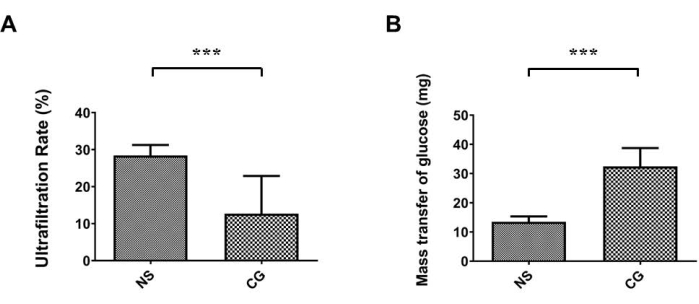
Figure 3 : Détérioration de la fonction péritonéale dans le modèle murin. (A) Dans le groupe exposé au gluconate de chlorhexidine (CG), le taux d’ultrafiltration était significativement inférieur à celui du groupe témoin salin. (B) Le transport de masse de glucose a également indiqué que CG induisait une augmentation de la perméabilité péritonéale. Les données sont représentées par la moyenne ±écart type, n ≥ 3; P < 0,005. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Dans cette étude, un modèle de MP murine est présenté par injection i.p. de CG, et les résultats ont montré une fibrose péritonéale et une détérioration fonctionnelle dans ce modèle, qui imitait l’état du patient MP.
Le protocole comporte plusieurs étapes critiques. Tout d’abord, pour effectuer une injection intra-électrique de CG ou NS, la peau de la paroi abdominale de la souris doit être ramassée à l’aide d’une pince pour prévenir les dommages aux organes intrapéritonéaux induits par la ponction. Deuxièmement, lors de la collecte du péritoine de la paroi abdominale pour les analyses histologiques, la zone endommagée par les injections i.p. doit être évitée.
Parmi les nombreux modèles animaux expérimentaux de fibrose péritonéale, le plus courant est le modèle CG en raison de sa facilité d’utilisation et de son adaptabilité. Suga et al.20 ont été les premiers à signaler un modèle de rat muco-muroséal induit par CG en 1995. Des injections i.p. de 0,1 % de CG et d’éthanol à 15 % dissous dans 2 mL de solution saline ont été utilisées quotidiennement pendant 26 jours. IshiI et coll.21 ont utilisé des souris C57BL/6 et ont administré 0,3 mL de CG à 0,1 % avec de l’éthanol à 15 % dissous dans une injection saline par injection pendant un total de 56 jours, où une péritonite expérimentale encapsulant la sclérosation a été induite chez la souris. Nishino et coll.22 ont utilisé des rats Wistar qui ont reçu des injections intraveineuses de 0,1 % de CG par jour dans de l’éthanol à 15 % dissous dans 2 mL de solution saline pendant 28 jours. Mishima et coll.23 ont utilisé une méthode similaire pour induire une fibrose péritonéale chez les rats Sprague-Dawley (SD) la même année. Kushiyama et coll.24 ont utilisé des rats SD et ont administré 0,1 % de CG dans de l’éthanol à 15 % dissous dans une solution saline (1,5 mL/100 g de poids corporel) par injection intraveineuse trois fois par semaine pendant 21 jours. Nishino et coll.25 ont utilisé des souris quotidiennement, administrant une injection de 0,1 % de CG dans de l’éthanol à 15 % par voie intrapéritonéale, dissoute dans 0,2 mL de solution saline pendant 7 jours et 15 jours. Lua et coll.26 ont utilisé du tamoxifène émulsionné dans de l’huile de sésame à 12,5 mg/mL, dissous dans de l’éthanol, et i.p. injecté à des souris à 100 mg/g de poids corporel pendant un intervalle de 3 jours. Après 2 semaines, 0,1 % de CG dans une solution saline tamponnée à 15 % d’éthanol/phosphate (1,5 mL/100 g) a été injectée aux souris tous les deux jours pour un total de 10 doses. Yoh et coll.14 ont utilisé des rats SD et ont administré 1,5 mL/100 g de poids corporel de 0,1 % de CG dans de l’éthanol à 15 % dissous dans des injections salines par voie intraveineuse trois fois par semaine pendant 21 jours. Yoh et al. ont utilisé des souris âgées de 10 semaines et ont administré 0,1% CG (0,01 ml / g de poids corporel) dans des injections d’éthanol i.p. à 15% trois fois par semaine pour un total de 21 jours. La même année, lo et coll.13 ont également utilisé une méthode similaire.
Le modèle actuel présente certaines limites. Tout d’abord, dans ce modèle animal, le CG a été utilisé comme stimulant chimique pour induire une détérioration fonctionnelle due à la fibrose péritonéale au lieu du dialysat. La CG est un irritant chimique, et son administration répétée peut entraîner une dégénérescence des cellules mésothéliales et des réponses inflammatoires, provoquant ainsi une fibrose excessive. Une inflammation et une néovascularisation ont été observées, et ces résultats étaient similaires à ceux observés chez les patients atteints de MP. Bien que les injections de CG entraînent un épaississement péritonéal important, une étude antérieure a montré que le dépôt de fibrine était relativement plus faible27. Deuxièmement, les souris utilisées dans la présente étude n’avaient pas de maladie rénale; Par conséquent, l’effet des toxines urémiques sur le péritoine n’a pas pu être évalué. Troisièmement, nous n’avons pas évalué l’inflammation, l’angiogenèse et le dépôt de matrice extracellulaire dans le péritoine. Cependant, selon une étude précédente13, le même modèle animal a déjà montré que le nombre de cellules F4/80-positives et de vaisseaux CD31-positifs augmentait après l’exposition au CG. Par conséquent, il convient de noter que les résultats obtenus dans ce modèle animal ne peuvent pas représenter pleinement l’état de la MP chez les patients dialysés péritonéaux. Chez les patients atteints de MP, le mécanisme des lésions péritonéales est complexe et peut suivre différents schémas.
Malgré toutes ces limitations, le modèle actuel est simple, facile à utiliser et réalisable par rapport à d’autres modèles animaux de MP, selon les études précédentes 3,13,14,16,18,25. Cette méthode représente un modèle de fibrose péritonéale liée à la MP qui peut être appliqué à la recherche sur le terrain sur la MP.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions sincèrement Shin-Han Tseng pour la discussion critique et l’exécution partielle de l’étude. Cette étude a été soutenue par EDAHP110003 et NCKUEDA110002 de la Fondation de recherche de l’hôpital E-DA et de l’Université nationale Cheng Kung, Taiwan.
matériels
| Name | Company | Catalog Number | Comments |
| 0.9% Normal Saline | Y F CHEMICAL CORP., New Taipei City, Taiwan | - | |
| 10% neutral buffered formalin | Taiwan Burnett International Co., Ltd., Taipei City, Taiwan | 00002A | |
| Automatic biochemical analyzer | Hitachi Ltd., Tokyo, Japan | Labospect Series 008 | for determining glucose concentration |
| Chlorhexidine digluconate solution, 20% in H2O | Sigma-Aldrich, MO, USA | C9394 | diluted to 0.1% with 15% ethanol for injection |
| Ethanol | Avantor Performance Materials, LLC, PA, USA | BAKR8006-05 | diluted to 15% with normal saline for working concentration |
| Glucose (Dianeal) | Baxter International, Inc., IL, USA | FNB9896 | Commercial dialysis solution (4.25%) |
| GraphPad Prism 8.0 | GraphPad Software, Inc., CA, US | ||
| L-type Glu 2 assay | FUJIFILM Wako, Japan | 461-32403 | |
| Xylazine 20 | Juily Pharmaceutical Co., Ltd., New Taipei City, Taiwan | - | |
| Zoletil 50 | Virbac Laboratories, Carros, France | - |
Références
- Han, S. H., et al. Improving outcome of CAPD: twenty-five years' experience in a single Korean center. Peritoneal Dialysis International. 27 (4), 432-440 (2007).
- Kawaguchi, Y., Hasegawa, T., Nakayama, M., Kubo, H., Shigematu, T. Issues affecting the longevity of the continuous peritoneal dialysis therapy. Kidney International Supplements. 62, 105-107 (1997).
- Lee, Y. C., et al. Vitamin D can ameliorate chlorhexidine gluconate-induced peritoneal fibrosis and functional deterioration through the inhibition of epithelial-to-mesenchymal transition of mesothelial cells. BioMed Research International. 2015, 595030 (2015).
- Nakamoto, H., Kawaguchi, Y., Suzuki, H. Is technique survival on peritoneal dialysis better in Japan. Peritoneal Dialysis International. 26 (2), 136-143 (2006).
- Schaefer, F., Klaus, G., Muller-Wiefel, D. E., Mehls, O. Current practice of peritoneal dialysis in children: results of a longitudinal survey. Mid European Pediatric Peritoneal Dialysis Study Group (MEPPS). Peritoneal Dialysis International. 19, 445-449 (1999).
- Woodrow, G., Turney, J. H., Brownjohn, A. M. Technique failure in peritoneal dialysis and its impact on patient survival. Peritoneal Dialysis International. 17 (4), 360-364 (1997).
- Schmidt, D. W., Flessner, M. F. Pathogenesis and treatment of encapsulating peritoneal sclerosis: basic and translational research. Peritoneal Dialysis International. 28, 10-15 (2008).
- Augustine, T., Brown, P. W., Davies, S. D., Summers, A. M., Wilkie, M. E. Encapsulating peritoneal sclerosis: clinical significance and implications. Nephron Clinical Practice. 111 (2), 149-154 (2009).
- Di Paolo, N., Nicolai, G. A., Garosi, G. The peritoneum: from histological studies to mesothelial transplant through animal experimentation. Peritoneal Dialysis International. 28, 5-9 (2008).
- Fusshoeller, A. Histomorphological and functional changes of the peritoneal membrane during long-term peritoneal dialysis. Pediatric Nephrology. 23 (1), 19-25 (2008).
- Goffin, E. Peritoneal membrane structural and functional changes during peritoneal dialysis. Seminars in Dialysis. 21 (3), 258-265 (2008).
- Ito, T., Yorioka, N. Peritoneal damage by peritoneal dialysis solutions. Clinical and Experimental Nephrology. 12 (4), 243-249 (2008).
- Io, K., et al. SAHA suppresses peritoneal fibrosis in mice. Peritoneal Dialysis International. 35 (3), 246-258 (2015).
- Yoh, K., Ojima, M., Takahashi, S. Th2-biased GATA-3 transgenic mice developed severe experimental peritoneal fibrosis compared with Th1-biased T-bet and Th17-biased RORgammat transgenic mice. Experimental Animals. 64 (4), 353-362 (2015).
- Karl, Z. J. T., et al. Peritoneal Equilibration Test. Peritoneal Dialysis International. 7 (3), 138-148 (1987).
- Lee, Y. C., et al. The clinical implication of vitamin D nanomedicine for peritoneal dialysis-related peritoneal damage. International Journal of Nanomedicine. 14, 9665-9675 (2019).
- Goldner, J. A. Modification of the masson trichrome technique for routine laboratory purposes. The American Journal of Pathology. 14 (2), 237-243 (1938).
- Cheng, F. Y., et al. Novel application of magnetite nanoparticle-mediated vitamin D3 delivery for peritoneal dialysis-related peritoneal damage. International Journal of Nanomedicine. 16, 2137-2146 (2021).
- Ross, A., Willson, V. L. . Basic and Advanced Statistical Tests: Writing Results Sections and Creating Tables and Figures. , 13-16 (2017).
- Suga, H., et al. Preventive effect of pirfenidone against experimental sclerosing peritonitis in rats. Experimental and Toxicologic Pathology. 47 (4), 287-291 (1995).
- Ishii, Y., et al. An experimental sclerosing encapsulating peritonitis model in mice. Nephrology Dialysis Transplantation. 16 (6), 1262-1266 (2001).
- Nishino, T., et al. Antisense oligonucleotides against collagen-binding stress protein HSP47 suppress peritoneal fibrosis in rats. Kidney International. 64 (3), 887-896 (2003).
- Mishima, Y., et al. Enhanced expression of heat shock protein 47 in rat model of peritoneal fibrosis. Peritoneal Dialysis International. 23 (1), 14-22 (2003).
- Kushiyama, T., et al. Effects of liposome-encapsulated clodronate on chlorhexidine gluconate-induced peritoneal fibrosis in rats. Nephrology Dialysis Transplantation. 26 (10), 3143-3154 (2011).
- Nishino, T., et al. Involvement of lymphocyte infiltration in the progression of mouse peritoneal fibrosis model. Renal Failure. 34 (6), 760-766 (2012).
- Lua, I., Li, Y., Pappoe, L. S., Asahina, K. Myofibroblastic conversion and regeneration of mesothelial cells in peritoneal and liver fibrosis. The American Journal of Pathology. 185 (12), 3258-3273 (2015).
- Kitamura, M., et al. Epigallocatechin gallate suppresses peritoneal fibrosis in mice. Chemico-Biological Interactions. 195 (1), 95-104 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon