Method Article
Un modelo de ratón de daño peritoneal inducido por gluconato de clorhexidina
* Estos autores han contribuido por igual
En este artículo
Resumen
El presente protocolo establece un modelo de ratón de diálisis peritoneal (DP) de fibrosis peritoneal inducida por gluconato de clorhexidina (CG). El modelo actual es simple y fácil de usar en comparación con otros modelos animales de EP.
Resumen
La fibrosis peritoneal es una complicación importante de la diálisis peritoneal (DP). Para investigar y abordar este problema, se requiere un modelo animal apropiado de EP. El presente protocolo establece un modelo de fibrosis peritoneal inducida por gluconato de clorhexidina (CG) que imita la condición de un paciente con EP. La fibrosis peritoneal se indujo mediante inyección intraperitoneal de 0,1% de CG en etanol al 15% durante 3 semanas (administrada cada dos días), para un total de nueve veces en ratones machos C57BL/6. Las pruebas funcionales peritoneales se realizaron el día 22. Después de sacrificar los ratones, se recolectaron el peritoneo parietal de la pared abdominal y el peritoneo visceral del hígado. Eran más gruesos y fibróticos cuando se analizaron microscópicamente después de la tinción tricrómica de Masson. La tasa de ultrafiltración disminuyó, y el transporte de masa de glucosa indicó un aumento inducido por CG en la permeabilidad peritoneal. El modelo de DP así establecido puede tener aplicaciones para mejorar la tecnología de DP, la eficacia de la diálisis y prolongar la supervivencia del paciente.
Introducción
La diálisis peritoneal (DP) es un tipo de terapia de reemplazo renal. Sin embargo, la EP tiene problemas que no se pueden resolver. Por ejemplo, el tratamiento a largo plazo de la EP puede causar daño peritoneal, lo que eventualmente conduce al fracaso de la ultrafiltración y al retiro del tratamiento 1,2,3,4,5,6. La fibrosis peritoneal es una de las complicaciones más graves 7,8. La fibrosis peritoneal se caracteriza por la deposición y acumulación de matriz extracelular dentro del intersticio, y neoangiogénesis y vasculopatía del peritoneo 9,10.
Las principales causas de estos cambios peritoneales son la peritonitis recurrente y la no biocompatibilidad del dializado, que son hiperosmóticas, alta glucosa, bajo pH y degradación de la glucosa11,12. Por lo tanto, los modelos experimentales animales adecuados pueden ayudar a los investigadores a estudiar mejor los cambios fisiológicos y patológicos del peritoneo durante la terapia de EP. Por lo tanto, el establecimiento de un modelo de EP animal es importante para mejorar la tecnología de EP y la eficacia de la diálisis y prolongar la supervivencia del paciente. Este estudio tuvo como objetivo generar un modelo de ratón con EP mediante inyección intraperitoneal (i.p.) de gluconato de clorhexidina (GC), como se describió anteriormente13,14. Este modelo de ratón PD es simple, fácil de usar y factible en comparación con otros modelos animales de PD.
Protocolo
Todos los experimentos con ratones fueron aprobados por el Centro de Animales de Laboratorio del Hospital E-DA / Universidad I-Shou y se manejaron de acuerdo con la "Guía para el cuidado y uso de animales de laboratorio" (NRC, EE. UU. 2011). Para el presente estudio se utilizaron ratones machos C57BL/6, de 7-8 semanas de edad.
1. Preparación química
- Prepare el irritante químico diluyendo el gluconato de clorhexidina al 0,1% (CG, consulte la Tabla de materiales) en etanol al 15%.
2. Tratamiento de los animales
- Asigne tres ratones como grupo de control. Realizar inyección intraperitoneal (i.p.) de 1 mL/kg de solución salina normal (NS) al 0,9% cada dos días durante 3 semanas, para un total de nueve veces.
- Asigne tres ratones al grupo de fibrosis peritoneal. Inducir fibrosis peritoneal utilizando gluconato de clorhexidina (GC) mediante la administración de inyecciones i.p. de 0,1% de CG en etanol al 15% (paso 1.1) a una dosis de 12,5 μL/g de peso corporal. Realice esto cada dos días durante 3 semanas, para un total de nueve veces.
3. Pruebas de función peritoneal (prueba de equilibrio peritoneal modificada)
- Prepare una solución de diálisis que contenga 4,25% de glucosa. Extraiga 0,5 ml de muestra de dializado con una jeringa y luego verifique la concentración de glucosa en la muestra de dializado.
NOTA: La concentración de glucosa se determina de acuerdo con el método hexoquinasa/G6PD. Se accedió a las muestras de dializado al ensayo Glu 2 de tipo L y se investigaron con un analizador bioquímico (ver Tabla de materiales). Esta es la concentración inicial de glucosa dializada. - Anestesiar a los ratones mediante inyección intramuscular de Zoletil y xilazina (preparados en una proporción de 1:2 por volumen, ver Tabla de materiales) a una dosis de 20 μL/20 gw. Además, use ungüento veterinario en los ojos para prevenir la sequedad bajo anestesia.
- Realizar la instilación i.p. de la solución de diálisis (2 mL/20 g de peso corporal).
- Después de 30 minutos, evalúe y verifique la profundidad de la anestesia con falta de reflejo de pellizco del dedo del pie. Luego, realice una incisión vertical en la línea media del abdomen (debajo del proceso xifoides), luego abra el abdomen de los ratones y recoja el líquido intraperitoneal con una jeringa (definida como "volumen 1"). Luego, mida el peso de un algodón limpio y seco y coloque el algodón en la cavidad abdominal de los ratones para absorber el líquido intraperitoneal residual. Finalmente, mide el peso del algodón nuevamente.
NOTA: El aumento de peso del algodón es igual al peso del líquido intraperitoneal residual. Luego, convertir al volumen obtenido (gravedad específica: 1 g / cm3; definido como "volumen 2"). El volumen final de dializado es el volumen 1 más el volumen 2. - Use 0.5 ml de muestra de dializado (dializado final) para medir la concentración de glucosa. Esta es la concentración final de glucosa dializada.
- Calcule la ultrafiltración neta utilizando la fórmula15:
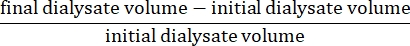
- Calcule la permeabilidad peritoneal utilizando la siguiente fórmula15:

4. Preparación tisular del músculo de la pared abdominal y del hígado y análisis histológico
- Sacrificar los ratones por punción cardíaca (flebotomía)3,16.
- Corte de la pared abdominal (1 cm x 1 cm) y hepatectomía total. Fije la pared abdominal y los tejidos hepáticos de los ratones durante la noche en formalina tamponada neutra al 10%.
- Preparar secciones de parafina de 3 μm de espesor del músculo de la pared abdominal y el hígado, y realizar análisis histológicos siguiendo el informe17 publicado anteriormente.
- Evaluar el peritoneo parietal de la pared abdominal y el peritoneo visceral de las superficies hepáticas de los ratones mediante morfometría18.
- Realice análisis estadísticos utilizando estadísticas y software de gráficos (consulte la Tabla de materiales). Expresar todos los datos como media ± SD y analizar la significación estadística utilizando una prueba t19. Defina valores con P < 0,05 como resultados significativos.
Resultados
En la Figura 1A,B, el peritoneo parietal de la pared abdominal era marcadamente más grueso y fibrótico bajo la tinción tricrómica de Masson17, indicando que en el grupo expuesto a CG, la fibrosis peritoneal es más grave que en el grupo control salino (SN). En la Figura 2A,B, el peritoneo visceral de las superficies hepáticas también era marcadamente más grueso y fibrótico, lo que demuestra que en el grupo expuesto a CG, la fibrosis peritoneal es más grave que en el grupo control de solución salina (SN). En la Figura 3A, la tasa de ultrafiltración disminuyó en el grupo GC, y el transporte de masa de glucosa indicó que la permeabilidad peritoneal aumentó en el grupo inducido por CG (Figura 3B).

Figura 1: Fibrosis del peritoneo parietal de la pared abdominal en modelo de ratón de diálisis peritoneal (DP). (A) Para el grupo expuesto al GC, la fibrosis peritoneal es más grave que en el grupo control (SN) bajo tinción tricrómica de Masson. (B) Datos cuantificados de (A) representados como la media ± desviación estándar, n ≥ 3; P < 0,01. Para (A), barra de escala = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
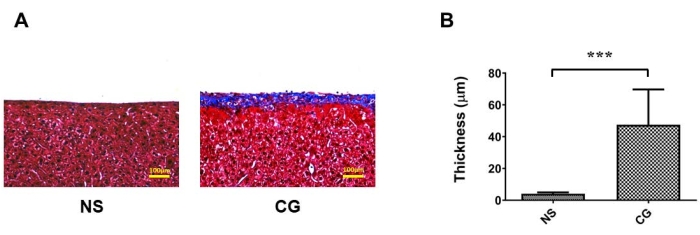
Figura 2: Fibrosis del peritoneo visceral de las superficies hepáticas en el modelo de ratón de diálisis peritoneal (DP). (A) Para el grupo expuesto al GC, la fibrosis peritoneal es más grave que en el grupo control (SN) bajo tinción tricrómica de Masson. (B) Datos cuantificados de (A) representados como la media ± desviación estándar, n ≥ 3; P < 0,005. Para (A), barra de escala = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
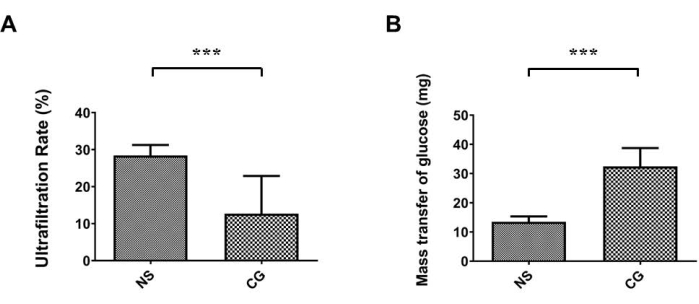
Figura 3: Deterioro de la función peritoneal en el modelo de ratón PD. (A) En el grupo expuesto a gluconato de clorhexidina (GC), la tasa de ultrafiltración fue significativamente menor que en el grupo control de solución salina (SN). (B) El transporte de masa de glucosa también indicó que CG-indujo un aumento de la permeabilidad peritoneal. Los datos se representan como la media ± la desviación estándar, n ≥ 3; P < 0,005. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En este estudio, un modelo de DP de ratón se presenta por inyección i.p. de GC, y los resultados mostraron fibrosis peritoneal y deterioro funcional en este modelo, que imitó la condición del paciente con EP.
Hay varios pasos críticos en el protocolo. Primero, para realizar una inyección i.p. de CG o NS, la piel de la pared abdominal del ratón debe recogerse con fórceps para evitar el daño intraperitoneal inducido por punción. En segundo lugar, al recoger el peritoneo de la pared abdominal para los análisis histológicos, se debe evitar el área dañada por las inyecciones i.p.
Entre los varios modelos animales experimentales de fibrosis peritoneal, el más común es el modelo CG debido a su facilidad de uso y adaptabilidad. Suga et al.20 fueron los primeros en reportar un modelo de rata de fibrosis peritoneal inducida por CG en 1995. Las inyecciones i.p. de 0,1% de CG y 15% de etanol disuelto en 2 mL de solución salina se utilizaron diariamente durante 26 días. IshiI et al.21 utilizaron ratones C57BL/6 y administraron 0,3 mL de CG al 0,1% con etanol al 15% disuelto en inyección de solución salina i.p. durante un total de 56 días, donde se indujo una peritonitis encapsulante esclerosante experimental en ratones. Nishino et al.22 utilizaron ratas Wistar que recibieron inyecciones i.p. de 0,1% CG diariamente en etanol al 15% disuelto en 2 mL de solución salina durante 28 días. Mishima et al.23 utilizaron un método similar para inducir fibrosis peritoneal en ratas Sprague-Dawley (SD) en el mismo año. Kushiyama et al.24 utilizaron ratas SD y administraron 0,1% de CG en etanol al 15% disuelto en inyecciones i.p. de solución salina (1,5 mL/100 g de peso corporal) tres veces a la semana durante 21 días. Nishino et al.25 utilizaron ratones diariamente, administrando una inyección de 0,1% CG en etanol al 15% por vía intraperitoneal, disuelto en 0,2 mL de solución salina durante 7 días y 15 días. Lua et al.26 utilizaron tamoxifeno emulsionado en aceite de sésamo a 12,5 mg/mL, disuelto en etanol, e inyectado en ratones a 100 mg/g de peso corporal durante un intervalo de 3 días. Después de 2 semanas, se inyectó 0,1% de CG en solución salina tamponada con etanol/fosfato al 15% (1,5 ml / 100 g) a los ratones cada dos días para un total de 10 dosis. Yoh et al.14 utilizaron ratas SD y administraron 1,5 mL/100 g de peso corporal de 0,1% CG en etanol al 15 % disuelto en inyecciones de solución salina tres veces a la semana durante 21 días. Yoh et al. utilizaron ratones de 10 semanas de edad y administraron 0,1% de CG (0,01 ml / g de peso corporal) en inyecciones de etanol al 15% tres veces a la semana durante un total de 21 días. En el mismo año, lo et al.13 también utilizaron un método similar.
El modelo actual tiene algunas limitaciones. En primer lugar, en este modelo animal, se utilizó CG como estimulante químico para inducir el deterioro funcional debido a la fibrosis peritoneal en lugar del dializado. La CG es un irritante químico, y su administración repetida puede conducir a la degeneración de las células mesoteliales y respuestas inflamatorias, causando así fibrosis excesiva. Se observó inflamación y neovascularización, y estos hallazgos fueron similares a los observados en pacientes con EP. Aunque las inyecciones de CG resultan en un engrosamiento peritoneal significativo, un estudio previo mostró que la deposición de fibrina era relativamente más débil27. En segundo lugar, los ratones utilizados en el presente estudio no tenían enfermedad renal; En consecuencia, no fue posible evaluar el efecto de las toxinas urémicas sobre el peritoneo. En tercer lugar, no evaluamos la inflamación, la angiogénesis y la deposición de la matriz extracelular en el peritoneo. Sin embargo, según un estudio previo13, el mismo modelo animal ya ha demostrado que el número de células positivas para F4/80 y de vasos CD31 positivos aumentó después de la exposición a CG. Por lo tanto, debe tenerse en cuenta que los resultados obtenidos en este modelo animal no pueden representar completamente la condición de DP en pacientes en diálisis peritoneal. En pacientes con EP, el mecanismo de daño peritoneal es complejo y puede seguir diferentes patrones.
A pesar de todas estas limitaciones, el presente modelo es simple, fácil de usar y factible en comparación con otros modelos animales de EP, según los estudios previos 3,13,14,16,18,25. Este método representa un modelo de fibrosis peritoneal relacionada con la EP que se puede aplicar a la investigación de campo de la EP.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos sinceramente a Shin-Han Tseng por la discusión crítica y la ejecución parcial del estudio. Este estudio fue apoyado por EDAHP110003 y NCKUEDA110002 de la Fundación de Investigación del Hospital E-DA y la Universidad Nacional Cheng Kung, Taiwán.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.9% Normal Saline | Y F CHEMICAL CORP., New Taipei City, Taiwan | - | |
| 10% neutral buffered formalin | Taiwan Burnett International Co., Ltd., Taipei City, Taiwan | 00002A | |
| Automatic biochemical analyzer | Hitachi Ltd., Tokyo, Japan | Labospect Series 008 | for determining glucose concentration |
| Chlorhexidine digluconate solution, 20% in H2O | Sigma-Aldrich, MO, USA | C9394 | diluted to 0.1% with 15% ethanol for injection |
| Ethanol | Avantor Performance Materials, LLC, PA, USA | BAKR8006-05 | diluted to 15% with normal saline for working concentration |
| Glucose (Dianeal) | Baxter International, Inc., IL, USA | FNB9896 | Commercial dialysis solution (4.25%) |
| GraphPad Prism 8.0 | GraphPad Software, Inc., CA, US | ||
| L-type Glu 2 assay | FUJIFILM Wako, Japan | 461-32403 | |
| Xylazine 20 | Juily Pharmaceutical Co., Ltd., New Taipei City, Taiwan | - | |
| Zoletil 50 | Virbac Laboratories, Carros, France | - |
Referencias
- Han, S. H., et al. Improving outcome of CAPD: twenty-five years' experience in a single Korean center. Peritoneal Dialysis International. 27 (4), 432-440 (2007).
- Kawaguchi, Y., Hasegawa, T., Nakayama, M., Kubo, H., Shigematu, T. Issues affecting the longevity of the continuous peritoneal dialysis therapy. Kidney International Supplements. 62, 105-107 (1997).
- Lee, Y. C., et al. Vitamin D can ameliorate chlorhexidine gluconate-induced peritoneal fibrosis and functional deterioration through the inhibition of epithelial-to-mesenchymal transition of mesothelial cells. BioMed Research International. 2015, 595030 (2015).
- Nakamoto, H., Kawaguchi, Y., Suzuki, H. Is technique survival on peritoneal dialysis better in Japan. Peritoneal Dialysis International. 26 (2), 136-143 (2006).
- Schaefer, F., Klaus, G., Muller-Wiefel, D. E., Mehls, O. Current practice of peritoneal dialysis in children: results of a longitudinal survey. Mid European Pediatric Peritoneal Dialysis Study Group (MEPPS). Peritoneal Dialysis International. 19, 445-449 (1999).
- Woodrow, G., Turney, J. H., Brownjohn, A. M. Technique failure in peritoneal dialysis and its impact on patient survival. Peritoneal Dialysis International. 17 (4), 360-364 (1997).
- Schmidt, D. W., Flessner, M. F. Pathogenesis and treatment of encapsulating peritoneal sclerosis: basic and translational research. Peritoneal Dialysis International. 28, 10-15 (2008).
- Augustine, T., Brown, P. W., Davies, S. D., Summers, A. M., Wilkie, M. E. Encapsulating peritoneal sclerosis: clinical significance and implications. Nephron Clinical Practice. 111 (2), 149-154 (2009).
- Di Paolo, N., Nicolai, G. A., Garosi, G. The peritoneum: from histological studies to mesothelial transplant through animal experimentation. Peritoneal Dialysis International. 28, 5-9 (2008).
- Fusshoeller, A. Histomorphological and functional changes of the peritoneal membrane during long-term peritoneal dialysis. Pediatric Nephrology. 23 (1), 19-25 (2008).
- Goffin, E. Peritoneal membrane structural and functional changes during peritoneal dialysis. Seminars in Dialysis. 21 (3), 258-265 (2008).
- Ito, T., Yorioka, N. Peritoneal damage by peritoneal dialysis solutions. Clinical and Experimental Nephrology. 12 (4), 243-249 (2008).
- Io, K., et al. SAHA suppresses peritoneal fibrosis in mice. Peritoneal Dialysis International. 35 (3), 246-258 (2015).
- Yoh, K., Ojima, M., Takahashi, S. Th2-biased GATA-3 transgenic mice developed severe experimental peritoneal fibrosis compared with Th1-biased T-bet and Th17-biased RORgammat transgenic mice. Experimental Animals. 64 (4), 353-362 (2015).
- Karl, Z. J. T., et al. Peritoneal Equilibration Test. Peritoneal Dialysis International. 7 (3), 138-148 (1987).
- Lee, Y. C., et al. The clinical implication of vitamin D nanomedicine for peritoneal dialysis-related peritoneal damage. International Journal of Nanomedicine. 14, 9665-9675 (2019).
- Goldner, J. A. Modification of the masson trichrome technique for routine laboratory purposes. The American Journal of Pathology. 14 (2), 237-243 (1938).
- Cheng, F. Y., et al. Novel application of magnetite nanoparticle-mediated vitamin D3 delivery for peritoneal dialysis-related peritoneal damage. International Journal of Nanomedicine. 16, 2137-2146 (2021).
- Ross, A., Willson, V. L. . Basic and Advanced Statistical Tests: Writing Results Sections and Creating Tables and Figures. , 13-16 (2017).
- Suga, H., et al. Preventive effect of pirfenidone against experimental sclerosing peritonitis in rats. Experimental and Toxicologic Pathology. 47 (4), 287-291 (1995).
- Ishii, Y., et al. An experimental sclerosing encapsulating peritonitis model in mice. Nephrology Dialysis Transplantation. 16 (6), 1262-1266 (2001).
- Nishino, T., et al. Antisense oligonucleotides against collagen-binding stress protein HSP47 suppress peritoneal fibrosis in rats. Kidney International. 64 (3), 887-896 (2003).
- Mishima, Y., et al. Enhanced expression of heat shock protein 47 in rat model of peritoneal fibrosis. Peritoneal Dialysis International. 23 (1), 14-22 (2003).
- Kushiyama, T., et al. Effects of liposome-encapsulated clodronate on chlorhexidine gluconate-induced peritoneal fibrosis in rats. Nephrology Dialysis Transplantation. 26 (10), 3143-3154 (2011).
- Nishino, T., et al. Involvement of lymphocyte infiltration in the progression of mouse peritoneal fibrosis model. Renal Failure. 34 (6), 760-766 (2012).
- Lua, I., Li, Y., Pappoe, L. S., Asahina, K. Myofibroblastic conversion and regeneration of mesothelial cells in peritoneal and liver fibrosis. The American Journal of Pathology. 185 (12), 3258-3273 (2015).
- Kitamura, M., et al. Epigallocatechin gallate suppresses peritoneal fibrosis in mice. Chemico-Biological Interactions. 195 (1), 95-104 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados