Method Article
نموذج الفئران للتلف البريتوني الناجم عن الكلورهيكسيدين غلوكونات
* These authors contributed equally
In This Article
Summary
ينشئ البروتوكول الحالي نموذجا لفأر غسيل الكلى البريتوني (PD) للتليف البريتوني الناجم عن الكلورهيكسيدين غلوكونات (CG). النموذج الحالي بسيط وسهل الاستخدام مقارنة بالنماذج الحيوانية PD الأخرى.
Abstract
التليف البريتوني هو أحد المضاعفات الهامة لغسيل الكلى البريتوني (PD). للتحقيق في هذه المشكلة ومعالجتها ، يلزم وجود نموذج حيواني مناسب لمرض باركنسون. ينشئ البروتوكول الحالي نموذج التليف البريتوني الناجم عن الكلورهيكسيدين غلوكونات (CG) الذي يحاكي حالة المريض المصاب بمرض باركنسون. تم إحداث التليف البريتوني عن طريق الحقن داخل الصفاق بنسبة 0.1٪ من CG في 15٪ من الإيثانول لمدة 3 أسابيع (تدار كل يومين) ، ليصبح المجموع تسع مرات في ذكور الفئران C57BL / 6. ثم تم إجراء الاختبارات الوظيفية البريتونية في اليوم 22. بعد التضحية بالفئران ، تم حصاد الصفاق الجداري لجدار البطن والصفاق الحشوي للكبد. كانت أكثر سمكا وأكثر تليفا عند تحليلها مجهريا بعد تلطيخ ماسون ثلاثي الألوان. انخفض معدل الترشيح الفائق ، وأشار نقل كتلة الجلوكوز إلى زيادة في نفاذية البريتوني التي يسببها CG. قد يكون لنموذج PD الذي تم إنشاؤه على هذا النحو تطبيقات في تحسين تقنية PD وفعالية غسيل الكلى وإطالة بقاء المريض.
Introduction
غسيل الكلى البريتوني (PD) هو نوع من العلاج ببدائل الكلى. ومع ذلك ، فإن PD لديه مشاكل لا يمكن حلها. على سبيل المثال ، يمكن أن يتسبب علاج PD طويل الأمد في تلف الصفاق ، مما يؤدي في النهاية إلى فشل الترشيح الفائق وسحب العلاج1،2،3،4،5،6. التليف البريتوني هو واحد من أخطر المضاعفات 7,8. يتميز التليف البريتوني بترسب وتراكم المصفوفة خارج الخلية داخل الخلالي ، وتكوين الأوعية الدموية الجديدة والاعتلال الوعائي في الصفاق9،10.
الأسباب الرئيسية لهذه التغيرات البريتونية هي التهاب الصفاق المتكرر وعدم التوافق الحيوي للديالة ، وهي فرط التناضح ، وارتفاع الجلوكوز ، وانخفاض درجة الحموضة ، وتراكم منتج تحلل الجلوكوز11,12. لذلك ، يمكن أن تساعد النماذج التجريبية الحيوانية المناسبة الباحثين على دراسة التغيرات الفسيولوجية والمرضية للبريتوني بشكل أفضل أثناء علاج PD. لذلك ، يعد إنشاء نموذج PD حيواني أمرا مهما لتحسين تقنية PD وفعالية غسيل الكلى وإطالة بقاء المريض. تهدف هذه الدراسة إلى إنشاء نموذج فأر PD عن طريق الحقن داخل الصفاق (i.p.) من غلوكونات الكلورهيكسيدين (CG) ، كما هو موضح سابقا13،14. نموذج الماوس PD هذا بسيط وسهل الاستخدام وممكن مقارنة بنماذج PD الأخرى.
Protocol
تمت الموافقة على جميع تجارب الفئران من قبل مركز المختبر التابع لمستشفى E-DA / جامعة I-Shou وتم التعامل معها وفقا ل "دليل رعاية واستخدام المختبر" (NRC ، الولايات المتحدة الأمريكية 2011). تم استخدام ذكور الفئران C57BL / 6 ، التي تتراوح أعمارها بين 7-8 أسابيع ، في هذه الدراسة.
1. التحضير الكيميائي
- تحضير المهيج الكيميائي عن طريق تخفيف 0.1 ٪ غلوكونات الكلورهيكسيدين (CG ، انظر جدول المواد) في 15 ٪ من الإيثانول.
2. معاملة الحيوان
- قم بتعيين ثلاثة فئران كمجموعة ضابطة. إجراء الحقن داخل الصفاق (IP) من 1 مل / كجم من محلول ملحي طبيعي 0.9٪ (NS) كل يومين لمدة 3 أسابيع ، ليصبح المجموع تسع مرات.
- تعيين ثلاثة الفئران لمجموعة التليف البريتوني. تحفيز التليف البريتوني باستخدام غلوكونات الكلورهيكسيدين (CG) عن طريق إعطاء حقن i.p. بنسبة 0.1٪ من CG في 15٪ من الإيثانول (الخطوة 1.1) بجرعة 12.5 ميكرولتر / جرام من وزن الجسم. قم بإجراء هذا كل يوم لمدة 3 أسابيع ، ليصبح المجموع تسع مرات.
3. اختبارات الوظيفة البريتونية (اختبار التوازن البريتوني المعدل)
- تحضير محلول غسيل الكلى يحتوي على 4.25 ٪ الجلوكوز. ارسم 0.5 مل من عينة الديالة باستخدام حقنة، ثم تحقق من تركيز الجلوكوز في عينة الديالة.
ملاحظة: يتم تحديد تركيز الجلوكوز وفقا لطريقة hexokinase / G6PD. تم الوصول إلى عينات غسيل الكلى إلى مقايسة L-type Glu 2 وفحصها باستخدام محلل كيميائي حيوي (انظر جدول المواد). هذا هو تركيز الجلوكوز الأولي للإديالة. - تخدير الفئران عن طريق الحقن العضلي للزوليتيل والزيلازين (المحضر بنسبة 1: 2 من حيث الحجم ، انظر جدول المواد) بجرعة 20 ميكرولتر / 20 جيجاواط. بالإضافة إلى ذلك ، استخدم مرهم الطبيب البيطري على العينين لمنع الجفاف تحت التخدير.
- إجراء تقطير i.p. من محلول غسيل الكلى (2 مل / 20 جم من وزن الجسم).
- بعد 30 دقيقة ، قم بتقييم والتحقق من عمق التخدير مع عدم وجود منعكس قرصة إصبع القدم. بعد ذلك ، قم بإجراء شق عمودي في خط الوسط من البطن (أسفل عملية الخنجري) ، ثم افتح بطن الفئران واجمع السائل داخل الصفاق باستخدام حقنة (تعرف باسم "الحجم 1"). بعد ذلك ، قم بقياس وزن القطن النظيف والجاف وضع القطن في تجويف البطن للفئران لامتصاص السائل داخل الصفاق المتبقي. أخيرا ، قم بقياس وزن القطن مرة أخرى.
ملاحظة: زيادة وزن القطن تساوي وزن السائل داخل الصفاق المتبقي. بعد ذلك ، قم بالتحويل إلى الحجم الذي تم الحصول عليه (الثقل النوعي: 1 جم / سم3 ؛ يعرف بأنه "الحجم 2"). حجم الديالة النهائي هو الحجم 1 زائد الحجم 2. - استخدم 0.5 مل من عينة الديالة (الديالة النهائية) لقياس تركيز الجلوكوز. هذا هو التركيز النهائي للجلوكوز في الديالة.
- احسب صافي الترشيح الفائق باستخدام الصيغة15:
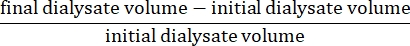
- احسب نفاذية البريتوني باستخدام الصيغة التالية15:

4. تحضير أنسجة عضلات جدار البطن والكبد والتحليل النسيجي
- التضحية بالفئران عن طريق ثقب القلب (الفصد)3,16.
- قطع جدار البطن (1 سم × 1 سم) واستئصال الكبد الكلي. ثبت جدار البطن وأنسجة الكبد للفئران طوال الليل في 10٪ فورمالين محايد مخزن.
- تحضير أقسام البارافين بسمك 3 ميكرومتر من عضلات جدار البطن والكبد ، وإجراء التحليل النسيجي بعد التقريرالمنشور سابقا 17.
- تقييم الصفاق الجداري لجدار البطن والصفاق الحشوي لأسطح الكبد للفئران باستخدام قياس التشكل18.
- إجراء التحليلات الإحصائية باستخدام برامج الإحصاء والرسوم البيانية (انظر جدول المواد). التعبير عن جميع البيانات كمتوسط ± SD وتحليل الدلالة الإحصائية باستخدام اختبار t19. حدد القيم التي تحتوي على P < 0.05 كنتائج مهمة.
النتائج
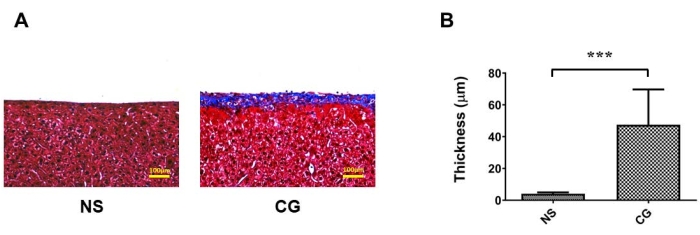
في الشكل 1 أ ، ب ، كان الصفاق الجداري لجدار البطن أكثر سمكا بشكل ملحوظ وأكثر تليفا تحت تلطيخ ماسونثلاثي الألوان 17 ، مما يشير إلى أنه في المجموعة المعرضة ل CG ، يكون التليف البريتوني أكثر حدة منه في المجموعة المالحة الضابطة (NS). في الشكل 2 أ ، ب ، كان الصفاق الحشوي لأسطح الكبد أكثر سمكا وتليفا بشكل ملحوظ ، مما يثبت أنه في المجموعة المعرضة ل CG ، يكون التليف البريتوني أكثر حدة منه في المجموعة المالحة الضابطة (NS). في الشكل 3 أ ، انخفض معدل الترشيح الفائق في مجموعة CG ، وأشار نقل كتلة الجلوكوز إلى أن نفاذية الصفاق زادت في المجموعة التي يسببها CG (الشكل 3 ب).

الشكل 1: تليف الصفاق الجداري لجدار البطن في نموذج فأر غسيل الكلى البريتوني (PD). (أ) بالنسبة للمجموعة المعرضة ل CG ، يكون التليف البريتوني أكثر حدة منه في المجموعة الضابطة (NS) تحت تلطيخ ماسون ثلاثي الألوان. (ب) بيانات كمية ل (أ) ممثلة كمتوسط ± الانحراف المعياري، رقم ≥ 3؛ ف < 0.01. بالنسبة ل (A) ، شريط المقياس = 100 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
الشكل 2: تليف الصفاق الحشوي لأسطح الكبد في نموذج فأر غسيل الكلى البريتوني (PD). (أ) بالنسبة للمجموعة المعرضة ل CG ، يكون التليف البريتوني أكثر حدة منه في المجموعة الضابطة (NS) تحت تلطيخ ماسون ثلاثي الألوان. (ب) بيانات كمية ل (أ) ممثلة كمتوسط ± الانحراف المعياري، رقم ≥ 3؛ ف < 0.005. بالنسبة ل (A) ، شريط المقياس = 100 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
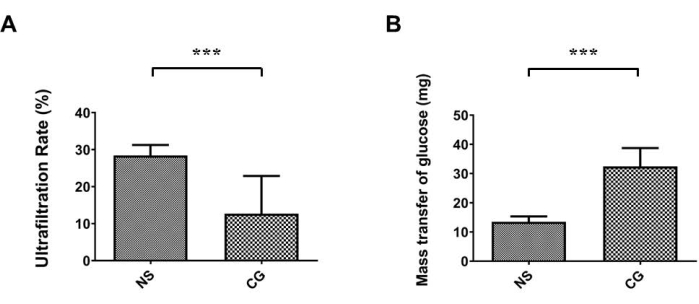
الشكل 3: تدهور الوظيفة البريتونية في نموذج الماوس PD. (أ) في المجموعة المعرضة للكلورهيكسيدين غلوكونات (CG) ، كان معدل الترشيح الفائق أقل بكثير منه في المجموعة المالحة الضابطة (NS). (ب) أشار النقل الكتلي للجلوكوز أيضا إلى أن CG الناجم عن زيادة في نفاذية الصفاق. يتم تمثيل البيانات كمتوسط ± الانحراف المعياري ، n ≥ 3 ؛ P < 0.005. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
في هذه الدراسة ، تم تقديم نموذج PD للفأر عن طريق حقن i.p. من CG ، وأظهرت النتائج التليف البريتوني والتدهور الوظيفي في هذا النموذج ، والذي يحاكي حالة مريض PD.
هناك العديد من الخطوات الحاسمة في البروتوكول. أولا ، لإجراء حقن i.p. من CG أو NS ، يجب التقاط جلد جدار البطن للفأر باستخدام ملقط لمنع تلف الأعضاء داخل الصفاق الناجم عن الثقب. ثانيا ، أثناء جمع الصفاق لجدار البطن للتحليلات النسيجية ، يجب تجنب المنطقة التي تضررت من حقن i.p.
من بين العديد من النماذج الحيوانية التجريبية للتليف البريتوني ، الأكثر شيوعا هو نموذج CG بسبب سهولة استخدامه وقدرته على التكيف. كان Suga et al.20 أول من أبلغ عن نموذج فأر التليف البريتوني الناجم عن CG في عام 1995. تم استخدام حقن i.p. من 0.1 ٪ CG و 15 ٪ من الإيثانول المذاب في 2 مل من المياه المالحة يوميا لمدة 26 يوما. استخدم IshiI et al.21 الفئران C57BL / 6 وأعطوا 0.3 مل من 0.1٪ CG مع 15٪ إيثانول مذاب في حقن i.p. الملحي لمدة 56 يوما ، حيث تم إحداث التهاب الصفاق المغلف المصلب التجريبي في الفئران. استخدم Nishino et al.22 فئران Wistar التي تلقت حقن i.p. بنسبة 0.1٪ CG يوميا في 15٪ إيثانول مذاب في 2 مل من المياه المالحة لمدة 28 يوما. استخدم Mishima et al.23 طريقة مماثلة للحث على التليف البريتوني في فئران Sprague-Dawley (SD) في نفس العام. استخدم Kushiyama et al.24 فئران SD وأعطوا 0.1٪ CG في 15٪ إيثانول مذاب في محلول ملحي (1.5 مل / 100 جم من وزن الجسم) حقن i.p. ثلاث مرات في الأسبوع لمدة 21 يوما. استخدم Nishino et al.25 الفئران يوميا ، حيث قام بإعطاء حقنة بنسبة 0.1٪ CG في 15٪ من الإيثانول داخل الصفاق ، مذابا في 0.2 مل من المياه المالحة لمدة 7 أيام و 15 يوما. استخدم Lua et al.26 مستحلب تاموكسيفين في زيت السمسم عند 12.5 مجم / مل ، مذاب في الإيثانول ، وحقن i.p. في الفئران عند 100 مجم / جم من وزن الجسم خلال فترة 3 أيام. بعد أسبوعين ، تم حقن 0.1٪ CG في محلول ملحي مخزن بالإيثانول / الفوسفات بنسبة 15٪ (1.5 مل / 100 جم) للفئران كل يومين لما مجموعه 10 جرعات. استخدم Yoh et al.14 فئران SD وأعطوا 1.5 مل / 100 جم من وزن الجسم بنسبة 0.1٪ CG في 15 ٪ إيثانول مذاب في حقن i.p. المالحة ثلاث مرات في الأسبوع لمدة 21 يوما. استخدم Yoh et al. الفئران البالغة من العمر 10 أسابيع وأعطيت 0.1٪ CG (0.01 مل / جم من وزن الجسم) في حقن الإيثانول بنسبة 15٪ ثلاث مرات في الأسبوع لمدة 21 يوما. في نفس العام ، استخدم lo et al.13 أيضا طريقة مماثلة.
النموذج الحالي لديه بعض القيود. أولا ، في هذا النموذج الحيواني ، تم استخدام CG كمنشط كيميائي للحث على التدهور الوظيفي بسبب التليف البريتوني بدلا من غسيل الكلى. CG هو مهيج كيميائي ، ويمكن أن يؤدي تناوله المتكرر إلى تنكس الخلايا الظهارية والاستجابات الالتهابية ، مما يسبب التليف المفرط. لوحظ التهاب والأوعية الدموية الجديدة ، وكانت هذه النتائج مماثلة لتلك التي لوحظت في المرضى الذين يعانون من مرض باركنسون. على الرغم من أن حقن CG تؤدي إلى سماكة بريتونية كبيرة ، إلا أن دراسة سابقة أظهرت أن ترسب الفيبرين كان أضعف نسبيا27. ثانيا ، الفئران المستخدمة في الدراسة الحالية لم تكن مصابة بأمراض الكلى. وبالتالي ، لا يمكن تقييم تأثير السموم البولية على الصفاق. ثالثا ، لم نقم بتقييم الالتهاب ، تولد الأوعية ، وترسب المصفوفة خارج الخلية في الصفاق. ومع ذلك ، وفقا لدراسة سابقة13 ، أظهر نفس النموذج الحيواني بالفعل أن أعداد كل من الخلايا الإيجابية F4 / 80 والأوعية الإيجابية CD31 زادت بعد التعرض ل CG. لذلك ، تجدر الإشارة إلى أن النتائج التي تم الحصول عليها في هذا النموذج الحيواني لا يمكن أن تمثل بشكل كامل حالة PD في مرضى غسيل الكلى البريتوني. في المرضى الذين يعانون من مرض باركنسون ، تكون آلية الضرر البريتوني معقدة وقد تتبع أنماطا مختلفة.
على الرغم من كل هذه القيود ، فإن النموذج الحالي بسيط وسهل الاستخدام وممكن مقارنة بالنماذج الحيوانية الأخرى لمرض باركنسون ، وفقا للدراسات السابقة3،13،14،16،18،25. تمثل هذه الطريقة نموذج التليف البريتوني المرتبط ب PD والذي يمكن تطبيقه على البحث الميداني PD.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
نشكر بصدق شين هان تسنغ على المناقشة النقدية والتنفيذ الجزئي للدراسة. تم دعم هذه الدراسة من قبل EDAHP110003 و NCKUEDA110002 من مؤسسة أبحاث مستشفى E-DA وجامعة تشنغ كونغ الوطنية ، تايوان.
Materials
| Name | Company | Catalog Number | Comments |
| 0.9% Normal Saline | Y F CHEMICAL CORP., New Taipei City, Taiwan | - | |
| 10% neutral buffered formalin | Taiwan Burnett International Co., Ltd., Taipei City, Taiwan | 00002A | |
| Automatic biochemical analyzer | Hitachi Ltd., Tokyo, Japan | Labospect Series 008 | for determining glucose concentration |
| Chlorhexidine digluconate solution, 20% in H2O | Sigma-Aldrich, MO, USA | C9394 | diluted to 0.1% with 15% ethanol for injection |
| Ethanol | Avantor Performance Materials, LLC, PA, USA | BAKR8006-05 | diluted to 15% with normal saline for working concentration |
| Glucose (Dianeal) | Baxter International, Inc., IL, USA | FNB9896 | Commercial dialysis solution (4.25%) |
| GraphPad Prism 8.0 | GraphPad Software, Inc., CA, US | ||
| L-type Glu 2 assay | FUJIFILM Wako, Japan | 461-32403 | |
| Xylazine 20 | Juily Pharmaceutical Co., Ltd., New Taipei City, Taiwan | - | |
| Zoletil 50 | Virbac Laboratories, Carros, France | - |
References
- Han, S. H., et al. Improving outcome of CAPD: twenty-five years' experience in a single Korean center. Peritoneal Dialysis International. 27 (4), 432-440 (2007).
- Kawaguchi, Y., Hasegawa, T., Nakayama, M., Kubo, H., Shigematu, T. Issues affecting the longevity of the continuous peritoneal dialysis therapy. Kidney International Supplements. 62, 105-107 (1997).
- Lee, Y. C., et al. Vitamin D can ameliorate chlorhexidine gluconate-induced peritoneal fibrosis and functional deterioration through the inhibition of epithelial-to-mesenchymal transition of mesothelial cells. BioMed Research International. 2015, 595030 (2015).
- Nakamoto, H., Kawaguchi, Y., Suzuki, H. Is technique survival on peritoneal dialysis better in Japan. Peritoneal Dialysis International. 26 (2), 136-143 (2006).
- Schaefer, F., Klaus, G., Muller-Wiefel, D. E., Mehls, O. Current practice of peritoneal dialysis in children: results of a longitudinal survey. Mid European Pediatric Peritoneal Dialysis Study Group (MEPPS). Peritoneal Dialysis International. 19, 445-449 (1999).
- Woodrow, G., Turney, J. H., Brownjohn, A. M. Technique failure in peritoneal dialysis and its impact on patient survival. Peritoneal Dialysis International. 17 (4), 360-364 (1997).
- Schmidt, D. W., Flessner, M. F. Pathogenesis and treatment of encapsulating peritoneal sclerosis: basic and translational research. Peritoneal Dialysis International. 28, 10-15 (2008).
- Augustine, T., Brown, P. W., Davies, S. D., Summers, A. M., Wilkie, M. E. Encapsulating peritoneal sclerosis: clinical significance and implications. Nephron Clinical Practice. 111 (2), 149-154 (2009).
- Di Paolo, N., Nicolai, G. A., Garosi, G. The peritoneum: from histological studies to mesothelial transplant through animal experimentation. Peritoneal Dialysis International. 28, 5-9 (2008).
- Fusshoeller, A. Histomorphological and functional changes of the peritoneal membrane during long-term peritoneal dialysis. Pediatric Nephrology. 23 (1), 19-25 (2008).
- Goffin, E. Peritoneal membrane structural and functional changes during peritoneal dialysis. Seminars in Dialysis. 21 (3), 258-265 (2008).
- Ito, T., Yorioka, N. Peritoneal damage by peritoneal dialysis solutions. Clinical and Experimental Nephrology. 12 (4), 243-249 (2008).
- Io, K., et al. SAHA suppresses peritoneal fibrosis in mice. Peritoneal Dialysis International. 35 (3), 246-258 (2015).
- Yoh, K., Ojima, M., Takahashi, S. Th2-biased GATA-3 transgenic mice developed severe experimental peritoneal fibrosis compared with Th1-biased T-bet and Th17-biased RORgammat transgenic mice. Experimental Animals. 64 (4), 353-362 (2015).
- Karl, Z. J. T., et al. Peritoneal Equilibration Test. Peritoneal Dialysis International. 7 (3), 138-148 (1987).
- Lee, Y. C., et al. The clinical implication of vitamin D nanomedicine for peritoneal dialysis-related peritoneal damage. International Journal of Nanomedicine. 14, 9665-9675 (2019).
- Goldner, J. A. Modification of the masson trichrome technique for routine laboratory purposes. The American Journal of Pathology. 14 (2), 237-243 (1938).
- Cheng, F. Y., et al. Novel application of magnetite nanoparticle-mediated vitamin D3 delivery for peritoneal dialysis-related peritoneal damage. International Journal of Nanomedicine. 16, 2137-2146 (2021).
- Ross, A., Willson, V. L. . Basic and Advanced Statistical Tests: Writing Results Sections and Creating Tables and Figures. , 13-16 (2017).
- Suga, H., et al. Preventive effect of pirfenidone against experimental sclerosing peritonitis in rats. Experimental and Toxicologic Pathology. 47 (4), 287-291 (1995).
- Ishii, Y., et al. An experimental sclerosing encapsulating peritonitis model in mice. Nephrology Dialysis Transplantation. 16 (6), 1262-1266 (2001).
- Nishino, T., et al. Antisense oligonucleotides against collagen-binding stress protein HSP47 suppress peritoneal fibrosis in rats. Kidney International. 64 (3), 887-896 (2003).
- Mishima, Y., et al. Enhanced expression of heat shock protein 47 in rat model of peritoneal fibrosis. Peritoneal Dialysis International. 23 (1), 14-22 (2003).
- Kushiyama, T., et al. Effects of liposome-encapsulated clodronate on chlorhexidine gluconate-induced peritoneal fibrosis in rats. Nephrology Dialysis Transplantation. 26 (10), 3143-3154 (2011).
- Nishino, T., et al. Involvement of lymphocyte infiltration in the progression of mouse peritoneal fibrosis model. Renal Failure. 34 (6), 760-766 (2012).
- Lua, I., Li, Y., Pappoe, L. S., Asahina, K. Myofibroblastic conversion and regeneration of mesothelial cells in peritoneal and liver fibrosis. The American Journal of Pathology. 185 (12), 3258-3273 (2015).
- Kitamura, M., et al. Epigallocatechin gallate suppresses peritoneal fibrosis in mice. Chemico-Biological Interactions. 195 (1), 95-104 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved