Method Article
グルコン酸クロルヘキシジンによる腹膜損傷のマウスモデル
* これらの著者は同等に貢献しました
要約
本プロトコルは、グルコン酸クロルヘキシジン(CG)誘発腹膜線維症の腹膜透析(PD)マウスモデルを確立する。現在のモデルは、他のPD動物モデルと比較してシンプルで使いやすいです。
要約
腹膜線維症は腹膜透析(PD)の重要な合併症です。この問題を調査して対処するには、PDの適切な動物モデルが必要です。本プロトコルは、PD患者の状態を模倣するグルコン酸クロルヘキシジン(CG)誘発腹膜線維症モデルを確立します。 腹膜線維症は、15%エタノール中のCGの0.1%を腹腔内注射によって3週間(1日おきに投与)、雄のC57BL / 6マウスで合計9回誘発しました。その後、腹膜機能試験を22日目に実施した。マウスを屠殺した後、腹壁の頭頂腹膜および肝臓の内臓腹膜を採取した。マッソンのトリクローム染色後に顕微鏡で分析すると、それらはより厚く、より線維化していました。限外濾過速度は低下し、グルコース物質輸送は腹膜透過性のCG誘発性の増加を示した。このようにして確立されたPDモデルは、PD技術の改善、透析の有効性、および患者の生存期間の延長に応用できる可能性があります。
概要
腹膜透析(PD)は腎代替療法の一種です。しかし、PDには解決できない問題があります。例えば、長期のPD治療は腹膜損傷を引き起こし、最終的には限外濾過不全および治療の中止につながる可能性がある1、2、3、4、5、6。腹膜線維症は最も深刻な合併症の1つです7,8。腹膜線維症は、間質内の細胞外マトリックスの沈着および蓄積、ならびに腹膜の血管新生および血管障害によって特徴付けられる9、10。
これらの腹膜変化の主な原因は、再発性腹膜炎および透析液の非生体適合性であり、これらは高浸透圧、高グルコース、低pH、およびグルコース分解生成物の蓄積である11,12。したがって、適切な動物実験モデルは、研究者がPD療法中の腹膜の生理学的および病理学的変化をよりよく研究するのに役立ちます。したがって、動物PDモデルの確立は、PD技術および透析有効性を改善し、患者の生存期間を延長するために重要である。この研究は、前述のように、グルコン酸クロルヘキシジン(CG)の腹腔内(i.p.)注射によってPDマウスモデルを生成することを目的としていました13,14。このPDマウスモデルは、他のPD動物モデルと比較して、シンプルで使いやすく、実現可能です。
プロトコル
すべてのマウス実験は、E-DA病院/I-Shou大学の実験動物センターによって承認され、「実験動物の世話と使用のためのガイド」(NRC、USA 2011)に従って処理されました。本研究には、7〜8週齢の雄C57BL / 6マウスを使用しました。
1.化学薬品の準備
- 0.1%グルコン酸クロルヘキシジン(CG、 材料表を参照)を15%エタノールで希釈することにより、化学刺激物を調製します。
2.動物の治療
- 3匹のマウスを対照群として割り当てます。1 mL / kgの0.9%生理食塩水(NS)を1日おきに3週間、合計9回腹腔内注射(i.p.)します。.
- 3匹のマウスを腹膜線維症群に割り当てます。グルコン酸クロルヘキシジン(CG)を使用して腹膜線維症を誘発する 15%エタノール中のCGの0.1%のi.p.注射(ステップ1.1)を12.5μL / g体重の用量で投与することにより。.これを1日おきに3週間、合計9回実行します。
3.腹膜機能検査(修正腹膜平衡検査)
- 4.25%グルコースを含む透析溶液を調製する。0.5mLの透析液サンプルを注射器で採取し、透析液サンプル中のグルコース濃度を確認します。
注:グルコース濃度は、ヘキソキナーゼ/ G6PD法に従って決定されます。透析液サンプルをL型Glu2アッセイにアクセスし、生化学分析装置で調査した( 材料の表を参照)。これが初期透析液グルコース濃度である。 - ゾレチルとキシラジン(体積で1:2の比率で調製、 材料の表を参照)を20μL / 20gwの用量で筋肉内注射することにより、マウスを麻酔します。.さらに、麻酔下での乾燥を防ぐために、目に獣医軟膏を使用してください。
- 透析液(2 mL / 20 g体重)の点滴を行います。
- 30分後、つま先のピンチ反射の欠如を伴う麻酔の深さを評価および検証します。次に、腹部の正中線(剣状突起の下)を垂直に切開し、マウスの腹部を開き、注射器(「ボリューム1」と定義)で腹腔内液を採取します。次に、清潔で乾燥した綿の重量を測定し、綿をマウスの腹腔に入れて、残留腹腔内液を吸収します。最後に、綿の重さをもう一度測定します。
注:綿の体重増加は、残留腹腔内液の重量と同じです。次に、得られた体積(比重:1 g / cm3、「体積2」と定義)に変換します。最終的な透析液量は、ボリューム1とボリューム2です。 - 0.5 mLの透析液サンプル(最終透析液)を使用してグルコース濃度を測定します。これが最終的な透析液グルコース濃度です。
- 式15を使用して正味限外ろ過を計算します。
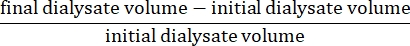
- 下記式15を用いて腹膜透過性を計算する:

4.腹壁筋と肝臓の組織調製と組織学的分析
- 心臓穿刺(瀉血)によってマウスを犠牲にする3,16。
- 腹壁(1 cm x 1 cm)と全肝切除術を切断します。マウスの腹壁と肝臓組織を10%中性緩衝ホルマリンで一晩固定します。
- 腹壁筋と肝臓の厚さ3μmのパラフィン切片を作製し、既報の17に続いて組織学的解析を行います。
- マウスの腹壁の頭頂腹膜および肝臓表面の内臓腹膜を形態測定18を用いて評価する。
- 統計およびグラフ作成ソフトウェアを使用して統計分析を実行します( 材料表を参照)。すべてのデータをSD±平均値として表し、t検定19を使用して統計的有意性を分析します。 P < 0.05 の値を有意な結果として定義します。
結果
図1A,Bでは、腹壁の頭頂腹膜はマッソンのトリクローム染色17の下で著しく厚く、より線維化しており、CG曝露群では腹膜線維症が対照生理食塩水群(NS)よりも重症であることを示しています。図2A,Bでは、肝臓表面の内臓腹膜も著しく厚く、線維性が高く、CG曝露群では、腹膜線維症が対照生理食塩水群(NS)よりも重症であることが証明されています。図3Aでは、CG群では限外濾過率が低下し、グルコース物質輸送はCG誘導群で腹腔透過性が上昇したことを示した(図3B)。

図1:腹膜透析(PD)マウスモデルにおける腹壁頭頂腹膜の線維化。 (A)CGに曝露された群では、腹膜線維症はマッソントリクローム染色下の対照群(NS)よりも重症です。(B)(A)の定量化データを平均値±標準偏差n≥3として表す; P < 0.01(A)の場合、スケールバー= 100μmです。 この図の拡大版を表示するには、ここをクリックしてください。
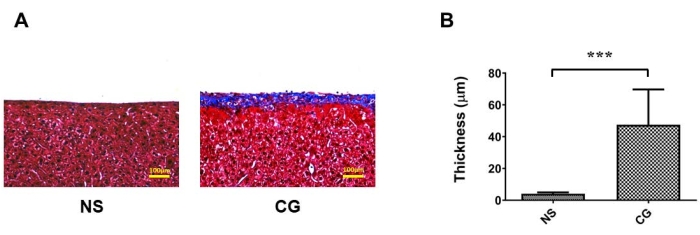
図2:腹膜透析(PD)マウスモデルにおける肝臓表面の内臓腹膜の線維化 。 (A)CGに曝露されたグループでは、腹膜線維症はマッソントリクローム染色下の対照群(NS)よりも重症です。(B)(A)の定量化データを平均値±標準偏差n≥3として表す; P < 0.005(A)の場合、スケールバー= 100μmです。 この図の拡大版を表示するには、ここをクリックしてください。
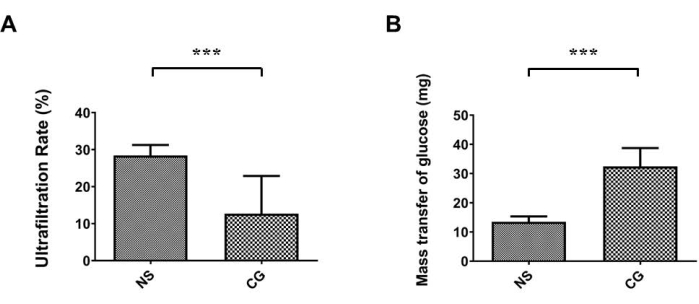
図3:PDマウスモデルにおける腹膜機能の低下 。 (a)グルコン酸クロルヘキシジン曝露群(CG)では、限外濾過率は対照生理食塩水群(NS)よりも有意に低かった。(B)グルコース物質輸送はまた、CGが腹膜透過性の増加を誘導することを示した。データは、標準偏差±n ≥ 3 の平均として表されます。 P < 0.005 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
本研究では、CGのi.p.注射によりマウスPDモデルを提示し、PD患者の状態を模倣した腹膜線維化と機能低下を示した。
プロトコルにはいくつかの重要なステップがあります。まず、CGまたはNSのi.p.注射を行うには、穿刺による腹腔内臓器損傷を防ぐために、鉗子を使用してマウスの腹壁皮膚をピックアップする必要があります。第二に、組織学的分析のために腹壁の腹膜を採取する際に、i.p.注射によって損傷を受けた領域は避けなければなりません。
腹膜線維症のいくつかの実験動物モデルの中で、最も一般的なのは、その使いやすさと適応性のためにCGモデルです。Sugaら20 は、1995年にCG誘発腹膜線維症ラットモデルを最初に報告した。2mLの生理食塩水に溶解した0.1%CGおよび15%エタノールの注射を26日間毎日使用した。IshiIら21 はC57BL/6マウスを用い、生理食塩水に溶解した15%エタノールを含む0.1%CGを0.3mLのi.p.注射で合計56日間投与し、マウスに腹膜炎を封入する実験的硬化性を誘発した。西野ら22は、2mL の生理食塩水に溶解した15%エタノールに0.1%CGを毎日28日間i.p.注射したWistarラットを用いた。Mishimaら23 は、同じ年にSprague-Dawley(SD)ラットで腹膜線維症を誘発するために同様の方法を使用した。Kushiyamaら24はSDラットを用い、生理食塩水(1.5mL/体重100g)に溶解した15%エタノール中の0.1%CGを週3回、21 日間注射した。西野ら25はマウスを毎日使用し、15%エタノール中の0.1%CGを腹腔内に注射し、0.2mL の生理食塩水に溶解して7日間および15日間投与した。Luaら26 は、ゴマ油に12.5 mg / mLで乳化したタモキシフェンを使用し、エタノールに溶解し、3日間に100 mg / g体重でマウスにi.p.注射しました。2週間後、15%エタノール/リン酸緩衝生理食塩水(1.5 mL / 100 g)中の0.1%CGを1日おきに合計10回マウスに注射しました。.Yohら14 はSDラットを使用し、生理食塩水に溶解した15%エタノール中の0.1%CGの1.5mL/100g体重を週3回21日間投与した。Yohらは10週齢のマウスを使用し、15%エタノールi.p.注射で0.1%CG(0.01 ml / g体重)を週3回、合計21日間投与しました。同年、loら13 も同様の方法を使用した。
現在のモデルにはいくつかの制限があります。まず、この動物モデルでは、透析液の代わりに腹膜線維症による機能低下を誘発する化学刺激剤としてCGが使用されました。CGは化学的刺激物であり、その反復投与は中皮細胞の変性および炎症反応を引き起こし、したがって過度の線維症を引き起こす可能性がある。炎症と新生血管形成が観察され、これらの所見はPD患者で観察されたものと同様でした。CG注射は有意な腹膜肥厚をもたらすが、以前の研究ではフィブリン沈着が比較的弱いことが示された27。第二に、本研究で使用されたマウスは腎臓病を患っていませんでした。その結果、腹膜に対する尿毒症毒素の影響を評価することができなかった。第三に、腹膜における炎症、血管新生、細胞外マトリックス沈着を評価しなかった。しかし、以前の研究13によると、同じ動物モデルでは、CG曝露後にF4 / 80陽性細胞とCD31陽性血管の両方の数が増加することがすでに示されています。したがって、この動物モデルで得られた結果は、腹膜透析患者におけるPDの状態を完全に表すことができないことに注意する必要があります。PD患者では、腹膜損傷のメカニズムは複雑であり、異なるパターンに従う可能性があります。
これらすべての制限にもかかわらず、本モデルは、以前の研究3、13、14、16、18、25によると、PDの他の動物モデルと比較して単純で使いやすく、実行可能である。この方法は、PDフィールド研究に適用できるPD関連腹膜線維症モデルを表しています。
開示事項
著者は開示するものは何もありません。
謝辞
私たちは、研究の批判的な議論と部分的な実行について、Shin-Han Tsengに心から感謝します。この研究は、E-DA病院研究財団と台湾の国立成功大学のEDAHP110003およびNCKUEDA110002によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 0.9% Normal Saline | Y F CHEMICAL CORP., New Taipei City, Taiwan | - | |
| 10% neutral buffered formalin | Taiwan Burnett International Co., Ltd., Taipei City, Taiwan | 00002A | |
| Automatic biochemical analyzer | Hitachi Ltd., Tokyo, Japan | Labospect Series 008 | for determining glucose concentration |
| Chlorhexidine digluconate solution, 20% in H2O | Sigma-Aldrich, MO, USA | C9394 | diluted to 0.1% with 15% ethanol for injection |
| Ethanol | Avantor Performance Materials, LLC, PA, USA | BAKR8006-05 | diluted to 15% with normal saline for working concentration |
| Glucose (Dianeal) | Baxter International, Inc., IL, USA | FNB9896 | Commercial dialysis solution (4.25%) |
| GraphPad Prism 8.0 | GraphPad Software, Inc., CA, US | ||
| L-type Glu 2 assay | FUJIFILM Wako, Japan | 461-32403 | |
| Xylazine 20 | Juily Pharmaceutical Co., Ltd., New Taipei City, Taiwan | - | |
| Zoletil 50 | Virbac Laboratories, Carros, France | - |
参考文献
- Han, S. H., et al. Improving outcome of CAPD: twenty-five years' experience in a single Korean center. Peritoneal Dialysis International. 27 (4), 432-440 (2007).
- Kawaguchi, Y., Hasegawa, T., Nakayama, M., Kubo, H., Shigematu, T. Issues affecting the longevity of the continuous peritoneal dialysis therapy. Kidney International Supplements. 62, 105-107 (1997).
- Lee, Y. C., et al. Vitamin D can ameliorate chlorhexidine gluconate-induced peritoneal fibrosis and functional deterioration through the inhibition of epithelial-to-mesenchymal transition of mesothelial cells. BioMed Research International. 2015, 595030 (2015).
- Nakamoto, H., Kawaguchi, Y., Suzuki, H. Is technique survival on peritoneal dialysis better in Japan. Peritoneal Dialysis International. 26 (2), 136-143 (2006).
- Schaefer, F., Klaus, G., Muller-Wiefel, D. E., Mehls, O. Current practice of peritoneal dialysis in children: results of a longitudinal survey. Mid European Pediatric Peritoneal Dialysis Study Group (MEPPS). Peritoneal Dialysis International. 19, 445-449 (1999).
- Woodrow, G., Turney, J. H., Brownjohn, A. M. Technique failure in peritoneal dialysis and its impact on patient survival. Peritoneal Dialysis International. 17 (4), 360-364 (1997).
- Schmidt, D. W., Flessner, M. F. Pathogenesis and treatment of encapsulating peritoneal sclerosis: basic and translational research. Peritoneal Dialysis International. 28, 10-15 (2008).
- Augustine, T., Brown, P. W., Davies, S. D., Summers, A. M., Wilkie, M. E. Encapsulating peritoneal sclerosis: clinical significance and implications. Nephron Clinical Practice. 111 (2), 149-154 (2009).
- Di Paolo, N., Nicolai, G. A., Garosi, G. The peritoneum: from histological studies to mesothelial transplant through animal experimentation. Peritoneal Dialysis International. 28, 5-9 (2008).
- Fusshoeller, A. Histomorphological and functional changes of the peritoneal membrane during long-term peritoneal dialysis. Pediatric Nephrology. 23 (1), 19-25 (2008).
- Goffin, E. Peritoneal membrane structural and functional changes during peritoneal dialysis. Seminars in Dialysis. 21 (3), 258-265 (2008).
- Ito, T., Yorioka, N. Peritoneal damage by peritoneal dialysis solutions. Clinical and Experimental Nephrology. 12 (4), 243-249 (2008).
- Io, K., et al. SAHA suppresses peritoneal fibrosis in mice. Peritoneal Dialysis International. 35 (3), 246-258 (2015).
- Yoh, K., Ojima, M., Takahashi, S. Th2-biased GATA-3 transgenic mice developed severe experimental peritoneal fibrosis compared with Th1-biased T-bet and Th17-biased RORgammat transgenic mice. Experimental Animals. 64 (4), 353-362 (2015).
- Karl, Z. J. T., et al. Peritoneal Equilibration Test. Peritoneal Dialysis International. 7 (3), 138-148 (1987).
- Lee, Y. C., et al. The clinical implication of vitamin D nanomedicine for peritoneal dialysis-related peritoneal damage. International Journal of Nanomedicine. 14, 9665-9675 (2019).
- Goldner, J. A. Modification of the masson trichrome technique for routine laboratory purposes. The American Journal of Pathology. 14 (2), 237-243 (1938).
- Cheng, F. Y., et al. Novel application of magnetite nanoparticle-mediated vitamin D3 delivery for peritoneal dialysis-related peritoneal damage. International Journal of Nanomedicine. 16, 2137-2146 (2021).
- Ross, A., Willson, V. L. . Basic and Advanced Statistical Tests: Writing Results Sections and Creating Tables and Figures. , 13-16 (2017).
- Suga, H., et al. Preventive effect of pirfenidone against experimental sclerosing peritonitis in rats. Experimental and Toxicologic Pathology. 47 (4), 287-291 (1995).
- Ishii, Y., et al. An experimental sclerosing encapsulating peritonitis model in mice. Nephrology Dialysis Transplantation. 16 (6), 1262-1266 (2001).
- Nishino, T., et al. Antisense oligonucleotides against collagen-binding stress protein HSP47 suppress peritoneal fibrosis in rats. Kidney International. 64 (3), 887-896 (2003).
- Mishima, Y., et al. Enhanced expression of heat shock protein 47 in rat model of peritoneal fibrosis. Peritoneal Dialysis International. 23 (1), 14-22 (2003).
- Kushiyama, T., et al. Effects of liposome-encapsulated clodronate on chlorhexidine gluconate-induced peritoneal fibrosis in rats. Nephrology Dialysis Transplantation. 26 (10), 3143-3154 (2011).
- Nishino, T., et al. Involvement of lymphocyte infiltration in the progression of mouse peritoneal fibrosis model. Renal Failure. 34 (6), 760-766 (2012).
- Lua, I., Li, Y., Pappoe, L. S., Asahina, K. Myofibroblastic conversion and regeneration of mesothelial cells in peritoneal and liver fibrosis. The American Journal of Pathology. 185 (12), 3258-3273 (2015).
- Kitamura, M., et al. Epigallocatechin gallate suppresses peritoneal fibrosis in mice. Chemico-Biological Interactions. 195 (1), 95-104 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved