Method Article
Анализ гранулоцитарно-макрофагальных колониестимулирующих фактор-продуцирующих Т-хелперов в мышиной модели контактной гиперчувствительности
В этой статье
Резюме
В данной работе мы представляем простой и стандартизированный метод анализа гранулоцитарно-макрофагального колониестимулирующего фактора-продуцирующего Т-хелпера in vivo.
Аннотация
Параллельно с традиционными линиями Th1/Th2/Th17/Treg, гранулоцитарно-макрофагальные колониестимулирующие фактор-продуцирующие Т-хелперы (Th-GM) были идентифицированы как отдельное подмножество Т-хелперных клеток (GM-CSF+ IFN-γ-IL-17A-IL-22-эффекторные CD4+ Т-клетки) у человека и мышей. Контактная гиперчувствительность (CHS) считается отличной животной моделью аллергического контактного дерматита (АХД) у человека, проявляющего интактный иммунный ответ, опосредованный Т-клетками. Чтобы обеспечить стандартизированный и всесторонний анализ субпопуляции Th-GM клеток в Т-клеточном иммунном ответе in vivo, мышиную модель CHS индуцировали путем сенсибилизации/провокации с реактивным, низкомолекулярным, органическим гаптеном, 2,4-динитрофробензолом (DNFB). Субпопуляция Th-GM в эффекторных CD4+ Т-клетках, полученная при иммунизации гаптеном, анализировали с помощью проточной цитометрии. Мы обнаружили, что Th-GM в основном был расширен в поражениях и дренирующих лимфатических узлах в мышиной модели CHS, индуцированной DNFB. Этот метод может быть применен для дальнейшего изучения биологии Th-GM клеток и фармакологических исследований терапевтических стратегий, основанных на GM-CSF при различных состояниях, таких как ACD.
Введение
Т-хелперные клетки, продуцирующие гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) - подмножество Th-GM - выделяются в отдельную подгруппу Т-хелперов у человека и мышей и, как считается, включают в себя "только экспрессирующие GM-CSF" (GM-CSF+ IFN-γ- IL-17A- IL-22-) CD4 Т-клетки, идентифицированные с помощью анализа одноклеточной РНК, массовой цитометрии и картирования судьбы мышей GM-CSF 1,2,3. В 2014 году Sheng et al. сообщили о программировании сигнального преобразователя и активатора транскрипции 5 (STAT5) подмножества Th-GM и впервые концептуализировали подмножество «Th-GM» 4,5. Клетки Th-GM характеризуются цитокиновой экспрессией GM-CSF, IL-2, TNF-α, IL-3, CCL20 и хемокиновых рецепторов типа C-X-C (CXCR) 4 или CXCR6 1,2. STAT и/или путь NF-κB имеют важное значение для дифференциации линии Th-GM. Был разработан метод in vitro для дифференцировки наивных CD4 Т-клеток в Th-GM клетки с использованием IL-7 в присутствии стимулов TCR6. Между тем, было показано, что цитокины IL-23 и IL-1β поддерживают экспрессию и патогенность клеток Th-GM ex vivo 3,7.
Повышение уровня клеток Th-GM было связано с несколькими аутоиммунными заболеваниями, такими как рассеянный склероз и ревматоидный артрит 2,8,9, что предполагает потенциальную роль в патогенезе аутоиммунитета10. Накапливающиеся данные свидетельствуют о том, что ГМ-КСФ может функционировать как медиатор воспаления. У мышей с генетической гиперэкспрессией Csf2 (гена, кодирующего GM-CSF) в CD4+ Т-клетках спонтанно развивался неврологический дефицит, сопровождающийся инфильтрацией фагоцитов в центральную нервную систему. В модели колита, связанного с переносом Т-клеток, адоптивный перенос Csf2−/− Т-клеток мышам Rag1−/− значительно снижал клинические и гистопатологические особенности заболевания. Тем не менее, существует мало сообщений о роли субпопуляции Th-GM в развитии аллергических заболеваний, таких как АХЗ.
АХП является одним из наиболее распространенных воспалительных дерматологических состояний с высокой распространенностью на работе и в быту11,12. Это реакция гиперчувствительности отсроченного типа IV, опосредованная интактной иммунной цепью, которая развивается в двух временных сегментированных фазах: сенсибилизация и выявление. АКД человека вызывается воздействием некоторых химических веществ (гаптенов или металлов), которые приводят к сенсибилизации. Во время этой фазы Т-клеточный ответ стимулируется гаптен-белковыми комплексами, представленными антигенпрезентирующими клетками. При последующем воздействии того же гаптена гаптен-специфические эффекторные и Т-клетки памяти реактивируются и локализуются на коже, что включает в себя инфильтрацию различных популяций иммунных клеток. Эта острая воспалительная реакция известна как элицитация, приводящая к полному развитию поражений13. ACD человека может быть изучена с использованием животных моделей контактной гиперчувствительности (CHS)14.
Модель CHS, индуцированная реакционноспособным, низкомолекулярным органическим гаптеном, 2,4-динитрофорбензолом (DNFB), является широко используемой мышиной моделью, которая использовалась при изучении патологии, а также потенциальных терапевтических вмешательств ACD15,16. Таким образом, эта Т-клеточно-зависимая модель может быть применена для изучения генерации субпопуляции Th-GM при аллергических заболеваниях. В данной работе мы индуцировали мышиную модель СЧХ с помощью DNFB, проанализировали генерацию Th-GM в поражениях и дренирующих лимфатических узлах и обнаружили, что субпопуляция Th-GM в основном расширяется при повторном воздействии того же гаптена. Это говорит о том, что субпопуляция Th-GM может быть существенной для развития АХД и представляет собой специфическую терапевтическую мишень при АХД.
протокол
Все мыши, используемые в этом протоколе, находились на генетическом фоне C57BL/6, содержались в определенных условиях, свободных от патогенов, и получали пищу и воду в неограниченном количестве. Все эксперименты были одобрены органом по этической экспертизе благополучия животных Западно-Китайского медицинского центра Сычуаньского университета (20210302059).
1. Подготовка реагентов и материалов
- 0,5% раствор DNFB в качестве сенсибилизатора
- Для сенсибилизации 10 мышей приготовьте 1,1 мл смеси ацетона и оливкового масла в соотношении 4:1 (v/v): смешайте 880 мкл ацетона и 220 мкл оливкового масла, чтобы 0,1 мл избыточного объема компенсировали любые незначительные потери объема. Добавьте 5 μL DNFB к 1,1 мл смеси гомогенизированного ацетона и оливкового масла 4:1.
ПРИМЕЧАНИЕ: Приготовьте свежие продукты в день сенсибилизации. Смесь ацетона и оливкового масла следует готовить в вытяжном шкафу.
- Для сенсибилизации 10 мышей приготовьте 1,1 мл смеси ацетона и оливкового масла в соотношении 4:1 (v/v): смешайте 880 мкл ацетона и 220 мкл оливкового масла, чтобы 0,1 мл избыточного объема компенсировали любые незначительные потери объема. Добавьте 5 μL DNFB к 1,1 мл смеси гомогенизированного ацетона и оливкового масла 4:1.
- Решение DNFB 0,2% в качестве претендента
- Чтобы испытать 10 мышей, добавьте 0,5 мкл DNFB в 0,25 мл гомогенизированной смеси ацетона и оливкового масла 4:1, описанной в шаге 1.1. Используйте смесь ацетона и оливкового масла 4:1 в качестве средства при работе с мышами после сенсибилизации.
ПРИМЕЧАНИЕ: Смесь ацетона и оливкового масла следует готовить в вытяжном шкафу.
- Чтобы испытать 10 мышей, добавьте 0,5 мкл DNFB в 0,25 мл гомогенизированной смеси ацетона и оливкового масла 4:1, описанной в шаге 1.1. Используйте смесь ацетона и оливкового масла 4:1 в качестве средства при работе с мышами после сенсибилизации.
- Хлоралгидрат в качестве обезболивающего средства
- Растворите 4 г хлоралгидрата в 50 мл фосфатно-солевого буфера (PBS) до получения 8% рабочего раствора. Отфильтровать и хранить при температуре 4 °C до 3 месяцев. Используйте 5 мкл на г массы тела для мыши.
- 50x коллагеназа внутривенно подвой
- Растворите 100 мг коллагеназы в/в в 1 мл базовой среды RPMI 1640 (без добавления антибиотиков или фетальной бычьей сыворотки [FBS]) до получения запаса 100 мг/мл. Хранить при температуре -20 °C в 100 μл аликвот до 6 месяцев.
- 1 000x DNase I stock
- Растворите 5 мг ДНКазы I в 1 мл 0,15 М NaCl до получения запаса 5 мг/мл. Хранить при температуре -20 °C в 100 μл аликвот до 6 месяцев.
- Буфер остановки
- Растворите 1,681 г ЭДТА в 50 мл базовой среды RPMI 1640 до получения запаса 100 мМ. Хранить при температуре 4 °C до 2 недель.
- Моющая среда
- Растворите 0,372 г ЭДТА до конечной концентрации 2 мМ и 5 мл FBS до конечной концентрации 1% с 500 мл PBS. Отфильтровать и хранить при температуре 4 °C до 1 месяца.
- Буфер для окрашивания
- Растворите 0,372 г ЭДТА до конечной концентрации 2 мМ и 10 мл FBS до конечной концентрации 2% с 500 мл PBS. Отфильтровать и хранить при температуре 4 °C до 1 месяца.
- Реагенты для рестимуляции
- Растворите 1 мг форбола 12-миристат13-ацетата (ФМА) в 20 мл ДМСО с получением запаса 50 мкг/мл (500x) и храните его при -20 °C в 50 мкл аликвот.
- Разведите 250 мкл иономицина в растворе (4 мг/мл) в 7,75 мл ДМСО с получением запаса 500 мкг/мл (500x) и храните его при -20 °C в 50 мкл аликвот.
- Аликвоту 1 мл раствора ингибитора транспорта белка (содержащего брефельдин А) в 50 мкл и хранить аликвоты при 4 °С.
2. Индукция CHS у мышей
- На 5-й день обезболите мышей, введя 400 мг/кг хлоралгидрата внутрибрюшинно.
- С помощью бритвы для домашних животных выбрейте область живота мыши от 2 см × 2 см.
ПРИМЕЧАНИЕ: Не царапайте кожу мыши; сохранить целостность кожного барьера в целости. - Аккуратно и равномерно нанесите 100 мкл 0,5% раствора DNFB на выбритый живот с помощью микропипетки с одноразовыми наконечниками. Подержите мышей 5-10 секунд, чтобы часть растворителя испарилась.
- На день -4 повторите шаги 2.1-2.3 для повторной сенсибилизации.
ПРИМЕЧАНИЕ: Два сенсибилизирующих события работают лучше, чем одно. - В день 0 обработайте правое ухо мышей 20 μл 0,2% DNFB с помощью микропипеттора с одноразовыми наконечниками, а левое ухо обработайте тем же объемом смеси ацетона и оливкового масла 4:1, что и носитель.
ПРИМЕЧАНИЕ: Проработайте тыльную и вентральную стороны уха с помощью одинакового объема DNFB или носителя. - В последующие 3 дня ежедневно измеряйте толщину уха правого и левого уха мышей с помощью циферблатного толщиномера, и рассчитывайте увеличение толщины уха: толщина правого уха - толщина левого уха.
Примечание: Постепенное увеличение толщины ушей может наблюдаться у 0,2% ушей мышей, подвергшихся воздействию DNFB, по сравнению с ушами, обработанными носителем.
3. Выборочная коллекция мышей CHS
- На 3-й день обезболите мышей внутрибрюшинной инъекцией 400 мг/кг хлоралгидрата. Подождите 5-10 минут, пока мышь не войдет в бессознательное состояние, и выполните легкое ущипывание пальцев обеих задних ног, чтобы подтвердить, что мыши глубоко обезболились.
- Сфотографируйте каждое ухо каждой мыши с помощью камеры. Оцените инкрустацию (шелушение на ухе) и покраснение уха (эритему на ухе) самостоятельно для оценки выраженности воспаления по шкале от 0 до 5:0, нет; 1, незначительный; 2, умеренный; 3, помеченный; 4, очень заметный; 5, самый тяжелый.
- Усыпите мышь при вывихе шейки матки. Отрежьте все ухо и рассеките параллельно дренируемые лимфатические узлы мышей с помощью стерильных острых ножниц и щипцов. Поместите ткани в одну лунку 6-луночного планшета, помещенного на лед, содержащую 5 мл предварительно охлажденного PBS для ферментативной или физической диссоциации с получением суспензий одиночных клеток (дополнительный рисунок S1A и дополнительный рисунок S2A).
- Для гистологического анализа зафиксировать образцы из уха в 4% параформальдегиде, обезвожить и погрузить их в парафин для иммуногистохимического окрашивания, как описано в другом месте17.
4. Приготовление одноклеточной суспензии из ушей
- Разделите вентральную и тыльную стороны уха, зажав и разорвав обрезанные концы двумя изогнутыми щипцами (дополнительный рисунок S1B). Поместите их в лунку 6-луночного планшета, содержащего 4,5 мл буфера для пищеварения, убедившись, что эти ткани полностью погружены в буфер для пищеварения (дополнительный рисунок S1C).
Примечание: Буфер для расщепления состоял из RPMI 1640, содержащего 10% FBS + 25 мМ HEPES + 2 мг/мл коллагеназы IV + 5 мкг/мл ДНКазы I. - Инкубируйте листочки колоса в инкубаторе для клеточных культур при температуре 37 °C в течение 20 минут. Разрежьте ушные листочки ножницами как можно мельче, чтобы облегчить переваривание тканей (дополнительный рисунок S1D), и поместите образец обратно в инкубатор еще на 40 минут.
ПРИМЕЧАНИЕ: Эффективное пищеварение может быть достигнуто в течение 40-50 минут. Переваривание при 37 °C влияет на жизнеспособность клеток. - Добавьте 0,5 мл стоп-буфера на лунку, чтобы нейтрализовать ферментативную активность коллагеназы IV и ДНКазы I. Выполните следующие шаги на льду.
- Перенесите фрагменты ткани уха с помощью пары изогнутых щипцов в центрифужную пробирку объемом 50 мл, содержащую клеточный фильтр 70 мкм, и нанесите пипетку всего объема среды в тот же клеточный фильтр.
- Разрушьте ткани с помощью верхнего конца поршня шприца объемом 1 мл. Надавливайте круговыми движениями на клеточный фильтр 70 мкм, пока не останутся только белые соединительные ткани (дополнительный рисунок S1D).
- Дважды промойте сетчатые фильтры 1 000 μл моющей среды. Перенесите весь объем лунки в центрифужную пробирку объемом 50 мл через сетчатый фильтр 40 μм. Держите трубку на льду.
5. Приготовление одноклеточных суспензий из дренирующих лимфатических узлов (дЛН)
- Перенесите лимфатические узлы с помощью пары изогнутых щипцов на клеточный фильтр 70 мкм, расположенный поверх лунки 6-луночного планшета (дополнительный рисунок S2B). Диссоциируйте лимфатические узлы с помощью верхнего конца поршня шприца объемом 1 мл. Надавливайте круговыми движениями на сетчатый фильтр 70 мкм до тех пор, пока не останется только белый мусор (дополнительный рисунок S2C).
- Дважды промойте сетчатое фильтр 1 000 μл моющей среды. Переложите весь объем лунки в трубку объемом 5 мл. Держите трубки на льду.
6. Рестимуляция субпопуляции Th-GM 12-миристатом 13-ацетатом (PMA)/иономицином в присутствии ингибитора транспорта белка
- Центрифугируйте клетки, выделенные из уха и образцов дренируемых лимфатических узлов, в течение 8 минут при 400 × г при 4 °C и выбросьте надосадочную жидкость. Осторожно восстановите суспендию в 1 000 μл моющей среды.
- Соберите небольшую часть каждого образца, чтобы подсчитать общее количество клеток, полученных из уха и дренируемого лимфатического узла, с помощью гемоцитометра. Добавьте 0,04% трипанового синего для измерения жизнеспособности клеток.
ПРИМЕЧАНИЕ: Жизнеспособность клеток должна составлять более 60% для последующей стимуляции и анализа Т-клеток. Плотность клеток может составлять 1-5 × 106/мл. - Центрифугируйте клетки на шаге 6.1 и выбросьте надосадочную жидкость. Осторожно ресуспендируйте гранулу 1000 мкл среды RPMI 1640, содержащей 2% FBS, и затравите 1 мл суспензии одиночных клеток (10–6 клеток/мл) в 12-луночных планшетах для культуры тканей с плоским дном.
- Добавьте 2 мкл форбол 12-миристат13-ацетата (PMA) (конечная концентрация 100 нг/мл), 2 мкл иономицина (конечная концентрация 1000 нг/мл) и 1 мкл ингибитора переноса белка (содержащего брефельдин А) в каждую лунку в 12-луночный планшет, содержащий 1 мл вышеуказанной суспензии одиночных клеток, и инкубируйте при 37 °C в течение 4 ч.
7. Анализ субпопуляций Th-GM, полученных in vivo путем окрашивания клеточной поверхности и внутриклеточного окрашивания
- Перенесите стимулированные клетки в центрифужные пробирки объемом 1,5 мл с помощью пипетки. Центрифугируйте пробирки центрифуги в течение 8 мин при 400 × г при комнатной температуре и выбросьте надосадочную жидкость.
- Промойте гранулу клетки один раз 1 мл буфера для окрашивания и обеспечьте клетки центрифугированием, как описано в шаге 7.1. Ресуспендируйте клетки в дозе 1-10 × 106/мл в 0,5 мл окрашивающего буфера.
- Добавьте 0,5 мкл стокового раствора красителя для жизнеспособности (см. Таблицу материалов) в 0,5 мл клеточной суспензии и немедленно сделайте вихрь. Выдержать смесь в течение 10 минут при комнатной температуре в темноте. Дважды промойте клетки 1 мл буфера для окрашивания и повторите центрифугирование в шаге 7.1 для гранулирования клеток.
- Суспендируйте гранулу в 0,1 мл буфера для окрашивания. Добавьте 1 мкл анти-CD4 антитела (FITC-конъюгированное), 1 мкл анти-CD44 антитела (APC-конъюгированное) и 1 мкл анти-CD62L антитела (PE/Cyanine7-конъюгированное) к трем 0,1 мл аликвот клеточной суспензии. Вихрь сразу же выдержать и инкубировать при комнатной температуре в течение 15 минут, защищенном от света месте.
- Повторите промывку и центрифугирование на шаге 7.3.
- Повторно суспендируйте гранулу в 200 мкл буфера для фиксации IC и инкубируйте в течение 20 минут в темноте. Тем временем приготовьте пермеабилизационный буфер (1x), разбавив 1 часть пермеабилизационного буфера (10x) 9 частями дистиллированной воды. Дважды промойте клетки 1 мл пермеабилизационного буфера (1x) центрифугированием при 600 × г в течение 5 минут при комнатной температуре.
- Ресуспендируют гранулу в 0,1 мл пермеабилизационного буфера (1x) с антителами против GM-CSF (PE-конъюгированный, 1 μл/анализ), ИФН-γ (BV711-конъюгированный, 1 μл/анализ), IL-17A (BV421-конъюгированный, 1 μл/анализ) и IL-22 (PerCP/Cyanine5,5-конъюгированный, 5 μл/анализ) и инкубируют в течение 30 минут при комнатной температуре в темноте.
- Повторите промывки и центрифугирование на шаге 7.6.
- Повторно суспендируйте клеточную гранулу в 200 мкл PBS и перенесите суспензию в пробирку с круглым дном. Запустите окрашенные клетки в проточный цитометр.
8. Стратегия стробирования для идентификации подмножества Th-GM
- Проанализируйте данные проточной цитометрии (см. Таблицу материалов для получения подробной информации об используемом программном обеспечении) с использованием стратегии стробирования, показанной на дополнительном рисунке S1. Используемое здесь программное обеспечение можно скачать и настроить на компьютере.
- Импортируйте данные проточной цитометрии, нажав на Файл |Открыть | Импортируйте файлы FCS в программное обеспечение и аннотируйте группу и имя каждого образца, выбрав вкладку Переименовать .
- Выберите лимфоциты на графике FSC и SSC ( FSC low SSC low, P1), чтобы исключить мусор, обнаруженный в нижнем левом углу, и миелоидные клетки с большим размером и высокой зернистостью, щелкнув по графику плотности, и отобразите ось X этого графика как FSC-A , а ось Y как SSC-A.
- Дважды щелкните события в P1, чтобы создать еще один график плотности, и отделите отдельные ячейки (показаны в виде коррелированной линии, P2) от агрегатов ячеек, выбрав высоту и площадь ячейки на этом графике (ось X как FSC-A и ось Y как FSC-H).
- Дважды щелкните события в P2, чтобы создать еще один график плотности, и покажите ось X этого графика как FSC-A , а ось Y как SSC-A. Гейтирование жизнеспособных клеточных популяций с помощью событий FVS 780- (P3).
- Дважды щелкните события в P3, чтобы построить следующий график плотности ( ось X как CD4-A , а ось Y как SSC-A), и выделите CD4 T-клетки, выбрав популяцию CD4+ (P4).
- Дважды щелкните события в P4, чтобы создать еще один график плотности (ось X как CD44-A, а ось Y как CD62L-A), и определите вспомогательные ячейки эффектора T, выбрав верхнюю правую популяцию этого графика (CD62L- CD44+, P5).
9. Статистический анализ
- Выполняйте статистический анализ, сравнивая две группы с помощью непарного t-критерия. *P < 0,05, ** P < 0,01, *** P < 0,001 и **** P < 0,0001 (среднее значение ± SD).
Результаты
DNFB-индуцированная CHS (контактная гиперчувствительность) у мышей
Чтобы индуцировать CHS у мышей, мышам проводили сенсибилизацию и вводили DNFB, наносимый на кожу уха, как показано на рисунке 1A. Толщина уха, являющаяся индикатором эпидермального спонгиоза, была заметно увеличена у мышей, получавших DNFB, по сравнению с мышами, получавшими носители (рис. 1B, 70 против 3 мкм в 1-й день, 203 против 7,5 мкм во 2-й день, 276 против 5 мкм в 3-й день). Через семьдесят два часа после заражения правое ухо мышей показало признаки эритемы, инкрустации и утолщения, в то время как ухо, обработанное носителем, не показало никаких признаков воспаления (рис. 1C). Показатели инкрустации и покраснения ушей мышей в группе с DNFB были выше, чем в ушах, обработанных носителем (Рисунок 1D).
Повышенное утолщение эпидермиса и выраженная воспалительная инфильтрация после DNFB
Анализ окрашенных H&E срезов кожи, обработанной DNFB, показал повышенное утолщение эпидермиса в коже ушей по сравнению с кожей, обработанной носителем (рис. 2A, B). Результаты иммуногистохимии показали, что инфильтрация CD45+ (общих гемопоэтических клеток), Ly6G+ (нейтрофилов) и F4/80+ (макрофагов) в ушах была значительно выше в коже, обработанной DNFB, чем в тканях, обработанных носителем (рис. 2C, D). В совокупности DNFB индуцировал типичный симптом ACD у мышей.
Генерация субпопуляции клеток Th-GM в иммунологической модели сенсибилизации/вызова DNFB
Мы предположили, что гаптен-специфичные наивные клетки-предшественники Th дифференцируются в эффекторные клетки, экспрессирующие GM-CSF, во время сенсибилизации/провокационных иммунных реакций. Чтобы проверить эту гипотезу, дифференцировку клеток Th исследовали в DNFB-сенсибилизированных/провоцированных или DNFB-сенсибилизированных/носительно пораженных ушах с внутриклеточным окрашиванием методом проточной цитометрии (дополнительный рисунок S3). После испытания на одну мышь приходилось в среднем около 4000 CD4+ Т-клеток и 1898 эффекторных CD4+ Т-клеток (увеличение в 23,8 и 38,7 раза по сравнению с мышами, получавшими носитель, соответственно. Дополнительный рисунок S4). Продукция GM-CSF+ ИФН-γ-IL-17A-IL-22- в эффекторных Th-клетках, то есть Th-GM, была более чем в 3 раза выше в ушах, сенсибилизированных/пораженных DNFB (25,6% по сравнению с 8,3% в ушах с поражением носителем, рис. 3A, B). Наблюдалось почти 10-кратное увеличение частоты эффекторных CD4 Т-клеток в ушах с поражением DNFB по сравнению с кожей с поражением носителем, что указывает на энергичность активации Th-клеток при заражении гаптеном (рис. 4A, B). Изменения в субпопуляции клеток Th-GM в кожных инфильтратах были частично отражены в dLNs, хотя это увеличение было не таким заметным, как в тканях (в 3,7 раза, рис. 4C, D). Таким образом, субпопуляция клеток Th-GM была успешно усилена в этой иммунологической модели сенсибилизации/вызова.

Рисунок 1: Вызванное DNFB дерматологическое воспаление у мышей фенотипически напоминает контактный дерматит у человека. (A) Схематическая иллюстрация предлагаемого эксперимента DNFB. Мышей C57BL/6J сенсибилизировали путем нанесения мазка DNFB на брюшную полость на 5-й и 4-й дни, на 0-й день проводили воздействие DNFB или носительного средства на ухо и оценивали на 1, 2 и 3 дни. (B) Отек уха у мышей, получавших лечение с помощью носительского средства или DNFB (n = 6 в группе). (C) Репрезентативные фотографии целых ушей у мышей, подвергшихся воздействию, или мышей, подвергшихся воздействию DNFB, на 3-й день. (D) Показаны показатели инкортации и покраснения в ушах, пораженных DNFB или носителем (n = 6 в группе). P < 0,001 и **** P < 0,0001 (среднее значение ± SD). Данные репрезентативны для трех независимых экспериментов с 6 образцами в каждой группе. Аббревиатура: DNFB = 2,4-динитрофторбензол. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
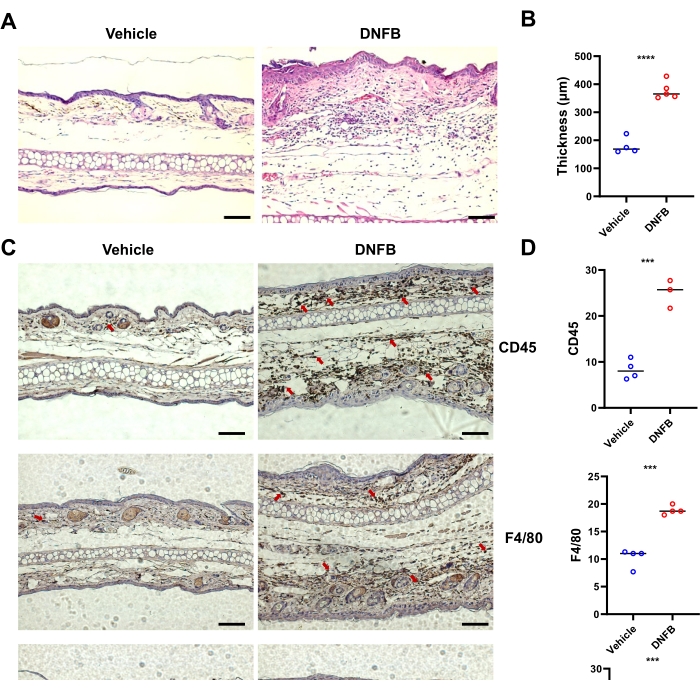
Рисунок 2: Типичное изменение гистологического воспаления у мышей, вызванное сенсибилизацией/провокацией DNFB. (A) H&E-окрашивание кожи уха у отдельных мышей, относящихся к указанным группам. (B) Утолщение эпидермиса, измеренное на изображениях окрашивания H&E, показанных гистограммой. (C) Иммуногистохимия CD45, F4/80 и Ly6G в ушах мышей, пораженных DNFB или носителем. Красные стрелки указывают на положительно окрашенные клетки. (D) Количественное определение CD45-, F4/80- или Ly6G-положительных клеток путем подсчета коричневого окрашивания из трех или четырех слепых разных срезов у одной мыши. P < 0,001, а **** P < 0,0001 (среднее значение ± SD). Данные репрезентативны для двух независимых экспериментов с 3-5 мышами в каждой группе. Масштабная линейка = 1 000 μм (А, С). Сокращения: DNFB = 2,4-динитрофторбензол; H&E = гематоксилин и эозин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Субпопуляция Th-GM в коже уха мышей. (A) Проточная цитометрия субпопуляции Th-GM в коже уха мышей, получавших DNFB или носитель, оцененная через 3 дня после заражения. (B) Частоты Th-GM в эффекторных CD4+ Т-клетках. Каждый символ представляет собой отдельную мышь. P < 0,001 и **** P < 0,0001 (среднее значение ± SD). Данные репрезентативны для 6 образцов в каждой группе. Сокращения: DNFB = 2,4-динитрофторбензол; GM-CSF = гранулоцитарно-макрофагальный колониестимулирующий фактор; Th-GM = Т-хелпер, продуцирующий GM-CSF. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
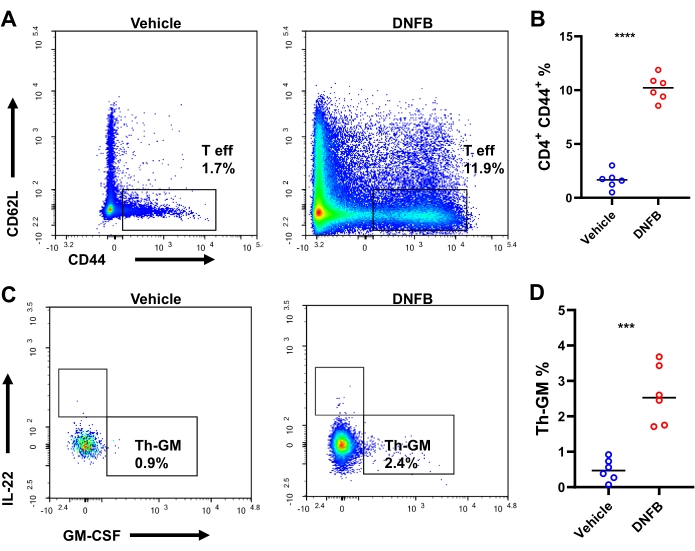
Рисунок 4: Субпопуляция Th-GM в ушных дренирующих лимфатических узлах мышей. (A) Проточная цитометрия эффекторных CD4+ Т-клеток в дренирующих ухо лимфатических узлах мышей, получавших DNFB или носитель, оцененных через 3 дня после заражения. (B) Частоты эффекторных CD4+ Т-клеток в CD4+ Т-клетках. (C) Проточная цитометрия субпопуляции Th-GM в дренирующих ухо лимфатических узлах мышей, пораженных DNFB или носителем, оцененным через 2 дня после заражения. (D) Процентное содержание субпопуляции Th-GM в эффекторных CD4+ Т-клетках в дренируемых ухом лимфатических узлах. P < 0,001 и **** P < 0,0001 (среднее значение ± SD). Данные репрезентативны для 6 образцов в каждой группе. Сокращения: DNFB = 2,4-динитрофторбензол; GM-CSF = гранулоцитарно-макрофагальный колониестимулирующий фактор; Th-GM = Т-хелпер, продуцирующий GM-CSF; T eff = эффекторные CD4+ Т-клетки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный рисунок S1: Обработка кожи ушей мыши. (A) Ухо, отрезанное от мыши C57BL/6J. (Б) Расщепление тыльной и вентральной сторон уха. (В) Погружение дорсальной и вентральной сторон в буфер для пищеварения. (D) Маленькие ушные листочки с ножницами. (E) Волосы и белые соединительные ткани, оставшиеся на сетчатом фильтре после диссоциации. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S2: Обработка аурикулярных лимфатических узлов мыши. (A) Рассечение ушных лимфатических узлов у мыши C57BL/6J. Красной стрелкой обозначено расположение аурикулярных лимфатических узлов. (B) Аурикулярный лимфатический узел переносили в клеточный фильтр размером 70 мкм на вершине лунки 6-луночного планшета перед измельчением. (C) Мусор, оставшийся на сетчатых фильтрах после измельчения. Аббревиатура: DNFB = 2,4-динитрофторбензол. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S3: Стратегия гейтирования, используемая для анализа субпопуляции Th-GM в аурикулярных лимфатических узлах. Во-первых, лимфатические клетки были скобированы на основе зернистости и размера (FSC низкий SSC низкий, P1), а синглеты были выбраны на графике FSC-A против FSC-H (P2). Затем мертвые клетки были удалены путем гейтирования популяции FVS780- (P3). В-третьих, эффекторные CD4 Т-клетки были идентифицированы как популяция CD4+- CD44+ (P5). Наконец, субпопуляция Th-GM отличалась внутриклеточной экспрессией цитокинов, то есть ИФН-γ-IL-17A-IL-22-GM-CSF+ (P7). Сокращения: GM-CSF = гранулоцитарно-макрофагальный колониестимулирующий фактор; Th-GM = Т-хелпер, продуцирующий GM-CSF; IFNγ = интерферон-гамма. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S4: Состав общего количества эффекторных CD4 Т-клеток, экспрессирующих GM-CSF, в тканях мышей после заражения. (A) Доля (%) эффекторных Th-клеток, экспрессирующих GM-CSF, среди общего числа GM-CSF+ CD4+ CD44+ клеток. (B) Проточная цитометрия экспрессии GM-CSF, IFN-γ и IL-17A, гейтированной в живых CD4+ CD44+ Т-клетках в ушах мышей после провокационной работы. Сокращения: GM-CSF = гранулоцитарно-макрофагальный колониестимулирующий фактор; Th-GM = Т-хелпер, продуцирующий GM-CSF; IFNγ = интерферон-гамма. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Этот протокол обеспечивает простой анализ in vivo для анализа генерации и расширения субпопуляции клеток Th-GM. Важно использовать Т-клеточно-опосредованную модель заболевания у мышей, инициируемую гаптенами или антигенами, имитируя эту активацию у человека. DNFB представляет собой низкомолекулярный гаптен, который является более экономичным и экономящим время, чем пептидные или белковые антигены, для запуска иммунного ответа Т-клеток in vivo18,19. В течение заболевания мы наблюдали наибольшую величину реакции отека уха, оспариваемой DNFB, по сравнению с индукцией другими гаптенами, включая 2,4,6-тринитрохлорбензол (TNCB), оксазолон (OXA) или флуоресцеин изотиоцианат (FITC), по крайней мере, у мышей с генетическим фоном C57BL/6J (данные не показаны), хотя сообщалось, что три других реагента вызывают контактную чувствительность у мышей14. Исследователи должны определить подходящую линию и гаптены мышей для полной индукции заболевания.
Низкий выход клеток из ушей – одна из наиболее часто встречающихся проблем при работе с тканями мыши меньшего размера. Это может быть вызвано неполным ферментативным перевариванием из-за неэффективной ферментативной активности типов коллагеназ или любых просроченных реагентов, используемых для пищеварения. Чтобы преодолеть это, мы использовали коллагеназу IV типа для переваривания кожи ушей, поскольку она превосходила другие коллагеназы, включая коллагеназу I, в эффективной диссоциации воспаленных ушей. Более высокая жизнеспособность клеток, выделенных из ушей, благоприятна для внутриклеточного накопления цитокинов при рестимуляции PMA/иономицином/ингибитором транспорта белка. Кроме того, концентрация кальция в среде RPMI 1640, используемой для рестимуляции, может быть отрегулирована до 1,5 мМ с помощью стерильного запаса 1 М хлорида кальция, а время рестимуляции может быть увеличено до 6 ч для достижения максимальной продукции цитокинов в Т-клетках20.
Многопараметрическая проточная цитометрия позволяет точно идентифицировать и количественно оценить субпопуляцию клеток Th-GM в контексте аутоиммунных реакций. При сборе данных с помощью цитометра были настроены образцы без окрашивания и с одним окрашиванием для определения соответствующих напряжений ФЭУ и корректировки компенсаций. Для расширенного анализа иммунных клеток с помощью проточной цитометрии читатели могут обратиться к признанным рекомендациям по использованию проточной цитометрии 21 для получения дополнительной информации о корректировке компенсации, настройках окрашивания антителами и стратегиях гейтирования. Примечательно, что субпопуляция Th-GM считается параллельной другим традиционным линиям и идентифицируется как GM-CSF+ ИФН-γ- IL-17A-IL-22- в эффекторных CD4 Т-клетках (дополнительный рисунок S1). Эта стратегия гейтинга должна применяться для анализа данных проточной цитометрии для исследования клеточной биологии Th-GM.
Таким образом, в данной статье представлен протокол анализа новой линии Th-GM при DNFB-индуцированной контактной гиперчувствительности мышей с использованием проточной цитометрии. Этот метод может быть использован для дальнейшего изучения биологии Th-GM клеток и фармакологических исследований терапевтических стратегий, сосредоточенных на GM-CSF при различных состояниях, таких как аллергический контактный дерматит.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Эта работа была поддержана Национальным фондом естественных наук Китая (No 81602763, 81803142, 82003347), Программой выдающихся исследователей Китайского фонда постдокторантуры (No 2017T100700) и Программой регулярных исследователей Китайского фонда постдокторантуры (No 2016M592673). Авторы хотели бы поблагодарить Ян Ванга и Мэн-Ли Чжу (Male Wang и Meng-Li Zhu) (Основные учреждения Западно-Китайской больницы, Сычуаньский университет) за техническую поддержку проточной цитометрии в этом исследовании.
Материалы
| Name | Company | Catalog Number | Comments |
| 2,4-dinitrofluorobenzene | BT REAGENT | P0001746 | CAS NO: 70-34-8 |
| Acetone | CHRON CHEMICALS | / | 67-64-1 |
| anti-CD4 antibody | Biolegend | 300506 | 1:100 Diluted |
| anti-CD44 antibody | Biolegend | 103012 | 1:100 Diluted |
| anti-CD62L antibody | Biolegend | 104417 | 1:100 Diluted |
| anti-GM-CSF antibody | BD Bioscience | 554507 | 1:100 Diluted |
| anti-IFN-γ antibody | Biolegend | 505836 | 1:100 Diluted |
| anti-IL-17A antibody | BD Bioscience | 563354 | 1:100 Diluted |
| anti-IL-22 antibody | Biolegend | 516411 | 5 µL/test |
| CD45 | Biolegend | 103101 | 1:200 Diluted |
| Chloral hydrate | CHRON CHEMICALS | / | 302-17-0 |
| Dial thickness gauge (0.01 mm type) | PEACOCK | G-1A | / |
| DMSO | LIFESCIENCES | D8371 | 67-68-5 |
| EDTA Na2 | Solarbio | E8030 | 6381-92-6 |
| F4/80 | Biolegend | 123102 | 1:200 Diluted |
| Fixable Viability Stain 780 | BD Bioscience | 565388 | 1:1,000 Diluted, viability dye |
| Flow cytometer | BD Bioscience | BD FACS ARIA II SORP | / |
| GraphPad Prism | GraphPad Software | Prism 7 | Software for statistics and graphing |
| Intracelluar Fixtation and Permeablization Buffer Set | Thermo Fisher | 88-8824-00 | prepared freshly |
| Ionomycin | Sigma-Aldrich | 407951 | CAS NO: 56092-81-0 |
| Ly6G | Biolegend | 127602 | 1:200 Dilutied |
| NovoExpress | Agilent | / | Software for flow cytometry data analysis; https://www.agilent.com.cn/zh-cn/product/research-flow-cytometry/flow-cytometry-software/novocyte-novoexpress-software-1320805 |
| Olive oil | YUANYE BIO | S30503 | 8001-25-0 |
| PMA | Sigma-Aldrich | P8139 | CAS NO: 16561-29-8 |
| Protein Transport Inhibitor (Containing Brefeldin A) | BD Bioscience | 555029 | 1 µL/mL |
Ссылки
- Rasouli, J., et al. A distinct GM-CSF(+) T helper cell subset requires T-bet to adopt a TH1 phenotype and promote neuroinflammation. Science Immunology. 5 (52), (2020).
- Galli, E., et al. GM-CSF and CXCR4 define a T helper cell signature in multiple sclerosis. Nature Medicine. 25 (8), 1290-1300 (2019).
- Komuczki, J., et al. Fate-mapping of GM-CSF expression identifies a discrete subset of inflammation-driving T helper cells regulated by cytokines IL-23 and IL-1beta. Immunity. 50 (5), 1289-1304 (2019).
- Sheng, W., et al. STAT5 programs a distinct subset of GM-CSF-producing T helper cells that is essential for autoimmune neuroinflammation. Cell Research. 24 (12), 1387-1402 (2014).
- Herndler-Brandstetter, D., Flavell, R. A. Producing GM-CSF: a unique T helper subset. Cell Research. 24 (12), 1379-1380 (2014).
- Lu, Y., Fu, X. Y., Zhang, Y. In vitro differentiation of mouse granulocyte-macrophage-colony-stimulating Factor (GM-CSF)-producing T Helper (THGM) Cells. Journal of Visualized Experiments: JoVE. (139), e58087(2018).
- Hu, Y., et al. Interleukin-1beta-induced IRAK1 ubiquitination is required for TH-GM-CSF cell differentiation in T cell-mediated inflammation. Journal of Autoimmunity. 102, 50-64 (2019).
- Reynolds, G., et al. Synovial CD4+ T-cell-derived GM-CSF supports the differentiation of an inflammatory dendritic cell population in rheumatoid arthritis. Annals of the Rheumatic Diseases. 75 (5), 899-907 (2016).
- Al-Mossawi, M. H., et al. Unique transcriptome signatures and GM-CSF expression in lymphocytes from patients with spondyloarthritis. Nature Communation. 8 (1), 1510(2017).
- Wicks, I. P., Roberts, A. W. Targeting GM-CSF in inflammatory diseases. Nature Reviews Rheumatology. 12 (1), 37-48 (2016).
- Scheinman, P. L., et al. Contact dermatitis. Nature Reviews Disease Primers. 7 (1), 38(2021).
- Pesonen, M., Koskela, K., Aalto-Korte, K. Contact urticaria and protein contact dermatitis in the Finnish Register of Occupational Diseases in a period of 12 years. Contact Dermatitis. 83 (1), 1-7 (2020).
- Vocanson, M., Hennino, A., Rozieres, A., Poyet, G., Nicolas, J. F. Effector and regulatory mechanisms in allergic contact dermatitis. Allergy. 64 (12), 1699-1714 (2009).
- Gaspari, A. A., Katz, S. I., Martin, S. F. Contact hypersensitivity. Current Protocols in Immunology. 113, 1-7 (2016).
- Manresa, M. C. Animal models of contact dermatitis: 2,4-dinitrofluorobenzene-induced contact hypersensitivity. Methods in Molecular Biology. 2223, 87-100 (2021).
- Kim, J. H., et al. CD1a on Langerhans cells controls inflammatory skin disease. Nature Immunology. 17 (10), 1159-1166 (2016).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods in Enzymology. 533, 225-233 (2013).
- Achuthan, A., et al. Cytokine-induced acute inflammatory monoarticular arthritis. Methods in Molecular Biology. 1784, 215-223 (2018).
- Stromnes, I. M., Goverman, J. M. Active induction of experimental allergic encephalomyelitis. Nature Protocols. 1 (4), 1810-1819 (2006).
- Kruisbeek, A. M., Shevach, E., Thornton, A. M. Proliferative assays for T cell function. Current Protocols in Immunology. , Chapter 3, Unit 3 (2004).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (second edition). European Journal of Immunology. 49 (10), 1457(2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены