Method Article
Análisis de células T colaboradoras productoras de factor estimulante de colonias de granulocitos y macrófagos en un modelo murino de hipersensibilidad de contacto
En este artículo
Resumen
Aquí, presentamos un método simple y estandarizado para analizar el subconjunto de T auxiliar productor de factor estimulante de colonias de granulocitos y macrófagos in vivo.
Resumen
Paralelamente a los linajes tradicionales Th1/Th2/Th17/Treg, se han identificado células T auxiliares productoras de factor estimulante de colonias (Th-GM) de granulocitos y macrófagos como un subconjunto distinto de células T auxiliares (GM-CSF+ IFN-γ- IL-17A- IL-22- células T efectoras CD4+ ) en humanos y ratones. La hipersensibilidad de contacto (CHS) se considera un excelente modelo animal para la dermatitis alérgica de contacto (ACD) en humanos, que manifiesta una respuesta inmunitaria intacta mediada por células T. Con el fin de proporcionar un ensayo estandarizado y completo para analizar el subconjunto de células Th-GM en la respuesta inmunitaria dependiente de células T in vivo, se indujo un modelo murino de CHS mediante sensibilización/desafío con un hapteno orgánico reactivo, de bajo peso molecular, 2,4-dinitrofluorobenceno (DNFB). El subconjunto Th-GM en linfocitos T CD4+ efectores generados tras la inmunización con el hapteno se analizó mediante citometría de flujo. Encontramos que Th-GM se expandió principalmente en lesiones y ganglios linfáticos drenantes en el modelo de ratón CHS inducido por DNFB. Este método se puede aplicar para estudiar más a fondo la biología de las células Th-GM y la investigación farmacológica de estrategias terapéuticas centradas en GM-CSF en diversas condiciones, como la ACD.
Introducción
Las células T auxiliares productoras de factor estimulante de colonias de granulocitos y macrófagos (GM-CSF), el subconjunto Th-GM, han estado emergiendo como un subconjunto distinto de células T auxiliares en humanos y ratones y se considera que comprenden células T CD4 "que solo expresan GM-CSF" (GM-CSF+ IFN-γ-17A- IL-22-) identificadas por análisis de ARN de una sola célula, citometría de masas y ratones mapeadores de destino GM-CSF 1,2,3. En 2014, Sheng et al. informaron sobre la programación del transductor de señal y activador de la transcripción 5 (STAT5) del subconjunto Th-GM y conceptualizaron el subconjunto "Th-GM" por primera vez 4,5. Las células Th-GM se caracterizan por la expresión de citocinas de GM-CSF, IL-2, TNF-α, IL-3, CCL20 y receptores de quimiocinas C-X-C tipo de receptor de quimiocinas (CXCR) 4 o CXCR6 1,2. STAT y/o la vía NF-κB son esenciales para la diferenciación del linaje Th-GM. Se estableció un método in vitro para diferenciar linfocitos T CD4 naïve en linfocitos Th-GM utilizando IL-7 en presencia de estímulos TCR6. Por su parte, se demostró que las citocinas IL-23 e IL-1β mantienen la expresión y patogenicidad de las células Th-GM ex vivo 3,7.
La elevación de las células Th-GM se ha asociado con varias enfermedades autoinmunes, como la esclerosis múltiple y la artritis reumatoide 2,8,9, lo que sugiere un papel potencial en la patogénesis de la autoinmunidad10. La evidencia acumulada sugiere que el GM-CSF puede funcionar como un mediador inflamatorio. Los ratones que sobreexpresan genéticamente Csf2 (gen que codifica GM-CSF) en células T CD4+ desarrollaron espontáneamente déficits neurológicos acompañados de la infiltración de fagocitos en el sistema nervioso central. En un modelo de colitis por transferencia de células T, la transferencia adoptiva de células T Csf2−/− a ratones Rag1−/− redujo significativamente las características clínicas e histopatológicas de la enfermedad. Sin embargo, hay pocos informes sobre las funciones del subconjunto Th-GM en enfermedades alérgicas, como la ACD.
La ACD es una de las afecciones dermatológicas inflamatorias más comunes, con alta prevalencia en el trabajo y en la vidapersonal 11,12. Es una respuesta de hipersensibilidad de tipo IV retardada mediada por un circuito inmune intacto que se desarrolla en dos fases segmentadas temporalmente: sensibilización y elicitación. La ACD humana se desencadena por la exposición a algunas sustancias químicas (haptenos o metales) que conducen a la sensibilización. Durante esta fase, una respuesta mediada por células T es preparada por complejos de proteínas haptenos presentados por células presentadoras de antígenos. Tras la exposición posterior al mismo hapteno, las células T efectoras y de memoria específicas del hapteno se reactivan y se localizan en la piel, un proceso que implica la infiltración de una variedad de poblaciones de células inmunitarias. Esta respuesta inflamatoria aguda se conoce como elicitación, resultando en el desarrollo completo de lesiones13. La ACD humana puede estudiarse utilizando modelos animales de hipersensibilidad de contacto (CHS)14.
El modelo CHS inducido por un hapteno orgánico reactivo, de bajo peso molecular, 2,4-dinitrofluorobenceno (DNFB), es un modelo murino comúnmente utilizado que se ha utilizado en el estudio de la patología, así como en las posibles intervenciones terapéuticas de ACD15,16. Por lo tanto, este modelo dependiente de células T podría aplicarse para estudiar la generación del subconjunto Th-GM en la enfermedad alérgica. Aquí, inducimos un modelo murino de CHS con DNFB, analizamos la generación de Th-GM en lesiones y ganglios linfáticos drenantes, y encontramos que el subconjunto de Th-GM se expandió principalmente tras la reexposición al mismo hapteno. Esto sugiere que el subconjunto Th-GM podría ser esencial para el desarrollo de la ACD y representa una diana terapéutica específica en la ACD.
Protocolo
Todos los ratones utilizados en este protocolo tenían el fondo genético C57BL/6, se mantuvieron en condiciones específicas libres de patógenos y se les proporcionó alimento y agua ad libitum. Todos los experimentos fueron aprobados por el organismo de revisión ética de bienestar animal del Centro Médico de China Occidental de la Universidad de Sichuan (20210302059).
1. Preparación de reactivos y materiales
- Solución de DNFB al 0,5% como sensibilizador
- Para la sensibilización de 10 ratones, prepare 1,1 mL de mezcla de acetona/aceite de oliva 4:1 (v/v): mezcle 880 μL de acetona y 220 μL de aceite de oliva para permitir 0,1 mL de exceso de volumen para tener en cuenta cualquier pérdida de volumen menor. Añadir 5 μL de DNFB a 1,1 mL de mezcla homogeneizada de acetona/aceite de oliva 4:1.
NOTA: Preparar fresco el día de la sensibilización. La mezcla de acetona y aceite de oliva debe prepararse en una campana extractora.
- Para la sensibilización de 10 ratones, prepare 1,1 mL de mezcla de acetona/aceite de oliva 4:1 (v/v): mezcle 880 μL de acetona y 220 μL de aceite de oliva para permitir 0,1 mL de exceso de volumen para tener en cuenta cualquier pérdida de volumen menor. Añadir 5 μL de DNFB a 1,1 mL de mezcla homogeneizada de acetona/aceite de oliva 4:1.
- 0.2% Solución DNFB como retador
- Para desafiar a 10 ratones, agregue 0,5 μL de DNFB en 0,25 mL de una mezcla homogeneizada de acetona y aceite de oliva 4:1 descrita en el paso 1.1. Utilice la mezcla de acetona y aceite de oliva 4:1 como vehículo cuando desafíe a los ratones después de la sensibilización.
NOTA: La mezcla de acetona y aceite de oliva debe prepararse en una campana extractora.
- Para desafiar a 10 ratones, agregue 0,5 μL de DNFB en 0,25 mL de una mezcla homogeneizada de acetona y aceite de oliva 4:1 descrita en el paso 1.1. Utilice la mezcla de acetona y aceite de oliva 4:1 como vehículo cuando desafíe a los ratones después de la sensibilización.
- Hidrato de cloral como anestésico
- Disuelva 4 g de hidrato de cloral en 50 ml de solución salina tamponada con fosfato (PBS) para hacer una solución de trabajo al 8%. Filtrar y almacenar a 4 °C durante un máximo de 3 meses. Use 5 μL por g de peso corporal para un ratón.
- 50x colagenasa IV
- Disolver 100 mg de colagenasa IV en 1 mL de medio RPMI 1640 básico (no suplementado con antibióticos o suero fetal bovino [FBS]) para hacer un caldo de 100 mg/mL. Almacenar a -20 °C en alícuotas de 100 μL durante un máximo de 6 meses.
- 1.000x DNase I stock
- Disuelva 5 mg de DNasa I en 1 mL de NaCl 0,15 M para hacer un caldo de 5 mg/mL. Almacenar a -20 °C en alícuotas de 100 μL durante un máximo de 6 meses.
- Búfer de parada
- Disuelva 1.681 g de EDTA en 50 mL de medio RPMI 1640 básico para hacer un caldo de 100 mM. Almacenar a 4 °C durante un máximo de 2 semanas.
- Medio de lavado
- Disuelva 0,372 g de EDTA a una concentración final de 2 mM y 5 mL de FBS a una concentración final de 1% con 500 mL de PBS. Filtrar y almacenar a 4 °C durante un máximo de 1 mes.
- Tampón de tinción
- Disuelva 0,372 g de EDTA a una concentración final de 2 mM y 10 mL de FBS a una concentración final del 2% con 500 mL de PBS. Filtrar y almacenar a 4 °C durante un máximo de 1 mes.
- Reactivos de reestimulación
- Disuelva 1 mg de forbol 12-miristato 13-acetato (PMA) en 20 mL de DMSO para hacer un caldo de 50 μg/mL (500x) y guárdelo a -20 °C en alícuotas de 50 μL.
- Diluir 250 μL de ionomicina en solución (4 mg/mL) en 7,75 mL de DMSO para hacer un caldo de 500 μg/mL (500x) y almacenarlo a -20 °C en alícuotas de 50 μL.
- Alícuota 1 mL de solución inhibidora del transporte de proteínas (que contiene brefeldina A) en 50 μL y almacenar las alícuotas a 4 °C.
2. Inducción de CHS en ratones
- En el día -5, anestesiar a los ratones inyectando 400 mg/kg de hidrato de cloral por vía intraperitoneal.
- Con una afeitadora para mascotas, afeita un área de 2 cm × 2 cm en el abdomen del ratón.
NOTA: Evite rascar la piel del ratón; Mantener intacta la integridad de la barrera cutánea. - Untar 100 μL de solución de DNFB al 0,5% sobre el abdomen afeitado de forma suave y uniforme con una micropipeta con puntas desechables. Sostenga los ratones de 5 a 10 segundos para permitir que se evapore parte del solvente.
- En el día -4, repita los pasos 2.1-2.3 para otra sensibilización.
NOTA: Dos eventos de sensibilización funcionan mejor que uno. - El día 0, desafíe el oído derecho de los ratones con 20 μL de DNFB al 0,2% utilizando una micropipeta con puntas desechables, y trate el oído izquierdo con el mismo volumen de mezcla de acetona y aceite de oliva 4:1 que el vehículo.
NOTA: Desafíe los lados dorsal y ventral de la oreja con volúmenes iguales de DNFB o vehículo. - En los próximos 3 días, mida diariamente el grosor de la oreja de los ratones derecho e izquierdo con un medidor de grosor de cuadrante y calcule el aumento del grosor de la oreja: grosor de la oreja derecha - grosor de la oreja izquierda.
NOTA: Se pudo observar un aumento gradual en el grosor de la oreja en las orejas de ratón desafiadas con DNFB en comparación con las orejas tratadas con vehículo.
3. Recogida de muestras de ratones CHS
- El día 3, anestesiar a los ratones mediante una inyección intraperitoneal de 400 mg/kg de hidrato de cloral. Espere de 5 a 10 minutos para que el ratón esté en un estado de inconsciencia y realice un suave pellizco en los dedos de los pies en ambas patas traseras para confirmar que los ratones están profundamente anestesiados.
- Tome una foto de cada oreja por ratón con una cámara. Puntuar la incrustación (descamación en la oreja) y el enrojecimiento de la oreja (eritema en la oreja) de forma independiente para evaluar la gravedad de la inflamación en una escala de 0 a 5: 0, ninguna; 1, leve; 2, moderado; 3, marcado; 4, muy marcado; 5, el más grave.
- Eutanasia del ratón por luxación cervical. Corta toda la oreja y disecciona los ganglios linfáticos de drenaje paralelos de los ratones con tijeras y fórceps afiladas estériles. Coloque los tejidos en un pocillo de una placa de 6 pocillos colocada sobre hielo que contenga 5 mL de PBS preenfriado para la disociación enzimática o física para generar suspensiones unicelulares (Figura Suplementaria S1A y Figura Suplementaria S2A).
- Para el análisis histológico, fije las muestras de oreja en paraformaldehído al 4%, deshidratado, e insértelas en parafina para la tinción inmunohistoquímica, como se describe en otra parte17.
4. Preparación de la suspensión unicelular de las orejas
- Divida los lados ventral y dorsal de la oreja pellizcando y rasgando los extremos cortados con dos pinzas curvas (Figura suplementaria S1B). Colóquelos en un pocillo de una placa de 6 pocillos que contenga 4,5 mL de tampón de digestión, asegurándose de que esos tejidos estén completamente sumergidos en el tampón de digestión (Figura suplementaria S1C).
NOTA: El tampón de digestión estaba compuesto por RPMI 1640 que contenía 10% de FBS + 25 mM HEPES + 2 mg/mL de colagenasa IV + 5 μg/mL de DNasa I. - Incubar las valvas de la mazorca en una incubadora de cultivo celular a 37 °C durante 20 min. Corte las valvas de la oreja con unas tijeras lo más pequeñas posible para facilitar la digestión del tejido (Figura suplementaria S1D) y vuelva a colocar la muestra en la incubadora durante otros 40 minutos.
NOTA: La digestión eficiente se puede lograr en 40-50 minutos. La sobredigestión a 37 °C afecta a la viabilidad celular. - Añadir 0,5 mL de tampón de parada por pocillo para neutralizar las actividades enzimáticas de la colagenasa IV y la DNasa I. Realice los siguientes pasos en hielo.
- Transfiera los fragmentos de tejido del oído con un par de pinzas curvas a un tubo de centrífuga de 50 ml que contenga un filtro de células de 70 μm y pipetee todo el volumen de medio en el mismo filtro de células.
- Rompe los tejidos con el extremo superior de un émbolo de jeringa de 1 mL. Presione con movimientos circulares contra el filtro de células de 70 μm hasta que solo queden tejidos conectivos blancos (Figura suplementaria S1D).
- Enjuague los filtros celulares dos veces con 1.000 μL de medio de lavado. Transfiera todo el volumen del pocillo a un tubo de centrífuga de 50 mL a través de un filtro de celdas de 40 μm. Mantenga el tubo en hielo.
5. Preparación de suspensiones unicelulares a partir de ganglios linfáticos drenantes (dLN)
- Transfiera los ganglios linfáticos con un par de pinzas curvas a un filtro de células de 70 μm en la parte superior del pocillo de una placa de 6 pocillos (Figura complementaria S2B). Disocie los ganglios linfáticos con el extremo superior de un émbolo de jeringa de 1 ml. Presione con movimientos circulares contra el filtro de células de 70 μm hasta que solo queden restos blancos (Figura suplementaria S2C).
- Enjuague el colador de células dos veces con 1.000 μL de medio de lavado. Transfiera todo el volumen del pocillo a un tubo de 5 mL. Mantenga los tubos en hielo.
6. Reestimulación del subconjunto Th-GM con 12-miristato 13-acetato (PMA)/ionomicina en presencia de un inhibidor del transporte de proteínas
- Centrifugar las células aisladas del oído y las muestras de ganglios linfáticos drenantes durante 8 min a 400 × g a 4 °C, y desechar el sobrenadante. Vuelva a suspender el pellet con 1.000 μL de medio de lavado suavemente.
- Recoja una pequeña porción de cada muestra para contar el número total de células derivadas del oído y el ganglio linfático que drena con un hemocitómetro. Agregue 0.04% de azul de tripano para medir la viabilidad celular.
NOTA: La viabilidad celular debe ser superior al 60% para la estimulación y el análisis posteriores de las células T. La densidad celular puede ser de 1-5 × 106/mL. - Centrifugar las células en el paso 6.1 y desechar el sobrenadante. Vuelva a suspender suavemente el pellet con 1.000 μL de medio RPMI 1640 que contenga 2% de FBS, y siembre 1 mL de la suspensión unicelular (106 células/mL) en placas de cultivo de tejidos de fondo plano de 12 pocillos.
- Añadir 2 μL de forbol 12-miristato 13-acetato (PMA) (concentración final 100 ng/mL), 2 μL de ionomicina (concentración final 1.000 ng/mL) y 1 μL de inhibidor del transporte de proteínas (que contiene Brefeldina A) a cada pocillo en la placa de 12 pocillos que contiene 1 mL de la suspensión unicelular anterior e incubar a 37 °C durante 4 h.
7. Análisis de subconjuntos de Th-GM generados in vivo por tinción intracelular y de superficie celular
- Transfiera las células estimuladas a tubos de centrífuga de 1,5 ml con una pipeta. Centrifugar los tubos de centrífuga durante 8 min a 400 × g a temperatura ambiente y desechar el sobrenadante.
- Lave el pellet de celdas una vez con 1 mL de tampón de tinción y granule las celdas por centrifugación, como se describe en el paso 7.1. Vuelva a suspender las células a 1-10 × 106/mL en 0,5 mL de tampón de tinción.
- Añada inmediatamente 0,5 μL de solución madre de colorante de viabilidad (véase la Tabla de Materiales) a 0,5 mL de suspensión celular y vórtice. Incubar la mezcla durante 10 minutos a temperatura ambiente en la oscuridad. Lave las células dos veces con 1 ml de tampón de tinción y repita la centrifugación en el paso 7.1 para granular las células.
- Vuelva a suspender el pellet en 0,1 ml de tampón de tinción. Agregue 1 μL de anticuerpo anti-CD4 (conjugado con FITC), 1 μL de anticuerpo anti-CD44 (conjugado con APC) y 1 μL de anticuerpo anti-CD62L (conjugado con PE/cianina 7) a tres alícuotas de 0,1 mL de la suspensión celular. Agite inmediatamente e incube a temperatura ambiente durante 15 minutos, protegido de la luz.
- Repita los lavados y la centrifugación en el paso 7.3.
- Vuelva a suspender el pellet en 200 μL de tampón de fijación de IC e incube durante 20 minutos en la oscuridad. Mientras tanto, prepare el tampón de permeabilización (1x) diluyendo 1 parte del tampón de permeabilización (10x) con 9 partes de agua destilada. Lavar las células dos veces con 1 mL de tampón de permeabilización (1x) por centrifugación a 600 × g durante 5 min a temperatura ambiente.
- Vuelva a suspender el pellet en 0,1 mL de tampón de permeabilización (1x) con anticuerpos contra GM-CSF (conjugado con PE, 1 μL/prueba), IFN-γ (conjugado con BV711, 1 μL/prueba), IL-17A (conjugado con BV421, 1 μL/prueba) e IL-22 (PerCP/Cianina 5,5-conjugada, 5 μL/prueba) e incube durante 30 min a temperatura ambiente en la oscuridad.
- Repita los lavados y la centrifugación en el paso 7.6.
- Vuelva a suspender el pellet de celda en 200 μL de PBS y transfiera la suspensión a un tubo de ensayo de fondo redondo. Ejecute las células teñidas en un citómetro de flujo.
8. Estrategia de compuerta para identificar el subconjunto Th-GM
- Analice los datos de citometría de flujo (consulte la Tabla de materiales para obtener detalles sobre el software utilizado) utilizando la estrategia de compuerta ilustrada en la Figura complementaria S1. Para el software utilizado aquí, descárguelo y configúrelo en la computadora.
- Importe los datos de citometría de flujo haciendo clic en Archivo |Abierto | Importe archivos FCS en el software y anote el grupo y el nombre de cada muestra seleccionando la pestaña Cambiar nombre .
- Elija los linfocitos en una gráfica FSC frente a SSC (FSC baja SSC baja, P1) para excluir los residuos que se encuentran en la esquina inferior izquierda y las células mieloides con gran tamaño y alta granularidad haciendo clic en la gráfica de densidad, y muestre el eje X de esta gráfica como FSC-A y el eje Y como SSC-A.
- Haga doble clic en los eventos de P1 para generar otra gráfica de densidad y separe las celdas individuales (mostradas como una línea correlacionada, P2) de los agregados de celdas seleccionando la altura y el área de la celda en esta gráfica (eje X como FSC-A frente a eje Y como FSC-H).
- Haga doble clic en los eventos de P2 para generar otra gráfica de densidad y muestre el eje X de esta gráfica como FSC-A y el eje Y como SSC-A. Controlar las poblaciones de células viables mediante eventos FVS 780- (P3).
- Haga doble clic en los eventos de P3 para generar la siguiente gráfica de densidad (el eje X como CD4-A y el eje Y como SSC-A) y distinga las células T CD4 eligiendo la población CD4+ (P4).
- Haga doble clic en los eventos de P4 para generar otra gráfica de densidad (el eje X como CD44-A y el eje Y como CD62L-A) y defina las células auxiliares T efectoras eligiendo la población superior derecha de esta gráfica (CD62L- CD44+, P5).
9. Análisis estadístico
- Realizar análisis estadísticos, comparando dos grupos utilizando una prueba t no apareada. *P < 0,05, ** P < 0,01, *** P < 0,001 y **** P < 0,0001 (media ± DE).
Resultados
CHS (hipersensibilidad de contacto) inducida por DNFB en ratones
Para inducir CHS en ratones, los ratones fueron sensibilizados y desafiados con DNFB aplicado a la piel del oído, como se ilustra en la Figura 1A. El grosor de la oreja, un indicador de esponjosis epidérmica, aumentó notablemente en los ratones desafiados con DNFB en comparación con los ratones tratados con vehículos (Figura 1B, 70 frente a 3 μm en el día 1, 203 frente a 7,5 μm en el día 2, 276 frente a 5 μm en el día 3). Setenta y dos horas después del desafío, la oreja derecha de los ratones mostraba signos de eritema, incrustación y engrosamiento, mientras que la oreja tratada con el vehículo no mostraba ningún signo de inflamación (Figura 1C). Las puntuaciones de incrustación y enrojecimiento de las orejas de ratón en el grupo desafiado con DNFB fueron más altas que las de las orejas tratadas con vehículos (Figura 1D).
Aumento del engrosamiento epidérmico e infiltración inflamatoria marcada después del desafío con DNFB
El análisis de las secciones teñidas con H&E de la piel tratada con DNFB mostró un mayor engrosamiento epidérmico en la piel del oído en comparación con la piel tratada con vehículo (Figura 2A, B). Los resultados de inmunohistoquímica mostraron que la infiltración de células CD45+ (células hematopoyéticas totales), Ly6G+ (neutrófilos) y F4/80+ (macrófagos) en los oídos fue significativamente mayor en la piel tratada con DNFB que en los tejidos tratados con vehículos (Figura 2C,D). En conjunto, el DNFB indujo un síntoma típico de ACD en ratones.
Generación de subconjuntos de células Th-GM en el modelo inmunológico de sensibilización/desafío de DNFB
Planteamos la hipótesis de que las células precursoras de Th naïve específicas de hapteno se diferencian en células efectoras que expresan GM-CSF durante las respuestas inmunitarias de sensibilización/desafío al hapteno. Para probar esta hipótesis, se investigó la diferenciación de células Th en oídos sensibilizados/desafiados con DNFB o sensibilizados/desafiados por DNFB con tinción intracelular por citometría de flujo (Figura suplementaria S3). Después del desafío, había aproximadamente 4,000 linfocitos T CD4+ y 1,898 linfocitos T CD4+ efectores por ratón en promedio (aumentos de 23,8 veces y 38,7 veces en comparación con los ratones tratados con vehículos, respectivamente, Figura Suplementaria S4). La producción de GM-CSF+ IFN-γ- IL-17A- IL-22- en las células Th efectoras, es decir, Th-GM, fue más de 3 veces mayor en los oídos sensibilizados/desafiados por DNFB (25,6% en contraste con el 8,3% en los oídos desafiados por vehículos, Figura 3A,B). Hubo una expansión de casi 10 veces en la frecuencia de células T CD4 efectoras en las orejas desafiadas con DNFB en comparación con las pieles desafiadas por vehículos, lo que indica una vigorosidad de la activación de las células Th tras el desafío con hapteno (Figura 4A, B). Los cambios en el subconjunto de células Th-GM en los infiltrados de la piel se reflejaron parcialmente en los dLN, aunque este aumento no fue tan notable como el de los tejidos (3,7 veces, Figura 4C, D). Por lo tanto, el subconjunto de células Th-GM se impulsó con éxito en este modelo inmunológico de sensibilización/desafío al hapteno.

Figura 1: La inflamación dermatológica inducida por DNFB en ratones se asemeja fenotípicamente a la dermatitis de contacto en humanos. (A) Ilustración esquemática del experimento propuesto por DNFB. Los ratones C57BL/6J se sensibilizaron untando DNFB en el abdomen en los días -5 y -4, se desafiaron con DNFB o vehículo en la oreja el día 0 y se evaluaron los días 1, 2 y 3. (B) Hinchazón del oído en ratones tratados con vehículos o desafiados con DNFB (n = 6 por grupo). (C) Fotografías representativas de orejas enteras en ratones desafiados por vehículos o DNFB en el día 3. (D) Se muestran las puntuaciones de incrustación y enrojecimiento en los oídos desafiados con DNFB o vehículo (n = 6 por grupo). P < 0,001 y **** P < 0,0001 (media ± DE). Los datos son representativos de tres experimentos independientes con 6 muestras en cada grupo. Abreviatura: DNFB = 2,4-dinitrofluorobenceno. Haga clic aquí para ver una versión más grande de esta figura.
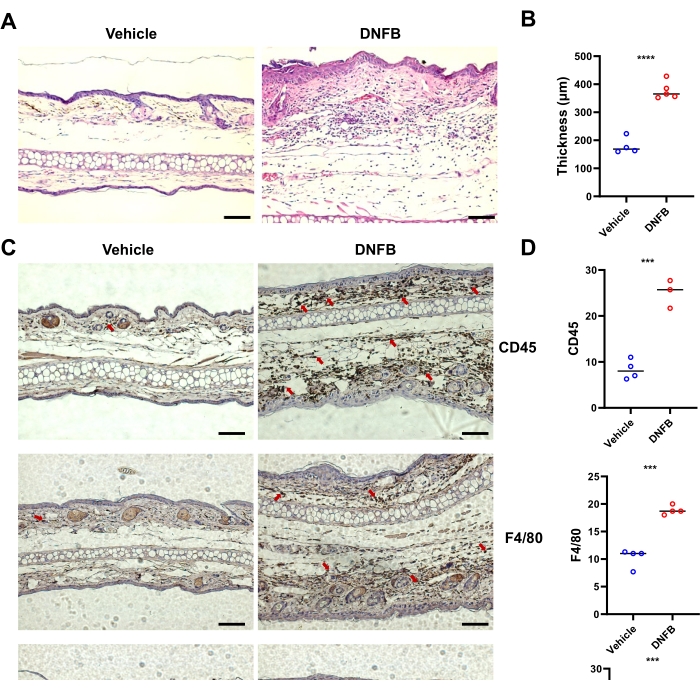
Figura 2: Alteración típica de la inflamación histológica en ratones inducida por la sensibilización/provocación con DNFB. (A) Tinción de H&E de la piel del oído de ratones individuales representativos de los grupos indicados. (B) Engrosamiento epidérmico medido en imágenes de tinción de H&E mostradas por gráfico de barras. (C) Inmunohistoquímica de CD45, F4/80 y Ly6G en los oídos de ratones desafiados con DNFB o vehículo. Las flechas rojas indican células teñidas positivamente. (D) Cuantificación de células CD45-, F4/80- o Ly6G-positivas mediante el recuento de tinciones marrones de tres o cuatro secciones diferentes ciegas por ratón. P < 0,001 y **** P < 0,0001 (media ± DE). Los datos son representativos de dos experimentos independientes con 3-5 ratones en cada grupo. Barra de escala = 1.000 μm (A, C). Abreviaturas: DNFB = 2,4-dinitrofluorobenceno; H&E = hematoxilina y eosina. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Subconjunto de Th-GM en la piel del oído de ratones. (A) Citometría de flujo del subconjunto Th-GM en la piel del oído de ratones desafiados con DNFB o evaluados en el vehículo 3 días después del desafío. (B) Frecuencias de Th-GM dentro de las células T efectoras CD4+ . Cada símbolo representa un ratón individual. P < 0,001 y **** P < 0,0001 (media ± DE). Los datos son representativos de 6 muestras en cada grupo. Abreviaturas: DNFB = 2,4-dinitrofluorobenceno; GM-CSF = factor estimulante de colonias de granulocitos y macrófagos; Th-GM = T helper productor de GM-CSF. Haga clic aquí para ver una versión más grande de esta figura.
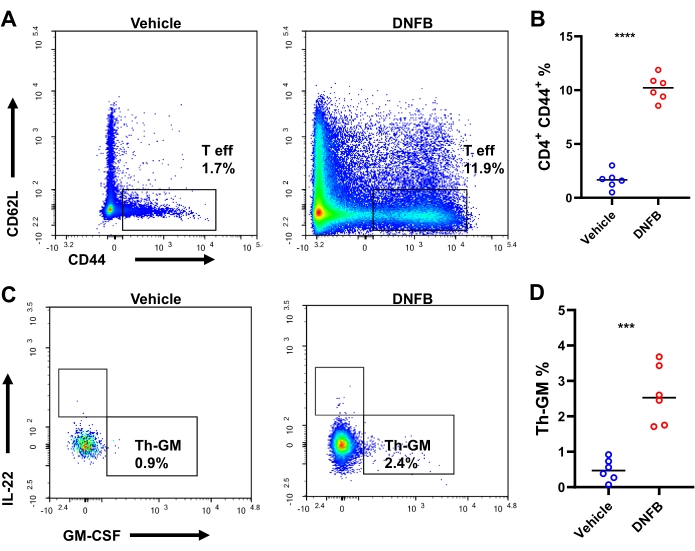
Figura 4: Subconjunto Th-GM en los ganglios linfáticos que drenan el oído de ratones. (A) Citometría de flujo de células T efectoras CD4+ en los ganglios linfáticos que drenan el oído de ratones desafiados con DNFB o vehículo evaluados 3 días después del desafío. (B) Frecuencias de las células T CD4+ efectoras dentro de las células T CD4+ . (C) Citometría de flujo del subconjunto Th-GM en los ganglios linfáticos de drenaje del oído de ratones desafiados con DNFB o evaluados en un vehículo 2 días después del desafío. (D) Porcentaje del subconjunto Th-GM dentro de las células T efectoras CD4+ en los ganglios linfáticos que drenan el oído. P < 0,001 y **** P < 0,0001 (media ± DE). Los datos son representativos de 6 muestras en cada grupo. Abreviaturas: DNFB = 2,4-dinitrofluorobenceno; GM-CSF = factor estimulante de colonias de granulocitos y macrófagos; Th-GM = T ayudante productor de GM-CSF; T eff = linfocitos T CD4+ efectores. Haga clic aquí para ver una versión más grande de esta figura.
Figura suplementaria S1: El procesamiento de la piel de la oreja del ratón. (A) Una oreja cortada de un ratón C57BL/6J. (B) División de los lados dorsal y ventral de la oreja. (C) Sumergir los lados dorsal y ventral en el tampón de digestión. (D) Pequeños folíolos de las orejas con tijeras. (E) Cabello y tejidos conectivos blancos que quedan en el filtro celular después de la disociación. Haga clic aquí para descargar este archivo.
Figura suplementaria S2: Procesamiento de los ganglios linfáticos auriculares de ratón. (A) Disección de ganglios linfáticos auriculares de un ratón C57BL/6J. La flecha roja indica la ubicación de los ganglios linfáticos auriculares. (B) El ganglio linfático auricular se transfirió a un filtro de células de 70 μm en la parte superior del pocillo de una placa de 6 pocillos antes de picarlo. (C) Los residuos que quedan en los filtros de celdas después de picar. Abreviatura: DNFB = 2,4-dinitrofluorobenceno. Haga clic aquí para descargar este archivo.
Figura suplementaria S3: Estrategia de compuerta utilizada para analizar el subconjunto Th-GM en los ganglios linfáticos auriculares. En primer lugar, las células linfáticas se comprimieron en función de la granularidad y el tamaño (FSC bajo SSC bajo, P1), y los singletes se seleccionaron en el gráfico FSC-A vs. FSC-H (P2). A continuación, se eliminaron las células muertas mediante compuerta en la población FVS780- (P3). En tercer lugar, se identificaron los linfocitos T CD4 efectores como la población CD4+- CD44+ (P5). Finalmente, el subconjunto Th-GM se distinguió por la expresión de citocinas intracelulares, es decir, IFN-γ- IL-17A- IL-22- GM-CSF+ (P7). Abreviaturas: GM-CSF = factor estimulante de colonias de granulocitos y macrófagos; Th-GM = T ayudante productor de GM-CSF; IFNγ = interferón-gamma. Haga clic aquí para descargar este archivo.
Figura suplementaria S4: Composición del total de linfocitos T CD4 efectores que expresan GM-CSF en el tejido de ratones después del desafío. (A) Proporción (%) de células Th efectoras que expresan GM-CSF entre el total de células GM-CSF+ CD4+ CD44+ . (B) Citometría de flujo de la expresión de GM-CSF, IFN-γ e IL-17A en células T CD4+ CD44+ vivas en los oídos de ratones después del desafío. Abreviaturas: GM-CSF = factor estimulante de colonias de granulocitos y macrófagos; Th-GM = T ayudante productor de GM-CSF; IFNγ = interferón-gamma. Haga clic aquí para descargar este archivo.
Discusión
Este protocolo proporciona un ensayo in vivo simple para analizar la generación y expansión del subconjunto de células Th-GM. Es esencial utilizar un modelo de enfermedad mediada por células T en ratones iniciada por haptenos o antígenos, imitando esa activación en humanos. El DNFB es un hapteno de molécula pequeña que es más económico y ahorra más tiempo que los antígenos peptídicos o proteicos para desencadenar la respuesta inmunitaria de las células T in vivo18,19. Durante el curso de la enfermedad, observamos la mayor magnitud de la reacción de hinchazón del oído desafiada con DNFB en comparación con la inducción con otros haptenos, incluidos el 2,4,6-trinitroclorobenceno (TNCB), la oxazalona (OXA) o el isotiocianato de fluoresceína (FITC), al menos en ratones con antecedentes genéticos C57BL/6J (datos no mostrados), aunque se informó que los otros tres reactivos anteriores generaban sensibilidad al contacto en ratones14. Los investigadores deben determinar la cepa y los haptenos apropiados para la inducción completa de la enfermedad.
Un bajo rendimiento de células de las orejas es uno de los problemas más frecuentes cuando se trabaja con tejidos de ratón de menor tamaño. Esto podría deberse a una digestión enzimática incompleta debido a la actividad enzimática ineficaz de los tipos de colagenasa o a cualquier reactivo caducado utilizado para la digestión. Para superar esto, utilizamos colagenasa tipo IV para la digestión de la piel del oído, ya que era superior a otras colagenasas, incluida la colagenasa I, para disociar eficazmente las orejas inflamadas. La mayor viabilidad de las células aisladas de los oídos es beneficiosa para la acumulación de citoquinas intracelulares tras la reestimulación con PMA/ionomicina/inhibidor del transporte de proteínas. Además, la concentración de calcio en el medio RPMI 1640 utilizado para la reestimulación se puede ajustar a 1,5 mM con un stock estéril de cloruro de calcio 1 M, y el tiempo de reestimulación se puede extender a 6 h para lograr la máxima producción de citocinas en las células T20.
La citometría de flujo multiparamétrica permite la identificación y cuantificación precisas del subconjunto de células Th-GM en el contexto de reacciones autoinmunes. Al adquirir datos con un citómetro, se configuraron muestras sin tinción y con una sola tinción para determinar los voltajes PMT apropiados y ajustar las compensaciones. Para un análisis extendido de las células inmunitarias mediante citometría de flujo, los lectores pueden consultar las pautas reconocidas para el uso de la citometría de flujo 21 para obtener más información sobre el ajuste de la compensación, la configuración de la tinción de anticuerpos y las estrategias de compuerta. En particular, se considera que el subconjunto Th-GM es paralelo a otros linajes tradicionales y se identifica como GM-CSF+ IFN-γ- IL-17A- IL-22- en células T CD4 efectoras (Figura suplementaria S1). Esta estrategia de compuerta debe aplicarse para analizar los datos de citometría de flujo para la investigación de la biología celular Th-GM.
En resumen, este artículo presenta un protocolo para analizar el nuevo linaje Th-GM en la hipersensibilidad de contacto murino inducida por DNFB mediante citometría de flujo. Este método se puede utilizar para estudiar más a fondo la biología de las células Th-GM y la investigación farmacológica de estrategias terapéuticas centradas en GM-CSF en diversas afecciones, como la dermatitis alérgica de contacto.
Divulgaciones
Los autores declaran que no tienen intereses financieros contrapuestos.
Agradecimientos
Este trabajo fue apoyado por la Fundación Nacional de Ciencias Naturales de China (No. 81602763, 81803142, 82003347), el Programa de Investigadores Excelentes de la Fundación de Ciencias Postdoctorales de China (No. 2017T100700) y el Programa de Investigadores Regulares de la Fundación de Ciencias Postdoctorales de China (No. 2016M592673). Los autores desean agradecer a Yan Wang y Meng-Li Zhu (Instalaciones Centrales del Hospital de China Occidental, Universidad de Sichuan) por el apoyo técnico de la citometría de flujo en este estudio.
Materiales
| Name | Company | Catalog Number | Comments |
| 2,4-dinitrofluorobenzene | BT REAGENT | P0001746 | CAS NO: 70-34-8 |
| Acetone | CHRON CHEMICALS | / | 67-64-1 |
| anti-CD4 antibody | Biolegend | 300506 | 1:100 Diluted |
| anti-CD44 antibody | Biolegend | 103012 | 1:100 Diluted |
| anti-CD62L antibody | Biolegend | 104417 | 1:100 Diluted |
| anti-GM-CSF antibody | BD Bioscience | 554507 | 1:100 Diluted |
| anti-IFN-γ antibody | Biolegend | 505836 | 1:100 Diluted |
| anti-IL-17A antibody | BD Bioscience | 563354 | 1:100 Diluted |
| anti-IL-22 antibody | Biolegend | 516411 | 5 µL/test |
| CD45 | Biolegend | 103101 | 1:200 Diluted |
| Chloral hydrate | CHRON CHEMICALS | / | 302-17-0 |
| Dial thickness gauge (0.01 mm type) | PEACOCK | G-1A | / |
| DMSO | LIFESCIENCES | D8371 | 67-68-5 |
| EDTA Na2 | Solarbio | E8030 | 6381-92-6 |
| F4/80 | Biolegend | 123102 | 1:200 Diluted |
| Fixable Viability Stain 780 | BD Bioscience | 565388 | 1:1,000 Diluted, viability dye |
| Flow cytometer | BD Bioscience | BD FACS ARIA II SORP | / |
| GraphPad Prism | GraphPad Software | Prism 7 | Software for statistics and graphing |
| Intracelluar Fixtation and Permeablization Buffer Set | Thermo Fisher | 88-8824-00 | prepared freshly |
| Ionomycin | Sigma-Aldrich | 407951 | CAS NO: 56092-81-0 |
| Ly6G | Biolegend | 127602 | 1:200 Dilutied |
| NovoExpress | Agilent | / | Software for flow cytometry data analysis; https://www.agilent.com.cn/zh-cn/product/research-flow-cytometry/flow-cytometry-software/novocyte-novoexpress-software-1320805 |
| Olive oil | YUANYE BIO | S30503 | 8001-25-0 |
| PMA | Sigma-Aldrich | P8139 | CAS NO: 16561-29-8 |
| Protein Transport Inhibitor (Containing Brefeldin A) | BD Bioscience | 555029 | 1 µL/mL |
Referencias
- Rasouli, J., et al. A distinct GM-CSF(+) T helper cell subset requires T-bet to adopt a TH1 phenotype and promote neuroinflammation. Science Immunology. 5 (52), (2020).
- Galli, E., et al. GM-CSF and CXCR4 define a T helper cell signature in multiple sclerosis. Nature Medicine. 25 (8), 1290-1300 (2019).
- Komuczki, J., et al. Fate-mapping of GM-CSF expression identifies a discrete subset of inflammation-driving T helper cells regulated by cytokines IL-23 and IL-1beta. Immunity. 50 (5), 1289-1304 (2019).
- Sheng, W., et al. STAT5 programs a distinct subset of GM-CSF-producing T helper cells that is essential for autoimmune neuroinflammation. Cell Research. 24 (12), 1387-1402 (2014).
- Herndler-Brandstetter, D., Flavell, R. A. Producing GM-CSF: a unique T helper subset. Cell Research. 24 (12), 1379-1380 (2014).
- Lu, Y., Fu, X. Y., Zhang, Y. In vitro differentiation of mouse granulocyte-macrophage-colony-stimulating Factor (GM-CSF)-producing T Helper (THGM) Cells. Journal of Visualized Experiments: JoVE. (139), e58087(2018).
- Hu, Y., et al. Interleukin-1beta-induced IRAK1 ubiquitination is required for TH-GM-CSF cell differentiation in T cell-mediated inflammation. Journal of Autoimmunity. 102, 50-64 (2019).
- Reynolds, G., et al. Synovial CD4+ T-cell-derived GM-CSF supports the differentiation of an inflammatory dendritic cell population in rheumatoid arthritis. Annals of the Rheumatic Diseases. 75 (5), 899-907 (2016).
- Al-Mossawi, M. H., et al. Unique transcriptome signatures and GM-CSF expression in lymphocytes from patients with spondyloarthritis. Nature Communation. 8 (1), 1510(2017).
- Wicks, I. P., Roberts, A. W. Targeting GM-CSF in inflammatory diseases. Nature Reviews Rheumatology. 12 (1), 37-48 (2016).
- Scheinman, P. L., et al. Contact dermatitis. Nature Reviews Disease Primers. 7 (1), 38(2021).
- Pesonen, M., Koskela, K., Aalto-Korte, K. Contact urticaria and protein contact dermatitis in the Finnish Register of Occupational Diseases in a period of 12 years. Contact Dermatitis. 83 (1), 1-7 (2020).
- Vocanson, M., Hennino, A., Rozieres, A., Poyet, G., Nicolas, J. F. Effector and regulatory mechanisms in allergic contact dermatitis. Allergy. 64 (12), 1699-1714 (2009).
- Gaspari, A. A., Katz, S. I., Martin, S. F. Contact hypersensitivity. Current Protocols in Immunology. 113, 1-7 (2016).
- Manresa, M. C. Animal models of contact dermatitis: 2,4-dinitrofluorobenzene-induced contact hypersensitivity. Methods in Molecular Biology. 2223, 87-100 (2021).
- Kim, J. H., et al. CD1a on Langerhans cells controls inflammatory skin disease. Nature Immunology. 17 (10), 1159-1166 (2016).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods in Enzymology. 533, 225-233 (2013).
- Achuthan, A., et al. Cytokine-induced acute inflammatory monoarticular arthritis. Methods in Molecular Biology. 1784, 215-223 (2018).
- Stromnes, I. M., Goverman, J. M. Active induction of experimental allergic encephalomyelitis. Nature Protocols. 1 (4), 1810-1819 (2006).
- Kruisbeek, A. M., Shevach, E., Thornton, A. M. Proliferative assays for T cell function. Current Protocols in Immunology. , Chapter 3, Unit 3 (2004).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (second edition). European Journal of Immunology. 49 (10), 1457(2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados