Method Article
Analisi delle cellule T helper produttrici di fattori stimolanti le colonie di granulociti-macrofagi in un modello murino di ipersensibilità da contatto
In questo articolo
Riepilogo
Qui, presentiamo un metodo semplice e standardizzato per analizzare il sottogruppo di T helper produttori di fattori stimolanti le colonie di granulociti-macrofagi in vivo.
Abstract
Parallelamente alle tradizionali linee Th1/Th2/Th17/Treg, le cellule T helper produttrici di fattori stimolanti le colonie di granulociti-macrofagi (Th-GM) sono state identificate come un sottoinsieme distinto di cellule T helper (cellule T CD4+ effettrici GM-CSF+ IFN-γ- IL-17A- IL-22-) nell'uomo e nei topi. L'ipersensibilità da contatto (SIC) è considerata un eccellente modello animale per la dermatite allergica da contatto (ACD) nell'uomo, che manifesta una risposta immunitaria mediata dalle cellule T intatta. Per fornire un test standardizzato e completo per analizzare il sottogruppo di cellule Th-GM nella risposta immunitaria dipendente dalle cellule T in vivo, un modello murino di CHS è stato indotto mediante sensibilizzazione/provocazione con un aptene organico reattivo, a basso peso molecolare, 2,4-dinitrofluorobenzene (DNFB). Il sottogruppo Th-GM nelle cellule T effettrici CD4+ generate dopo l'immunizzazione con l'aptene è stato analizzato mediante citometria a flusso. Abbiamo scoperto che il Th-GM era principalmente espanso nelle lesioni e nei linfonodi drenanti nel modello murino di CHS indotto da DNFB. Questo metodo può essere applicato per studiare ulteriormente la biologia delle cellule Th-GM e la ricerca farmacologica di strategie terapeutiche incentrate su GM-CSF in varie condizioni, come l'ACD.
Introduzione
Le cellule T helper produttrici di fattore stimolante le colonie di granulociti-macrofagi (GM-CSF) - il sottogruppo Th-GM - stanno emergendo come un sottoinsieme distinto di cellule T helper nell'uomo e nei topi e si ritiene che comprendano cellule T CD4 "che esprimono solo GM-CSF" (GM-CSF+ IFN-γ- IL-17A- IL-22-) identificate mediante analisi dell'RNA a singola cellula, citometria di massa e topi mappatori del destino GM-CSF 1,2,3. Nel 2014, Sheng et al. hanno riportato la programmazione del trasduttore di segnale e attivatore della trascrizione 5 (STAT5) del sottoinsieme Th-GM e hanno concettualizzato per la prima volta il sottoinsieme "Th-GM" 4,5. Le cellule Th-GM sono caratterizzate dall'espressione citochinica di GM-CSF, IL-2, TNF-α, IL-3, CCL20 e dei recettori delle chemochine C-X-C tipo di recettore delle chemochine (CXCR) 4 o CXCR6 1,2. STAT e/o la via NF-κB sono essenziali per il differenziamento del lignaggio Th-GM. È stato stabilito un metodo in vitro per differenziare le cellule T CD4 naive in cellule Th-GM utilizzando IL-7 in presenza di stimoli TCR6. Nel frattempo, le citochine IL-23 e IL-1β hanno dimostrato di mantenere l'espressione e la patogenicità delle cellule Th-GM ex vivo 3,7.
L'aumento delle cellule Th-GM è stato associato a diverse malattie autoimmuni, come la sclerosi multipla e l'artrite reumatoide 2,8,9, suggerendo un potenziale ruolo nella patogenesi dell'autoimmunità10. Prove crescenti suggeriscono che il GM-CSF può funzionare come mediatore infiammatorio. I topi che sovraesprimono geneticamente Csf2 (gene che codifica per GM-CSF) nelle cellule T CD4+ hanno sviluppato spontaneamente deficit neurologici accompagnati dall'infiltrazione di fagociti nel sistema nervoso centrale. In un modello di colite con trasferimento di cellule T, il trasferimento adottivo di cellule T Csf2−/- in topi Rag1−/− ha ridotto significativamente le caratteristiche cliniche e istopatologiche della malattia. Tuttavia, ci sono pochi rapporti sul ruolo del sottogruppo Th-GM nelle malattie allergiche, come l'ACD.
L'ACD è tra le condizioni dermatologiche infiammatorie più comuni con un'elevata prevalenza negli ambienti di lavoro e di vita11,12. Si tratta di una risposta di ipersensibilità di tipo IV di tipo ritardato mediata da un circuito immunitario intatto che si sviluppa in due fasi temporalmente segmentate: sensibilizzazione ed elicitazione. L'ACD umano è innescato dall'esposizione ad alcune sostanze chimiche (apteni o metalli) che portano alla sensibilizzazione. Durante questa fase, una risposta mediata dalle cellule T è innescata da complessi apten-proteina presentati dalle cellule presentanti l'antigene. Dopo la successiva esposizione allo stesso aptene, le cellule T effettrici apten-specifiche e di memoria vengono riattivate e localizzate sulla pelle, un processo che comporta l'infiltrazione di una varietà di popolazioni di cellule immunitarie. Questa risposta infiammatoria acuta è nota come elicitazione, con conseguente pieno sviluppo delle lesioni13. L'ACD umano può essere studiato utilizzando modelli animali di ipersensibilità da contatto (CHS)14.
Il modello CHS indotto da un aptene organico reattivo, a basso peso molecolare, 2,4-dinitrofluorobenzene (DNFB), è un modello murino comunemente usato che è stato utilizzato nello studio della patologia e nei potenziali interventi terapeutici dell'ACD 15,16. Pertanto, questo modello dipendente dalle cellule T potrebbe essere applicato per studiare la generazione del sottogruppo Th-GM nelle malattie allergiche. Qui, abbiamo indotto un modello murino di CHS con DNFB, analizzato la generazione di Th-GM nelle lesioni e nei linfonodi drenanti e abbiamo scoperto che il sottogruppo Th-GM si espandeva principalmente dopo la riesposizione allo stesso aptene. Ciò suggerisce che il sottogruppo Th-GM potrebbe essere essenziale per lo sviluppo dell'ACD e rappresenta un bersaglio terapeutico specifico nell'ACD.
Protocollo
Tutti i topi utilizzati in questo protocollo erano sul background genetico C57BL/6, mantenuti in specifiche condizioni prive di agenti patogeni e forniti di cibo e acqua ad libitum. Tutti gli esperimenti sono stati approvati dall'ente di revisione etica del benessere animale del West China Medical Center, Sichuan University (20210302059).
1. Preparazione del reagente e del materiale
- Soluzione DNFB allo 0,5% come sensibilizzante
- Per la sensibilizzazione di 10 topi, preparare 1,1 ml di miscela acetone/olio d'oliva 4:1 (v/v): mescolando 880 μL di acetone e 220 μL di olio d'oliva per consentire 0,1 mL di volume in eccesso per tenere conto di eventuali perdite di volume minori. Aggiungere 5 μL di DNFB a 1,1 mL di miscela omogeneizzata di acetone/olio d'oliva 4:1.
NOTA: Preparare fresco il giorno della sensibilizzazione. La miscela acetone/olio d'oliva deve essere preparata in una cappa aspirante.
- Per la sensibilizzazione di 10 topi, preparare 1,1 ml di miscela acetone/olio d'oliva 4:1 (v/v): mescolando 880 μL di acetone e 220 μL di olio d'oliva per consentire 0,1 mL di volume in eccesso per tenere conto di eventuali perdite di volume minori. Aggiungere 5 μL di DNFB a 1,1 mL di miscela omogeneizzata di acetone/olio d'oliva 4:1.
- Soluzione DNFB allo 0,2% come sfidante
- Per sfidare 10 topi, aggiungere 0,5 μL di DNFB in 0,25 mL di una miscela omogeneizzata di acetone/olio d'oliva 4:1 descritta nel passaggio 1.1. Usa la miscela acetone/olio d'oliva 4:1 come veicolo quando sfidi i topi dopo la sensibilizzazione.
NOTA: La miscela di acetone e olio d'oliva deve essere preparata in una cappa aspirante.
- Per sfidare 10 topi, aggiungere 0,5 μL di DNFB in 0,25 mL di una miscela omogeneizzata di acetone/olio d'oliva 4:1 descritta nel passaggio 1.1. Usa la miscela acetone/olio d'oliva 4:1 come veicolo quando sfidi i topi dopo la sensibilizzazione.
- Idrato di cloralio come anestetico
- Sciogliere 4 g di idrato di cloralio in 50 mL di soluzione salina tamponata con fosfato (PBS) per ottenere una soluzione di lavoro all'8%. Filtrare e conservare a 4 °C per un massimo di 3 mesi. Utilizzare 5 μl per g di peso corporeo per un topo.
- 50x collagenasi IV stock
- Sciogliere 100 mg di collagenasi EV in 1 mL di terreno base RPMI 1640 (non integrato con antibiotici o siero fetale bovino [FBS]) per ottenere una riserva di 100 mg/mL. Conservare a -20 °C in aliquote da 100 μL per un massimo di 6 mesi.
- 1.000x DNase I stock
- Sciogliere 5 mg di DNasi I in 1 mL di NaCl 0,15 M per ottenere un brodo di 5 mg/mL. Conservare a -20 °C in aliquote da 100 μL per un massimo di 6 mesi.
- Buffer di arresto
- Sciogliere 1,681 g di EDTA in 50 mL di terreno RPMI 1640 basico per ottenere un impasto da 100 mM. Conservare a 4 °C per un massimo di 2 settimane.
- Mezzo di lavaggio
- Sciogliere 0,372 g di EDTA a una concentrazione finale di 2 mM e 5 mL di FBS a una concentrazione finale dell'1% con 500 mL di PBS. Filtrare e conservare a 4 °C per un massimo di 1 mese.
- Tampone di colorazione
- Sciogliere 0,372 g di EDTA a una concentrazione finale di 2 mM e 10 mL di FBS a una concentrazione finale del 2% con 500 mL di PBS. Filtrare e conservare a 4 °C per un massimo di 1 mese.
- Reagenti di restimolazione
- Sciogliere 1 mg di forbolo 12-miristato 13-acetato (PMA) in 20 mL di DMSO per ottenere un impasto di 50 μg/mL (500x) e conservarlo a -20 °C in aliquote da 50 μL.
- Diluire 250 μL di ionomicina in soluzione (4 mg/mL) in 7,75 mL di DMSO per ottenere una riserva di 500 μg/mL (500x) e conservarla a -20 °C in aliquote da 50 μL.
- Aliquotare 1 mL di soluzione di inibitore del trasporto proteico (contenente brefeldina A) in 50 μL e conservare le aliquote a 4 °C.
2. Induzione di CHS nei topi
- Il giorno -5, anestetizzare i topi iniettando 400 mg/kg di idrato di cloralio per via intraperitoneale.
- Utilizzando un rasoio per animali domestici, radere un'area di 2 cm × 2 cm sull'addome del topo.
NOTA: Evitare di graffiare la pelle del mouse; Mantenere intatta l'integrità della barriera cutanea. - Spalmare 100 μl di soluzione DNFB allo 0,5% sull'addome rasato delicatamente e uniformemente con una micropipetta con puntali monouso. Tenere i topi per 5-10 secondi per consentire l'evaporazione di parte del solvente.
- Il giorno -4, ripetere i passaggi 2.1-2.3 per un'altra sensibilizzazione.
NOTA: Due eventi di sensibilizzazione funzionano meglio di uno. - Il giorno 0, sfidare l'orecchio destro dei topi con 20 μl di DNFB allo 0,2% utilizzando un micropipettatore con punte monouso e trattare l'orecchio sinistro con lo stesso volume di miscela acetone/olio d'oliva 4:1 del veicolo.
NOTA: Sfidare i lati dorsale e ventrale dell'orecchio con volumi uguali di DNFB o veicolo. - Nei prossimi 3 giorni, misurare quotidianamente lo spessore dell'orecchio destro e sinistro dei topi utilizzando uno spessimetro a quadrante e calcolare l'aumento dello spessore dell'orecchio: spessore dell'orecchio destro - spessore dell'orecchio sinistro.
NOTA: È stato possibile osservare un graduale aumento dello spessore dell'orecchio nelle orecchie di topo con DNFB dello 0,2% rispetto alle orecchie trattate con veicolo.
3. Raccolta di campioni di topi CHS
- Il giorno 3, anestetizzare i topi con un'iniezione intraperitoneale di 400 mg/kg di cloralio idrato. Attendere 5-10 minuti affinché il topo sia in uno stato di incoscienza ed eseguire un leggero pizzicamento delle dita su entrambe le zampe posteriori per confermare che i topi siano profondamente anestetizzati.
- Scatta una foto di ogni orecchio per mouse usando una fotocamera. Valutare l'incrostazione (desquamazione sull'orecchio) e il rossore dell'orecchio (eritema sull'orecchio) in modo indipendente per valutare la gravità dell'infiammazione su una scala da 0 a 5:0, nessuna; 1, lieve; 2, moderato; 3, contrassegnato; 4, molto marcato; 5, più grave.
- Eutanasia del topo mediante lussazione cervicale. Tagliare l'intero orecchio e sezionare i linfonodi drenanti paralleli dei topi usando forbici e pinze affilate sterili. Posizionare i tessuti in un pozzetto di una piastra a 6 pozzetti posta su ghiaccio contenente 5 mL di PBS preraffreddato per la dissociazione enzimatica o fisica per generare sospensioni a singola cellula (Figura supplementare S1A e Figura supplementare S2A).
- Per l'analisi istologica, fissare i campioni dell'orecchio in paraformaldeide al 4%, disidratarli e incorporarli in paraffina per la colorazione immunoistochimica, come descritto altrove17.
4. Preparazione della sospensione unicellulare dalle orecchie
- Dividere i lati ventrale e dorsale dell'orecchio pizzicando e strappando le estremità tagliate con due pinze curve (Figura supplementare S1B). Posizionarli in un pozzetto di una piastra a 6 pozzetti contenente 4,5 ml di tampone digestivo, assicurandosi che tali tessuti siano completamente immersi nel tampone digestivo (Figura supplementare S1C).
NOTA: Il tampone di digestione era composto da RPMI 1640 contenente il 10% di FBS + 25 mM di HEPES + 2 mg/mL di collagenasi IV + 5 μg/mL di DNasi I. - Incubare i lembi auricolari in un incubatore per colture cellulari a 37 °C per 20 minuti. Tagliare i lembi auricolari con le forbici il più piccoli possibile per facilitare la digestione dei tessuti (Figura supplementare S1D) e rimettere il campione nell'incubatore per altri 40 minuti.
NOTA: Una digestione efficiente può essere raggiunta entro 40-50 minuti. La sovradigestione a 37 °C influisce sulla vitalità cellulare. - Aggiungere 0,5 mL di tampone di arresto per pozzetto per neutralizzare le attività enzimatiche della collagenasi IV e della DNasi I. Eseguire i passaggi successivi sul ghiaccio.
- Trasferire i frammenti di tessuto auricolare con un paio di pinze curve in una provetta da centrifuga da 50 ml contenente un colino cellulare da 70 μm e pipettare l'intero volume di terreno nello stesso colino cellulare.
- Disgregare i tessuti utilizzando l'estremità superiore di uno stantuffo per siringa da 1 mL. Premere con un movimento circolare contro il filtro cellulare da 70 μm fino a quando rimangono solo tessuti connettivi bianchi (Figura supplementare S1D).
- Sciacquare due volte i filtri cellulari con 1.000 μl di terreno di lavaggio. Trasferire l'intero volume del pozzetto in una provetta da centrifuga da 50 mL attraverso un filtro cellulare da 40 μm. Mantieni il tubo sul ghiaccio.
5. Preparazione di sospensioni unicellulari da linfonodi drenanti (dLN)
- Trasferire i linfonodi con un paio di pinze curve in un colino cellulare da 70 μm sopra il pozzetto di una piastra a 6 pozzetti (Figura supplementare S2B). Dissociare i linfonodi utilizzando l'estremità superiore di uno stantuffo da siringa da 1 ml. Premere con movimenti circolari contro il filtro cellulare da 70 μm fino a quando non rimangono solo detriti bianchi (Figura supplementare S2C).
- Sciacquare due volte il filtro cellulare con 1.000 μL di terreno di lavaggio. Trasferire l'intero volume del pozzetto in una provetta da 5 mL. Mantieni i tubi sul ghiaccio.
6. Restimolazione del sottogruppo di Th-GM con 12-miristato 13-acetato (PMA)/ionomicina in presenza di un inibitore del trasporto proteico
- Centrifugare le cellule isolate dall'orecchio e i campioni di linfonodi drenanti per 8 minuti a 400 × g a 4 °C ed eliminare il surnatante. Risospendere delicatamente il pellet con 1.000 μL di mezzo di lavaggio.
- Raccogliere una piccola parte di ciascun campione per contare il numero totale di cellule derivate dall'orecchio e dal linfonodo drenante utilizzando un emocitometro. Aggiungere lo 0,04% di blu di tripano per misurare la vitalità cellulare.
NOTA: La vitalità cellulare dovrebbe essere superiore al 60% per la successiva stimolazione e analisi delle cellule T. La densità cellulare potrebbe essere compresa tra 1-5 × 106/mL. - Centrifugare le cellule al punto 6.1 ed eliminare il surnatante. Risospendere delicatamente il pellet con 1.000 μL di terreno RPMI 1640 contenente il 2% di FBS e seminare 1 mL di sospensione a cellula singola (106 cellule/mL) in piastre di coltura tissutale a fondo piatto a 12 pozzetti.
- Aggiungere 2 μL di forbolo 12-miristato 13-acetato (PMA) (concentrazione finale 100 ng/mL), 2 μL di ionomicina (concentrazione finale 1.000 ng/mL) e 1 μL di inibitore del trasporto proteico (contenente Brefeldina A) a ciascun pozzetto nella piastra a 12 pozzetti contenente 1 mL della sospensione unicellulare di cui sopra e incubare a 37 °C per 4 ore.
7. Analisi di sottogruppi di Th-GM generati in vivo mediante colorazione della superficie cellulare e intracellulare
- Trasferire le cellule stimolate in provette da centrifuga da 1,5 mL utilizzando una pipetta. Centrifugare le provette da centrifuga per 8 minuti a 400 × g a temperatura ambiente ed eliminare il surnatante.
- Lavare una volta il pellet della cella con 1 mL di tampone colorante e pellettare le celle mediante centrifugazione, come descritto al punto 7.1. Risospendere le cellule a 1-10 × 106/mL in 0,5 mL di tampone di colorazione.
- Aggiungere 0,5 μL di soluzione madre di colorante vitale (vedere la Tabella dei materiali) a 0,5 mL di sospensione cellulare e agitare immediatamente. Incubare la miscela per 10 minuti a temperatura ambiente al buio. Lavare le cellule due volte con 1 mL di tampone colorante e ripetere la centrifugazione al punto 7.1 per pellettare le cellule.
- Risospendere il pellet in 0,1 mL di tampone colorante. Aggiungere 1 μL di anticorpo anti-CD4 (coniugato con FITC), 1 μL di anticorpo anti-CD44 (coniugato con APC) e 1 μL di anticorpo anti-CD62L (coniugato con PE/Cianine7) a tre aliquote da 0,1 mL della sospensione cellulare. Agitare immediatamente e incubare a temperatura ambiente per 15 min, al riparo dalla luce.
- Ripetere i lavaggi e la centrifugazione al punto 7.3.
- Risospendere il pellet in 200 μL di tampone di fissazione IC e incubare per 20 minuti al buio. Nel frattempo, preparare il tampone di permeabilizzazione (1x) diluendo 1 parte di tampone di permeabilizzazione (10x) con 9 parti di acqua distillata. Lavare le cellule due volte con 1 mL di tampone di permeabilizzazione (1x) mediante centrifugazione a 600 × g per 5 minuti a temperatura ambiente.
- Risospendere il pellet in 0,1 mL di tampone di permeabilizzazione (1x) con anticorpi contro GM-CSF (PE-coniugato, 1 μL/test), IFN-γ (BV711-coniugato, 1 μL/test), IL-17A (BV421-coniugato, 1 μL/test) e IL-22 (PerCP/Cianina5.5-coniugato, 5 μL/test) e incubare per 30 minuti a temperatura ambiente al buio.
- Ripetere i lavaggi e la centrifugazione al punto 7.6.
- Risospendere il pellet di cella in 200 μL di PBS e trasferire la sospensione in una provetta a fondo tondo. Eseguire le cellule colorate in un citometro a flusso.
8. Strategia di gating per identificare il sottoinsieme Th-GM
- Analizzare i dati della citometria a flusso (vedere la Tabella dei materiali per i dettagli sul software utilizzato) utilizzando la strategia di gating illustrata nella Figura S1 supplementare. Per il software utilizzato qui, scaricalo e configuralo nel computer.
- Importare i dati della citometria a flusso cliccando su File |Aperto | Importare i file FCS nel software e annotare il gruppo e il nome di ciascun campione selezionando la scheda Rinomina .
- Scegliere i linfociti su un grafico FSC rispetto a SSC (FSC basso , SSC basso, P1) per escludere i detriti trovati nell'angolo in basso a sinistra e le cellule mieloidi con grandi dimensioni e alta granularità facendo clic sul grafico di densità e mostrare l'asse X di questo grafico come FSC-A e l'asse Y come SSC-A.
- Fare doppio clic sugli eventi in P1 per generare un altro grafico di densità e separare le singole celle (visualizzate come una linea correlata, P2) dagli aggregati di celle selezionando l'altezza e l'area della cella in questo grafico (asse X come FSC-A e asse Y come FSC-H).
- Fare doppio clic sugli eventi in P2 per generare un altro grafico di densità e visualizzare l'asse X di questo grafico come FSC-A e l'asse Y come SSC-A. Gate delle popolazioni cellulari vitali utilizzando gli eventi FVS 780- (P3).
- Fare doppio clic sugli eventi in P3 per generare il grafico di densità successivo ( l'asse X come CD4-A e l'asse Y come SSC-A) e distinguere le cellule T CD4 scegliendo la popolazione CD4+ (P4).
- Fare doppio clic sugli eventi in P4 per generare un altro grafico di densità (l'asse X come CD44-A e l'asse Y come CD62L-A) e definire le celle helper T effettrici scegliendo la popolazione in alto a destra di questo grafico (CD62L- CD44+, P5).
9. Analisi statistica
- Eseguire analisi statistiche, confrontando due gruppi utilizzando un t-test non appaiato. *P < 0,05, ** P < 0,01, *** P < 0,001 e **** P < 0,0001 (media ± DS).
Risultati
CHS (ipersensibilità da contatto) indotta da DNFB nei topi
Per indurre la SIC nei topi, i topi sono stati sensibilizzati e sottoposti a test con DNFB applicato sulla pelle dell'orecchio, come illustrato nella Figura 1A. Lo spessore dell'orecchio, un indicatore di spongiosi epidermica, è stato notevolmente aumentato nei topi con DNFB rispetto ai topi trattati con veicolo (Figura 1B, 70 vs 3 μm al giorno 1, 203 vs 7,5 μm al giorno 2, 276 vs 5 μm al giorno 3). Settantadue ore dopo la sfida, l'orecchio destro dei topi mostrava segni di eritema, incrostazione e ispessimento, mentre l'orecchio trattato con il veicolo non mostrava alcun segno di infiammazione (Figura 1C). I punteggi di incrostazione e arrossamento delle orecchie di topo nel gruppo con DNFB erano più alti di quelli delle orecchie trattate con veicolo (Figura 1D).
Aumento dell'ispessimento epidermico e marcata infiltrazione infiammatoria dopo l'provocazione con DNFB
L'analisi delle sezioni colorate con H&E della pelle trattata con DNFB ha mostrato un aumento dell'ispessimento epidermico nella pelle dell'orecchio rispetto alla pelle trattata con veicolo (Figura 2A, B). I risultati dell'immunoistochimica hanno mostrato che l'infiltrazione di cellule CD45+ (cellule ematopoietiche totali), Ly6G+ (neutrofili) e F4/80+ (macrofagi) nelle orecchie era significativamente più alta nella pelle trattata con DNFB rispetto ai tessuti trattati con veicolo (Figura 2C, D). Nel complesso, DNFB ha indotto un sintomo tipico di ACD nei topi.
Generazione di sottoinsiemi di cellule Th-GM nel modello immunologico di sensibilizzazione/sfida DNFB
Abbiamo ipotizzato che le cellule precursori naive del Th apten-specifiche si differenzino in cellule effettrici che esprimono GM-CSF durante le risposte immunitarie di sensibilizzazione/sfida all'aptene. Per testare questa ipotesi, la differenziazione delle cellule Th è stata studiata in orecchie sensibilizzate/provocate da DNFB o sensibilizzate a DNFB/con veicolo con colorazione intracellulare mediante citometria a flusso (Figura S3 supplementare). Dopo la sfida, c'erano in media circa 4.000 cellule T CD4+ e 1.898 cellule T effettrici CD4+ per topo (aumenti di 23,8 volte e 38,7 volte rispetto ai topi trattati con veicolo, rispettivamente, Figura supplementare S4). La produzione di IFN-γ- IL-17A- IL-22- GM-CSF+ nelle cellule Th effettrici, cioè Th-GM, era più di 3 volte superiore nelle orecchie sensibilizzate/sfidate da DNFB (25,6% in contrasto con l'8,3% nelle orecchie provocate dal veicolo, Figura 3A, B). C'è stata un'espansione di quasi 10 volte della frequenza delle cellule T effettrici CD4 nelle orecchie con DNFB rispetto alle pelli con veicolo sfidato, indicando una vigorosità dell'attivazione delle cellule Th dopo l'aptene (Figura 4A, B). I cambiamenti nel sottogruppo di cellule Th-GM negli infiltrati cutanei erano parzialmente rispecchiati nei dLN, sebbene questo aumento non fosse così notevole come quello nei tessuti (3,7 volte, Figura 4C, D). Pertanto, il sottogruppo di cellule Th-GM è stato potenziato con successo in questo modello immunologico di sensibilizzazione/sfida aptenica.

Figura 1: L'infiammazione dermatologica indotta da DNFB nei topi assomiglia fenotipicamente alla dermatite da contatto nell'uomo. (A) Illustrazione schematica dell'esperimento DNFB proposto. I topi C57BL/6J sono stati sensibilizzati spalmando DNFB sull'addome nei giorni -5 e -4, sfidati con DNFB o veicolo sull'orecchio il giorno 0 e valutati nei giorni 1, 2 e 3. (B) Gonfiore dell'orecchio in topi trattati con veicolo o sfidati con DNFB (n = 6 per gruppo). (C) Fotografie rappresentative di orecchie intere in topi con veicolo o DNFB al giorno 3. (D) Vengono mostrati i punteggi di incrostazioni e arrossamenti nelle orecchie sottoposte a DNFB o veicolo (n = 6 per gruppo). P < 0,001 e **** P < 0,0001 (media ± DS). I dati sono rappresentativi di tre esperimenti indipendenti con 6 campioni in ciascun gruppo. Abbreviazione: DNFB = 2,4-dinitrofluorobenzene. Clicca qui per visualizzare una versione più grande di questa figura.
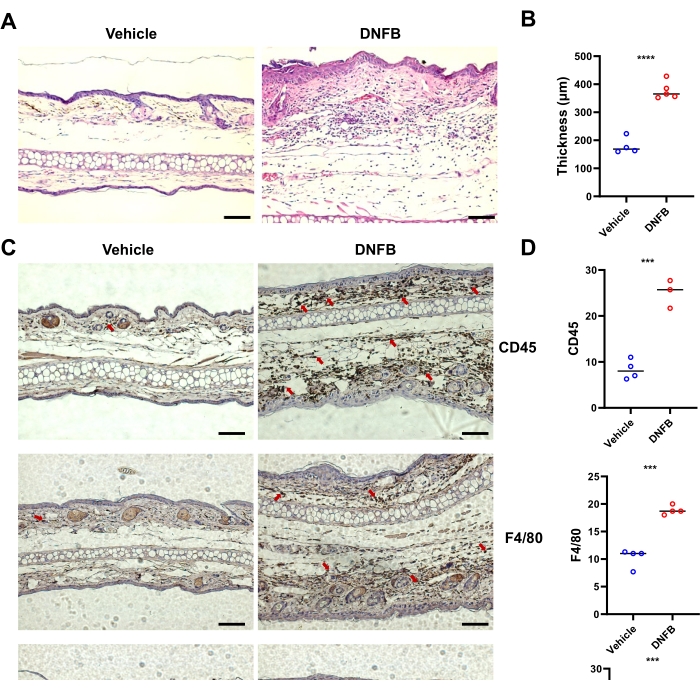
Figura 2: Alterazione tipica dell'infiammazione istologica nei topi indotta da sensibilizzazione/provocazione DNFB. (A) Colorazione H&E della pelle dell'orecchio da singoli topi rappresentativi dei gruppi indicati. (B) Ispessimento epidermico misurato su immagini di colorazione H&E mostrate da un grafico a barre. (C) Immunoistochimica di CD45, F4/80 e Ly6G nelle orecchie di topi sottoposti a DNFB o veicolo. Le frecce rosse indicano le cellule colorate positivamente. (D) Quantificazione di cellule CD45-, F4/80 o Ly6G-positive contando la colorazione marrone da tre o quattro sezioni diverse cieche per topo. P < 0,001 e **** P < 0,0001 (media ± DS). I dati sono rappresentativi di due esperimenti indipendenti con 3-5 topi in ciascun gruppo. Barra graduata = 1.000 μm (A, C). Abbreviazioni: DNFB = 2,4-dinitrofluorobenzene; H&E = ematossilina ed eosina. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Sottogruppo di Th-GM nella pelle dell'orecchio dei topi. (A) Citometria a flusso del sottogruppo di Th-GM nella pelle dell'orecchio di topi sottoposti a DNFB o con veicolo valutato 3 giorni dopo il provocazione. (B) Frequenze di Th-GM all'interno delle cellule T effettrici CD4+ . Ogni simbolo rappresenta un singolo mouse. P < 0,001 e **** P < 0,0001 (media ± DS). I dati sono rappresentativi di 6 campioni in ciascun gruppo. Abbreviazioni: DNFB = 2,4-dinitrofluorobenzene; GM-CSF = fattore stimolante le colonie di granulociti-macrofagi; Th-GM = T helper produttore di GM-CSF. Clicca qui per visualizzare una versione più grande di questa figura.
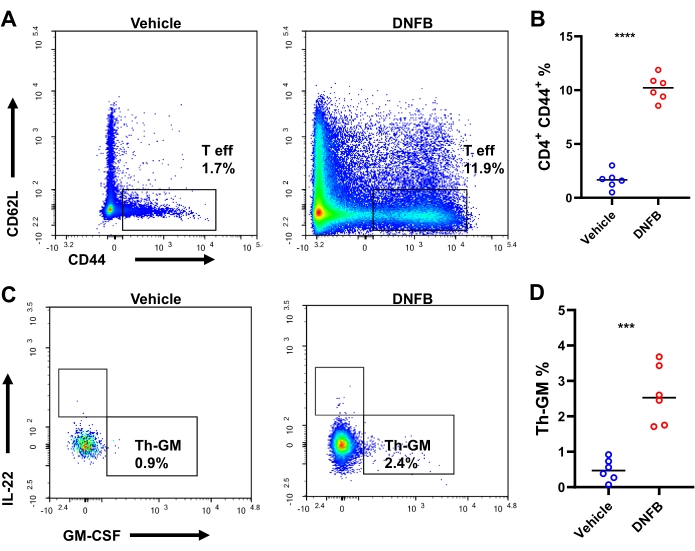
Figura 4: Sottogruppo di Th-GM nei linfonodi drenanti dell'orecchio di topi. (A) Citometria a flusso delle cellule T effettrici CD4+ nei linfonodi drenanti dell'orecchio di topi sottoposti a DNFB o veicolo valutati 3 giorni dopo il provocazione. (B) Frequenze delle cellule T effettrici CD4+ all'interno delle cellule T CD4+ . (C) Citometria a flusso del sottogruppo Th-GM nei linfonodi drenanti dell'orecchio di topi sottoposti a DNFB o veicolo valutati 2 giorni dopo il provocazione. (D) Percentuale del sottogruppo Th-GM all'interno delle cellule T effettrici CD4+ nei linfonodi drenanti dell'orecchio. P < 0,001 e **** P < 0,0001 (media ± DS). I dati sono rappresentativi di 6 campioni in ciascun gruppo. Abbreviazioni: DNFB = 2,4-dinitrofluorobenzene; GM-CSF = fattore stimolante le colonie di granulociti-macrofagi; Th-GM = helper T produttore di GM-CSF; T eff = cellule T effettrici CD4+ . Clicca qui per visualizzare una versione più grande di questa figura.
Figura supplementare S1: L'elaborazione della pelle dell'orecchio del topo. (A) Un orecchio tagliato da un topo C57BL/6J. (B) Dividere i lati dorsale e ventrale dell'orecchio. (C) Immergere i lati dorsale e ventrale nel tampone di digestione. (D) Piccoli foglietti auricolari con forbici. (E) Capelli e tessuti connettivi bianchi lasciati sul colino cellulare dopo la dissociazione. Clicca qui per scaricare questo file.
Figura supplementare S2: Elaborazione dei linfonodi auricolari di topo. (A) Dissezione di linfonodi auricolari da un topo C57BL/6J. La freccia rossa indica la posizione dei linfonodi auricolari. (B) Il linfonodo auricolare è stato trasferito in un colino cellulare da 70 μm sopra il pozzetto di una piastra a 6 pozzetti prima della macinazione. (C) I detriti lasciati sui filtri delle celle dopo la macinazione. Abbreviazione: DNFB = 2,4-dinitrofluorobenzene. Clicca qui per scaricare questo file.
Figura supplementare S3: Strategia di gating utilizzata per analizzare il sottogruppo Th-GM nei linfonodi auricolari. In primo luogo, le cellule linfatiche sono state gated in base alla granularità e alle dimensioni (FSC basso , SSC basso, P1) e i singoletti sono stati selezionati nel grafico FSC-A vs. FSC-H (P2). Quindi, le cellule morte sono state eliminate mediante gating sulla popolazione FVS780- (P3). In terzo luogo, le cellule T effettrici CD4 sono state identificate come la popolazione CD4+- CD44+ (P5). Infine, il sottogruppo Th-GM è stato distinto dall'espressione di citochine intracellulari, cioè IFN-γ- IL-17A- IL-22- GM-CSF+ (P7). Abbreviazioni: GM-CSF = fattore stimolante le colonie di granulociti-macrofagi; Th-GM = helper T produttore di GM-CSF; IFNγ = interferone-gamma. Clicca qui per scaricare questo file.
Figura supplementare S4: Composizione delle cellule T effettrici CD4 totali che esprimono GM-CSF nel tessuto dei topi dopo la provocazione. (A) Proporzione (%) di cellule Th effettrici che esprimono GM-CSF rispetto al totale delle cellule GM-CSF+ CD4+ CD44+ . (B) Citometria a flusso di espressione di GM-CSF, IFN-γ e IL-17A gated in cellule T CD4+ CD44+ vive nelle orecchie dei topi dopo provocazione. Abbreviazioni: GM-CSF = fattore stimolante le colonie di granulociti-macrofagi; Th-GM = helper T produttore di GM-CSF; IFNγ = interferone-gamma. Clicca qui per scaricare questo file.
Discussione
Questo protocollo fornisce un semplice saggio in vivo per analizzare la generazione e l'espansione del sottogruppo di cellule Th-GM. È essenziale utilizzare un modello di malattia mediata dalle cellule T nei topi avviati da apteni o antigeni, imitando tale attivazione nell'uomo. DNFB è un aptene a piccola molecola che è più economico e fa risparmiare tempo rispetto agli antigeni peptidici o proteici per innescare la risposta immunitaria delle cellule T in vivo18,19. Durante il corso della malattia, abbiamo osservato la massima entità della reazione di gonfiore dell'orecchio sfidata con DNFB rispetto all'induzione con altri apteni, tra cui 2,4,6-trinitroclorobenzene (TNCB), oxazalone (OXA) o isotiocianato di fluoresceina (FITC), almeno nei topi con un background genetico C57BL/6J (dati non mostrati), sebbene gli altri tre reagenti di cui sopra siano stati riportati per generare sensibilità al contatto nei topi14. Gli investigatori devono determinare il ceppo di topo e gli apteni appropriati per l'induzione completa della malattia.
Una bassa resa di cellule dalle orecchie è uno dei problemi più frequenti quando si lavora con tessuti di topo di dimensioni più piccole. Ciò potrebbe essere causato da una digestione enzimatica incompleta a causa di un'attività enzimatica inefficace dei tipi di collagenasi o di eventuali reagenti scaduti utilizzati per la digestione. Per ovviare a questo, abbiamo usato la collagenasi di tipo IV per la digestione della pelle dell'orecchio poiché era superiore ad altre collagenasi, inclusa la collagenasi I, nel dissociare efficacemente le orecchie infiammate. La maggiore vitalità delle cellule isolate dalle orecchie è vantaggiosa per l'accumulo intracellulare di citochine dopo la restimolazione con PMA/ionomicina/inibitore del trasporto proteico. Inoltre, la concentrazione di calcio nel terreno RPMI 1640 utilizzato per la restimolazione può essere regolata a 1,5 mM con stock sterile di cloruro di calcio da 1 M e il tempo di restimolazione può essere esteso a 6 ore per ottenere la massima produzione di citochine nelle cellule T20.
La citometria a flusso multiparametrica consente l'identificazione e la quantificazione accurate del sottogruppo di cellule Th-GM nel contesto delle reazioni autoimmuni. Durante l'acquisizione dei dati con un citometro, sono stati impostati campioni non colorati e con colorazione singola per determinare le tensioni PMT appropriate e regolare le compensazioni. Per un'analisi estesa delle cellule immunitarie mediante citometria a flusso, i lettori possono fare riferimento alle linee guida riconosciute per l'uso della citometria a flusso 21 per ulteriori informazioni sull'aggiustamento della compensazione, sulle impostazioni di colorazione degli anticorpi e sulle strategie di gating. In particolare, il sottogruppo Th-GM è considerato parallelo ad altri lignaggi tradizionali e identificato come GM-CSF+ IFN-γ- IL-17A- IL-22- nelle cellule T effettrici CD4 (Figura supplementare S1). Questa strategia di gating dovrebbe essere applicata per analizzare i dati della citometria a flusso per lo studio della biologia cellulare Th-GM.
In sintesi, questo articolo presenta un protocollo per analizzare il nuovo lignaggio Th-GM nell'ipersensibilità murina da contatto indotta da DNFB utilizzando la citometria a flusso. Questo metodo può essere utilizzato per approfondire lo studio della biologia delle cellule Th-GM e per la ricerca farmacologica di strategie terapeutiche incentrate sul GM-CSF in varie condizioni, come la dermatite allergica da contatto.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
Questo lavoro è stato sostenuto dalla National Natural Science Foundation of China (n. 81602763, 81803142, 82003347), dall'Excellent Researcher Program della China Postdoctoral Science Foundation (n. 2017T100700) e dal Regular Researcher Program della China Postdoctoral Science Foundation (n. 2016M592673). Gli autori desiderano ringraziare Yan Wang e Meng-Li Zhu (Core Facilities of West China Hospital, Sichuan University) per il supporto tecnico della citometria a flusso in questo studio.
Materiali
| Name | Company | Catalog Number | Comments |
| 2,4-dinitrofluorobenzene | BT REAGENT | P0001746 | CAS NO: 70-34-8 |
| Acetone | CHRON CHEMICALS | / | 67-64-1 |
| anti-CD4 antibody | Biolegend | 300506 | 1:100 Diluted |
| anti-CD44 antibody | Biolegend | 103012 | 1:100 Diluted |
| anti-CD62L antibody | Biolegend | 104417 | 1:100 Diluted |
| anti-GM-CSF antibody | BD Bioscience | 554507 | 1:100 Diluted |
| anti-IFN-γ antibody | Biolegend | 505836 | 1:100 Diluted |
| anti-IL-17A antibody | BD Bioscience | 563354 | 1:100 Diluted |
| anti-IL-22 antibody | Biolegend | 516411 | 5 µL/test |
| CD45 | Biolegend | 103101 | 1:200 Diluted |
| Chloral hydrate | CHRON CHEMICALS | / | 302-17-0 |
| Dial thickness gauge (0.01 mm type) | PEACOCK | G-1A | / |
| DMSO | LIFESCIENCES | D8371 | 67-68-5 |
| EDTA Na2 | Solarbio | E8030 | 6381-92-6 |
| F4/80 | Biolegend | 123102 | 1:200 Diluted |
| Fixable Viability Stain 780 | BD Bioscience | 565388 | 1:1,000 Diluted, viability dye |
| Flow cytometer | BD Bioscience | BD FACS ARIA II SORP | / |
| GraphPad Prism | GraphPad Software | Prism 7 | Software for statistics and graphing |
| Intracelluar Fixtation and Permeablization Buffer Set | Thermo Fisher | 88-8824-00 | prepared freshly |
| Ionomycin | Sigma-Aldrich | 407951 | CAS NO: 56092-81-0 |
| Ly6G | Biolegend | 127602 | 1:200 Dilutied |
| NovoExpress | Agilent | / | Software for flow cytometry data analysis; https://www.agilent.com.cn/zh-cn/product/research-flow-cytometry/flow-cytometry-software/novocyte-novoexpress-software-1320805 |
| Olive oil | YUANYE BIO | S30503 | 8001-25-0 |
| PMA | Sigma-Aldrich | P8139 | CAS NO: 16561-29-8 |
| Protein Transport Inhibitor (Containing Brefeldin A) | BD Bioscience | 555029 | 1 µL/mL |
Riferimenti
- Rasouli, J., et al. A distinct GM-CSF(+) T helper cell subset requires T-bet to adopt a TH1 phenotype and promote neuroinflammation. Science Immunology. 5 (52), (2020).
- Galli, E., et al. GM-CSF and CXCR4 define a T helper cell signature in multiple sclerosis. Nature Medicine. 25 (8), 1290-1300 (2019).
- Komuczki, J., et al. Fate-mapping of GM-CSF expression identifies a discrete subset of inflammation-driving T helper cells regulated by cytokines IL-23 and IL-1beta. Immunity. 50 (5), 1289-1304 (2019).
- Sheng, W., et al. STAT5 programs a distinct subset of GM-CSF-producing T helper cells that is essential for autoimmune neuroinflammation. Cell Research. 24 (12), 1387-1402 (2014).
- Herndler-Brandstetter, D., Flavell, R. A. Producing GM-CSF: a unique T helper subset. Cell Research. 24 (12), 1379-1380 (2014).
- Lu, Y., Fu, X. Y., Zhang, Y. In vitro differentiation of mouse granulocyte-macrophage-colony-stimulating Factor (GM-CSF)-producing T Helper (THGM) Cells. Journal of Visualized Experiments: JoVE. (139), e58087(2018).
- Hu, Y., et al. Interleukin-1beta-induced IRAK1 ubiquitination is required for TH-GM-CSF cell differentiation in T cell-mediated inflammation. Journal of Autoimmunity. 102, 50-64 (2019).
- Reynolds, G., et al. Synovial CD4+ T-cell-derived GM-CSF supports the differentiation of an inflammatory dendritic cell population in rheumatoid arthritis. Annals of the Rheumatic Diseases. 75 (5), 899-907 (2016).
- Al-Mossawi, M. H., et al. Unique transcriptome signatures and GM-CSF expression in lymphocytes from patients with spondyloarthritis. Nature Communation. 8 (1), 1510(2017).
- Wicks, I. P., Roberts, A. W. Targeting GM-CSF in inflammatory diseases. Nature Reviews Rheumatology. 12 (1), 37-48 (2016).
- Scheinman, P. L., et al. Contact dermatitis. Nature Reviews Disease Primers. 7 (1), 38(2021).
- Pesonen, M., Koskela, K., Aalto-Korte, K. Contact urticaria and protein contact dermatitis in the Finnish Register of Occupational Diseases in a period of 12 years. Contact Dermatitis. 83 (1), 1-7 (2020).
- Vocanson, M., Hennino, A., Rozieres, A., Poyet, G., Nicolas, J. F. Effector and regulatory mechanisms in allergic contact dermatitis. Allergy. 64 (12), 1699-1714 (2009).
- Gaspari, A. A., Katz, S. I., Martin, S. F. Contact hypersensitivity. Current Protocols in Immunology. 113, 1-7 (2016).
- Manresa, M. C. Animal models of contact dermatitis: 2,4-dinitrofluorobenzene-induced contact hypersensitivity. Methods in Molecular Biology. 2223, 87-100 (2021).
- Kim, J. H., et al. CD1a on Langerhans cells controls inflammatory skin disease. Nature Immunology. 17 (10), 1159-1166 (2016).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods in Enzymology. 533, 225-233 (2013).
- Achuthan, A., et al. Cytokine-induced acute inflammatory monoarticular arthritis. Methods in Molecular Biology. 1784, 215-223 (2018).
- Stromnes, I. M., Goverman, J. M. Active induction of experimental allergic encephalomyelitis. Nature Protocols. 1 (4), 1810-1819 (2006).
- Kruisbeek, A. M., Shevach, E., Thornton, A. M. Proliferative assays for T cell function. Current Protocols in Immunology. , Chapter 3, Unit 3 (2004).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (second edition). European Journal of Immunology. 49 (10), 1457(2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon