Method Article
接触超敏反应小鼠模型中粒细胞-巨噬细胞集落刺激因子-产生 T 辅助细胞的分析
摘要
在这里,我们提出了一种简单且标准化的方法,用于分析 体内产生粒细胞 - 巨噬细胞集落刺激因子的 T 辅助细胞亚群。
摘要
与传统的 Th1/Th2/Th17/Treg 谱系平行,粒细胞-巨噬细胞集落刺激因子产生辅助性 T 细胞 (Th-GM) 已被鉴定为人和小鼠中辅助性 T 细胞(GM-CSF+ IFN-γ-IL-17A-IL-22-效应 CD4+ T 细胞)的不同亚群。接触超敏反应 (CHS) 被认为是人类过敏性接触性皮炎 (ACD) 的优良动物模型,表现为完整的 T 细胞介导的免疫反应。为了提供标准化和全面的分析方法来分析体内 T 细胞依赖性免疫反应中的 Th-GM 细胞亚群,使用反应性、低分子量、有机半抗原、2,4-二硝基氟苯 (DNFB) 致敏/攻击诱导小鼠 CHS 模型。通过流式细胞术分析用半抗原免疫后产生的效应 CD4 + T 细胞中的 Th-GM 亚群。我们发现 Th-GM 主要在 DNFB 诱导的 CHS 小鼠模型中的病灶和引流淋巴结中扩增。该方法可用于进一步研究 Th-GM 细胞的生物学以及在各种疾病(如 ACD)中以 GM-CSF 为中心的治疗策略的药理学研究。
引言
粒细胞-巨噬细胞集落刺激因子 (GM-CSF) -产生 T 辅助细胞-Th-GM 亚群-已在人和小鼠中作为 T 辅助细胞的一个独特亚群出现,并被认为包含"仅表达 GM-CSF"(GM-CSF+ IFN-γ-IL-17A-IL-22-)CD4 T 细胞,通过单细胞 RNA 分析、质谱流式细胞术和 GM-CSF 命运图谱小鼠鉴定 1,2,3.2014 年,Sheng 等人报道了 Th-GM 子集的信号转导和转录激活因子 5 (STAT5) 编程,并首次概念化了"Th-GM"子集 4,5。Th-GM 细胞的特征是 GM-CSF、IL-2、TNF-α、IL-3、CCL20 和趋化因子受体 C-X-C 趋化因子受体型 (CXCR) 4 或 CXCR6 1,2 的细胞因子表达。STAT 和/或 NF-κB 通路对于 Th-GM 谱系分化至关重要。建立了一种体外方法,在 TCR 刺激6 存在下使用 IL-7 将初始 CD4 T 细胞分化为 Th-GM 细胞。同时,细胞因子 IL-23 和 IL-1β 被证明在离体时维持 Th-GM 细胞的表达和致病性 3,7。
Th-GM 细胞升高与多种自身免疫性疾病有关,例如多发性硬化症和类风湿性关节炎 2,8,9,表明在自身免疫的发病机制中起潜在作用10。越来越多的证据表明,GM-CSF 可以作为炎症介质发挥作用。在 CD4+ T 细胞中基因过表达 Csf2 (编码 GM-CSF 的基因) 的小鼠自发性出现神经功能缺损,并伴有吞噬细胞浸润到中枢神经系统。在 T 细胞转移性结肠炎模型中,Csf2 - / - T 细胞过继转移到 Rag1 - / - 小鼠中显着降低了该疾病的临床和组织病理学特征。然而,关于 Th-GM 亚群在过敏性疾病(如 ACD)中的作用的报道很少。
ACD 是最常见的炎症性皮肤病之一,在工作和生活环境中患病率很高11,12。它是一种 IV 型迟发型超敏反应,由完整的免疫回路介导,在两个时间分段阶段发展:敏化和激发。人类 ACD 是由接触某些导致致敏的化学物质(半抗原或金属)引发的。在此阶段,T 细胞介导的反应由抗原呈递细胞呈递的半抗原蛋白复合物引发。在随后暴露于相同的半抗原时,半抗原特异性效应细胞和记忆 T 细胞被重新激活并定位于皮肤,这一过程涉及各种免疫细胞群的浸润。这种急性炎症反应称为诱发,导致病变的完全发展13。可以使用接触超敏反应 (CHS) 的动物模型来研究人类 ACD(14)。
由反应性、低分子量、有机半抗原 2,4-二硝基氟苯 (DNFB) 诱导的 CHS 模型是一种常用的小鼠模型,已用于 ACD 的病理学研究以及潜在的治疗干预15,16。因此,这种 T 细胞依赖性模型可用于研究过敏性疾病中 Th-GM 亚群的产生。在这里,我们诱导了具有 DNFB 的 CHS 小鼠模型,分析了病灶和引流淋巴结中 Th-GM 的产生,发现 Th-GM 亚群主要在再暴露于相同的半抗原时扩增。这表明 Th-GM 亚群可能对 ACD 的发展至关重要,并且代表了 ACD 中的特定治疗靶点。
研究方案
该方案中使用的所有小鼠均具有 C57BL/6 遗传背景,保持在无特定病原体的条件下,并 随意提供食物和水。所有实验均获得四川大学华西医学中心动物福利伦理审查机构 (20210302059) 的批准。
1. 试剂和材料制备
- 0.5% DNFB 溶液作为敏化剂
- 为了使 10 只小鼠致敏,准备 1.1 mL 丙酮/橄榄油 4:1 (v/v) 混合物:混合 880 μL 丙酮和 220 μL 橄榄油,以允许 0.1 mL 的过量体积,以解决任何微小的体积损失。将 5 μL DNFB 添加到 1.1 mL 均质丙酮/橄榄油 4:1 混合物中。
注意:在致敏当天新鲜准备。丙酮/橄榄油混合物应在通风橱中制备。
- 为了使 10 只小鼠致敏,准备 1.1 mL 丙酮/橄榄油 4:1 (v/v) 混合物:混合 880 μL 丙酮和 220 μL 橄榄油,以允许 0.1 mL 的过量体积,以解决任何微小的体积损失。将 5 μL DNFB 添加到 1.1 mL 均质丙酮/橄榄油 4:1 混合物中。
- 0.2% DNFB 溶液作为挑战者
- 要攻击 10 只小鼠,请在步骤 1.1 中描述的 0.25 mL 匀浆丙酮/橄榄油 4:1 混合物中加入 0.5 μL DNFB。在致敏后攻击小鼠时,使用丙酮/橄榄油 4:1 混合物作为载体。
注意:丙酮/橄榄油混合物应在通风橱中制备。
- 要攻击 10 只小鼠,请在步骤 1.1 中描述的 0.25 mL 匀浆丙酮/橄榄油 4:1 混合物中加入 0.5 μL DNFB。在致敏后攻击小鼠时,使用丙酮/橄榄油 4:1 混合物作为载体。
- 水合氯醛作为麻醉剂
- 将 4 g 水合氯醛溶于 50 mL 磷酸盐缓冲盐水 (PBS) 中,制成 8% 的工作溶液。过滤并在 4 °C 下储存长达 3 个月。小鼠每克体重使用 5 μL。
- 50x 胶原酶 IV 原液
- 将 100 mg 胶原酶 IV 溶解在 1 mL 碱性 RPMI 1640 培养基(未补充抗生素或胎牛血清 [FBS])中,制成 100 mg/mL 原液。在 -20 °C 下以 100 μL 等分试样储存长达 6 个月。
- 1,000x DNase I 储备液
- 将 5 mg DNase I 溶于 1 mL 的 0.15 M NaCl 中,制成 5 mg/mL 的储备液。在 -20 °C 下以 100 μL 等分试样储存长达 6 个月。
- 停止缓冲区
- 将 1.681 g EDTA 溶解在 50 mL 碱性 RPMI 1640 培养基中,制成 100 mM 原液。在 4 °C 下储存长达 2 周。
- 洗涤介质
- 用 500 mL PBS 溶解 0.372 g EDTA 至终浓度为 2 mM,将 5 mL FBS 溶解至终浓度为 1%。过滤并在 4 °C 下储存长达 1 个月。
- 染色缓冲液
- 用 500 mL PBS 溶解 0.372 g EDTA 至终浓度为 2 mM,将 10 mL FBS 溶解至终浓度为 2%。过滤并在 4 °C 下储存长达 1 个月。
- 再刺激试剂
- 将 1 mg 佛波醇 12-肉豆蔻酸酯 13-乙酸酯 (PMA) 溶解在 20 mL DMSO 中,制成 50 μg/mL 原液 (500x),并在 -20 °C 下以 50 μL 等分试样储存。
- 在 7.75 mL DMSO 溶液 (4 mg/mL) 中稀释 250 μL 离子霉素,制成 500 μg/mL 储备液 (500x),并在 -20 °C 下以 50 μL 等分试样储存。
- 在 50 μL 中分装 1 mL 蛋白质转运抑制剂溶液(含有布雷菲德菌素 A),并将等分试样储存在 4 °C 下。
2. 小鼠 CHS 的诱导
- 在第 -5 天,通过腹膜内注射 400 mg/kg 水合氯醛麻醉小鼠。
- 使用宠物剃须刀,在小鼠腹部剃掉 2 厘米× 2 厘米的区域。
注意:避免刮伤鼠标皮肤;保持皮肤屏障的完整性完好无损。 - 用带有一次性吸头的微量移液器将 100 μL 0.5% DNFB 溶液轻轻均匀地涂抹在剃光的腹部上。让小鼠保持 5-10 秒,让一些溶剂蒸发。
- 在第 -4 天,重复步骤 2.1-2.3 进行另一次致敏。
注意:两次致敏活动比一次效果更好。 - 在第 0 天,使用带有一次性吸头的微量移液器用 20 μL 0.2% DNFB 攻击小鼠的右耳,并用与载体相同体积的丙酮/橄榄油 4:1 混合物处理左耳。
注意:用等体积的 DNFB 或载体挑战耳朵的背侧和腹侧。 - 在接下来的 3 天内,每天使用表盘测厚仪测量小鼠左右耳的耳朵厚度,并计算耳朵厚度的增加量:右耳厚度 - 左耳厚度。
注:与载体处理的耳朵相比,在 0.2% DNFB 攻击的小鼠耳朵中可以观察到耳朵厚度的逐渐增加。
3. CHS 小鼠样本采集
- 第 3 天,通过腹膜内注射 400 mg/kg 水合氯醛麻醉小鼠。等待 5-10 分钟,让小鼠处于昏迷状态,并在双后脚上轻轻捏住脚趾,以确认小鼠已深度麻醉。
- 使用相机为每只鼠标的每只耳朵拍摄一张照片。独立对耳垢(耳部脱屑)和发红(耳部红斑)进行评分,以评估炎症的严重程度,评分范围为 0 到 5:0,无;1、轻微;2、适度;3、标记;4、非常明显;5、最严重。
- 通过颈椎脱位对小鼠实施安乐死。切掉整个耳朵,用无菌锋利的剪刀和镊子解剖小鼠平行的引流淋巴结。将组织放入 6 孔板的一个孔中,该板放置在含有 5 mL 预冷 PBS 的冰上,用于酶或物理解离以产生单细胞悬液(补充图 S1A 和 补充图 S2A)。
- 对于组织学分析,将耳标本固定在 4% 多聚甲醛中,脱水,并将其包埋在石蜡中进行免疫组织化学染色,如其他地方所述17。
4. 耳单细胞悬液的制备
- 用两个弯曲的镊子捏住和撕裂切口末端,劈开耳朵的腹侧和背侧(补充图 S1B)。将它们放入含有 4.5 mL 消化缓冲液的 6 孔板的孔中,确保这些组织完全浸入消化缓冲液中(补充图 S1C)。
注:消化缓冲液由含有 10% FBS + 25 mM HEPES + 2 mg/mL 胶原酶 IV + 5 μg/mL DNase I 的 RPMI 1640 组成。 - 将耳小叶在 37 °C 细胞培养箱中孵育 20 分钟。用剪刀尽可能小地剪下耳叶,以促进组织消化(补充图 S1D),然后将样品放回培养箱中再放置 40 分钟。
注意:可在 40-50 分钟内实现高效消化。37 °C 的过度消化会影响细胞活力。 - 每孔添加 0.5 mL 终止缓冲液以中和胶原酶 IV 和 DNase I 的酶活性。在冰上执行下一步。
- 用一对弯曲的镊子将耳组织碎片转移到含有 70 μm 细胞过滤器的 50 mL 离心管中,并将整个体积的培养基移液到同一细胞过滤器中。
- 使用 1 mL 注射器柱塞的顶端破坏组织。在 70 μm 细胞过滤器上打圈按压,直到只剩下白色结缔组织(补充图 S1D)。
- 用 1,000 μL 洗涤培养基冲洗细胞过滤器两次。通过 40 μm 细胞过滤器将孔的整个体积转移到 50 mL 离心管中。将试管放在冰上。
5. 从引流淋巴结 (dLN) 制备单细胞悬液
- 用一对弯曲的镊子将淋巴结转移到 6 孔板孔顶部的 70 μm 细胞过滤器上(补充图 S2B)。使用 1 mL 注射器柱塞的顶端解离淋巴结。以圆周运动按压 70 μm 细胞过滤器,直到只剩下白色碎片(补充图 S2C)。
- 用 1,000 μL 洗涤介质冲洗细胞过滤器两次。将孔的整个体积转移到 5 mL 试管中。将试管放在冰上。
6. 在蛋白质转运抑制剂存在下,用 12-肉豆蔻酸酯 13-乙酸酯 (PMA)/离子霉素再刺激 Th-GM 亚群
- 将从耳朵和引流淋巴结样品中分离的细胞在 4 °C 下以 400 × g 离心 8 分钟,并弃去上清液。用 1,000 μL 洗涤培养基轻轻重悬沉淀。
- 收集每个样品的一小部分,以使用血细胞计数器计算来自耳朵和引流淋巴结的细胞总数。添加 0.04% 台盼蓝以测量细胞活力。
注:细胞活力应大于 60%,用于后续的 T 细胞刺激和分析。细胞密度可以是 1-5 × 106/mL。 - 在步骤 6.1 中离心细胞并弃去上清液。用 1,000 μL 含 2% FBS 的 RPMI 1640 培养基轻轻重悬沉淀,并将 1 mL 单细胞悬液(106 个细胞/mL)接种在 12 孔平底组织培养板中。
- 在含有 1 mL 上述单细胞悬液的 12 孔板中的每个孔中加入 2 μL 佛波醇 12-肉豆蔻酸酯 13-乙酸酯 (PMA)(终浓度 100 ng/mL)、2 μL 离子霉素(终浓度 1,000 ng/mL)和 1 μL 蛋白质转运抑制剂(含有布雷菲德菌素 A),并在 37 °C 下孵育 4 小时。
7. 通过细胞表面和细胞内染色分析 体内 产生的 Th-GM 亚群
- 使用移液管将刺激的细胞转移到 1.5 mL 离心管中。在室温下以 400 × g 离心离心管 8 分钟,弃去上清液。
- 用 1 mL 染色缓冲液洗涤细胞沉淀一次,然后离心沉淀细胞,如步骤 7.1 所述。在 0.5 mL 染色缓冲液中以 1-10 ×10 6/mL 的浓度重悬细胞。
- 将 0.5 μL 活力染料储备液(参见 材料表)添加到 0.5 mL 细胞悬液中并立即涡旋。将混合物在室温下避光孵育 10 分钟。用 1 mL 染色缓冲液洗涤细胞两次,并在步骤 7.1 中重复离心以沉淀细胞。
- 将沉淀重悬于 0.1 mL 染色缓冲液中。将 1 μL 抗 CD4 抗体(FITC 偶联)、1 μL 抗 CD44 抗体(APC 偶联)和 1 μL 抗 CD62L 抗体(PE/Cyanine7 偶联)添加到三个 0.1 mL 等分试样的细胞悬液中。立即涡旋并在室温下避光孵育 15 分钟。
- 重复步骤 7.3 中的洗涤和离心。
- 将沉淀重悬于 200 μL IC 固定缓冲液中,并在黑暗中孵育 20 分钟。同时,用 9 份蒸馏水稀释 1 份透化缓冲液 (10x) 来制备透化缓冲液 (1x)。用 1 mL 透化缓冲液 (1x) 洗涤细胞两次,在室温下以 600 × g 离心 5 分钟。
- 将沉淀重悬于 0.1 mL 透化缓冲液 (1x) 中,并加入抗 GM-CSF(PE 偶联,1 μL/检测)、IFN-γ(BV711 偶联,1 μL/检测)、IL-17A(BV421 偶联,1 μL/检测)和 IL-22(PerCP/Cyanine5.5 偶联,5 μL/检测)的抗体,并在室温下避光孵育 30 分钟。
- 重复步骤 7.6 中的洗涤和离心。
- 将细胞沉淀重悬于 200 μL PBS 中,并将悬浮液转移到圆底试管中。在流式细胞仪中运行染色的细胞。
8. 识别 Th-GM 子集的门控策略
- 使用补充图 S1 中所示的门控策略分析流式细胞术数据(有关所用软件的详细信息,请参阅材料表)。对于此处使用的软件,请下载并在计算机中进行设置。
- 通过单击 文件 |打开 |将 FCS 文件导入 软件,并通过选择 Rename 选项卡来注释每个样品的组和名称。
- 在 FSC 与 SSC 图(FSC 低 、SSC 低、P1)上选择淋巴细胞,以通过单击 密度图来排除在左下角发现的碎片和大尺寸、高粒度的髓样细胞,并将该图的 X 轴 显示为 FSC-A , 将 Y 轴 显示为 SSC-A。
- 双击 P1 中的事件以生成另一个密度图,并通过在此图中选择单元格高度和面积(X 轴为 FSC-A,Y 轴为 FSC-H)将单个单元格(显示为相关线,P2)与单元格聚集体分开。
- 双击 P2 中的事件以生成另一个密度图,并将该图的 X 轴 显示为 FSC-A ,将 Y 轴 显示为 SSC-A。使用 FVS 780 - 事件 (P3) 对活细胞群进行门控。
- 双击 P3 中的事件以生成下一个密度图(X 轴为 CD4-A,Y 轴为 SSC-A),并通过选择 CD4 + 群体 (P4) 来区分 CD4 T 细胞。
- 双击 P4 中的事件以生成另一个密度图(X 轴为 CD44-A,Y 轴为 CD62L-A),并通过选择该图的右上角群体(CD62L-CD44+,P5)来定义效应 T 辅助细胞。
9. 统计分析
- 执行统计分析,使用未配对的 t 检验比较两组。*P < 0.05,** P < 0.01,*** P < 0.001 和 **** P < 0.0001(SD ±平均值)。
结果
DNFB 诱导的小鼠 CHS(接触超敏反应)
为了在小鼠中诱导 CHS,小鼠被致敏并用 DNFB 施加到耳朵皮肤上进行攻击,如图 1A 所示。与载体处理的小鼠相比,DNFB 攻击小鼠的耳厚(表皮海绵体病的指标)显着增加(图 1B,第 1 天 70 对 3 μm,第 2 天 203 对 7.5 μm,第 3 天 276 对 5 μm)。攻击后 72 小时,小鼠的右耳出现红斑、结垢和增厚的迹象,而载体处理的耳朵没有表现出任何炎症迹象(图 1C)。DNFB 攻击组小鼠耳朵的结垢和发红评分高于载体处理的耳朵(图 1D)。
DNFB 攻击后表皮增厚增加和明显的炎性浸润
对 DNFB 处理皮肤的 H&E 染色切片的分析显示,与载体处理的皮肤相比,耳皮肤的表皮增厚增加(图 2A、B)。免疫组化结果显示,CD45 + (总造血细胞)、Ly6G + (中性粒细胞)和 F4 / 80 + (巨噬细胞)细胞在耳朵中的浸润在 DNFB 处理的皮肤中显着高于载体处理的组织(图 2C,D)。综上所述,DNFB 诱导了小鼠 ACD 的典型症状。
DNFB 致敏/激发免疫学模型中的 Th-GM 细胞亚群生成
我们假设半抗原特异性幼稚 Th 前体细胞在半抗原致敏/攻击免疫反应期间分化为表达 GM-CSF 的效应细胞。为了检验这一假设,通过流式细胞术进行细胞内染色,在 DNFB 致敏/攻击或 DNFB 致敏/载体攻击的耳朵中研究 Th 细胞分化(补充图 S3)。攻击后,平均每只小鼠大约有 4,000 个 CD4 + T 细胞和 1,898 个效应 CD4 + T 细胞(与载体处理的小鼠相比分别增加了 23.8 倍和 38.7 倍,补充图 S4)。在效应 Th 细胞中,即 Th-GM 中 GM-CSF + IFN-γ-IL-17A-IL-22-的产生在 DNFB 致敏/攻击的耳朵中高出 3 倍以上(25.6%,而载体攻击的耳朵中为 8.3%,图 3A,B)。与载体攻击的皮肤相比,DNFB 攻击的耳朵中效应 CD4 T 细胞的频率增加了近 10 倍,表明半抗原攻击后 Th 细胞活化的旺盛(图 4A、B)。皮肤浸润中 Th-GM 细胞亚群的变化部分反映在 dLN 中,尽管这种增加不如组织中的增加显着(3.7 倍,图 4C,D)。因此,Th-GM 细胞亚群在这种半抗原致敏/攻击免疫学模型中成功得到增强。

图 1:DNFB 诱导的小鼠皮肤病炎症表型类似于人类接触性皮炎。 (A) 拟议的 DNFB 实验的示意图。C57BL/6J 小鼠在第 -5 天和第 -4 天通过腹部涂抹 DNFB 致敏,第 0 天用 DNFB 或耳上载体攻击,并在第 1 、 2 和 3 天进行评估。(B) 载体处理或 DNFB 攻击小鼠的耳朵肿胀 (每组 n = 6)。(C) 第 3 天载体或 DNFB 攻击小鼠全耳的代表性照片。(D) 显示用 DNFB 或载体攻击的耳朵的硬壳和发红评分(每组 n = 6)。 P < 0.001 和 **** P < 0.0001(SD ±平均值)。数据代表三个独立实验,每组 6 个样品。缩写:DNFB = 2,4-二硝基氟苯。 请单击此处查看此图的较大版本。
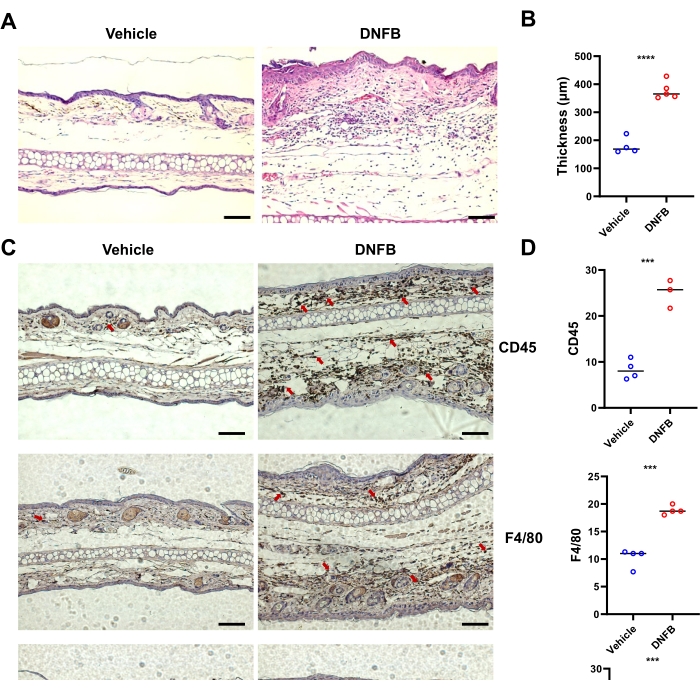
图 2:DNFB 致敏/攻击诱导的小鼠组织学炎症的典型改变。 (A) 代表指定组的个体小鼠的耳皮肤 H&E 染色。(B) 在条形图显示的 H&E 染色图像上测量的表皮增厚。(C) DNFB 或载体攻击小鼠耳朵中 CD45 、 F4/80 和 Ly6G 的免疫组织化学。红色箭头表示阳性染色的细胞。(D) 通过对每只小鼠 3 个或 4 个盲法不同切片的棕色染色进行计数,对 CD45、F4/80 或 Ly6G 阳性细胞进行定量。 P < 0.001,**** P < 0.0001(SD ±平均值)。数据代表每组 3-5 只小鼠的两次独立实验。比例尺 = 1,000 μm (A, C)。缩写:DNFB = 2,4-二硝基氟苯;H&E = 苏木精和伊红。 请单击此处查看此图的较大版本。

图 3:小鼠耳皮肤中的 Th-GM 亚群。 (A) 用 DNFB 或载体攻击后 3 天评估的小鼠耳皮肤中 Th-GM 亚群的流式细胞术。(B) 效应 CD4+ T 细胞内 Th-GM 的频率。每个元件代表一个单独的鼠标。 P < 0.001 和 **** P < 0.0001(SD ±平均值)。数据代表每组中的 6 个样本。缩写:DNFB = 2,4-二硝基氟苯;GM-CSF = 粒细胞-巨噬细胞集落刺激因子;Th-GM = GM-CSF 产生 T 辅助物。 请单击此处查看此图的较大版本。
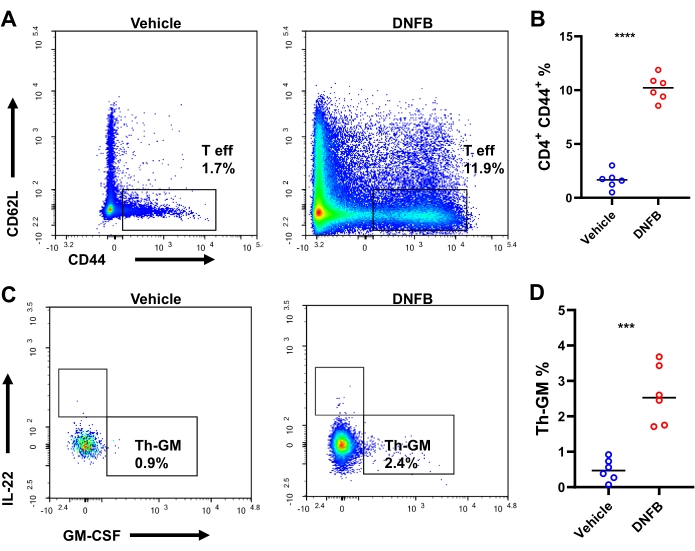
图 4:小鼠耳引流淋巴结中的 Th-GM 亚群。(A) 用 DNFB 或载体攻击后 3 天评估小鼠耳引流淋巴结中效应 CD4+ T 细胞的流式细胞术。(B) CD4+ T 细胞中效应 CD4+ T 细胞的频率。(C) 在攻击后 2 天评估用 DNFB 或载体攻击的小鼠耳引流淋巴结中 Th-GM 亚群的流式细胞术。(D) 耳引流淋巴结中效应 CD4 + T 细胞中 Th-GM 亚群的百分比。 P < 0.001 和 **** P < 0.0001(SD ±平均值)。数据代表每组中的 6 个样本。缩写:DNFB = 2,4-二硝基氟苯;GM-CSF = 粒细胞-巨噬细胞集落刺激因子;Th-GM = 产生 GM-CSF 的 T 辅助物;T eff = 效应 CD4+ T 细胞。请单击此处查看此图的较大版本。
补充图 S1:小鼠耳皮的加工。 (A) 从 C57BL/6J 鼠标上切下的耳朵。(B) 劈开耳朵的背侧和腹侧。(C) 将背侧和腹侧浸入消化缓冲液中。(D) 带剪刀的小耳传。(E) 解离后留在细胞过滤器上的头发和白色结缔组织。 请点击此处下载此文件。
补充图 S2:小鼠耳淋巴结的处理。 (A) 解剖 C57BL/6J 小鼠的耳淋巴结。红色箭头表示耳淋巴结的位置。(B) 切碎前,将耳廓淋巴结转移到 6 孔板孔顶部的 70 μm 细胞过滤器中。(C) 切碎后留在细胞过滤器上的碎屑。缩写:DNFB = 2,4-二硝基氟苯。 请点击此处下载此文件。
补充图 S3:用于分析耳廓淋巴结中 Th-GM 亚群的门控策略。 首先,根据粒度和大小对淋巴细胞进行门控 (FSC 低 SSC 低,P1),并在 FSC-A 与 FSC-H 图 (P2) 中选择单细胞。然后,通过设门 FVS780- 群体 (P3) 来消除死细胞。第三,将效应 CD4 T 细胞鉴定为 CD4 + - CD44 + 群体 (P5)。最后,通过细胞内细胞因子表达来区分 Th-GM 亚群,即 IFN-γ- IL-17A- IL-22- GM-CSF+ (P7)。缩写:GM-CSF = 粒细胞-巨噬细胞集落刺激因子;Th-GM = 产生 GM-CSF 的 T 辅助物;IFNγ = 干扰素-γ。 请点击此处下载此文件。
补充图 S4:攻击后小鼠组织中表达 GM-CSF 的总效应 CD4 T 细胞的组成。 (A) 表达 GM-CSF 的效应子 Th 细胞在总 GM-CSF + CD4 + CD44 + 细胞中的比例 (%)。(B) 攻击后小鼠耳朵中活 CD4+ CD44+ T 细胞中设门的 GM-CSF 、 IFN-γ 和 IL-17A 表达的流式细胞术。缩写:GM-CSF = 粒细胞-巨噬细胞集落刺激因子;Th-GM = 产生 GM-CSF 的 T 辅助物;IFNγ = 干扰素-γ。 请点击此处下载此文件。
讨论
该方案提供了一种简单的体内测定法来分析 Th-GM 细胞亚群的产生和扩增。在小鼠中使用由半抗原或抗原引发的 T 细胞介导的疾病模型,模拟人类的这种激活是必不可少的。DNFB 是一种小分子半抗原,在体内触发 T 细胞免疫反应方面比肽或蛋白质抗原更经济、更省时 18,19。在疾病过程中,我们观察到与其他半抗原(包括 2,4,6-三硝基氯苯 (TNCB)、恶唑嗪 (OXA) 或异硫氰酸荧光素 (FITC))诱导相比,DNFB 攻击的耳肿胀反应的最大幅度,至少在具有 C57BL/6J 遗传背景的小鼠中(数据未显示),尽管据报道上述其他三种试剂在小鼠中产生接触敏感性14.研究人员必须确定适当的小鼠品系和半抗原以完全诱导疾病。
在处理较小尺寸的小鼠组织时,耳朵细胞产量低是最常遇到的问题之一。这可能是由于胶原酶类型的酶活性无效或用于消化的任何过期试剂导致酶消化不完全引起的。为了克服这个问题,我们使用 IV 型胶原酶进行耳部皮肤消化,因为它在有效解离发炎的耳朵方面优于其他胶原酶,包括胶原酶 I。从耳朵中分离的细胞的较高活力有利于在用 PMA/离子霉素/蛋白质转运抑制剂再刺激后细胞因子的细胞内积累。此外,用无菌的 1 M 氯化钙原液将用于再刺激的 RPMI 1640 培养基中的钙浓度调节至 1.5 mM,并且再刺激时间可延长至 6 小时,以实现 T 细胞中细胞因子的最大产生20。
多参数流式细胞术可在自身免疫反应的情况下准确鉴定和定量 Th-GM 细胞亚群。使用细胞仪采集数据时,设置未染色和单染样品以确定适当的 PMT 电压并调整补偿。有关使用流式细胞术对免疫细胞进行扩展分析的信息,读者可以参考公认的流式细胞术使用指南21,了解有关补偿调整、抗体染色设置和设门策略的更多信息。值得注意的是,Th-GM 亚群被认为与其他传统谱系平行,并在效应 CD4 T 细胞中鉴定为 GM-CSF+ IFN-γ-IL-17A-IL-22-(补充图 S1)。应应用这种门控策略来分析流式细胞术数据,以研究 Th-GM 细胞生物学。
总之,本文提出了一种使用流式细胞术分析 DNFB 诱导的小鼠接触超敏反应中新型 Th-GM 谱系的方案。该方法可用于进一步研究 Th-GM 细胞的生物学和以 GM-CSF 为中心的各种病症(如过敏性接触性皮炎)治疗策略的药理学研究。
披露声明
作者声明他们没有相互竞争的经济利益。
致谢
这项工作得到了国家自然科学基金(No. 81602763, 81803142, 82003347)、中国博士后科学基金优秀研究员计划(No. 2017T100700)和中国博士后科学基金正式研究员计划(No. 2016M592673)的支持。作者感谢 Yan Wang 和 Meng-Li Zhu(四川大学华西医院核心设施)在本研究中对流式细胞术的技术支持。
材料
| Name | Company | Catalog Number | Comments |
| 2,4-dinitrofluorobenzene | BT REAGENT | P0001746 | CAS NO: 70-34-8 |
| Acetone | CHRON CHEMICALS | / | 67-64-1 |
| anti-CD4 antibody | Biolegend | 300506 | 1:100 Diluted |
| anti-CD44 antibody | Biolegend | 103012 | 1:100 Diluted |
| anti-CD62L antibody | Biolegend | 104417 | 1:100 Diluted |
| anti-GM-CSF antibody | BD Bioscience | 554507 | 1:100 Diluted |
| anti-IFN-γ antibody | Biolegend | 505836 | 1:100 Diluted |
| anti-IL-17A antibody | BD Bioscience | 563354 | 1:100 Diluted |
| anti-IL-22 antibody | Biolegend | 516411 | 5 µL/test |
| CD45 | Biolegend | 103101 | 1:200 Diluted |
| Chloral hydrate | CHRON CHEMICALS | / | 302-17-0 |
| Dial thickness gauge (0.01 mm type) | PEACOCK | G-1A | / |
| DMSO | LIFESCIENCES | D8371 | 67-68-5 |
| EDTA Na2 | Solarbio | E8030 | 6381-92-6 |
| F4/80 | Biolegend | 123102 | 1:200 Diluted |
| Fixable Viability Stain 780 | BD Bioscience | 565388 | 1:1,000 Diluted, viability dye |
| Flow cytometer | BD Bioscience | BD FACS ARIA II SORP | / |
| GraphPad Prism | GraphPad Software | Prism 7 | Software for statistics and graphing |
| Intracelluar Fixtation and Permeablization Buffer Set | Thermo Fisher | 88-8824-00 | prepared freshly |
| Ionomycin | Sigma-Aldrich | 407951 | CAS NO: 56092-81-0 |
| Ly6G | Biolegend | 127602 | 1:200 Dilutied |
| NovoExpress | Agilent | / | Software for flow cytometry data analysis; https://www.agilent.com.cn/zh-cn/product/research-flow-cytometry/flow-cytometry-software/novocyte-novoexpress-software-1320805 |
| Olive oil | YUANYE BIO | S30503 | 8001-25-0 |
| PMA | Sigma-Aldrich | P8139 | CAS NO: 16561-29-8 |
| Protein Transport Inhibitor (Containing Brefeldin A) | BD Bioscience | 555029 | 1 µL/mL |
参考文献
- Rasouli, J., et al. A distinct GM-CSF(+) T helper cell subset requires T-bet to adopt a TH1 phenotype and promote neuroinflammation. Science Immunology. 5 (52), (2020).
- Galli, E., et al. GM-CSF and CXCR4 define a T helper cell signature in multiple sclerosis. Nature Medicine. 25 (8), 1290-1300 (2019).
- Komuczki, J., et al. Fate-mapping of GM-CSF expression identifies a discrete subset of inflammation-driving T helper cells regulated by cytokines IL-23 and IL-1beta. Immunity. 50 (5), 1289-1304 (2019).
- Sheng, W., et al. STAT5 programs a distinct subset of GM-CSF-producing T helper cells that is essential for autoimmune neuroinflammation. Cell Research. 24 (12), 1387-1402 (2014).
- Herndler-Brandstetter, D., Flavell, R. A. Producing GM-CSF: a unique T helper subset. Cell Research. 24 (12), 1379-1380 (2014).
- Lu, Y., Fu, X. Y., Zhang, Y. In vitro differentiation of mouse granulocyte-macrophage-colony-stimulating Factor (GM-CSF)-producing T Helper (THGM) Cells. Journal of Visualized Experiments: JoVE. (139), e58087(2018).
- Hu, Y., et al. Interleukin-1beta-induced IRAK1 ubiquitination is required for TH-GM-CSF cell differentiation in T cell-mediated inflammation. Journal of Autoimmunity. 102, 50-64 (2019).
- Reynolds, G., et al. Synovial CD4+ T-cell-derived GM-CSF supports the differentiation of an inflammatory dendritic cell population in rheumatoid arthritis. Annals of the Rheumatic Diseases. 75 (5), 899-907 (2016).
- Al-Mossawi, M. H., et al. Unique transcriptome signatures and GM-CSF expression in lymphocytes from patients with spondyloarthritis. Nature Communation. 8 (1), 1510(2017).
- Wicks, I. P., Roberts, A. W. Targeting GM-CSF in inflammatory diseases. Nature Reviews Rheumatology. 12 (1), 37-48 (2016).
- Scheinman, P. L., et al. Contact dermatitis. Nature Reviews Disease Primers. 7 (1), 38(2021).
- Pesonen, M., Koskela, K., Aalto-Korte, K. Contact urticaria and protein contact dermatitis in the Finnish Register of Occupational Diseases in a period of 12 years. Contact Dermatitis. 83 (1), 1-7 (2020).
- Vocanson, M., Hennino, A., Rozieres, A., Poyet, G., Nicolas, J. F. Effector and regulatory mechanisms in allergic contact dermatitis. Allergy. 64 (12), 1699-1714 (2009).
- Gaspari, A. A., Katz, S. I., Martin, S. F. Contact hypersensitivity. Current Protocols in Immunology. 113, 1-7 (2016).
- Manresa, M. C. Animal models of contact dermatitis: 2,4-dinitrofluorobenzene-induced contact hypersensitivity. Methods in Molecular Biology. 2223, 87-100 (2021).
- Kim, J. H., et al. CD1a on Langerhans cells controls inflammatory skin disease. Nature Immunology. 17 (10), 1159-1166 (2016).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods in Enzymology. 533, 225-233 (2013).
- Achuthan, A., et al. Cytokine-induced acute inflammatory monoarticular arthritis. Methods in Molecular Biology. 1784, 215-223 (2018).
- Stromnes, I. M., Goverman, J. M. Active induction of experimental allergic encephalomyelitis. Nature Protocols. 1 (4), 1810-1819 (2006).
- Kruisbeek, A. M., Shevach, E., Thornton, A. M. Proliferative assays for T cell function. Current Protocols in Immunology. , Chapter 3, Unit 3 (2004).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (second edition). European Journal of Immunology. 49 (10), 1457(2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。