Method Article
接触過敏症マウスモデルにおける顆粒球マクロファージコロニー刺激因子産生Tヘルパー細胞の解析
要約
ここでは、顆粒球-マクロファージのコロニー刺激因子産生Tヘルパーサブセットを in vivoで解析する簡単で標準化された方法を紹介します。
要約
従来のTh1/Th2/Th17/Treg系統と並行して、顆粒球マクロファージコロニー刺激因子産生Tヘルパー(Th-GM)細胞は、ヒトおよびマウスのTヘルパー細胞(GM-CSF+ IFN-γ-IL-17A-IL-22-エフェクターCD4+ T細胞)の別個のサブセットとして同定されています。接触過敏症(CHS)は、ヒトのアレルギー性接触皮膚炎(ACD)の優れた動物モデルと考えられており、無傷のT細胞媒介性免疫応答を示します。in vivoでのT細胞依存性免疫応答におけるTh-GM細胞サブセットを解析するための標準化された包括的なアッセイを提供するために、反応性、低分子量、有機ハプテン、2,4-ジニトロフルオロベンゼン(DNFB)による感作/チャレンジによりマウスCHSモデルを誘導しました。ハプテンによる免疫時に生成されたエフェクターCD4+ T細胞のTh-GMサブセットをフローサイトメトリーで解析しました。DNFB誘導CHSマウスモデルでは、Th-GMが主に病変やリンパ節に拡大していることがわかった。この方法は、Th-GM細胞の生物学をさらに研究し、ACDなどのさまざまな条件でGM-CSFを中心とした治療戦略の薬理学的研究に適用することができます。
概要
顆粒球マクロファージコロニー刺激因子(GM-CSF)産生Tヘルパー細胞であるTh-GMサブセットは、ヒトおよびマウスのTヘルパー細胞の別個のサブセットとして浮上しており、シングルセルRNA分析、マスサイトメトリー、およびGM-CSF運命マッパマウス1,2,3によって同定された「GM-CSF発現のみ」(GM-CSF+ IFN-γ-IL-17A-IL-22-)CD4 T細胞を含むと考えられている.2014年、Shengらは、Th-GMサブセットのシグナルトランスデューサーおよび転写活性化因子5(STAT5)プログラミングを報告し、「Th-GM」サブセットを初めて概念化しました4,5。Th-GM細胞は、GM-CSF、IL-2、TNF-α、IL-3、CCL20、およびケモカイン受容体C-X-Cケモカイン受容体型(CXCR)4またはCXCR6 1,2のサイトカイン発現によって特徴付けられます。STATおよび/またはNF-κB経路は、Th-GM系統の分化に不可欠です。TCR刺激6の存在下でIL-7を用いてナイーブCD4 T細胞をTh-GM細胞に分化させるin vitro法が確立された。一方、サイトカインIL-23およびIL-1βは、Th-GM細胞の発現と病原性をex vivoで維持することが示されました3,7。
Th-GM細胞の上昇は、多発性硬化症や関節リウマチなどのいくつかの自己免疫疾患と関連しており2,8,9、自己免疫の病因における潜在的な役割を示唆しています10。蓄積された証拠は、GM-CSFが炎症メディエーターとして機能することを示唆しています。CD4+ T細胞でCsf2(GM-CSFをコードする遺伝子)を遺伝的に過剰発現させたマウスは、中枢神経系への食細胞の浸潤を伴う神経障害を自発的に発症しました。T細胞移植性大腸炎モデルでは、Csf2-/-T細胞のRag1-/-マウスへの養子移植により、疾患の臨床的および組織病理学的特徴が大幅に減少しました。しかし、ACDなどのアレルギー疾患におけるTh-GMサブセットの役割についての報告はほとんどありません。
ACDは、最も一般的な炎症性皮膚疾患の1つであり、仕事や生活環境で高い有病率を示しています11,12。これは、感作と誘発という2つの時間的にセグメント化されたフェーズで発生する無傷の免疫回路によって媒介されるIV型の遅延型過敏反応です。ヒトACDは、感作につながるいくつかの化学物質(ハプテンまたは金属)への曝露によって引き起こされます。この段階では、T細胞媒介性応答は、抗原提示細胞によって提示されるハプテンタンパク質複合体によってプライミングされます。その後、同じハプテンに曝露すると、ハプテン特異的エフェクターT細胞とメモリーT細胞が再活性化され、皮膚に局在します。このプロセスには、さまざまな免疫細胞集団の浸潤が含まれます。この急性炎症反応は誘発として知られており、病変13が完全に発生します。ヒトACDは、接触過敏症(CHS)14の動物モデルを用いて研究することができる。
反応性、低分子量、有機ハプテン、2,4-ジニトロフルオロベンゼン(DNFB)によって誘導されたCHSモデルは、ACDの病理学だけでなく、潜在的な治療介入の研究に利用されている一般的に使用されるマウスモデルです15,16。したがって、このT細胞依存性モデルは、アレルギー疾患におけるTh-GMサブセットの生成を研究するために適用できます。ここでは、DNFBを用いてCHSのマウスモデルを誘導し、病変およびドレーンリンパ節におけるTh-GMの生成を解析し、Th-GMサブセットは主に同じハプテンに再曝露すると拡大することを見出しました。このことは、Th-GMサブセットがACDの発症に不可欠であり、ACDの特定の治療標的を表していることを示唆しています。
プロトコル
このプロトコルで利用されたすべてのマウスは、C57BL/6遺伝的背景を持ち、特定の病原体のない条件下で飼育され、食物と水 を自由に与えられました。すべての実験は、四川大学(20210302059)のWest China Medical Centerの動物福祉倫理審査機関によって承認されました。
1. 試薬および材料の準備
- 増感剤としての0.5% DNFB溶液
- 10匹のマウスの感作のために、1.1 mLのアセトン/オリーブオイル4:1(v / v)混合物を調製します:880 μLのアセトンと220 μLのオリーブオイルを混合して、0.1 mLの過剰容量で軽微な体積損失を考慮できるようにします。5 μL の DNFB を 1.1 mL の均質化アセトン/オリーブオイル 4:1 混合物に加えます。
注:感作の日に新たに準備してください。アセトン/オリーブオイルの混合物は、ドラフトで調製する必要があります。
- 10匹のマウスの感作のために、1.1 mLのアセトン/オリーブオイル4:1(v / v)混合物を調製します:880 μLのアセトンと220 μLのオリーブオイルを混合して、0.1 mLの過剰容量で軽微な体積損失を考慮できるようにします。5 μL の DNFB を 1.1 mL の均質化アセトン/オリーブオイル 4:1 混合物に加えます。
- 0.2% DNFBソリューション 挑戦者
- 10匹のマウスにチャレンジするには、ステップ1.1で説明した均質化されたアセトン/オリーブオイル4:1混合物0.25 mLに0.5 μLのDNFBを加えます。アセトン/オリーブオイル4:1混合物を、感作後のマウスに挑戦する際の媒体として使用します。
注:アセトン/オリーブオイルの混合物は、ドラフトで調製する必要があります。
- 10匹のマウスにチャレンジするには、ステップ1.1で説明した均質化されたアセトン/オリーブオイル4:1混合物0.25 mLに0.5 μLのDNFBを加えます。アセトン/オリーブオイル4:1混合物を、感作後のマウスに挑戦する際の媒体として使用します。
- 麻酔薬としてのクロラール水和物
- 4 gのクロラール水和物を50 mLのリン酸緩衝生理食塩水(PBS)に溶解して、8%の作業溶液を作ります。ろ過し、4°Cで最大3ヶ月間保存します。マウスには体重1gあたり5μLを使用してください。
- 50x コラゲナーゼIVストック
- 100 mgのコラゲナーゼIVを1 mLの塩基性RPMI 1640培地(抗生物質またはウシ胎児血清[FBS]を添加していない)に溶解して、100 mg/mLのストックを作ります。-20°Cで100μLのアリコートに最大6ヶ月間保存してください。
- 1,000x DNase Iストック
- 5 mg の DNase I を 1 mL の 0.15 M NaCl に溶解して、5 mg/mL のストック液を調製します。-20°Cで100μLのアリコートに最大6ヶ月間保存してください。
- ストップバッファ
- 1.681 g の EDTA を 50 mL の塩基性 RPMI 1640 培地に溶解して、100 mM ストックを調製します。4°Cで最大2週間保存してください。
- ウォッシュメディウム
- 0.372 g の EDTA を最終濃度 2 mM に、5 mL の FBS を最終濃度 1% に 500 mL の PBS に溶解します。ろ過し、4°Cで最大1か月間保存します。
- 染色バッファー
- 0.372 g の EDTA を最終濃度 2 mM に、10 mL の FBS を 500 mL の PBS で最終濃度 2% に溶解します。ろ過し、4°Cで最大1か月間保存します。
- 再刺激試薬
- 1 mgのホルボール12-ミリスチン酸13-アセテート(PMA)を20 mLのDMSOに溶解して50 μg/mLのストック(500x)を調製し、-20°Cで50 μLのアリコートで保存します。
- 250 μL のイオノマイシンを 7.75 mL の DMSO 溶液 (4 mg/mL) に希釈して 500 μg/mL のストック (500x) を調製し、50 μL アリコートで -20 °C で保存します。
- 1 mLのタンパク質輸送阻害剤溶液(ブレフェルジンAを含む)を50 μLに分注し、アリコートを4°Cで保存します。
2. マウスにおけるCHSの誘導
- -5日目に、400 mg / kgのクロラール水和物を腹腔内に注射してマウスに麻酔をかけます。
- ペットのシェーバーを使用して、マウスの腹部の2cm×2cmの領域を剃ります。
注意: マウスの皮膚を傷つけないでください。皮膚バリアの完全性を損なわないようにします。 - 100 μL の 0.5% DNFB 溶液を、使い捨てチップ付きのマイクロピペットで、剃毛した腹部に優しく均一に塗ります。マウスを5〜10秒間保持して、溶媒の一部を蒸発させます。
- -4日目に、別の感作のためにステップ2.1〜2.3を繰り返します。
注:2つの感作イベントは1つよりも効果的です。 - 0日目に、使い捨てチップ付きのマイクロピペッターを使用して、マウスの右耳に0.2%DNFBの20μLを添加し、ビヒクルと同じ量のアセトン/オリーブオイル4:1混合物で左耳を治療します。
注意: 耳の背側と腹側を、同量のDNFBまたはビヒクルで挑戦します。 - 次の3日間で、ダイヤル厚さゲージを使用してマウスの右耳と左耳の耳の厚さを毎日測定し、耳の厚さの増加を計算します:右耳の厚さ-左耳の厚さ。
注:耳の厚さの段階的な増加は、ビヒクルで治療された耳と比較して、0.2%DNFBチャレンジマウスの耳で観察される可能性があります。
3. CHSマウスのサンプル採取
- 3日目に、400 mg / kgのクロラール水和物の腹腔内注射によりマウスに麻酔をかけます。マウスが意識不明の状態になるまで5〜10分待ち、マウスが深く麻酔をかけられていることを確認するために、両後足でつま先を優しくつまみます。
- カメラを使用して、マウスごとに各耳の写真を撮ります。外皮 (耳のスケーリング) と耳の発赤 (耳の紅斑) を個別に採点して、炎症の重症度を 0 から 5: 0 のスケールで評価します。1、わずか;2、中程度;3、マークされています。4、非常にマークされています。5、最も深刻です。
- 子宮頸部脱臼によってマウスを安楽死させます。耳全体を切り取り、滅菌済みの鋭利なハサミと鉗子を使用してマウスの平行なドレナージリンパ節を解剖します。5 mLの予冷PBSを含む氷上に置いた6ウェルプレートの1ウェルに組織を1ウェル入れて、酵素的または物理的解離を行い、単一細胞懸濁液を生成します(補足図S1A および 補足図S2A)。
- 組織学的解析のためには、耳標本を4%パラホルムアルデヒドで固定し、脱水し、他の場所で述べたように、免疫組織化学的染色のためにパラフィンに包埋する17。
4. 耳からの単一細胞懸濁液の調製
- 2つの湾曲した鉗子で切り口をつまんで引き裂くことにより、耳の腹側と背側を分割します(補足図S1B)。4.5 mLの消化バッファーが入った6ウェルプレートのウェルにマウスを入れ、これらの組織が消化バッファーに完全に浸されていることを確認します(補足図S1C)。
注:消化バッファーは、10% FBS + 25 mM HEPES + 2 mg/mL コラゲナーゼ IV + 5 μg/mL DNase I を含む RPMI 1640 で構成されていました。 - 耳飾りを37°Cの細胞培養インキュベーターで20分間インキュベートします。組織の消化を容易にするために、ハサミで耳の弁尖をできるだけ小さく切り(補足図S1D)、サンプルをインキュベーターにさらに40分間戻します。
注:効率的な分解は40〜50分以内に達成できます。37°Cでの過剰消化は細胞の生存率に影響を与えます。 - ウェルあたり0.5 mLのストップバッファーを添加して、コラゲナーゼIVおよびDNase Iの酵素活性を中和します。
- 一対の湾曲した鉗子で耳組織の断片を70μmの細胞ストレーナーが入った50mLの遠心分離チューブに移し、培地の全容量を同じ細胞ストレーナーにピペットで移します。
- 1 mLシリンジプランジャーの上端を使用して組織を破壊します。.白い結合組織だけが残るまで、70 μmのセルストレーナーに対して円を描くように押し込みます(補足図S1D)。
- 細胞ストレーナーを1,000 μLの洗浄液で2回すすぎます。ウェルの全容積を40 μmのセルストレーナーを介して50 mLの遠心分離チューブに移します。チューブを氷の上に保ちます。
5. ドレナージリンパ節(dLN)からの単一細胞懸濁液の調製
- 一対の湾曲した鉗子でリンパ節を6ウェルプレートのウェルの上にある70μmの細胞ストレーナーに移します(補足図S2B)。1 mLシリンジプランジャーの上端を使用してリンパ節を解離します。.白い破片だけが残るまで、70 μmのセルストレーナに対して旋回運動を押し込みます(補足図S2C)。
- 細胞ストレーナーを1,000 μLの洗浄液で2回すすぎます。ウェルの全容量を5mLチューブに移します。チューブを氷の上に保ちます。
6. タンパク質輸送阻害剤の存在下での12-ミリスチン酸13-酢酸(PMA)/イオノマイシンによるTh-GMサブセットの再刺激
- 耳および排液リンパ節サンプルから単離した細胞を400 × g 、4°Cで8分間遠心分離し、上清を廃棄する。ペレットを1,000μLの洗浄液で穏やかに再懸濁します。
- 各サンプルのごく一部を採取し、血球計算盤を使用して耳とドレナージリンパ節に由来する細胞の総数をカウントします。0.04%トリパンブルーを添加して細胞生存率を測定します。
注:細胞生存率は、その後のT細胞の刺激および分析のために60%以上である必要があります。細胞密度は1〜5×106 / mLであり得る。 - ステップ6.1で細胞を遠心分離し、上清を捨てます。2% FBSを含む1,000 μLのRPMI 1640培地でペレットを穏やかに再懸濁し、12ウェル平底組織培養プレートに1 mLのシングルセル懸濁液(106 細胞/mL)を播種します。
- 上記の1 mLのシングルセル懸濁液を含む12ウェルプレートの各ウェルに、2 μLのホルボール12ミリスチン酸13-酢酸(PMA)(最終濃度100 ng/mL)、2 μLのイオノマイシン(最終濃度1,000 ng/mL)、および1 μLのタンパク質輸送阻害剤(ブレフェルジンAを含む)を1 μL加え、37°Cで4時間インキュベートします。
7. 細胞表面染色および細胞内染色による in vivo で作製したTh-GMサブセットの解析
- 刺激した細胞をピペットを使用して1.5 mLの遠心チューブに移します。遠心チューブを室温で400 × g で8分間遠心分離し、上清を捨てます。
- 細胞ペレットを1 mLの染色バッファーで1回洗浄し、ステップ7.1で説明したように遠心分離により細胞をペレット化します。細胞を1-10 × 106/mLで0.5 mLの染色緩衝液に再懸濁します。
- 0.5 mLの細胞懸濁液に0.5 μLの生菌色素ストック溶液( 材料表を参照)を直ちに加え、ボルテックスします。混合物を暗所で室温で10分間インキュベートします。1 mLの染色バッファーで細胞を2回洗浄し、ステップ7.1の遠心分離を繰り返して細胞をペレット化します。
- ペレットを0.1 mLの染色緩衝液に再懸濁します。抗CD4抗体(FITC標識)1 μL、抗CD44抗体(APC標識)1 μL、抗CD62L抗体(PE/シアニン7標識)1 μLを細胞懸濁液の0.1 mLアリコート3種に加えます。すぐにボルテックスし、光から保護して室温で15分間インキュベートします。
- ステップ7.3の洗浄と遠心分離を繰り返します。
- ペレットを200 μLのIC固定バッファーに再懸濁し、暗所で20分間インキュベートします。その間に、透過化緩衝液1部(10倍)を9部の蒸留水で希釈することにより、透過化緩衝液(1x)を調製します。細胞を1 mLの透過化バッファー(1x)で2回、600 × g で室温で5分間遠心分離します。
- GM-CSF(PE-標識、1 μL/試験)、IFN-γ(BV711標識、1 μL/試験)、IL-17A(BV421標識、1 μL/試験)、IL-22(PerCP/Cyanine5.5-標識、5 μL/試験)に対する抗体を含む0.1 mLの透過化緩衝液(1x)にペレットを再懸濁し、室温で暗所で30分間インキュベートします。
- ステップ7.6の洗浄と遠心分離を繰り返します。
- 細胞ペレットを200μLのPBSに再懸濁し、懸濁液を丸底試験管に移します。染色した細胞をフローサイトメーターで分析します。
8. Th-GMサブセットを特定するためのゲーティング戦略
- フローサイトメトリーのデータ(使用したソフトウェアの詳細については 、資料の表 を参照)を 、補足図S1に示すゲーティング戦略を用いて解析します。ここで使用するソフトウェアについては、ダウンロードしてコンピューターにセットアップします。
- フローサイトメトリーのデータをインポートするには、 File |オープン |FCSファイルをソフトウェアにインポート し、[ Rename ]タブを選択して各サンプルのグループと名前に注釈を付けます。
- FSC 対 SSC プロット (FSC 低 SSC 低、P1) でリンパ球を選択し、左下隅に見つかった破片と、サイズが大きく粒度の高い骨髄細胞を除外するには、 密度プロットをクリックし、このプロットの X 軸 を FSC-A 、 Y 軸 を SSC-A として表示します。
- P1 のイベントをダブルクリックして別の密度プロットを生成し、このプロットでセルの高さと面積 (X 軸 を FSC-A 、 Y 軸 を FSC-H) を選択して、単一セル (相関線 P2 として表示) をセル集約から分離します。
- P2 のイベントをダブルクリックして別の密度プロットを生成し、このプロットの X 軸 を FSC-A 、 Y 軸 を SSC-A として表示します。FVS 780- イベント(P3)を使用して生存細胞集団をゲートします。
- P3 のイベントをダブルクリックして、次の密度プロット ( X 軸 を CD4-A 、 Y 軸 を SSC-A) を生成し、CD4+ 集団 (P4) を選択して CD4 T 細胞を区別します。
- P4 のイベントをダブルクリックすると、別の密度プロット (X 軸が CD44-A、Y 軸が CD62L-A) が生成され、このプロットの右上の母集団 (CD62L- CD44+, P5) を選択して、エフェクター T ヘルパー細胞を定義します。
9. 統計分析
- 対応のない t検定を使用して2つのグループを比較し、統計分析を実行します。*P < 0.05、** P < 0.01、*** P < 0.001、および **** P < 0.0001 (平均 SD ±)。
結果
マウスにおけるDNFB誘導性CHS(接触過敏症)
マウスでCHSを誘導するために、 図1Aに示すように、マウスを感作し、DNFBを耳の皮膚に適用して挑戦しました。表皮海綿症の指標である耳の厚さは、ビヒクル治療マウスと比較して、DNFBチャレンジマウスで著しく増加しました(図1B、1日目に70対3μm、2日目に203対7.5μm、3日目に276対5μm)。チャレンジの72時間後、マウスの右耳には紅斑、痂皮、肥厚の兆候が見られましたが、ビヒクルで治療された耳には炎症の兆候は見られませんでした(図1C)。DNFBに挑戦されたグループのマウスの耳の皮膚の付着と発赤のスコアは、ビヒクルで治療された耳のものよりも高かった(図1D)。
DNFBチャレンジ後の表皮肥厚の増加と顕著な炎症性浸潤
DNFB処理された皮膚のH&E染色切片の分析では、ビヒクルで処理された皮膚と比較して、耳の皮膚の表皮の肥厚が増加したことが示されました(図2A、B)。免疫組織化学の結果は、耳のCD45+ (総造血細胞)、Ly6G + (好中球)、およびF4 / 80+ (マクロファージ)細胞の浸潤が、ビヒクル処理された組織よりもDNFB処理された皮膚で有意に高かったことを示しました(図2C、D)。まとめると、DNFBはマウスにACDの典型的な症状を誘発しました。
DNFB感作・チャレンジ免疫モデルにおけるTh-GM細胞サブセット作製
私たちは、ハプテン特異的なナイーブTh前駆細胞が、ハプテン感作/挑戦免疫応答中にGM-CSF発現エフェクター細胞に分化するという仮説を立てました。この仮説を検証するために、DNFB感作/チャレンジ耳またはDNFB感作/ビヒクルチャレンジ耳で、フローサイトメトリーによる細胞内染色を行ったTh細胞分化を調査しました(補足図S3)。チャレンジ後、マウスあたり平均約4,000個のCD4+ T細胞と1,898個のエフェクターCD4+ T細胞がありました(ビヒクル処理マウスと比較して、それぞれ23.8倍と38.7倍の増加、補足図S4)。エフェクターTh細胞、すなわちTh-GMにおけるGM-CSF+ IFN-γ-IL-17A-IL-22-の産生は、DNFB感作/チャレンジ耳で3倍以上高かった(ビヒクルチャレンジ耳の8.3%とは対照的に25.6%)、図3A、B。DNFBチャレンジを受けた耳とビヒクルチャレンジされた皮膚では、エフェクターCD4 T細胞の頻度が約10倍に拡大し、ハプテンチャレンジ時のTh細胞の活性化が活発であることが示されました(図4A、B)。皮膚浸潤物におけるTh-GM細胞サブセットの変化は、dLNsに部分的に反映されていましたが、この増加は組織における増加ほど顕著ではありませんでした(3.7倍、図4C、D)。したがって、Th-GM細胞サブセットは、このハプテン感作/チャレンジ免疫学的モデルで成功裏にブーストされました。

図1:マウスにおけるDNFB誘発性皮膚科学的炎症は、表現型的にはヒトの接触性皮膚炎に類似している。C57BL/6Jマウスは、-5日目と-4日目に腹部にDNFBを塗撹拌して感作し、0日目にDNFBまたはビヒクルを耳に投与し、1日目、2日目、3日目に評価しました。(B)ビヒクル治療またはDNFBチャレンジマウスの耳の腫れ(グループあたりn = 6)。(C)3日目のビヒクルまたはDNFBチャレンジマウスの全耳の代表的な写真。(D) DNFB またはビヒクルでチャレンジされた耳の挫傷と発赤のスコアが表示されます (グループあたり n = 6)。P < 0.001 および **** P < 0.0001 (平均 ± SD)。データは、各グループに6つのサンプルを使用した3つの独立した実験の代表的なものです。略語:DNFB = 2,4-ジニトロフルオロベンゼン。この図の拡大版を表示するには、ここをクリックしてください。
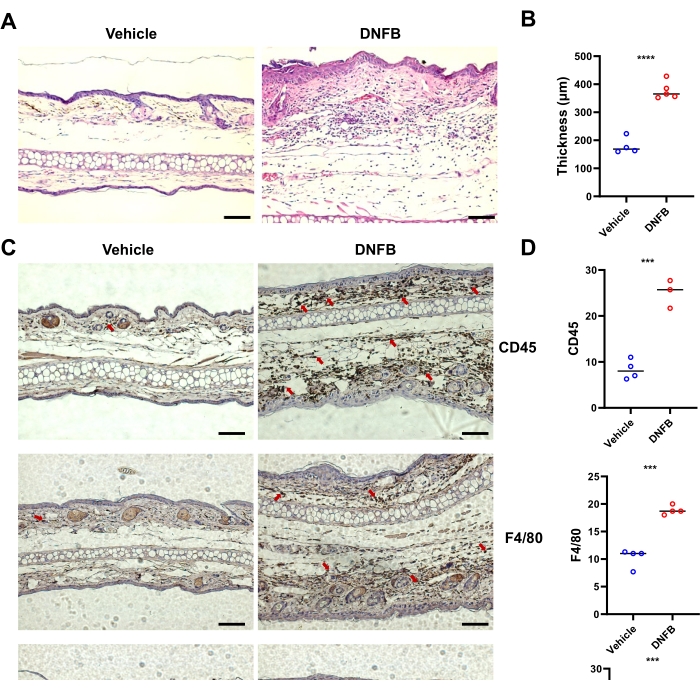
図2:DNFB感作/チャレンジによって誘発されたマウスの組織学的炎症の典型的な変化。 (A)示されたグループを代表する個々のマウスからの耳の皮膚のH&E染色。(B)棒グラフで示されたH&E染色の画像で測定された表皮の肥厚。(C)DNFBまたはビヒクルで挑戦したマウスの耳におけるCD45、F4 / 80、およびLy6Gの免疫組織化学。赤い矢印は陽性染色された細胞を示します。(D)マウスあたり3つまたは4つの盲検異なる切片からの褐色染色をカウントすることによるCD45陽性、F4/80、またはLy6G陽性細胞の定量。 P < 0.001、**** P < 0.0001 (平均± SD)。データは、各グループに3〜5匹のマウスを用いた2つの独立した実験を代表するものです。スケールバー = 1,000 μm (A, C)。略語:DNFB = 2,4-ジニトロフルオロベンゼン;H&E = ヘマトキシリンとエオシン。 この図の拡大版を表示するには、ここをクリックしてください。

図3:マウスの耳の皮膚のTh-GMサブセット(A)DNFBを惹起したマウスの耳の皮膚のTh-GMサブセットのフローサイトメトリー、または惹起の3日後に評価されたビヒクル。(B)エフェクターCD4+ T細胞内のTh-GMの頻度。各記号は、個々のマウスを表します。P < 0.001 および **** P < 0.0001 (平均 ± SD)。データは、各グループの6つのサンプルを表しています。略語:DNFB = 2,4-ジニトロフルオロベンゼン;GM-CSF = 顆粒球マクロファージコロニー刺激因子;Th-GM = GM-CSFを生成するTヘルパー。この図の拡大版を表示するには、ここをクリックしてください。
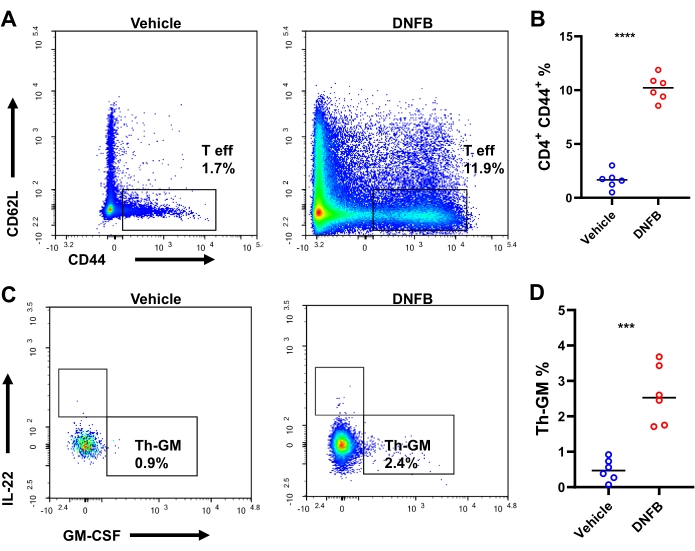
図4:マウスの耳ドレナージリンパ節におけるTh-GMサブセット(A)DNFBをチャレンジしたマウスの耳ドレナージリンパ節のエフェクターCD4+ T細胞のフローサイトメトリー、またはチャレンジの3日後に評価したビヒクル。(B)CD4+ T細胞内のエフェクターCD4+ T細胞の頻度。(C)DNFBを惹起したマウスの耳を排出するリンパ節のTh-GMサブセットのフローサイトメトリー、または惹起の2日後に評価されたビヒクル。(D)耳のドレナージリンパ節のエフェクターCD4 + T細胞内のTh-GMサブセットの割合。 P < 0.001 および **** P < 0.0001 (平均 ± SD)。データは、各グループの6つのサンプルを表しています。略語:DNFB = 2,4-ジニトロフルオロベンゼン;GM-CSF = 顆粒球マクロファージコロニー刺激因子;Th-GM = GM-CSFを生成するTヘルパー;T eff = エフェクターCD4+ T細胞。この図の拡大版を表示するには、ここをクリックしてください。
補足図S1:マウスの耳の皮膚の処理。 (A)C57BL / 6Jマウスから切り取った耳。(B)耳の背側と腹側を分割します。(C)背側と腹側を消化緩衝液に浸します。(D)ハサミ付きの小さな耳のリーフレット。(E)解離後に細胞ストレーナーに残った毛髪と白い結合組織。 このファイルをダウンロードするには、ここをクリックしてください。
補足図S2:マウス耳介リンパ節の処理。 (A)C57BL/6Jマウスの耳介リンパ節の解剖。赤い矢印は耳介リンパ節の位置を示しています。(B)耳介リンパ節を、ミンチする前に6ウェルプレートのウェルの上にある70μmセルストレーナーに移しました。(C)ミンチ後にセルストレーナーに残った破片。略語:DNFB = 2,4-ジニトロフルオロベンゼン。 このファイルをダウンロードするには、ここをクリックしてください。
補足図S3:耳介リンパ節のTh-GMサブセットを分析するために使用されるゲーティング戦略。まず、リンパ細胞を粒度とサイズ(FSC低SSC低、P1)に基づいてゲートし、FSC-A対FSC-Hプロット(P2)でシングレットを選択しました。次に、死んだ細胞をFVS780-集団(P3)にゲーティングして排除しました。第三に、エフェクターCD4 T細胞をCD4+-CD44+集団(P5)として同定した。最後に、Th-GMサブセットは、細胞内サイトカイン発現、すなわちIFN-γ-IL-17A-IL-22-GM-CSF+(P7)によって区別されました。略語:GM-CSF =顆粒球-マクロファージコロニー刺激因子;Th-GM = GM-CSFを生成するTヘルパー;IFNγ = インターフェロン-ガンマ。このファイルをダウンロードするには、ここをクリックしてください。
補足図S4:チャレンジ後のマウス組織における総GM-CSF発現エフェクターCD4 T細胞の組成。 (A)全GM-CSF+ CD4+ CD44+ 細胞に占めるGM-CSF発現エフェクターTh細胞の割合(%)。(B)チャレンジ後のマウスの耳の生CD4+ CD44+ T細胞におけるGM-CSF、IFN-γ、およびIL-17A発現のフローサイトメトリー。略語:GM-CSF =顆粒球-マクロファージコロニー刺激因子;Th-GM = GM-CSFを生成するTヘルパー;IFNγ = インターフェロン-ガンマ。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
このプロトコルは、Th-GM細胞サブセットの生成と増殖を解析するためのシンプルなin vivoアッセイを提供します。ハプテンまたは抗原によって開始されたマウスでは、ヒトでのその活性化を模倣して、T細胞媒介性疾患モデルを利用することが不可欠です。DNFBは、ペプチド抗原やタンパク質抗原よりも経済的で時間を節約する低分子ハプテンであり、in vivoでT細胞免疫応答を誘発します18,19。疾患の経過中、少なくともC57BL/6J遺伝的背景を持つマウス(データは示さず)では、2,4,6-トリニトロクロロベンゼン(TNCB)、オキサザロン(OXA)、またはフルオレセインイソチオシアネート(FITC)などの他のハプテンによる誘導と比較して、DNFBで挑戦される耳の腫れ反応の最大の大きさが観察されました(データは示されていません)が、上記の他の3つの試薬はマウスで接触感受性を生成することが報告されています14.研究者は、疾患の完全誘発のための適切なマウス系統とハプテンを決定する必要があります。
耳からの細胞の収率が低いことは、より小さなサイズのマウス組織を扱う際に最も頻繁に遭遇する問題の1つです。これは、コラゲナーゼタイプの無効な酵素活性による酵素消化の不完全さ、または消化に使用される期限切れの試薬によって引き起こされる可能性があります。これを克服するために、コラゲナーゼIV型は、炎症を起こした耳を効率的に解離する上で、コラゲナーゼIを含む他のコラゲナーゼよりも優れているため、耳の皮膚消化にコラゲナーゼIV型を使用しました。耳から単離された細胞の生存率が高いことは、PMA/イオノマイシン/タンパク質輸送阻害剤による再刺激による細胞内サイトカイン蓄積に有益です。さらに、再刺激に用いるRPMI 1640培地中のカルシウム濃度は、滅菌済みの1M塩化カルシウムストックを用いて1.5mMに調整することができ、再刺激時間を6時間に延長して、T細胞におけるサイトカインの最大産生を達成することができる20。
マルチパラメトリックフローサイトメトリーは、自己免疫反応の状況におけるTh-GM細胞サブセットの正確な同定と定量を可能にします。サイトメーターを使用してデータを取得する際には、未染色サンプルと単一染色サンプルをセットアップして、適切なPMT電圧を決定し、補償を調整しました。フローサイトメトリーを用いた免疫細胞の詳細な解析については、読者は、コンペンセーション調整、抗体染色設定、およびゲーティング戦略について、フローサイトメトリー21の使用に関する一般的なガイドラインを参照することができます。特に、Th-GMサブセットは他の従来の系統と並行していると考えられており、エフェクターCD4 T細胞でGM-CSF+ IFN-γ-IL-17A-IL-22-として同定されます(補足図S1)。このゲーティング戦略は、Th-GM細胞生物学の研究のためのフローサイトメトリーデータの解析に適用する必要があります。
要約すると、この論文は、フローサイトメトリーを使用してDNFB誘発マウス接触過敏症における新しいTh-GM系統を分析するためのプロトコルを示しています。この方法は、Th-GM細胞の生物学をさらに研究し、アレルギー性接触皮膚炎などのさまざまな状態でGM-CSFを中心とした治療戦略の薬理学的研究に使用することができます。
開示事項
著者らは、競合する金銭的利益がないことを宣言します。
謝辞
本研究は、中国国家自然科学基金会(81602763号、81803142号、82003347号)、中国ポスドク科学基金会優秀研究員プログラム(No.2017T100700)、中国ポスドク科学基金会定期研究員プログラム(No.2016M592673)の支援を受けて行われました。著者らは、この研究でフローサイトメトリーの技術サポートを提供してくれたYan Wang氏とMeng-Li Zhu氏(四川大学西中国病院中核施設)に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 2,4-dinitrofluorobenzene | BT REAGENT | P0001746 | CAS NO: 70-34-8 |
| Acetone | CHRON CHEMICALS | / | 67-64-1 |
| anti-CD4 antibody | Biolegend | 300506 | 1:100 Diluted |
| anti-CD44 antibody | Biolegend | 103012 | 1:100 Diluted |
| anti-CD62L antibody | Biolegend | 104417 | 1:100 Diluted |
| anti-GM-CSF antibody | BD Bioscience | 554507 | 1:100 Diluted |
| anti-IFN-γ antibody | Biolegend | 505836 | 1:100 Diluted |
| anti-IL-17A antibody | BD Bioscience | 563354 | 1:100 Diluted |
| anti-IL-22 antibody | Biolegend | 516411 | 5 µL/test |
| CD45 | Biolegend | 103101 | 1:200 Diluted |
| Chloral hydrate | CHRON CHEMICALS | / | 302-17-0 |
| Dial thickness gauge (0.01 mm type) | PEACOCK | G-1A | / |
| DMSO | LIFESCIENCES | D8371 | 67-68-5 |
| EDTA Na2 | Solarbio | E8030 | 6381-92-6 |
| F4/80 | Biolegend | 123102 | 1:200 Diluted |
| Fixable Viability Stain 780 | BD Bioscience | 565388 | 1:1,000 Diluted, viability dye |
| Flow cytometer | BD Bioscience | BD FACS ARIA II SORP | / |
| GraphPad Prism | GraphPad Software | Prism 7 | Software for statistics and graphing |
| Intracelluar Fixtation and Permeablization Buffer Set | Thermo Fisher | 88-8824-00 | prepared freshly |
| Ionomycin | Sigma-Aldrich | 407951 | CAS NO: 56092-81-0 |
| Ly6G | Biolegend | 127602 | 1:200 Dilutied |
| NovoExpress | Agilent | / | Software for flow cytometry data analysis; https://www.agilent.com.cn/zh-cn/product/research-flow-cytometry/flow-cytometry-software/novocyte-novoexpress-software-1320805 |
| Olive oil | YUANYE BIO | S30503 | 8001-25-0 |
| PMA | Sigma-Aldrich | P8139 | CAS NO: 16561-29-8 |
| Protein Transport Inhibitor (Containing Brefeldin A) | BD Bioscience | 555029 | 1 µL/mL |
参考文献
- Rasouli, J., et al. A distinct GM-CSF(+) T helper cell subset requires T-bet to adopt a TH1 phenotype and promote neuroinflammation. Science Immunology. 5 (52), (2020).
- Galli, E., et al. GM-CSF and CXCR4 define a T helper cell signature in multiple sclerosis. Nature Medicine. 25 (8), 1290-1300 (2019).
- Komuczki, J., et al. Fate-mapping of GM-CSF expression identifies a discrete subset of inflammation-driving T helper cells regulated by cytokines IL-23 and IL-1beta. Immunity. 50 (5), 1289-1304 (2019).
- Sheng, W., et al. STAT5 programs a distinct subset of GM-CSF-producing T helper cells that is essential for autoimmune neuroinflammation. Cell Research. 24 (12), 1387-1402 (2014).
- Herndler-Brandstetter, D., Flavell, R. A. Producing GM-CSF: a unique T helper subset. Cell Research. 24 (12), 1379-1380 (2014).
- Lu, Y., Fu, X. Y., Zhang, Y. In vitro differentiation of mouse granulocyte-macrophage-colony-stimulating Factor (GM-CSF)-producing T Helper (THGM) Cells. Journal of Visualized Experiments: JoVE. (139), e58087(2018).
- Hu, Y., et al. Interleukin-1beta-induced IRAK1 ubiquitination is required for TH-GM-CSF cell differentiation in T cell-mediated inflammation. Journal of Autoimmunity. 102, 50-64 (2019).
- Reynolds, G., et al. Synovial CD4+ T-cell-derived GM-CSF supports the differentiation of an inflammatory dendritic cell population in rheumatoid arthritis. Annals of the Rheumatic Diseases. 75 (5), 899-907 (2016).
- Al-Mossawi, M. H., et al. Unique transcriptome signatures and GM-CSF expression in lymphocytes from patients with spondyloarthritis. Nature Communation. 8 (1), 1510(2017).
- Wicks, I. P., Roberts, A. W. Targeting GM-CSF in inflammatory diseases. Nature Reviews Rheumatology. 12 (1), 37-48 (2016).
- Scheinman, P. L., et al. Contact dermatitis. Nature Reviews Disease Primers. 7 (1), 38(2021).
- Pesonen, M., Koskela, K., Aalto-Korte, K. Contact urticaria and protein contact dermatitis in the Finnish Register of Occupational Diseases in a period of 12 years. Contact Dermatitis. 83 (1), 1-7 (2020).
- Vocanson, M., Hennino, A., Rozieres, A., Poyet, G., Nicolas, J. F. Effector and regulatory mechanisms in allergic contact dermatitis. Allergy. 64 (12), 1699-1714 (2009).
- Gaspari, A. A., Katz, S. I., Martin, S. F. Contact hypersensitivity. Current Protocols in Immunology. 113, 1-7 (2016).
- Manresa, M. C. Animal models of contact dermatitis: 2,4-dinitrofluorobenzene-induced contact hypersensitivity. Methods in Molecular Biology. 2223, 87-100 (2021).
- Kim, J. H., et al. CD1a on Langerhans cells controls inflammatory skin disease. Nature Immunology. 17 (10), 1159-1166 (2016).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods in Enzymology. 533, 225-233 (2013).
- Achuthan, A., et al. Cytokine-induced acute inflammatory monoarticular arthritis. Methods in Molecular Biology. 1784, 215-223 (2018).
- Stromnes, I. M., Goverman, J. M. Active induction of experimental allergic encephalomyelitis. Nature Protocols. 1 (4), 1810-1819 (2006).
- Kruisbeek, A. M., Shevach, E., Thornton, A. M. Proliferative assays for T cell function. Current Protocols in Immunology. , Chapter 3, Unit 3 (2004).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (second edition). European Journal of Immunology. 49 (10), 1457(2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved